Method Article
Kemirgen neuroblasts nucleofection Neuroblast Göç Eğitim için
Bu Makalede
Özet
Neuroblast göç postnatal nörojenezindeki çok önemli bir adımdır. Protokol Burada açıklanan DNA / küçük firkete RNA (ShRNA) nucleofection ve kemirgen doğum sonrası rostral göçmen akımından izole nöroblast ile 3D göç deneyi kullanılarak neuroblast göç aday düzenleyicilerinin rolünü araştırmak için kullanılabilir.
Özet
Lateral ventriküllerin lateral duvarında bulunan bölge subventricular (SVZ'una) yetişkin nöron temel bir rol oynar. Beynin bu kısıtlı alanda, nöral kök hücreler çoğalır ve sürekli koku ampul (OB) ulaşmak için rostral göçmen akışı (RMS) boyunca zincirlerinde teğet göç neuroblasts oluşturmak. Bir kez OB, Nöroblastlar radyal göç geçmek ve daha sonra önceden var olan nöronal ağ içine dahil etmek mümkün olgun nöronların içine ayırt. Uygun neuroblast göç yenidoğan nöronlarının fonksiyonel doğru olgunlaşmasını sağlamak, nöron temel bir adımdır. Hareketliliğini yatan hücre içi mekanizmaları araştıran, beyinde yaralı alanları hedef SVZ'una türetilmiş neuroblasts yeteneği verilen nöron anlayış geliştirmek değil, aynı zamanda nörorejeneratif stratejilerinin geliştirilmesini teşvik edebilir.
Bu el yazması ayrıntılı açıklarBirincil kemirgen transfeksiyonu için protokol sonrası neuroblasts ve in vivo olarak gözlenen göç bunların hareket mod yansıtan 3B, in vitro göçü deneyi kullanarak motilite analizi RMS. Her iki sıçan ve fare nöro plazmid DNA, küçük bir saç tokası (sh) RNA ya da kısa RNA oligo ilgi duyulan gen hedefleme (si) müdahale ile ya Nucleofection ile hızlı ve verimli bir şekilde transfekte edilmiş olabilir. Göç analiz etmek için, hücreler, nucleofected 'asılı damla "in reaggregated ve daha sonra üç boyutlu bir matris içinde yer almaktadır. Nucleofection başına anlamlı neuroblasts göç zarar vermez. Nucleofected ve reaggregated neuroblasts farmakolojik tedavi de neuroblast göç dahil sinyal yolları rolünü incelemek için yapılabilir.
Giriş
Yeni nöron (nöron) ve postnatal memeli beyin, nesil yaşam boyunca oluşur ve iki nörojenik nişler sınırlıdır: lateral ventriküllerin subventricular bölgesi (SVZ) ve hipokampus 1 kıvrımlarının subgranular bölge. Yapılan yeni çalışmalar, öğrenme ve hafıza görevleri 2,3 kolaylaştırmada yetişkin nöron önemli rolü olduğunu göstermiştir. Ayrıca, beyin hasarı 4-7 aşağıdaki sinir atalarıdır çoğalması ve işe kanıt nöral tamir nöron farmakolojik aktivasyon olasılığını yükseltir.
Doğum sonrası nöron kesinlikle nöral progenitör proliferasyon, göç, farklılaşma, hayatta kalma ve yeni doğan nöronlar 8 final sinaptik entegrasyon dahil tüm aşamaları, düzenlenir. SVZ'unda kök hücrelerinden elde edilen nöral atalarıdır (nöro) rostral göç ile büyük bir mesafe üzerinde göçişlevsel nöronlara 9 içine olgun koku ampul (OB) doğru akım (RMS). Göçmen Nöroblastlar tek bir lider süreci uzatılmış bir hücre gövdesi, ağırlıklı olarak tek kutuplu vardır. Bu hücreler bir başka 10 üzerinde kayar, toplu bir şekilde zincirleri hareket. Göç fonksiyonel nöronlar 11 içine SVZ'una türetilmiş atalarıdır sonraki olgunlaşması için çok önemli bir adımdır ve dahil olmak üzere birçok faktöre ve rehberlik moleküller tarafından kontrol edilir: polisialilatlanmış nöral hücre adezyon molekülü (PSA-NCAM) 12, Ephrins 13, 14 integrinlerin, yarıklar 15, büyüme faktörleri 16 ve 17 nörotransmitörlerinin, ancak bu sürecin altında yatan moleküler mekanizmalar tam olarak anlaşılmış değildir. Neuroblast göç düzenleyen hücre içi sinyal yollarını araştıran yetişkin nöron daha iyi anlaşılmasını sağlayacaktır değil sadece, aynı zamanda yeni tedavi gelişmesine katkı sağlayacakbeyin onarımı teşvik yaklaşır.
Bu makale Nucleofection ve 3D göç deneyi kullanılarak in vitro neuroblast göç aday düzenleyici rolünü incelemek için ayrıntılı bir protokol açıklar. Nucleofection elektroporasyon için geliştirilmiş bir yönteme göre, bir hücre transfeksiyon tekniktir. Hücre tipi özel elektrik akımı ve Nucleofection çözelti izin doğrudan hücre çekirdeği ve yavaş yavaş bölünmesi veya mitoz şeklinde memeli embriyonik ve nöron 18 gibi hareketsiz hücreleri içine transfeksiyonu izin bu DNA ve shRNA vektörler ve siRNA oligonükleotidler gibi polianyonik makromoleküllerin transferi. Bu yöntem, hızlı gerçekleştirmek için nispeten kolay ve primer neuroblasts ve nöron 19-21 dahil olmak üzere hücre tiplerinin geniş bir alanda yüksek oranda tekrarlanabilir olduğunu transfeksiyon ile sonuçlanır.
RMS doku ayrışma başarıyla DNA / SHR ile nucleofected olabilir göçmen neuroblasts izolasyonu sağlar,NA vektörler veya siRNA oligolar ilgi genleri hedef. Nucleofection sonra, nöro damla askıdaki reaggregated ve daha sonra üç boyutlu bir Matrigel matriksi içinde gömülü. Bu koşullar, böylece neuroblast göç katılan sinyal yolları araştırmak ve bu hücrelerin motilitesi üzerinde farmakolojik tedavilerin etkisini değerlendirmek için mükemmel bir model sistemi sağlayarak, nöro-vivo gözlenen göç modu yansıtan hücre agrega üzerinden geçiş için izin verir.
Protokol
Bu prosedür, İngiltere İçişleri Bakanlığı Yönetmeliği (Hayvan Bilimsel Usul Yasası, 1986) ile uyumludur. Bilim adamları kurulan ve kendi kurumsal ve ulusal hayvan düzenleyici kuruluşlar tarafından onaylanan yönergeleri takip etmelidir.
1.. Diseksiyon ve Rat RMS neuroblasts Ayrılma
- RMS diseksiyon ve ayrışma için gerekli çözümleri hazırlayın:
Diseksiyon ortamı (100 mi)
Hank Dengeli Tuz Çözeltisi (HBSS) - 98.5 mi
5 M HEPES pH 7,4-0,5 mi
Penisilin-streptomisin (10.000 ünite / ml ve 10,000 ug / ml) - 1 mi
Ayrışma ortamı (2 ml)
HBSS - 1.760 ml
Tripsin 10x (% 2.5) - 200 ul
DNAse1 (1 mg / ml) - 40 ul
Dulbecco'nun Eagle Vasatı (DMEM) +,% 10 Fetal Buzağı Serumu (FCS) (40 mi) Modifiye
DMEM -36 mi
FCS - 4 mi
Komple ortam (12 mi)
Neurobasal orta - 11.46 ml
B27 Supplement - 250 ul
L-Glutamin (200 mM) - 125 ul
Glikoz (45%) - 165 ul
2. DMEM +% 10 FCS ve tam orta filtre-sterilize ve bir 37 ° C /% 5 CO2 inkübatörü içinde onları preequilibrate.
- Teşrih
- Servikal dislokasyon ile P6-P7 sıçan çöp (yaklaşık 12 yavru) Kurban ve makas ile başını kesmek.
- Bir neşter ile beyinciğe burun orta sagital sütür boyunca deride bir anteroposterior kesi olun. Deri soyulabilir ve kafatası boyunca aynı kesi tekrarlayın.
- Forseps ile yavaşça kranial kanatlara çıkarın ve dikkatli koku ampuller dahil özen, bir spatula ile beyin kaldırmak.
- Beynin en kaudal üçüncü kesme ve atın.
- Inci doğrayınBir doku kıyıcı kullanarak 1.4 mm kalınlığında koronal dilimler halinde e beyin dokusu.
- Soğuk diseksiyon orta içeren yemekler dilimleri yerleştirin ve dikkatli bir iğne kullanılarak ayırın.
- RMS bir üçgen, OB bölme merkezinde ve daha kaudal beyin dilimleri küçük bir dairesel alanı olarak yarı saydam bir alan olarak görünür. Çevre doku dahil önlemek için özen, bir mikrocerrahi bıçakla her dilimin dışında RMS kesin. P7 sıçan yavrular, genellikle (OB dahil) ~ 8 en rostral dilim RMS içerir.
- Bir plastik Pasteur pipeti ile RMS parçalarını toplamak ve buz üzerinde soğuk diseksiyon orta içeren küçük bir tabak koyun.
- Diseksiyon tamamlandığında, plastik bir pipet ile bir 15 ml tüp içine RMS parçaları aktarın. Tüpün alt kısmında yerleşmeye parçaları bırakın.
- Ayrışma
- Ayrışma ortamına 2 ml ile diseksiyon orta değiştirin.
- Yavaşça p RMS parçaları toz haline getirinyukarı ve yaklaşık 10x P1000 pipet kullanarak aşağı fragmanı süspansiyon ipetting.
- 2 dakika için bir 37 ° C su banyosu içinde doku parçaları ile tüp bırakın.
- Tekrar 10x çözümü Pipet ve fragmanları (süspansiyon bulutlu haline gelmelidir) ayrışmış emin olunuz.
- Önceden ısıtılmış DMEM +% 10 FCS eklenerek 5 ml tripsin etkisiz hale getirirler.
- 5 dakika boyunca 433 x g'de hücre süspansiyonu santrifüj.
- Bu arada bir alikotu, Eppendorf tüpleri içine siRNA / DNA gerekli miktarda (genellikle 3-5 ug DNA / shRNA veya Nucleofection başına 5-9 ug oligo siRNA, ancak DNA / siRNA miktarı optimizasyon gerektirebilir).
- Aşırı Ortamı çıkarın ve önceden ısıtılmış DMEM +% 10 FCS içinde, 5 ml hafif bir pipetleme hücre pelletini.
- Bir hücre sayımı gerçekleştirmek. Sıçan yavrusuna beyin başına ~ 1 x 10 6 hücre bekliyoruz. Ise 2.5 x 10 6 hücre az, her Nucleofection için gereklidiren iyi sonuçlar Nucleofection başına 3-4 x 10 6 hücreleri kullanılarak elde edilir.
- 5 dakika boyunca 433 x g'de hücre süspansiyonu santrifüj. Mümkün olduğunca orta kaldırmak için emin olun.
2. Nucleofection
- Önce oda sıcaklığında inkübe nöron Nucleofection çözeltisi (Fare hücreleri kullanılarak gerçekleştirilen halinde veya fare) hemen sıçan hücre pelletini. Nucleofection başına 100 ul kullanın Not:. Genellikle 12 yavru sıçan çöp 4 nucleofections gerçekleştirmek için yeterli olduğunu ve bir fare çöp (12 yavru) 2 nucleofections gerçekleştirmek için yeterlidir.
- SiRNA / DNA içeren her bir Eppendorf tüpüne, hücre süspansiyonu 100 ul aktarın ve bir P200 pipet ile pipetleme ile yavaşça 2-3x karıştırın.
- Kabarcıklarını önlemek için dikkat ederek, nucleofectioncuvette altına örnek (cell-DNA/siRNA süspansiyon) ilave edin.
- Nucleofect programı G-013 (fare hücreleri) kullanılarak ya da O-005 için (Fare hücreleri). Bir nucleofection yaklaşık 5 sn sürer.
- Çabuk nucleofected örnek, önceden ısıtılmış DMEM +% 10 FCS içinde 1 ml.
- Tekrar 2.4 ve diğer tüm numuneler için 2.5 adımları. Not: En iyi sonuçlar için, tüm nucleofection işlem 5 dakika daha uzun sürmelidir.
- Nucleofection kiti ile sağlanan plastik pipet kullanılarak önceden ısıtılmış DMEM +% 10 FCS içinde 5 ml ihtiva eden bir 15 ml tüp için her bir örnek aktarın. Tüpe bir hücre kalıntıları aktarma kaçının.
- 5 dakika boyunca 433 x g Santrifüj örnekleri.
- Dikkatle tüm aşırı orta kaldırmak ve P20 pipet kullanarak önceden ısıtılmış DMEM +% 10 FCS 25-30 ul pelletini. Ortamın fazla 30 ul kullanmayın.
- Bir p35 çanak kapağın iç tarafı üzerine bir damla olarak süspansiyonu pipetle.
- (Şekil 1 'e de bakınız) tam ortam 2 ml ihtiva eden p35 yemeğin kapağı ters çevirin.
- De (37 ° C /% 5 CO2) inkübatör bırakkadar 7 saat için en az 5 saat ve. Daha uzun inkübasyon süresi hücre kümelerinin iyi reaggregation sağlar.
- Bir kesme ucu ile bir P1000 pipet kullanarak çanak tam ortam içine kapak arasındaki asılı damla aktarın.
- DNA nucleofections ve siRNA / shRNA nucleofections boyunca 48 saat boyunca 24 saat boyunca 37 ° C /% 5 CO2 ile inkübe edin.
3. Katıştırma
- Komple ortam (25 ml) hazırlayın ve bir kaç saat için 37 ° C /% 5 CO2 azından preequilibrate.
- -80 ° C dondurucu bazal membran matris donmuş hacimde çıkarın ve soğuk odada buz çözülme.
- Her sekiz 13 mm steril coverlips kadar içeren 6 cm yemek hazırlamak nucleofection için.
- Ince film kaplı bir buz kutuyu yemekler yerleştirin. Bu gömme işlemi sırasında matris katılaşmayı önlemek için soğuk lamelleri tutmak önemlidir.
- Nem korumak için, 15 cm çanak içinde nemli doku şeridi yer whasta gömülü neuroblasts içeren üç 6 cm yemekleri kadar tutmak için kullanılır.
- 1:3 oranında çözülmüş matrise tam orta ekleyin. Örneğin, pipetleme matris 120 ul komple ortam içinde 40 ul karıştırın. Matrisin Bu miktar sekiz ila 12 mm kapak agrega gömmek için yeterlidir.
- Bir 15 ml santrifüj tüpü ve at reaggregated hücre kümeleri aktarma 5 dakika boyunca 433 x g.
- Aşırı Ortamı çıkarın ve tam ortam içinde 10 ul pelletini.
- Her steril lamel üzerine hücre agrega süspansiyonu 2 ul yerleştirin ve matris / tam orta karışımı 18 ul ekleyin. Tüm lamel üzerine matrisi yaymak için pipet kullanın.
- Hemen 15 cm tabak lamelleri içeren 6 cm çanak koyun ve 15-20 dakika boyunca (37 ° C /% 5 CO2) inkübatör bırakın. Matris katılaşmış sonra, hafifçe itmek için her 6 cm çanak alarak bakımına 5 ml tam orta eklemekBir pipet ile herhangi bir yüzen lamel aşağı.
- Nöro-blastlar hücre agrega üzerinden geçiş sağlamak için 37 ° C /% 5 CO2 'de 24 saat süreyle inkübe edilir.
4. 3D Geçiş Deneyi
- Immün için gerekli çözümler hazırlayın.
- Blok çözüm hazırlayın:
Keçi bloğu çözeltisi (50 mi)
Fosfat Tamponlu Salin (PBS) - 5 mi
Keçi serumu - 7.5 ml
% 10 Triton X-100-1,5 mi
BSA - 50 mg
H 2 O - 36 mi - 4 ° C'de filtre ve mağaza
- Sabitleme çözeltisi hazırlayın:
(100 mi) çözeltisi Tespit
Paraformaldehit (PFA) - 4 gr UYARI: bir başlık altında ele PFA
Sakaroz - 20 g (isteğe bağlı)
PBS kadar 100 ml - Sıcak bir levha üzerinde ve sabit karıştırma altında, 80 ml PBS PFA çözülür 65 ° C de muhafaza
- PFA çözündükten sonra, 20 g sükroz ilave edin.
- PH ayarlama7.4 (genellikle solüsyonun 100 ml başına ~ 60 ul 1 M NaOH ilave edilerek).
- PBS ile 100 ml arasında bir toplam hacme kadar getir.
- Blok çözüm hazırlayın:
- İmmünoboyama
- , 24 oyuklu bir plaka içerisinde lamelleri yerleştirin.
- PBS 2x ile lamelleri durulayın.
- Oda sıcaklığında 45 dakika boyunca sabitleme çözeltisi ile, RMS neuroblast agrega düzeltildi.
- PBS 3x lamelleri (- sallanan bir platform üzerinde 5 dak / yıkama) durulayın.
- Keçi blok solüsyonu ile 30-60 dakika boyunca engelleyin.
- Keçi blok çözeltisi içinde seyreltin primer antikorlar ile 4 ° C de bir gece inkübe (Arzu edildiği takdirde, floresan phalloidin (1:400) ve Hoechst boya (1:10,000) ve ayrıca filaman tarzı aktinin çekirdekleri görselleştirmek için birincil antikor çözeltisine ilave edilebilir).
- PBS 3x (5 dak / yıkama) ile lamelleri durulayın.
- Keçi blok çözeltisi içinde sekonder antikor seyreltin ve oda sıcaklığında 2 saat boyunca inkübe edilir.
- Coversli durulayınPBS 3x ps (5 dak / yıkama)
- Montaj floresan montaj ortamı ile lamelleri ve gece boyunca oda sıcaklığında kurumaya bırakın.
- Geçiş Analizi
- 10X objektif kullanılarak bir floresan mikroskop ile sabit RMS neuroblast agrega görüntüler yakalayın. Bir örnek görüntüde bir ölçek bar bulunmaktadır.
- , Ölçümü için ölçek kurmak ImageJ araç çubuğunda 'Düz çizgi' aracını seçerek resimdeki ölçek çubuğu ölçmek için.
- 'Analiz' seçeneğini seçin ve 'set ölçekte' üzerine tıklayın.
- Ölçek pencerede 'bilinen mesafeyi' ayarlanır ve tüm ölçümler için aynı ayarları korumak için 'küresel' kutusunu işaretleyin.
- Tüm agrega (Şekil 3B) yaklaşık 6 farklı sektörlerde uzak göç neuroblast için agreganın kenarından mesafeyi ölçmek için ImageJ araç çubuğunda 'Parçalı satır' aracını kullanın. Sadece izole ag düşününanalizi için gregates.
- Her bir agrega için elde edilen 6 değerlerden ortalama göç mesafesi hesaplayın.
- Üç bağımsız deneyden en az her bağımsız deney sonuçları ve havuz, her durum için 10-20 agrega ölçün. Her zaman nucleofection kontrol (örn.. GFP veya bir kontrol sh / SiRNA) bulunmaktadır.
Sonuçlar
Nöroblastomun başarılı Dissected RMS doku (Şekil 1A) izole edilir ve üç boyutlu bir matris içine gömülü olabilir. Sıçan veya fare postnatal RMS ya izole hücreler gibi doublekortin (DCX), βIII tubulin veya PSA-NCAM (Şekil 1B-C) gibi göçmen neuroblast belirteçleri için immünopozitif vardır.
Ayrılmış nöro verimli DNA ile nucleofected (örn.. Bir GFP kodlayan plazmid, Şekil 2) western blot analizi ile tespit edilebilir protein azalmasını elde etmek için ya da shRNA plasmidler (Şekil 4), (Şekil 4B) ve immünoflüoresan (gösterilmemiştir) .
GFP-kodlayan plazmidlerle nucleofected hücreler reaggregated neuroblast kümeleri (Şekil 3A) üzerinden radyal olarak değiştirmektedir. (Şekil 3B) gömme göreli Taşınan mesafe 24 saat yazılan Kantitasyonu GFP-varsaymak arasında göç hiçbir farklılık gösterir Nucleofection başına göç bozmayan gösteren hücreler ve GFP-negatif, nonnucleofected hücreleri (Şekil 3C) ive. Doğrudan RMS eksplantlarından (veriler gösterilmemiştir) üzerinden göç nucleofected nöroblast ve neuroblasts arasındaki göç ölçüde anlamlı bir fark vardır.

Şekil 1. RMS neuroblasts diseksiyonu. RMS neuroblast diseksiyonu (A) şematik gösterimi. Ayrıntılı bilgi için metne bakınız. (B) İzole sıçan RMS hücreleri göç neuroblast yapımcıları DCX ve βlll Tübülin için immünopozitif vardır. Fare RMS eksplantlarının üzerinden göç Bar, 20 mikron. (C) Hücreler göç neuroblast DCX ve PSA-NCAM işaretleri ifade. Bar, 20 mikron.0989/50989fig1highres.jpg "target =" _blank "> büyük resmi görebilmek için buraya tıklayın.
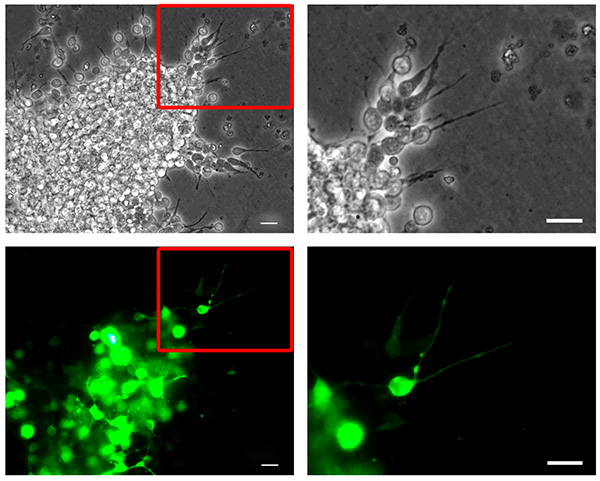
Şekil 2. Fare neuroblast nucleofection. Disosiye fare RMS Nöro-blastlar, Pmax-GFP ile nucleofected reaggregated, üç boyutlu bir matris içine gömülü ve 6 saat boyunca göç bırakılmıştır. Bir reaggregated hücre küme dışına göç nöroblastomun (üst, faz kontrast resim) yüksek transfeksiyon verimliliği (alt, GFP kanal resim) gösterir. Sağ sütun panelleri sol sütun panellerinde vurgulanır ilavelerde karşılık yüksek büyütme resimleri göstermek. Barlar, 20 mikron. resmi büyütmek için buraya tıklayın .
ontent-width = "6in" src = "/ files/ftp_upload/50989/50989fig3.jpg" width = "500px" />
Şekil 3,. 3D göç deneyi. (A) Rat nöro-Pmax-GFP (GFP) veya pCAG-IRES-EGFP reaggregated 22 (EV), bir matris içine gömülü ve 24 saat boyunca geçiş için sol nucleofected edilmiştir. Hücreler daha sonra sabit ve GFP (yeşil) ve βIII tubulin (kırmızı) için boyama yapıldı. Bar, 50 mikron. (B) ImageJ kullanarak göç mesafe ölçme. Reaggregated zigot 6 eşit sektöre ayrılmıştır. Kümenin (noktalı çizgi) ve uzak göç hücrenin kenarı arasındaki mesafe, her bir sektör için ölçülmüştür. Göreceli mesafe (C) miktarının nucleofected göre göç eden hücreler (GFP-pozitif) ve kontrol, nonnucleofected hücreleri (GFP-negatif) . resmi büyütmek için buraya tıklayın .
Fo "Şekil 4": İçerik-width = src = "/ files/ftp_upload/50989/50989fig4.jpg" genişliği "6in" = "500px" />
Şekil 4. ShRNA nucleofection sonra neuroblast göçü izlenmesi. (A) Rat nöro-(aynı zamanda 23 EGFP ifade pCA-b-EGFPm5 susturucu 3) bir kontrol shRNA vektör ya da bir shRNA fascin hedef, aktin-donatılacak proteini 24 içeren aynı vektör ile nucleofected edilmiştir. Hücreler, 48 saat boyunca reaggregated matris içine gömülü ve 24 saat boyunca göç bırakılmıştır. Büyüklükleri daha sonra sabit ve GFP (yeşil) ve βIII tubulin (kırmızı) için boyama yapıldı. Bar, 50 mikron. (B) Etkili fascin tükenmesi western blot analizi ile shRNA Nucleofection 50 saat sonra tespit edilebilir. Aktin bir yükleme kontrolü olarak burada gösterilir (C) fascin tükenmesi anlamlı neuroblast göç bozar gösteren göreli göç mesafesi kantitatif analizi. (Ortalama ± SEM; ** p <0.01, n = 3 bağımsız deneyler). büyük resmi görebilmek için buraya tıklayın.
Tartışmalar
OB nihai konuma RMS boyunca neuroblasts göç postnatal nörojenezindeki temel bir adımdır. Ancak, bu karmaşık süreci kontrol eden moleküler mekanizmalar kadar tam olarak anlaşılmamıştır olmaktan vardır.
Burada tarif edilen deney prosedürü, in vitro neuroblast göç çalışma sağlar. Biz erken doğum sonrası fare veya sıçanın 25 RMS neuroblasts izole etmek için daha önce yayınlanan bir protokol adapte var. Bir asgari diseksiyonu ve nucleofection arasındaki zaman aralığını tutmak için çok önemlidir, çünkü en iyi sonuçları elde etmek için bu, diseksiyon adım master için önemlidir. Nucleofection sonra nöro-, reaggregated edilebilir üç boyutlu bir matris içine gömülmüş ve bir 24 saat süre boyunca ilerlemesine izin verilir. Seçenek olarak ise, taşıma (örneğin imüno-veya western blot analizi) başka amaçlar için, hücreler hemen polyornithine/laminin- on Nucleofection sonra kaplı olabilir4-5 güne kadar hayatta kaplı lamelleri. Fare ve sıçan nöro benzer ölçüde Matrigel göç, ancak fare hücreleri fare hücrelerinden daha zincirleri geçirmek için güçlü bir eğilimi göstermektedir.
Çalışmanın amacı bağlı olarak, nöro-floresan proteinleri veya ilgi duyulan vahşi tip / mutant proteinleri kodlayan farklı plazmitler ile nucleofected edilebilir. (CMV arttırıcı ve β-globin poli-A kuyruk ile β-aktin promoter) bir CAG promotör ile en iyi protein sentezleme plasmidleri için 26 derece tavsiye edilir. Ayrıca, siRNA veya oligos shRNA plasmidlerinin ilgilenilen hedefleri demonte nucleofected edilebilir. Etkin protein tükenmesi bağışıklık veya western blot (genellikle standart liziz tamponu 50 ul 1 sıçan yavru gömülü agregalar yokedici) ile görselleştirilebilir.
Nucleofection, birincil neuroblasts transfekte edilmesi için nispeten basit bir yöntemdir vi için daha kolay ve daha hızlı bir alternatifral vektör-aracılı transfeksiyon, ve yüksek (~% 70-80) transfeksiyon verimi elde edilebilir. Bu, büyük ölçüde hücre canlılığını azaltır uzun bir süre boyunca çözelti içerisinde Nucleofection neuroblasts bırakarak bu yana, Nucleofection işlem sırasında hızlı bir şekilde çalışması için önemlidir.
RMS diseksiyon ikinci ortalama hücre verimi P7 farelere kıyasla (~ 5 x 10 5 hücre / beyin) P7 fareler için nispeten düşüktür (~ 1 x 10 6 hücre / beyin) ve Nucleofection başına en az 3 x 10 6 hücre gerekmektedir % 50 verim ~ ile transfeksiyon elde etmek. Ayrıca, sıçan Nöroblastlar fare nöroblast göre nucleofection daha karşı görünür. Bu nedenle erken doğum sonrası (P6-P7) sıçan yavrular ayrıca fare ve sıçan RMS organizasyonu oldukça simi olduğunu düşünüyor, uygun bir neuroblast kaynağını temsil edebilirlar 27 ve in vitro olarak, sıçan ve fare neuroblast göç ölçüde da karşılaştırılabilir. Bu hücre morfolojisi ve göç (yayınlanmamış gözlemler) anormal etkileri önlemek için 48 saat daha uzun süre süspansiyon nucleofected neuroblasts reaggregated kümelerini tutmak için değil tavsiye edilir.
Burada tarif edilen deney, 3 boyutlu bir matris (örneğin,. 24 saat) gömme sonra sabit bir zaman noktasında neuroblast göç ölçmek için kullanılabilir. Agrega boyutu ve göç mesafesi (yayınlanmamış gözlemler) arasında anlamlı bir ilişki olduğu için farklı boyutlarda agrega, analizinde kullanılabilir. Görselleştirmek ve daha neuroblast göç dinamiklerini incelemek için, zaman atlamalı görüntüleme kullanılabilir. Bu neuroblasts hızı büyük ölçüde uzun zaman noktalarında (yayınlanmamış gözlemler) azaltmak için görünür beri, gömme sonra 24 saat aralığında göç analizi yürütmek için tavsiye edilir.
Bu protokol için bazı sınırlamalar vardır. Viral vektörler ile enfeksiyon yetişkin neuroblasts 28 için en etkili transfeksiyon yöntemi kalırken İlk olarak, Nucleofection kadar, erken doğum sonrası kemirgen neuroblasts için kullanılabilir. İkinci olarak, in vitro göçü deneyi tam olarak, in vivo olarak gözlenen RMS karmaşık mimarisini yeniden değildir. Gerçekten de, bu tür nöro da hareketliliğini 9,29 düzenleyen katkı astrositler ve kan damarları gibi diğer RMS bileşenlerle etkileşimi eksikliği burada açıklanan deney sisteminde, in vivo meslektaşları benzer bir şekilde geçirmek için yeteneğini korumak da, 30. Bu sorun üç boyutlu kokültürü modeli sistemlerinin optimizasyonu ile gelecekte ele alınabilir.
Sonuç olarak, 3D göç deneyi ile nucleofection birleştirerek daha altında yatan moleküler mekanizmaları anlamak için değerli bir aracı temsilneuroblast göç. Bu deneysel prosedür ayrıca in vivo doğum sonrası elektroporasyon ve beyin dilim kültürlerin time-lapse görüntüleme gibi diğer yaklaşımlarla valide edilebilir neuroblast göç aday regülatörleri, rolünü değerlendirmek için bir başlangıç, hızlı ve nispeten basit bir yöntem sağlar 28,31,32 .
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma PD ve GL verilen bir Wellcome Trust Projesi Grant (089236/Z/09/Z) tarafından finanse edildi. SG Bir Biyoteknoloji ve Biyolojik Bilimler Araştırma Konseyi Doktora öğrencilikle tarafından desteklenmiştir. Biz neuroblast nucleofection değerli tavsiye için ShRNA vektör ve Jennifer Shieh tür hediye için Matthieu Vermeren teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hank’s Balanced Salt Solution (HBSS) | Invitrogen Life Technologies | 14175129 | |
| HEPES | Sigma-Aldrich | H3375-25G | |
| Penicillin-Streptomycin | Invitrogen Life Technologies | 15140-122 | |
| 2.5% Trypsin-EDTA (10x) | Gibco | 15090-046 | store 200 µl aliquots at -20 °C |
| DNAse I Vial (D2) | Worthington | LK003170 | ≥1,000 units per vial; store 50 µl aliquots at -20 °C |
| Dulbecco Modified Eagle's Medium (DMEM) | Gibco | 11960-044 | |
| Fetal Calf Serum (FCS) | Hyclone | SH3007902 | |
| Neurobasal medium | Gibco | 21103-049 | |
| B27 supplement | Invitrogen Life Technologies | 17504044 | |
| L-Glutamine (200 mM) | Invitrogen Life Technologies | 25030-081 | |
| D-(+)-Glucose solution (45%) | Sigma-Aldrich | G8769 | |
| Matrigel Basement Membrane Matrix, Growth Factor Reduced (GFR), Phenol Red-free, 10 ml, LDEV-Free | BD Biosciences | 356231 | prepare 120 µl aliquots at 4 °C, then store at -80 °C |
| PFA | Sigma-Aldrich | 441242 | |
| Sucrose | BDH | 102745C | |
| Goat serum | Sigma-Aldrich | 69023 | |
| Triton X-100 | VWR International Ltd. | 306324N | |
| BSA | Fisher Chemical | BPE9701-100 | |
| Dako fluorescence mounting medium | Dako | S3023 | |
| Rat neuron nucleofection kit | Lonza | VPG-1003 | |
| Mouse neuron nucleofection kit | Lonza | VPG-1001 | |
| Microsurgical knife | Angiotech | 7516 | |
| McIlwain tissue chopper | The Mickle Laboratory Engineering Company | ||
| Nucleofector II | Lonza |
Referanslar
- Ming, G. L., Song, H. J. Adult Neurogenesis in the Mammalian Brain: Significant Answers and Significant Questions. Neuron. 70, 687-702 (2011).
- Alonso, M., et al. Activation of adult-born neurons facilitates learning and and memory. Nat. Neurosci. 15, 897-U127 (2012).
- Lazarini, F., Lledo, P. M. Is adult neurogenesis essential for olfaction?. Trends Neurosci. 34, 20-30 (2011).
- Arvidsson, A., Collin, T., Kirik, D., Kokaia, Z., Lindvall, O. Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat. Med. 8, 963-970 (2002).
- Jin, K. L., et al. Evidence for stroke-induced neurogenesis in the human brain. Proc. Natl. Acad. Sci. U.S.A. 103, 13198-13202 (2006).
- Kim, Y., Szele, F. G. Activation of subventricular zone stem cells after neuronal injury. Cell Tissue Res. 331, 337-345 (2008).
- Massouh, M., Saghatelyan, A. De-routing neuronal precursors in the adult brain to sites of injury: Role of the vasculature. Neuropharmacology. 58, 877-883 (2010).
- Pathania, M., Yan, L. D., Bordey, A. A symphony of signals conducts early and late stages of adult neurogenesis. Neuropharmacology. 58, 865-876 (2010).
- Lois, C., Alvarez-Buylla, A. Long-Distance Neuronal Migration in the Adult Mammalian Brain. Science. 264, 1145-1148 (1994).
- Lois, C., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Belvindrah, R., Nissant, A., Lledo, P. M. Abnormal Neuronal Migration Changes the Fate of Developing Neurons in the Postnatal Olfactory Bulb. J. Neurosci. 31, 7551-7562 (2011).
- Battista, D., Rutishauser, U. Removal of Polysialic Acid Triggers Dispersion of Subventricularly Derived Neuroblasts into Surrounding CNS Tissues. J .Neurosci. 30, 3995-4003 (2010).
- Conover, J. C., et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone. Nat. Neurosci. 3, 1091-1097 (2000).
- Mobley, A. K., McCarty, J. H. beta 8 Integrin is Essential for Neuroblast Migration in the Rostral Migratory Stream. Glia. 59, 1579-1587 (2011).
- Nguyen-Ba-Charvet, K. T., et al. Multiple roles for slits in the control of cell migration in the rostral migratory stream. J. Neurosci. 24, 1497-1506 (2004).
- Garzotto, D., Giacobini, P., Crepaldi, T., Fasolo, A., De Marchis, S. Hepatocyte growth factor regulates migration of olfactory interneuron precursors in the rostral migratory stream through Met-Grb2 coupling. J. Neurosci. 28, 5901-5909 (2008).
- Platel, J. C., Stamboulian, S., Nguyen, I., Bordey, A. Neurotransmitter signaling in postnatal neurogenesis: The first leg. Brain Res. Rev. 63, 60-71 (2010).
- Dityateva, G., et al. Rapid and efficient electroporation-based gene transfer into primary dissociated neurons. J. Neurosci. Meth. 130, 65-73 (2003).
- Shieh, J. C., Schaar, B. T., Srinivasan, K., Brodsky, F. M., McConnell, S. K. Endocytosis Regulates Cell Soma Translocation and the Distribution of Adhesion Proteins in Migrating Neurons. PloS One. 6, (2011).
- Viesselmann, C., Ballweg, J., Lumbard, D., Dent, E. W. Nucleofection and Primary Culture of Embryonic Mouse Hippocampal and Cortical Neurons. J. Vis. Exp. , e2373 (2011).
- Gartner, A., Collin, L., Lalli, G. Nucleofection of primary neurons. Method Enzymol. 406 (06), 374-388 (2006).
- Causeret, F., et al. The p21-Activated Kinase Is Required for Neuronal Migration in the Cerebral Cortex. Cereb. Cortex. 19, 861-875 (2009).
- Bron, R., Eickholt, B. J., Vermeren, M., Fragale, N., Cohen, J. Functional knockdown of neuropilin-1 in the developing chick nervous system by siRNA hairpins phenocopies genetic ablation in the mouse. Dev. Dynam. 230, 299-308 (2004).
- Sonego, M., et al. Fascin regulates the migration of subventricular zone-derived neuroblasts in the postnatal brain. J. Neurosci. 33, 12171-12185 (2013).
- Ward, M., Rao, Y. Investigations of neuronal migration in the central nervous system. Methods Mol. Biol. 294, 137-156 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient Selection for High-Expression Transfectants with a Novel Eukaryotic Vector. Gene. 108, 193-199 (1991).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487, 407-427 (2005).
- Khlghatyan, J., Saghatelyan, A. Time-lapse Imaging of Neuroblast Migration in Acute Slices of the Adult Mouse Forebrain. J. Vis. Exp. , e4061 (2012).
- Bozoyan, L., Khlghatyan, J., Saghatelyan, A. Astrocytes Control the Development of the Migration-Promoting Vasculature Scaffold in the Postnatal Brain via VEGF Signaling. J. Neurosci. 32, 1687-1704 (2012).
- Whitman, M. C., Fan, W., Rela, L., Rodriguez-Gil, D. J., Greer, C. A. Blood Vessels Form a Migratory Scaffold in the Rostral Migratory Stream. J. Comp. Neurol. 516, 94-104 (2009).
- Sonego, M., Ya, Z., Oudin, M. J., Doherty, P., Lalli, G. In vivo Postnatal Electroporation and Time-lapse Imaging of Neuroblast Migration in Mouse Acute Brain. J. Vis. Exp. , (2013).
- Feliciano, D. M., Lafourcade, C. A., Bordey, A., lique, Neonatal Subventricular Zone Electroporation. J. Vis. Exp. , e50197 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır