Method Article
설치류 Neuroblasts의 Nucleofection는 Neuroblast 마이그레이션을 연구하는
요약
Neuroblast 이주는 출생 후 신경에 중요한 단계입니다. 여기에 설명되는 프로토콜은 DNA / 작은 머리핀 RNA (shRNA를) nucleofection 및 설치류 출생 주동이의 철새 스트림에서 격리 neuroblasts와 3D 마이그레이션 분석을 사용하여 neuroblast 마이그레이션 후보 규제 기관의 역할을 조사 할 수 있습니다.
초록
측면 뇌실의 측면 벽에있는 subventricular 영역 (SVZ)은 성인 신경에 근본적인 역할을한다. 뇌의이 제한된 영역에서 신경 줄기 세포는 증식하고 지속적으로 후각 망울 (OB)에 도달하는 주동이의 철새 스트림 (RMS)을 따라 체인에 접선 방향으로 마이그레이션 neuroblasts를 생성합니다. 일단 OB에서, neuroblasts은 반경 이주로 전환하고 기존의 연결을 네트워크에 통합 할 수 성숙한 신경 세포로 분화. 적절한 neuroblast 마이그레이션은 신생 뉴런의 정확한 기능의 성숙을 보장, 신경에 근본적인 단계이다. 자신의 운동의 기초가되는 세포 내 메커니즘을 조사하고, 뇌에 부상당한 지역을 대상으로 SVZ 파생 neuroblasts의 능력을 감안할 때 신경에 대한 이해를 향상시킬뿐만 아니라, neuroregenerative 전략의 개발을 촉진 할 수 있습니다.
이 원고에 대한 자세한 설명차 설치류의 형질 전환을위한 프로토콜은 출생 neuroblasts 및 생체 내에서 관찰 마이그레이션 자신의 모드를 recapitulating 3D 체외 마이그레이션 분석을 사용하여 자신의 운동의 분석을 RMS. 두 쥐와 마우스 neuroblasts는 플라스미드 DNA, 작은 머리핀 (SH) RNA 또는 짧은 RNA 올리고 관심의 유전자를 대상으로 (SI) 간섭 하나와 nucleofection를 통해 신속하고 효율적으로 형질 전환 할 수있다. 마이그레이션을 분석하기 nucleofected 균체 '매달려 알갱이'에 reaggregated이어서 입체 매트릭스에 매립된다. Nucleofection 자체가 크게 neuroblasts의 이동을 방해하지 않습니다. nucleofected 및 reaggregated neuroblasts의 약물 치료는 neuroblast 마이그레이션에 관련된 신호 전달 경로의 역할을 연구하기 위해 수행 할 수 있습니다.
서문
새로운 뉴런 (신경)의 출생 포유류의 뇌, 세대의 삶 전반에 걸쳐 발생하고 두 신경성 틈새로 제한됩니다 측면 심실의 subventricular 영역 (SVZ) 및 해마 1의 치아 이랑의 subgranular 영역. 최근의 몇몇 연구는 학습과 기억 작업에게 2,3를 촉진 성인 신경의 중요한 역할을 보여 주었다. 또한, 뇌 손상 4-7 다음 신경 전구 세포의 증식과 채용의 증거는 신경 수리 신경의 약리학 적 활성화의 가능성을 제기한다.
출생 후의 신경을 엄격히 신경 전구의 증식, 이동, 분화, 생존, 그리고 새로 태어난 뉴런 8의 최종 시냅스 통합을 포함 모든 단계에서 조절된다. SVZ 줄기 세포에서 파생 된 신경 전구 세포 (neuroblasts)의 주동이의 철새를 통해 먼 거리를 통해 마이그레이션그들은 기능 신경 9 성숙 후각 망울 (OB)으로 스트림 (RMS). 철새 neuroblasts는 하나의 선도적 인 프로세스를 확장 연장 세포체로, 주로 유니 폴라 있습니다. 이러한 세포는 서로 10 위에 슬라이딩 일괄해서 사슬 이동. 마이그레이션 기능 신경 (11)에 SVZ 유래 전구 세포의 연속적인 성숙을위한 중요한 단계입니다 등 여러 요인 및 지침 분자에 의해 제어됩니다 polysialylated 신경 세포 접착 분자 (PSA-NCAM) 12 Ephrins 13, 14 인테그린, 슬릿 (15), 성장은 16 요소와 17 신경 전달 물질, 그러나이 과정의 기초가되는 분자 메커니즘은 완전히 이해되지 않습니다. neuroblast 이동을 규제하는 세포 내 신호 전달 경로를 조사하는 것은 성인 신경의 더 나은 이해를 제공 할뿐만 아니라, 새로운 치료의 발전에 기여할뇌의 복구를 촉진하기 위해 접근한다.
이 원고는 nucleofection 및 3D 마이그레이션 분석을 사용하여 체외에서 neuroblast 마이그레이션 후보 규제 기관의 역할을 연구하기 위해 상세한 프로토콜을 설명합니다. Nucleofection은 전기 천공의 개선 된 방법에 따라 세포 형질 감염 기술이다. 셀 타입 별 전류 및 nucleofection 솔루션을 허용 직접 세포핵 천천히 분할 또는 mitotically 배아와 포유류의 신경 (18)과 같은 비활성 셀의 허가 형질에 같은 DNA와 shRNA를 벡터와 siRNA의 올리고 뉴클레오티드와 같은 폴리 음이온 고분자의 전송. 이 방법은, 빠른 수행하기가 비교적 용이하고 일차 neuroblasts 뉴런 19-21 포함한 세포 유형의 넓은 범위의 높은 재현성 형질 결과이다.
RMS 조직 해리 성공적 DNA / SHR로 nucleofected 수 이동성 neuroblasts의 분리를 허용NA 벡터 또는 siRNA를 올리고 관심의 유전자를 대상으로. nucleofection 이어 neuroblasts은 알갱이 걸려 reaggregated되고이어서 입체 마트 리겔 매트릭스에 매립. 이러한 조건은 따라서 neuroblast 이주에 관여 신호 전달 경로를 조사하고 이들 세포의 운동성에 대한 약리 치료의 영향을 평가하기 위해 우수한 모델 시스템을 제공 neuroblasts 생체 내에서 관찰 이주 모드 recapitulating 세포 집합체 중 이주 할 수있다.
프로토콜
이 절차는 영국 홈 오피스 규정 (동물 과학적인 절차의 법, 1986)에 따른다. 과학자들은 설립하고 자신의 기관 및 국가 동물 규제 기관에 의해 승인 된 지침을 따라야합니다.
1. 해부 및 쥐 RMS Neuroblasts의 해리
- RMS의 해부 및 분리에 필요한 솔루션을 준비 :
해부 배지 (100 ㎖)
행크의 균형 소금 솔루션 (HBSS) - 98.5 ML
5 M HEPES pH가 7.4-0.5 ML
페니실린 스트렙토 마이신 (10,000 단위 / ㎖ 10,000 ㎍ / ㎖) - 1 ㎖
해리 매체 (2 ㎖)
HBSS - 1.760 ML
배 트립신 (2.5 %) - 200 μL
DNAse1 (1 ㎎ / ㎖) - 40 μL
둘 베코 이글의 중간 (DMEM) + 10 % 소 태아 혈청 (FCS) (40 ㎖)에 수정
DMEM -36 ML
FCS - 4 ML
완전 배지 (12 ㎖)
Neurobasal 매체 - 11.46 ML
B27 보충 - 250 μL
L-글루타민 (200 MM) - 125 μL
포도당 (45 %) - 165 μL
2. DMEM + 10 % FCS와 완전한 매체 필터 소독 및 37 ° C / 5 % CO 2 배양기에서 그들을 preequilibrate.
- 해부
- 자궁 전위에 의해 P6-P7 쥐 쓰레기 (약 12 새끼)를 희생하고 가위로 목을 베다.
- 메스 블레이드와 소뇌에 코의 중간 시상 봉합을 따라 피부에 전후의 절개를합니다. 피부를 벗기고 두개골을 따라 같은 절개를 반복합니다.
- 부드럽게 집게와 두개골 뚜껑을 제거하고 조심스럽게 후각 전구를 포함하도록주의하면서 주걱으로 두뇌를 제거합니다.
- 뇌의 가장 꼬리 제를 잘라 버린다.
- 일을 잘라조직 헬기를 사용하여 1.4 mm 두께의 관상 조각으로 전자 뇌 조직.
- 차가운 해부 매체를 포함하는 요리 조각을 놓고 조심스럽게 바늘을 사용하여 구분합니다.
- RMS는 삼각형, OB 구역의 중앙에 더 많은 꼬리 뇌 조각의 작은 원형 영역으로 반투명 영역으로 나타납니다. 주변 조직을 포함하지 않도록주의하면서 미세 수술 칼을 각 조각 중 RMS를 잘라. P7 쥐 새끼에서, 일반적으로 (OB 포함) ~ 8 가장 주동이의 조각은 RMS가 포함되어 있습니다.
- 플라스틱 파스퇴르 피펫으로 RMS 조각을 수집하고 얼음에 차가운 해부 매체를 포함하는 작은 접시에 놓습니다.
- 박리가 완료되면, 플라스틱 피펫으로 15 ㎖의 튜브에 RMS 단편을 전송. 튜브의 바닥에 정착 조각을 남겨주세요.
- 분리
- 해리 배지 2 ㎖로 해부 매체를 교체합니다.
- 부드럽게 P에 의해 RMS 조각을 씹다최대 약 10 배 P1000 피펫을 사용하여 아래로 조각 서스펜션 ipetting.
- 2 분 동안 37 ° C의 물을 욕조에 조직 파편 튜브를 남겨주세요.
- 다시 배를 솔루션을 피펫 단편 (서스펜션이 흐려질한다) 해리했는지 확인하십시오.
- 데워진 DMEM + 10 % FCS 5 ㎖를 추가하여 트립신을 불 활성화.
- 5 분 동안 433 XG에서 세포 현탁액을 원심 분리기.
- 한편 분취에서 에펜 도르프 튜브에의 siRNA / DNA의 필요한 금액 (보통 3-5 μg의 DNA / shRNA를 또는 nucleofection 당 5-9 μg의 siRNA를 올리고 그러나 DNA / siRNA의 양이 최적화가 필요할 수 있습니다.)
- 초과 매체를 제거하고 데워진 DMEM + 10 % FCS 5 ㎖에 부드러운 피펫으로 세포 펠렛을 resuspend.
- 셀 카운트를 수행합니다. 쥐 강아지의 뇌 당 ~ 1 × 10 6 세포를 기대합니다. 동안 2.5 × 10 6 세포의 최소 각 nucleofection 필요합니다최적의 결과는 nucleofection 당 3 ~ 4 × 10 6 세포를 사용하여 달성된다.
- 5 분 동안 433 XG에서 세포 현탁액을 원심 분리기. 가능한 한 많은 매체를 제거해야합니다.
2. Nucleofection
- 이전에 실온에서 배양 신경 nucleofection 용액 (마우스 세포를 사용하는 경우 나 마우스) 즉시 래트에서 세포 펠렛을 재현 탁. nucleofection 당 100 μl를 사용하십시오 :. 일반적으로 12 새끼 쥐 쓰레기 4 nucleofections을 수행하기에 충분하며, 마우스 쓰레기 (12 새끼가) 2 nucleofections을 수행하기에 충분하다.
- siRNA를 / DNA를 포함하는 각 에펜 도르프 튜브에 세포 현탁액 100 μl를 전송하고 P200 피펫과 피펫으로 가볍게 2 - 3 배 혼합.
- 거품을 방지 해주는 nucleofectioncuvette의 바닥에 샘플 (cell-DNA/siRNA 서스펜션)를 추가합니다.
- Nucleofect 프로그램 G-013 (쥐 세포)를 사용 또는 O-005 (대한마우스 세포). 한 nucleofection 약 5 초 정도의 시간이 소요됩니다.
- 빨리 nucleofected 샘플에 데워진 DMEM + 10 % FCS의 1 ML을 추가합니다.
- 반복 2.4 다른 모든 샘플에 대한 2.5 단계를 반복합니다. 참고 : 최적의 결과를 위해, 전체 nucleofection 과정은 5 분보다 더 이상 지속되어야한다.
- nucleofection 키트에서 제공하는 플라스틱 피펫을 사용하여 데워진 DMEM + 10 % FCS 5 ㎖를 포함하는 15 ML 튜브에 각각의 샘플을 전송합니다. 튜브에 어떤 세포 파편을 전송하지 마십시오.
- 5 분 433 XG에 원심 분리기 샘플.
- 주의 깊게 초과 매체를 제거하고 P20 피펫을 사용하여 데워진 DMEM + 10 % FCS의 25 ~ 30 μL에 펠렛을 재현 탁. 매체의 30 μl를 사용하지 마십시오.
- P35 접시 뚜껑의 안쪽에 드롭으로 현탁액을 피펫.
- (그림 1 참조) 완전 배지 2 ㎖를 포함하는 P35의 접시 위에 뚜껑을 반전.
- 에 대한 (37 ° C / 5 % CO 2) 배양기에서 떠나최대 7 시간에 적어도 5 시간합니다. 긴 배양 시간은 세포 클러스터의 더 나은 재 응집 할 수 있습니다.
- 컷 팁 P1000 피펫을 사용하여 접시에 완전한 매체에 뚜껑에서 매달려 방울을 전송합니다.
- DNA의 nucleofections과의 siRNA / shRNA를의 nucleofections 48 시간 동안 24 시간 동안 37 ° C / 5 % CO 2에서 배양한다.
3. 퍼가기
- 완전 배지 (25 ㎖)을 준비하고 몇 시간 동안 37 ° C / 5 % CO 2에서 그것을 preequilibrate.
- -80 ° C 냉동고에서 기저막 행렬의 냉동 분량 씩 꺼내 냉장실에서 얼음에 녹여.
- 각 여덟 13mm 멸균 coverlips까지 포함 6cm 요리를 준비 nucleofection하십시오.
- 집착 필름으로 덮여 아이스 박스에 음식을 놓습니다. 그것은 매립 절차를 수행하는 동안 매트릭스 응고를 방지하기 위해 멋진 커버 슬립을 유지하는 것이 중요합니다.
- 습도를 유지하기 위해 15cm 접시 축축한 내부 조직의 스트립을 배치하는 것이 w병이 포함 된 neuroblasts를 포함하는 세 6cm 요리까지 수용 할 수.
- 1:3 비율로 해동 행렬에 완전 배지를 추가합니다. 예를 들어, 피펫 팅에 의해 행렬의 120 μL로 전체 매체의 40 μl를 섞는다. 행렬의이 금액은 8 ~ 12 밀리의 coverslips에 집계를 포함하기에 충분하다.
- 15 ML 튜브와 원심 분리기에서에 reaggregated 세포 클러스터로 이동 5 분 433 XG.
- 초과 매체를 제거하고 완전한 매체의 10 μL에 펠렛을 재현 탁.
- 각 멸균 커버 슬립에 세포 집계 정지 2 μl를 놓고 매트릭스 / 완전 배지 혼합물의 18 μl를 추가합니다. 전체 커버 슬립을 통해 매트릭스를 확산 피펫 팁을 사용합니다.
- 즉시 15cm 접시에 커버 슬립을 포함 6cm 접시를 놓고 15 ~ 20 분 (37 ° C / 5 % CO 2) 배양기에서 떠난다. 행렬이 응고 할 때, 부드럽게 밀어 각 6cm 요리 돌보는에 5 ㎖ 완전 배지를 추가피펫 팁과 부동 커버 슬립 다운.
- neuroblasts가 세포 집합체 밖으로 마이그레이션 할 수 있도록 37 ° C / 5 % CO 2에서 24 시간 동안 배양한다.
4. 3D 마이그레이션 분석
- 면역 염색에 필요한 솔루션을 준비합니다.
- 블록 솔루션을 준비 :
염소 블록 용액 (50 ㎖)
인산염 완충 생리 식염수 (PBS) - 5 ㎖
염소 혈청 - 12 ML
10 % 트리톤 X-100-1.5 ML
BSA - 50 밀리그램
H 2 O - 36 ML - 4 ° C에서 필터 및 저장
- 고정 솔루션을 준비 :
(100 ㎖) 솔루션을 고정
파라 포름 알데히드 (PFA) - 4g주의 : 항상 후드 PFA 처리
자당 - 20 G (선택 사양)
PBS 최대 100 ML - 핫 플레이트에 일정한 교반하면서 80 ㎖에 PFA를 용해 PBS는 65 ℃로 유지
- PFA가 용해되면, 자당 20g을 추가합니다.
- 에 산도를 조정7.4 (통상 용액 100 ㎖ 당 1 ~ 60 ㎕의 M의 NaOH를 첨가함으로써).
- PBS 100 ML의 총 부피까지 오십시오.
- 블록 솔루션을 준비 :
- 면역 염색
- 24 - 웰 플레이트에 커버 슬립을 놓습니다.
- PBS 배와 커버 슬립을 씻어.
- 실온에서 45 분 동안 고정 솔루션 RMS의 neuroblast 집계를 수정.
- PBS 배와 커버 슬립 (- 락을 플랫폼에서 5 분 / 워시)를 씻어.
- 염소 블록 솔루션을 30 ~ 60 분 동안 차단합니다.
- 염소 블록 솔루션에 기본 항체를 희석하고 4 ℃에서 하룻밤 배양 (원하는 경우, 형광 phalloidin도 (1:400) 및 훽스트 염료 (1:10,000)도 사상 액틴과 핵을 시각화 차 항체 용액에 첨가 될 수있다).
- PBS 배 (5 분 / 워시)와 커버 슬립을 씻어.
- 염소 블록 솔루션 차 항체를 희석하고 실온에서 2 시간 동안 배양한다.
- coversli을 씻어PBS 배와 PS (5 분 / 워시)
- 마운트 형광 설치 매체의 coverslips 실온에서 하룻밤 건조 둡니다.
- 마이그레이션 분석
- 10X 목표를 사용하여 형광 현미경으로 고정 RMS의 neuroblast 집계의 이미지를 캡처합니다. 샘플 이미지의 스케일 바 (가) 있습니다.
- , 정량의 규모를 설정 ImageJ에 도구 모음의 '직선'도구를 선택하여 이미지의 눈금 막대를 측정합니다.
- '분석'옵션을 선택하고 '설정 규모'를 클릭합니다.
- 스케일 창에서 '알려진 거리'를 설정하고 모든 측정에 동일한 설정을 유지하기 위해 '글로벌'상자에 체크.
- 전체 집계 (그림 3B)의 주위에 6 개의 부문에서 멀리 이주 neuroblast로 집계의 가장자리까지의 거리를 측정하기 위해 ImageJ에 도구 모음의 '분단 선'도구를 사용합니다. 만 고립 AG를 고려분석을 위해 gregates.
- 각 집계 얻은 6 값의 평균 이동 거리를 계산합니다.
- 세 개의 독립적 인 실험의 최소으로부터 모든 독립적 인 실험 및 수영장 결과에 각 조건에 대한 10-20 집계를 측정한다. 항상 nucleofection 제어 (예를 들면. GFP 또는 제어 쉬 /의 siRNA) 등이 있습니다.
결과
Neuroblasts 성공적 해부 RMS 조직 (도 1a)로부터 분리하고 입체 매트릭스에 내장 될 수있다. 쥐 또는 마우스 출생의 RMS 하나에서 분리 된 세포는 doublecortin (DCX), βIII의 튜 불린 또는 PSA-NCAM (그림 1B-C)와 같은 철새 neuroblast 마커에 대한 면역 양성이다.
해리 neuroblasts 효율적으로 DNA와 nucleofected 할 수있다 (예를 들면. GFP 인코딩 플라스미드, 그림 2) 서양 얼룩 분석에 의해 평가 될 수있다 단백질의 고갈을 달성하기 위해 또는 shRNA를 플라스미드 (그림 4) (그림 4B) 또는 면역 (도시하지 않음) .
GFP를 코딩하는 플라스미드와 nucleofected 세포 reaggregated neuroblast 클러스터 (그림 3A) 방사상 이동한다. (그림 3B)를 삽입 상대 마이그레이션 거리 24 시간 게시물의 정량화는 GFP-멋 부리다 간 마이그레이션에 차이를 보여줍니다 nucleofection 자체가 이동을 방해하지 않음을 나타내는 세포와 GFP 음성, nonnucleofected 세포 (그림 3C)를 필자. 직접 RMS 이식편 (데이터 미도시) 중 이주 nucleofected neuroblasts 및 neuroblasts 간의 마이그레이션의 정도에 큰 차이는 없다.

그림 1. RMS의 neuroblasts의 해부. RMS의 neuroblast 해부의 (A) 도식 표현. 자세한 설명은 텍스트를 참조하십시오. (B) 고립 된 쥐 RMS 세포는 철새 neuroblast 메이커 DCX와 βlll 튜 불린에 대한 면역 양성이다. 마우스 RMS 외식 밖으로 이주 바, 20 μm의. (C) 세포 철새 neuroblast가 DCX와 PSA-NCAM 마커 표현한다. 바, 20 μm의.0989/50989fig1highres.jpg "대상 ="_blank "> 큰 이미지를 보려면 여기를 클릭하십시오.
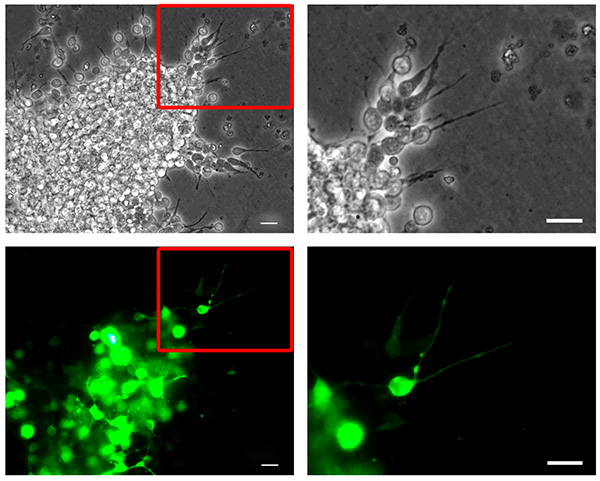
그림 2. 마우스 neuroblast의 nucleofection. 해리 마우스 RMS neuroblasts은 PMAX-GFP로 nucleofected reaggregated, 입체 매트릭스에 매립하고 6 시간 동안 마이그레이션시켰다. reaggregated 세포 클러스터 밖으로 이주 Neuroblasts는 (위, 위상 콘트라스트 사진) 높은 형질 전환 효율 (바닥, GFP 채널 사진)를 보여줍니다. 오른쪽 열 패널은 왼쪽 열 패널에 강조 인 세트에 해당하는 높은 배율의 사진을 보여줍니다. 바, 20 μm의는. 더 큰 이미지를 보려면 여기를 클릭하십시오 .
ontent 폭 = "6 인치"SRC = "/ files/ftp_upload/50989/50989fig3.jpg"폭 = "는 500px"/>
그림 3. 3D 마이그레이션 분석. (A) 쥐 neuroblasts는 PMAX-GFP (GFP) 또는 pCAG-IRES-EGFP reaggregated 22 (EV), 매트릭스에 포함 된 24 시간 동안 마이그레이션 왼쪽으로 nucleofected했다. 세포는 다음 고정 및 GFP (녹색) 및 βIII 튜 불린 (적색)에 대한 면역 염색 하였다. 바, 50 μm의. (B) ImageJ에를 사용하여 이동 거리를 측정합니다. reaggregated 세포 클러스터는 6 동일한 섹터로 나누어 져 있습니다. 클러스터 (점선)과 가장 먼 마이그레이션 셀의 가장자리 사이의 거리가 각 부문을 측정한다. 상대 거리 (C) 정량화 nucleofected 세포에 의해 마이그레이션 (GFP 양성) 및 제어, nonnucleofected 세포 (GFP 음) . 더 큰 이미지를 보려면 여기를 클릭하십시오 .
FO "그림 4"콘텐츠 폭 = SRC = "/ files/ftp_upload/50989/50989fig4.jpg"폭 "6 인치"= "는 500px"/>
그림 4. shRNA를의 nucleofection 후 neuroblast 마이그레이션을 모니터링. (A) 쥐 neuroblasts은 (또한 EGFP 23 표현 PCA-B-EGFPm5 소음기 3) 제어 shRNA를 벡터 또는 shRNA를이 fascin 대상, 말라 - 번들 단백질 (24)를 포함하는 같은 벡터로 nucleofected했다. 세포는 48 시간 동안 reaggregated 매트릭스에 포함 된 24 시간 동안 마이그레이션 남았다. 집계는 다음 고정 및 GFP (녹색) 및 βIII 튜 불린 (적색)에 대한 면역 염색 하였다. 바, 50 μm의. (B) 유효 fascin 고갈 서양 얼룩 분석에 의해하는 shRNA nucleofection 후 50 시간을 검출 할 수있다. 말라가 로딩 컨트롤로 다음과 같습니다 (C) fascin 고갈이 크게 neuroblast 마이그레이션 손상 것을 보여 상대적으로 이동 거리의 정량 분석. (± SEM을 의미 ** p <0.01, N = 3 독립적 인 실험). 큰 이미지를 보려면 여기를 클릭하십시오.
토론
OB의 마지막 위치에 RMS를 따라 neuroblasts의 마이그레이션은 출생 후 신경에 근본적인 단계이다. 그러나이 복잡한 프로세스를 제어하는 분자 메커니즘은 지금까지 완전히 이해되지 있습니다.
여기에 설명 된 실험 절차는 체외에서 neuroblast 이주의 연구를 할 수 있습니다. 우리는 출생 초기 마우스 또는 쥐 25에서 RMS의 neuroblasts을 분리하기위한 이전에 출판 된 프로토콜을 적용했다. 그것은 최소 절개 및 nucleofection 간의 시간 간격을 유지하는 것이 중요하기 때문에 최적의 결과를 달성하기 때문에, 박리 단계를 습득하는 것이 중요하다. nucleofection 후 neuroblasts는 reaggregated 수 입체 매트릭스에 매립하고 24 시간 기간 동안 이주하는 왼쪽. 또한, 마이그레이션 (예를 들면 면역 형광 또는 웨스턴 블롯 분석) 이외의 목적으로, 세포는 즉시 polyornithine/laminin-에 nucleofection 후 도금 될 수있다그들은 4 ~ 5 일까지 생존 코팅 커버 슬립. 마우스와 쥐 neuroblasts 비슷한 정도 리겔에서 마이그레이션 그러나 마우스 세포는 쥐의 세포보다 체인에서 마이그레이션하는 강한 경향이 나타납니다.
연구의 목적에 따라, neuroblasts는 형광 단백질 또는 그 야생형 / 돌연변이 단백질을 코딩하는 다른 플라스미드와 nucleofected 할 수 있습니다. (CMV 증강 및 β-글로빈 폴리-A 꼬리를 가진 β-액틴 프로모터) CAG 프로모터 최적의 단백질 발현 플라스미드를 들어 26은 매우 좋습니다. 또한, siRNA를 올리고 또는 shRNA를 플라스미드는 관심의 대상을 때려 눕힘에 nucleofected 할 수 있습니다. 효과적인 단백질 결핍은 면역 형광 또는 웨스턴 블롯 (일반적으로 표준 용해 완충액 50 μL로 1 쥐 강아지에서 포함 된 집계를 용균)에 의해 시각하실 수 있습니다.
Nucleofection는 기본 neuroblasts 형질하는 비교적 간단한 방법입니다 VI에 쉽고 빠르게 대안을 제공합니다RAL 벡터 - 매개 형질 감염, 및 높은 (~ 70~80%) 형질 감염 효율을 달성 할 수있다. 이 비약적으로 세포 생존 능력을 감소보다 오랫동안 nucleofection 용액 neuroblasts을두기 때문에, nucleofection 절차 동안 빠르게 작동하는 것이 중요하다.
RMS 절제술의 평균 세포 수율은 P7 쥐에 비해 (~ 5 × 10 5 세포 / 뇌) P7 마우스의 경우 상대적으로 낮은 (~ 1 × 10 6 세포 / 뇌)와 nucleofection 당 적어도 3 × 10 6 세포가 필요합니다 50 %의 효율로 형질 ~를 달성했다. 또한, 쥐 neuroblasts 마우스 neuroblasts에 비해 nucleofection 더 나은 저항 나타납니다. 따라서, 출생 초기 (P6-P7) 쥐의 새끼는 쥐와 마우스 RMS의 조직이 현저하게 시미 것을 고려, 편리한 neuroblast 소스를 나타낼 수 있습니다LAR (27)와 체외에서 쥐와 마우스 neuroblast 마이그레이션의 범위도 비교할 수있다. 그것은 세포 형태 및 마이그레이션 (우리의 게시되지 않은 관찰)에 이상이 효과를 방지하기 위해 48 시간 이상을 위해 서스펜션에 nucleofected neuroblasts의 reaggregated 클러스터를 유지하지 않는 것이 좋습니다.
여기에 설명 된 3D 분석은 매트릭스 (예. 24 시간)에 매립 한 후 고정 시점 neuroblast 이주를 정량화하는데 사용될 수있다. 응집체의 크기와 이동 거리 (트립 미발표 관측) 사이에는 유의 한 상관 관계가 없기 때문에 다양한 크기의 응집체는, 분석에 사용될 수있다. 시각화 및 추가 neuroblast 이동의 역학을 조사하기 위해, 시간 경과 영상을 사용할 수 있습니다. 그것은 neuroblasts의 속도가 현저하게 더 시간이 지점에서 (우리의 게시되지 않은 관찰) 감소가 나타납니다 때문에, 삽입 후 24 시간 간격 내에서 마이그레이션 분석을 수행하는 것이 좋습니다.
이 프로토콜에 대한 몇 가지 제한 사항이 있습니다. 바이러스 성 벡터와 감염이 성인 neuroblasts 28에 가장 효율적인 형질 전환 방법을 유지하면서 첫째, nucleofection 지금까지, 출생 초기 설치류 neuroblasts 사용할 수 있습니다. 둘째, 체외 마이그레이션 분석은 완전히 생체 내에서 관찰 된 RMS의 복잡한 구조를 재현하지 않습니다. 실제로, neuroblasts들이 그러한 또한 운동성 9,29 조절에 기여 성상 교세포 및 혈관과 같은 다른 RMS 성분과의 상호 작용이 부족 여기서 설명한 실험 설정에서, 그들의 생체 대조 유사한 방식으로 이주 할 수있는 능력을 유지할 수 있지만, 30. 이 문제는 입체 공동 배양 모델 시스템의 최적화에 의해 앞으로 언급 될 수있다.
결론적으로, 3D 마이그레이션 분석에 nucleofection을 결합하면 더 나은 기초가되는 분자 메커니즘을 이해하는 데 유용한 도구를 나타냅니다neuroblast 마이그레이션. 이 실험 절차는 또한 생체 내 출생의 일렉트로 뇌 슬라이스 문화의 시간 경과 영상과 같은 다른 방법에 의해 검증 될 수 neuroblast 마이그레이션 후보 규제 기관의 역할을 평가하기 위해, 초기 빠르고 비교적 간단한 방법을 제공 28,31,32 .
공개
저자가 공개하는 게 없다.
감사의 말
이 작품은 PD와 GL에게 수여 Wellcome 트러스트 프로젝트 부여 (089236/Z/09/Z)에 의해 투자되었다. SG는 생물 공학 및 생물 과학 연구 협의회의 박사 과정 학생이기 의해 지원되었다. 우리는 neuroblast의 nucleofection에 귀중한 조언을 shRNA를 벡터와 제니퍼 Shieh의 종류의 선물 마티유 Vermeren 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Hank’s Balanced Salt Solution (HBSS) | Invitrogen Life Technologies | 14175129 | |
| HEPES | Sigma-Aldrich | H3375-25G | |
| Penicillin-Streptomycin | Invitrogen Life Technologies | 15140-122 | |
| 2.5% Trypsin-EDTA (10x) | Gibco | 15090-046 | store 200 µl aliquots at -20 °C |
| DNAse I Vial (D2) | Worthington | LK003170 | ≥1,000 units per vial; store 50 µl aliquots at -20 °C |
| Dulbecco Modified Eagle's Medium (DMEM) | Gibco | 11960-044 | |
| Fetal Calf Serum (FCS) | Hyclone | SH3007902 | |
| Neurobasal medium | Gibco | 21103-049 | |
| B27 supplement | Invitrogen Life Technologies | 17504044 | |
| L-Glutamine (200 mM) | Invitrogen Life Technologies | 25030-081 | |
| D-(+)-Glucose solution (45%) | Sigma-Aldrich | G8769 | |
| Matrigel Basement Membrane Matrix, Growth Factor Reduced (GFR), Phenol Red-free, 10 ml, LDEV-Free | BD Biosciences | 356231 | prepare 120 µl aliquots at 4 °C, then store at -80 °C |
| PFA | Sigma-Aldrich | 441242 | |
| Sucrose | BDH | 102745C | |
| Goat serum | Sigma-Aldrich | 69023 | |
| Triton X-100 | VWR International Ltd. | 306324N | |
| BSA | Fisher Chemical | BPE9701-100 | |
| Dako fluorescence mounting medium | Dako | S3023 | |
| Rat neuron nucleofection kit | Lonza | VPG-1003 | |
| Mouse neuron nucleofection kit | Lonza | VPG-1001 | |
| Microsurgical knife | Angiotech | 7516 | |
| McIlwain tissue chopper | The Mickle Laboratory Engineering Company | ||
| Nucleofector II | Lonza |
참고문헌
- Ming, G. L., Song, H. J. Adult Neurogenesis in the Mammalian Brain: Significant Answers and Significant Questions. Neuron. 70, 687-702 (2011).
- Alonso, M., et al. Activation of adult-born neurons facilitates learning and and memory. Nat. Neurosci. 15, 897-U127 (2012).
- Lazarini, F., Lledo, P. M. Is adult neurogenesis essential for olfaction?. Trends Neurosci. 34, 20-30 (2011).
- Arvidsson, A., Collin, T., Kirik, D., Kokaia, Z., Lindvall, O. Neuronal replacement from endogenous precursors in the adult brain after stroke. Nat. Med. 8, 963-970 (2002).
- Jin, K. L., et al. Evidence for stroke-induced neurogenesis in the human brain. Proc. Natl. Acad. Sci. U.S.A. 103, 13198-13202 (2006).
- Kim, Y., Szele, F. G. Activation of subventricular zone stem cells after neuronal injury. Cell Tissue Res. 331, 337-345 (2008).
- Massouh, M., Saghatelyan, A. De-routing neuronal precursors in the adult brain to sites of injury: Role of the vasculature. Neuropharmacology. 58, 877-883 (2010).
- Pathania, M., Yan, L. D., Bordey, A. A symphony of signals conducts early and late stages of adult neurogenesis. Neuropharmacology. 58, 865-876 (2010).
- Lois, C., Alvarez-Buylla, A. Long-Distance Neuronal Migration in the Adult Mammalian Brain. Science. 264, 1145-1148 (1994).
- Lois, C., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Chain migration of neuronal precursors. Science. 271, 978-981 (1996).
- Belvindrah, R., Nissant, A., Lledo, P. M. Abnormal Neuronal Migration Changes the Fate of Developing Neurons in the Postnatal Olfactory Bulb. J. Neurosci. 31, 7551-7562 (2011).
- Battista, D., Rutishauser, U. Removal of Polysialic Acid Triggers Dispersion of Subventricularly Derived Neuroblasts into Surrounding CNS Tissues. J .Neurosci. 30, 3995-4003 (2010).
- Conover, J. C., et al. Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone. Nat. Neurosci. 3, 1091-1097 (2000).
- Mobley, A. K., McCarty, J. H. beta 8 Integrin is Essential for Neuroblast Migration in the Rostral Migratory Stream. Glia. 59, 1579-1587 (2011).
- Nguyen-Ba-Charvet, K. T., et al. Multiple roles for slits in the control of cell migration in the rostral migratory stream. J. Neurosci. 24, 1497-1506 (2004).
- Garzotto, D., Giacobini, P., Crepaldi, T., Fasolo, A., De Marchis, S. Hepatocyte growth factor regulates migration of olfactory interneuron precursors in the rostral migratory stream through Met-Grb2 coupling. J. Neurosci. 28, 5901-5909 (2008).
- Platel, J. C., Stamboulian, S., Nguyen, I., Bordey, A. Neurotransmitter signaling in postnatal neurogenesis: The first leg. Brain Res. Rev. 63, 60-71 (2010).
- Dityateva, G., et al. Rapid and efficient electroporation-based gene transfer into primary dissociated neurons. J. Neurosci. Meth. 130, 65-73 (2003).
- Shieh, J. C., Schaar, B. T., Srinivasan, K., Brodsky, F. M., McConnell, S. K. Endocytosis Regulates Cell Soma Translocation and the Distribution of Adhesion Proteins in Migrating Neurons. PloS One. 6, (2011).
- Viesselmann, C., Ballweg, J., Lumbard, D., Dent, E. W. Nucleofection and Primary Culture of Embryonic Mouse Hippocampal and Cortical Neurons. J. Vis. Exp. , e2373 (2011).
- Gartner, A., Collin, L., Lalli, G. Nucleofection of primary neurons. Method Enzymol. 406 (06), 374-388 (2006).
- Causeret, F., et al. The p21-Activated Kinase Is Required for Neuronal Migration in the Cerebral Cortex. Cereb. Cortex. 19, 861-875 (2009).
- Bron, R., Eickholt, B. J., Vermeren, M., Fragale, N., Cohen, J. Functional knockdown of neuropilin-1 in the developing chick nervous system by siRNA hairpins phenocopies genetic ablation in the mouse. Dev. Dynam. 230, 299-308 (2004).
- Sonego, M., et al. Fascin regulates the migration of subventricular zone-derived neuroblasts in the postnatal brain. J. Neurosci. 33, 12171-12185 (2013).
- Ward, M., Rao, Y. Investigations of neuronal migration in the central nervous system. Methods Mol. Biol. 294, 137-156 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient Selection for High-Expression Transfectants with a Novel Eukaryotic Vector. Gene. 108, 193-199 (1991).
- Peretto, P., Giachino, C., Aimar, P., Fasolo, A., Bonfanti, L. Chain formation and glial tube assembly in the shift from neonatal to adult subventricular zone of the rodent forebrain. J. Comp. Neurol. 487, 407-427 (2005).
- Khlghatyan, J., Saghatelyan, A. Time-lapse Imaging of Neuroblast Migration in Acute Slices of the Adult Mouse Forebrain. J. Vis. Exp. , e4061 (2012).
- Bozoyan, L., Khlghatyan, J., Saghatelyan, A. Astrocytes Control the Development of the Migration-Promoting Vasculature Scaffold in the Postnatal Brain via VEGF Signaling. J. Neurosci. 32, 1687-1704 (2012).
- Whitman, M. C., Fan, W., Rela, L., Rodriguez-Gil, D. J., Greer, C. A. Blood Vessels Form a Migratory Scaffold in the Rostral Migratory Stream. J. Comp. Neurol. 516, 94-104 (2009).
- Sonego, M., Ya, Z., Oudin, M. J., Doherty, P., Lalli, G. In vivo Postnatal Electroporation and Time-lapse Imaging of Neuroblast Migration in Mouse Acute Brain. J. Vis. Exp. , (2013).
- Feliciano, D. M., Lafourcade, C. A., Bordey, A., lique, Neonatal Subventricular Zone Electroporation. J. Vis. Exp. , e50197 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유