需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个全面协议的内侧颞叶结构的手动分割
* 这些作者具有相同的贡献
Erratum Notice
摘要
The present work provides a comprehensive set of guidelines for manually tracing the medial temporal lobe (MTL) structures. This protocol can be applied to research involving structural and/or combined structural-functional magnetic resonance imaging (MRI) investigations of the MTL, in both healthy and clinical groups.
摘要
本论文描述了一个全面的协议集的大脑区域包括内侧颞叶(MTL)的手动跟踪:杏仁核,海马,以及相关的海马旁区(嗅, 嗅和海马旁适当)。可不像其他大多数跟踪协议,通常专注于某些MTL领域( 如杏仁核和/或海马),通过跟踪目前的指导方针综合的角度允许所有MTL次区域的清晰定位。通过从不同的来源,其中包括现存的跟踪协议分别针对不同MTL结构,组织学报告和脑地图集,并用说明性的视觉材料的补充整合信息,本协议为了解准确,直观,方便的引导MTL解剖。需要这样的跟踪指引还示出了由自动和手动分割协议之间可能存在的差异强调。这种知识可以走向不仅涉及结构的MRI调查研究可以应用,而且结构功能的共存与fMRI信号的提取从解剖学上定义的ROI,在健康和临床组的一致好评。
引言
内侧颞叶(MTL),整合感觉信息1的最高水平假定的区域,一直有针对性的分析的常见主题。例如,海马和海马旁相关领域已被广泛研究记忆研究2-5。此外,杏仁核的作用已被频频强调研究探讨情绪加工与情感认知的相互作用6-11。最近,各种各样的现代货箱码头地区也受到了关注个性神经,连接这些和其他脑区的结构和功能在个体的人格特质差异12的新兴领域。评估MTL结构的解剖和功能可促进退行性疾病,其中具体结构和功能异常可发生在不同的现代货箱码头结构的诊断是非常重要的。例如,在阿尔茨海默病(AD),显著一个内嗅皮质和海马的奖杯可以观察到13,14,和海马萎缩可预测从轻度认知损害转变到AD 15。最近的自动分割算法已成为流行的分割皮层和皮层下结构,但与任何工具,这些程序不可避免地在某些情况下会发生错误。在这样的情况下研究者应配备两个的知识和指导方针,识别MTL结构的解剖边界。在现存文献的趋势已经针对个别MTL次区域16-21,有许多协议趋向于集中在海马16-19。
不像大多数的现代货箱跟踪可用的出版方针,本协议提供了一套全面的指引,让所有MTL次区域的清晰定位。以下MTL结构跟踪指导方针进行了说明:杏仁核(AMY),海马(HC),边缘皮层(中国),内嗅皮层(ERC)和旁海马皮层(PHC)。阿美与慧聪首先追查,并再其次是海马旁回(PHG)的结构。注意,通称HC此处用来指对HC的形成,这包括对HC正确,下托,以及在钩回22-24的后段。还请注意,PHG可以分为两部分,前部和后部部分。内PHG的前部,它可以进一步分为外侧和内侧前PHG,其皮层区域对应于中国及ERC,分别。在PHC中,PHG的后侧部分的皮层区域,对应于海马旁皮质正确。为简单起见,我们将使用术语中国和ERC来指外侧和内侧前PHG,和PHC指后PHG。该segme陈述的每个结构始于一个粗定位的前部和后部的边界,以及其他相关的地标,然后接着在冠状面切片进行逐片的实际跟踪,在一个anterior-posterior/rostro-caudal方向。在所有情况下,矢状和轴部分密切监控,以协助解剖界限和标志性建筑的本土化。
需要这样的跟踪准则还示出在数字显示的自动和手动分割协议的输出之间可能存在的差异。一种协议,它描述了所有的MTL结构在当前视觉格式的优点是在变化的解剖结构( 例如,抵押品沟[CS]深度),可以影响边界定义可以在上下文中与周围的解剖结构(将描述如中国和ERC内侧和外侧边界的位置,具体取决于在CS 25的深度)。这可能不是很清楚或可理解为一个没有经验的示踪剂或有经验的示踪剂谁只跟踪单个或独立的结构,并且据我们所知,这种视觉上全面指引不存在。
本协议是在以前的调查,查明差贡献MTL次区域情感26的记忆增强的效果,适用于最近的事态发展在结构磁共振(MR)成像允许更高分辨率的脑图像用于现代货箱跟踪指导方针明确简报。跟踪说明从健康志愿者(女,24岁)获得的扫描,使用的是3T磁共振扫描仪。解剖图像被收购的3D MPRAGE(TR = 1800毫秒,TE = 2.26毫秒; FOV = 256×256毫米,体素大小= 1×0.5×0.5毫米),角平行于AC-PC的收购。如果图像数据被获取具有不同的获取角度,如倾斜取向,该数据应该是章ridded以平行或垂直的方向,以AC-PC,使得解剖标志的描述翻译适当。该图像,然后翻译成NIFTI格式和输入分割软件27手动跟踪。在目前的协议中使用的扫描数据被收集作为被批准的机构审查委员会的一项研究的一部分,并提供了书面同意的志愿者。
通过各种不同的协议跟踪这些结构18-22,28-31,以及从解剖分析和地图集23,32,33图纸信息,本协议提出了一套全面的指引,解决矛盾的现存文献。通过随附的视觉材料的补充,这项工作有望推动现代货箱结构更清晰的认识,并挑起未来的研究兴趣在采用手动分割,无论是作为现代货箱追踪的主要方法还是作为supplementaRy的方法来自动分割。通过提供对于理解现代货箱解剖准确,直观,方便的指南,该协议将有助于研究人员识别出所有MTL次区域的位置,相对于其相邻的结构,即使只有一些MTL结构是专门针对分析。这不仅会增加定位精度,也有利于示踪剂作出明智的决定在形态变异,这是极有可能在MTL的案件。这些准则可以适用于研究涉及MTL的结构和/或功能性磁共振成像研究,包括体积分析和脑异常检测,以及用于功能,解剖定位程序,并tractographic分析,在健康组。本协议也可以被用于通知MTL结构分割为患者( 例如 ,患有萎缩),如果主要解剖标志相对保留。追踪临床学科s'的数据可以采取额外的时间和精力,这取决于萎缩和/或解剖结构变化的严重程度。
定义的ROI时,需要考虑脑回和皮层之间的区别是很重要的。在解剖学上,带回这里指的是白质和灰质,而皮质指事只有灰色。根据不同的使用目的的投资回报率,分割可能包括白质或排除它。
我们建议跟踪按顺序进行,由子子,一个半球的时间。某些软件程序包34允许跟踪概述了一个片被粘贴到随后的切片,一个功能,可以加速这个过程的边界。它始终是最好根据需要来参考相对的半球,以便检查整个双方一致( 例如 ,在检测的解剖学界标)。或者,平行两半球内的相同结构的跟踪S可同时被执行。不管跟踪是否串行或并行,一旦这个过程完成后,示踪剂应仔细检查最终结果,并根据需要进行调整,参照两半球和多平面意见。取决于示踪剂的经验和成像数据的分辨率,对MTL为健康受试者数据的手动分段可以从8-10小时或更多,在一个新手示踪剂的情况下,以3-4小时,在情况的经验之一。
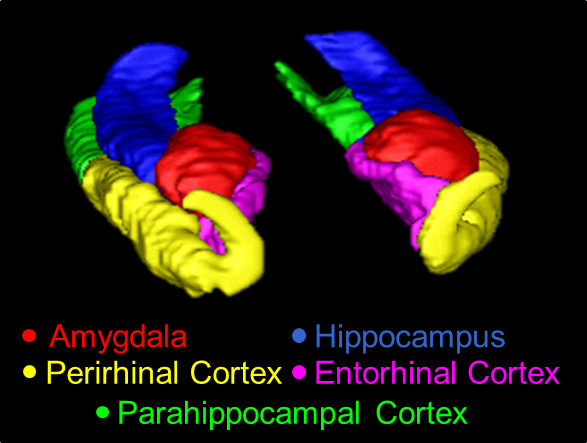
图1。一个3D概述现代货箱码头,利用本协议的追踪。此处所示的结构是AMY(红色),HC(蓝色),中国(黄色),在ERC(粉红色),和初级卫生保健(绿色) 。
研究方案
1,杏仁核
- 艾米的前片
- 找出其中的阈限岛最初出现,那里的额叶和颞叶之间的白质连接是连续的,可见30的AMY的第一片。在冠状视图中,使用角包作为AMY的下侧壁边界。
- 找到视交叉作为一个具有里程碑意义的AMY的外观。用轴向和矢状意见,从周围的钩回区分AMY在其早期片。跟随周边AMY白质束的轴向视图以排除内嗅区32。
- 向后运动,识别第一切片,其中,前连合是贯穿两个半球28,其中AMY是其典型的形状可见连续的。使用嗅沟作为superomedial地界,从semianular sulcu眼底的假想线追踪逆时针AMY沿白质的AMY作为内下方边框,颞干的外侧缘,并回到嗅沟的下尖s到完成跟踪31。
- 在AMY的后片
- 请注意,在这个层面上,无论是AMY和HC在同一个片(S)可见。
- 仍然在冠状视图,识别AMY,其中结构优于内侧延伸侧脑室36的颞角(或alveus如果心室不存在)和横向于钩突回,突起的最后切片慧聪的头。检查的准确性和一致性跟踪的矢状和轴的意见。
- 绘制的假想线从岛的下圆沟的眼底视神经束作为AMY 31,这也区分它从苍白球和壳核的灰质的上缘。
- 沿迹半月回作为superomedial边框和排除钩突回32。使用侧脑室下角和横向划分的时间干。
- 在前后方向的AMY连续切片
- 使用上述有关指引系统地跟踪AMY片逐片。在AMY的前部部分,使用相同的边界,作为最前片;相反,在AMY的后部,使用相同的边界作为最靠后的切片。
- 继续聘请轴向和矢状面的意见,以帮助定义和进一步细化AMY边界。
2,海马
- 本地化慧聪
- 开始跟踪慧聪时,侧脑室颞角出现沿AMY的下侧壁边界。如果侧脑室颞角已经存在于前一个切片,注意,第Ë发病的HC,然后由侧脑室扩大和伸展superolaterally颞角来表示。
- 结束的HC,其最后一个出场的内下方,以侧脑室31的三角跟踪。总是利用不同的观点,帮助本地化HC和它的边界。
- 慧聪的边界定义
- 划定对颞角外侧HC。在情况下,侧脑室颞角是不够的感知,从分割排除的体素中的一个行来表示它。
- Inferiorly,使用束角(或其假想扩展名)的心室腔慧聪从PHG分开。使用alveus随着伞的上缘。在整个使用相同的定义跟踪慧聪。
- 此外,包括下托插入分割,使得其内侧边界的PHG的白质束,优对齐与钩回的曲线,以及主要水平地从HC 37延伸。向后跟踪,维护这些定义,直到距状沟干预。
- 慧聪的注意到分部
- 请注意,HC可分为三个部分:头部,身体和尾巴。
- 使用钩回顶点的外观来标记从HC头向HC体的尺寸的过渡,并迅速升高和膨胀,这通常与穹窿的小腿的外观一致,以表示的HC尾巴的外观23,30,38。
- 跟踪以下结构时要特别注意。
- 包括在分割后钩回。
- 省略脉络丛从在冠状切片的分割的alveus以上,虽然这可能是不可能的较低分辨率图像。
- 指两个不同的观点,以避免包含了C的尾巴audate和枕在慧聪尾优越的方面。
- 通过注意到其出现在穹窿,其中最初它是从海马尾部由片形吸虫灰霉病和更多分离的小腿的水平避免夹杂物的束状回的后部变成灰质优于距状沟32。
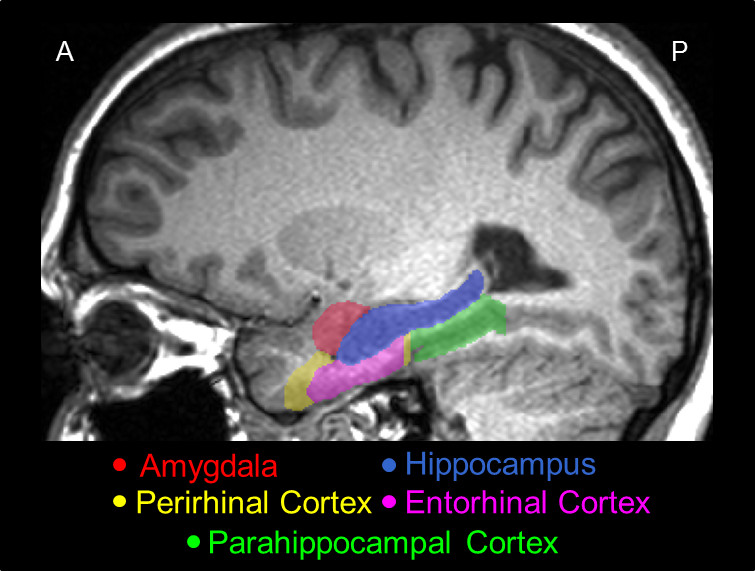
图2。 使用本协议,显示出大脑中的实际位置跟踪的现代货箱码头,并在其主要结构的相对位置的一位代表矢状切片, 即 AMY(红色),HC(蓝色),中国(黄色),在ERC(粉红色),和初级卫生保健(绿色)。
3,海马旁回
- 对PHG的注意到分部
- 注意,PHG约n为分为两个主要部分:前PHG( 即中国和ERC),和后PHG( 即 PHC)。
- 请注意,在所述前部部分,在中国出现早于ERC,并通过其整个过程横向侧翼它。
- 在ERC消失后,注意到,中国涵括其对PHG的地方,并继续对3毫米。
- 超出了这个段,跟踪后PHG,其中PHC接管PHG的宽度,直到其端部30。
- 对PHG的前片
- 定义中国的第一片与CS 25,39的出现。在ERC来临之前,跟踪中国从内侧边缘在CS的横向银行对施瓦尔贝的回的横向眼底,或内侧之一,如果存在施瓦尔贝两回,或的中点在没有这个回25,39背temporopolar表面。
- 开始追查ERC 5 mm的内六角圆柱的阈限岛40,41。
- 继续使用内侧temporopolar沟作为优良端40的眼底,以及半环形沟的眼底的AMY出现之后,或在转角束的假想延伸满足心室腔,如果半环形沟是点跟踪ERC区分25。请注意,它延伸inferiorly直接满足心室腔或软脑膜表面。
- 中国与ERC之间的边界可能会有所不同切片切片。
- 当CS为深 (≥1.5公分),从内侧缘此沟的内侧银行追查中国,其横向银行25的中点。
- 在一个普通的 CS(深度为1-1.5厘米)的情况下,跟踪中国从抵押品沟的沟25的侧堤的内侧端部的内侧银行的中点的区域。
- 以浅CS(<1公分),跟踪中国从这个沟的眼底的梭状回25冠的中点。
- 当CS被中断,通常在钩回顶点的水平,通过新兴从其眼底小回,跟踪中国向外侧沟25的眼底。包括或根据目标投资回报率不包括白质。
- 跟踪ERC直到1.5毫米后的钩回顶点,或回intralimbicus 42月底。
- 延长中国的跟踪内侧占据ERC其终止,在后者的定义一直持续到4.5毫米后适用于钩回顶点,或回intralimbicus 42结束后的地方。中国然后由PHC 25,30被取代。
- 对PHG的后片
- 开始跟踪PHC对切片后至中国的末尾,直到4毫米后到t他最后的HC尾32。从文献的替代定义在讨论部分进行了描述。同样,包含或排除根据目标白质。
- 使用ERC消失后中国的后部所描述的同样的方法描出初级卫生保健。也可以使用扣带的白质为上缘,一旦它出现。继续跟踪,以这种方式,直到距状沟,这superomedially限制了初级卫生保健的沟30的下边缘的外观。
- 如果一个小沟出现在距状沟的出现之前,它包括在分割,但在从距状沟区分它谨慎。
结果
插图手动和自动分割之间可能存在的差异的
手动分割为AMY,慧聪,中国,ERC和肝癌的三维模型如图1所示,和分割的矢状切面示于图2。为了说明手动和自动之间极端的可能差异的目的描记中,艾米从与错误自动分割代表受切片并列手动跟踪(见下图3)。虽然自动分割软件能够识别该结构的核心机构,其分割是相当粗糙的,?...
讨论
传统上,手动分割一直被认为是黄金标准被许多研究者。尽管如此,个别结构的精确划定变得复杂化了MTL结构的高度可变的形态,并通过对周围神经组织和非神经领域这些结构的通常弱的MRI对比。从历史上看,有在文献中已经描述冲突的一些MTL结构。在某些情况下,分割中国,例如,抵押品沟已被描述为中断40,41,但这种先前已在其他文献中描述为一个短的CS不超过该阈限insulae 30?...
披露声明
The authors have no conflicts of interest to declare.
致谢
This research was supported by funds to FD. MM was supported by an IGERT Fellowship under National Science Foundation Grant No. 0903622. The authors wish to thank the Dolcos Lab members for assistance with data collection and preparation.
材料
| Name | Company | Catalog Number | Comments |
| ITK-SNAP | ITK-SNAP Team at University of Pennsylvania and University of Utah | ITK-SNAP v2.2 | |
| FSL | Functional Magnetic Resonance Imaging of the Brain (FMRIB) Analysis Group | FSL v4.1 | |
| Siemens Magnetom Trio 3T MR Scanner | Siemens | Magnetom Trio 3T |
参考文献
- Amaral, D. G. Introduction: what is where in the medial temporal lobe. Hippocampus. 9, 1-6 (1999).
- Squire, L. R., Zola-Morgan, S. The medial temporal lobe memory system. Science. 253 (5026), 1380-1386 (1991).
- Eichenbaum, H., Otto, T., Cohen, N. J. The hippocampus: what does it do. Behavioral & Neural Biology. 57 (1), 2-36 (1992).
- Henke, K., Buck, A., Weber, B., Wieser, H. G. Human hippocampus establishes associations in memory. Hippocampus. 7 (3), 249-256 (1997).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8 (3), 198-204 (1998).
- Dolcos, F., Iordan, A. D., Dolcos, S. Neural correlates of emotion–cognition interactions: a review of evidence from brain imaging investigations. Journal of Cognitive Psychology. 23 (6), 669-694 (2011).
- Davidson, R. J., Irwin, W. The functional neuroanatomy of emotion and affective style. Trends in Cognitive Sciences. 3 (1), 11-21 (1999).
- Lindquist, K. A., Wager, T. D., Kober, H., Bliss-Moreau, E., Barrett, L. F. The brain basis of emotion: a meta-analytic review. The Behavioral and Brain Sciences. 35 (3), 121-143 (2012).
- Phan, K. L., Wager, T., Taylor, S. F., Liberzon, I. Functional neuroanatomy of emotion: a meta-analysis of emotion activation studies in PET and fMRI. Neuroimage. 16 (2), 331-348 (2002).
- Wager, T. D., Phan, K. L., Liberzon, I., Taylor, S. F. Valence, gender, and lateralization of functional brain anatomy in emotion: a meta-analysis of findings from neuroimaging. Neuroimage. 19, 513-531 (2003).
- Zald, D. H. The human amygdala and the emotional evaluation of sensory stimuli. Brain Research Reviews. 41, 88-123 (2003).
- DeYoung, C. G., Hirsh, J. B., Shane, M. S., Papademetris, X., Rajeevan, N., Gray, J. R. Testing predictions from personality neuroscience: brain structure and the big five. Psychological Science. 21 (6), 820-828 (2010).
- Visser, P. J., Verhey, F. R., Hofman, P. A., Scheltens, P., Jolles, J. Medial temporal lobe atrophy predicts Alzheimer’s disease in patients with minor cognitive impairment. Journal of Neurology, Neurosurgery, & Psychiatry. 72 (4), 491-497 (2002).
- Ezekiel, F., et al. Comparisons between global and focal brain atrophy rates in normal aging and Alzheimer disease. Alzheimer Disease & Associated Disorders. 18 (4), 196-201 (2004).
- de Leon, M. J., et al. Imaging and CSF studies in the preclinical diagnosis of Alzheimer’s disease. Annals of the New York Academy of Sciences. 1097, 114-145 (2007).
- Boccardi, M., et al. Survey of protocols for the manual segmentation of the hippocampus: preparatory steps towards a joint EADC-ADNI harmonized protocol. Journal of Alzheimer's Disease. 26, 61-75 (2011).
- Konrad, C., Ukas, T., Nebel, C., Arolt, V., Toga, A. W., Narr, K. L. Defining the human hippocampus in cerebral magnetic resonance images-an overview of current segmentation protocols. Neuroimage. 47 (4), 1185-1195 (2009).
- Hasboun, D., et al. MR determination of hippocampal volume: comparison of three methods. American Journal of Neuroradiology. 17 (6), 1091-1098 (1996).
- Pantel, J., et al. A new method for the in vivo volumetric measurement of the human hippocampus with high neuroanatomical accuracy. Hippocampus. 10, 752-758 (2000).
- Entis, J. J., Doerga, P., Barrett, L. F., Dickerson, B. C. A reliable protocol for the manual segmentation of the human amygdala and its subregions using ultra-high resolution MRI. Neuroimage. 60 (2), 1226-1235 (2012).
- Goncharova, I. I., Dickerson, B. C., Stoub, T. R., deToledo-Morrell, L. MRI of human entorhinal cortex: a reliable protocol for volumetric measurement. Neurobiology of Aging. 22, 737-745 (2001).
- Watson, C., et al. Anatomic basis of amygdaloid and hippocampal volume measurement by magnetic resonance imaging. Neurology. 42 (9), 1743-1750 (1992).
- Duvernoy, H. The human hippocampus: functional anatomy, vascularization, and serial sections with MRI. Third Edition. , (2005).
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Insausti, R., et al. MR volumetric analysis of the human entorhinal, perirhinal, and temporopolar cortices. American Journal of Neuroradiology. 19 (4), 659-671 (1998).
- Dolcos, F., LaBar, K. S., Cabeza, R. Interaction between the amygdala and the medial temporal lobe memory system predicts better memory for emotional events. Neuron. 42 (5), 855-863 (2004).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Bonilha, L., Kobayashi, E., Cendes, F., Li, M. L. Protocol for volumetric segmentation of medial temporal structures using high-resolution 3-D magnetic resonance imaging. Human Brain Mapping. 22 (2), 145-154 (2004).
- Bronen, R. A., Cheung, G. Relationship of hippocampus and amygdala to coronal MRI landmarks. Magnetic Resonance Imaging. 9 (3), 449-457 (1991).
- Pruessner, J. C., et al. Volumetry of temporopolar, perirhinal, entorhinal and parahippocampal cortex from high-resolution MR images: considering the variability of the collateral sulcus. Cerebral Cortex. 12 (12), 1342-1353 (2002).
- Pruessner, J. C., et al. Volumetry of hippocampus and amygdala with high-resolution MRI and three-dimensional analysis software: minimizing the discrepancies between laboratories. Cerebral Cortex. 10 (4), 433-442 (2000).
- Duvernoy, H. . The human brain: surface, three-dimensional sectional anatomy with MRI, and blood supply. Second Edition. , (1999).
- Amaral, D. G., Lavenex, P., et al. . in The hippocampus book. Hippocampal neuroanatomy. , (2006).
- Blaizot, X., et al. The human parahippocampal region: I. temporal pole cytoarchitectonic and MRI correlation. Cerebral Cortex. 20 (9), 2198-2212 (2010).
- Ding, S. -. L., Van Hoesen, G. W. Borders, extent, and topography of human perirhinal cortex as revealed using multiple modern neuroanatomical and pathological markers. Human Brain Mapping. 31 (9), 1359-1379 (2010).
- Ding, S. -. L., Van Hoesen, G. W., Cassell, M. D., Poremba, A. Parcellation of human temporal polar cortex: a combined analysis of multiple cytoarchitectonic, chemoarchitectonic, and pathological markers. The Journal of Comparative Neurology. 514 (6), 595-623 (2009).
- Frankó, E., Insausti, A. M., Artacho-Pérula, E., Insausti, R., Chavoix, C. Identification of the human medial temporal lobe regions on magnetic resonance images. Human Brain Mapping. 35 (1), 248-256 (2014).
- Lehmann, M., et al. Atrophy patterns in Alzheimer's disease and semantic dementia: a comparison of FreeSurfer and manual volumetric measurements. Neuroimage. 49 (3), 2264-2274 (2010).
- Winterburn, J. L., et al. A novel in vivo atlas of human hippocampal subfields using high-resolution 3T magnetic resonance imaging. Neuroimage. 74, 254-265 (2013).
- Malykhin, N. V., Bouchard, T. P., Ogilvie, C. J., Coupland, N. J., Seres, P., Camicioli, R. Three-dimensional volumetric analysis and reconstruction of amygdala and hippocampal head, body and tail. Psychiatry research. Neuroimaging. 155 (2), 155-165 (2007).
- Patenaude, B., Smith, S. M., Kennedy, D. N., Jenkinson, M. A Bayesian model of shape and appearance for subcortical brain segmentation. Neuroimage. 56 (3), 907-922 (2011).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, (2004).
- Woolrich, M. W., et al. Bayesian analysis of neuroimaging data in FSL. Neuroimage. 45, (2009).
- Smith, S. M. Fast robust automated brain extraction. Human Brain Mapping. 17 (3), 143-155 (2002).
- Morey, R. A., et al. A comparison of automated segmentation and manual tracing for quantifying hippocampal and amygdala volumes. Neuroimage. 45 (3), 855-866 (2009).
- Baldassano, C., Beck, D. M., Fei-Fei, L. Differential connectivity within the parahippocampal place area. Neuroimage. 75, 228-237 (2013).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychological Bulletin. 86 (2), 420-428 (1979).
- Bland, J. M., Altman, D. G. A note on the use of the intraclass correlation coefficient in the evaluation of agreement between two methods of measurement. Computers in Biology and Medicine. 20, 337-340 (1990).
- Yushkevich, P. A., et al. A high-resolution computational atlas of the human hippocampus from postmortem magnetic resonance imaging at 9.4 T. Neuroimage. 44 (2), 385-398 (2009).
Erratum
Formal Correction: Erratum: A Comprehensive Protocol for Manual Segmentation of the Medial Temporal Lobe Structures
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A Comprehensive Protocol for Manual Segmentation of the Medial Temporal Lobe Structures. Table 1 and its legend were updated. References 10 and 14 were also updated.
The references were updated from:
- Wager, T. D. & Smith, E. E. Neuroimaging studies of working memory: a meta-analysis. Cognitive, Affective & Behavioral Neuroscience. 3(4), 255-274 (2003).
- Scheltens, Ph, et al. Atrophyofmedialtemporallobeson MRIin 'probable' Alzheimer's disease and normal ageing: diagnostic value and neuropsychological correlates. Journal of Neurology, Neurosurgery, and Psychiatry. 55(10), 967-972, (1992).
to:
- Wager, T. D., Phan, K. L., Liberzon, I., & Taylor, S. F. Valence, gender, and lateralization of functional brain anatomy in emotion: a meta-analysis of findings from neuroimaging. Neuroimage. 19 (3), 513-31, doi:10.1016/S1053-8119(03)00078-8 (2003).
- de Leon, M. J. et al. Imaging and CSF studies in the preclinical diagnosis of Alzheimer's disease. Annals of the New York Academy of Sciences. 1097, 114-145, doi:10.1196/annals.1379.012 (2007).
Table 1 had its legend updated from:
Table 1. Representative volumetric results of the bilateral AMY and the HC of a single subject, from manual tracing using the present protocol and automatic segmentation. Automatic segmentation has underestimated the volume of each of the four structures compared. Corrected volume was calculated as the ratio between Voxel volume and Intracranial volume (ICV). For this subject, ICV = 1446616.73 mm3.
to:
Table 1. Representative volumetric results of the bilateral AMY and the HC of a single subject, from manual tracing using the present protocol and automatic segmentation. Automatic segmentation has misestimated the volume of each of the four structures compared. Corrected volume was calculated as the ratio between Voxel volume and ICV. For this subject, ICV = 1599482.11 mm3. Please click here to view a larger version of this figure.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。