このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
内側側頭葉構造の手動分割のための総合的なプロトコル
* これらの著者は同等に貢献しました
Erratum Notice
要約
The present work provides a comprehensive set of guidelines for manually tracing the medial temporal lobe (MTL) structures. This protocol can be applied to research involving structural and/or combined structural-functional magnetic resonance imaging (MRI) investigations of the MTL, in both healthy and clinical groups.
要約
扁桃体、海馬、および関連する海馬領域(鼻周囲、 嗅内、適切な海馬):本稿では内側側頭葉(MTL)を含む脳領域のセットを手動でトレースするための包括的なプロトコルについて説明します。利用可能な他のほとんどのトレースプロトコルとは異なり、通常は特定のMTL領域( 例えば 、扁桃体および/ または海馬)に焦点を当て、現在のトレースガイドラインが採択した統合的な視点は、すべてのMTLサブ領域を明確に局所化することができます。現存トレースプロトコルが別々に様々なMTL構造、組織学的レポート、および脳の地図帳をターゲットとし、説明の映像資料の補数を含む、さまざまなソースからの情報を統合することによって、本プロトコルは、理解のために、正確で直感的、かつ便利なガイドを提供していますMTLの解剖学。このようなトレースガイドラインの必要性また、自動と手動のセグメンテーションプロトコル間の可能性の違いを示すことで強調されている。この知識は問わず、健康と臨床グループで、だけでなく、構造的なMRIの調査に関連する研究だけでなく、構造的·機能的な共局在し、解剖学的に定義されたROIからのfMRI信号抽出に向かって適用することができます。
概要
内側側頭葉(MTL)は、感覚情報1の最高レベルの統合の推定面積は、対象となる分析を頻繁に対象となっている。例えば、海馬および関連する海馬傍領域は広範囲にメモリの研究2-5に研究されている。また、扁桃体の役割は頻繁に感情処理と感情認知の相互作用6-11調べる研究に強調されている。近年、様々なMTL領域は、12のトレイト人格には個人差にこれらと他の脳領域の構造と機能をリンク人格神経科学の新たな分野で注目されている。 MTL構造の解剖学的構造および機能を評価する特定の構造および機能の異常が、異なるMTL構造において起こり得る変性疾患の診断を容易にする上で重要であることができる。例えば、アルツハイマー病(AD)、有意A嗅内皮質および海馬のトロフィーは、13,14観察することができ、および海馬の萎縮は、AD 15に軽度認知障害からの移行を予測することができます。自動分割アルゴリズムは、最近皮質および皮質下構造をセグメント化するために人気となっているが、任意のツールと同様に、これらのプログラムは、必然的に、場合によってはエラーが発生した。このような場合には研究者が知識とMTL構造の解剖学的な境界線を認識するためのガイドラインの両方を装備する必要があります。現存文献における傾向は、海馬16〜19に集中する傾向が多くのプロトコルで、個々のMTLの部分領域を16〜21を対象としてきました。
MTLのトレースに利用可能な公開されたガイドラインのほとんどとは異なり、本プロトコルは、すべてのMTLサブ領域の明確な定位を可能にガイドラインの包括的なセットを提供します。以下MTL構造のトレースガイドラインが説明されています。扁桃体(AMY)、海馬(HC)、鼻周囲皮質(PRC)、嗅内皮質(ERC)、および海馬傍皮質(PHC)。 AMYおよびHCが最初にトレースされ、その後、海馬傍回(PHG)構造が続いている。一般的な用語のHCは HC適切、鉤状回、そしてuncus 22〜24の後区を含むHC形成、を参照するために、ここで使用されていることに注意してください。また、PHG二つのセグメント、前方部分と後方部分に分けることができることに留意されたい。 PHGの前方部分内に、さらに外側および内側前部皮質領域がそれぞれ、PRCおよびERCに対応PHG、に分けることができる。 PHC、PHGの後方部分の皮質領域は、適切な海馬皮質に対応しています。簡略化の理由から、我々は、後方PHGを指すためにPRCおよびERCは、外側及び内側前部PHGを指すために用語を使用し、PHC説明する。 segme各構造用ntationはanterior-posterior/rostro-caudalで[冠状面でスライスごと実行される実際のトレースが続いている他の関連のランドマークと一緒に、前方および後方の境界線の大まかな位置特定で始まる方向。全ての場合において、矢状および軸方向セクションは、密接に解剖学的ランドマークの境界および局在化を補助するために監視される。
そのようなトレースガイドラインの必要性は、自動および手動セグメンテーションプロトコルの出力との間の可能な差異を表示する図面に示されている。現在の視覚的な形式でMTL構造の全てを記載するプロトコルの利点は、境界線の定義に影響を与えることができる解剖学的構造( 例えば、側副溝[CS]深さ)の変化は、周囲の解剖学的構造( 例えばによる文脈で説明することができることである、中国とERC内側と外側の境界線は、CS 25の深さに応じて位置が異なる)。これは、単一または別々の構造をトレースして、我々の知る限り、このような視覚的に総合的なガイドラインが存在しない未経験トレーサーまたは経験豊富なトレーサーに明らかか理解できないかもしれません。
この議定書は、以前の調査は、構造磁気共鳴(MR)イメージングにおける最近の開発によって許可され、より高解像度の脳画像に適応し、感情26のメモリ増強効果にMTLのサブ領域からの差動貢献を特定する際に、MTLのトレースに使用する指針の明示的な表示である。トレースは3T MRスキャナを使用して、健康なボランティア(女性、24歳)から得たスキャンで示されている。 AC-PCへの取り込み角と平行して、解剖学的画像は3D MPRAGE(ボクセルサイズ= 1×0.5×0.5ミリメートル、TE = 2.26ミリ秒;; FOV = 256×256ミリメートル、TR = 1800ミリ秒)として取得された。画像データは、例えば、斜め方向など異なる取り込み角度で取得された場合、データがあるべきでREG解剖学的ランドマークの説明が適切に翻訳するように、AC-PCに対して平行または垂直の向きにridded。画像は、マニュアルトレース用のセグメント化ソフトウェア27にNIFTI形式や入力に翻訳されました。現在のプロトコルで使用されるスキャンデータは、治験審査委員会により承認された研究の一部であり、書面による同意を提供し、ボランティアとして回収した。
これらの構造18-22,28-31のための様々な個別のトレーシング·プロトコルから、だけでなく、解剖学的な分析とアトラス23,32,33から情報を描画することにより、この議定書は、現存する文献の不整合に対処するガイドラインの包括的なセットを提供します。添付映像資料によって補完、この作業は、MTL構造をより明確に理解を促進し、MTLのトレースの主な方法として、あるいはsupplementaのいずれかとして、手動分割を採用する中で、今後の研究の興味をかき立てることが期待されている自動分割へRY法。 MTLの解剖学的構造を理解するための、正確で直感的、かつ便利なガイドを提供することにより、このプロトコルは、研究者が一部だけMTL構造が具体的な分析対象とされている場合でも、その隣接構造と比較して、すべてのMTLの小領域の位置を特定するのに役立ちます。これはローカライズ精度が向上しますだけでなく、トレーサーがMTLに可能性が高い形態学的変化、例に情報に基づいた意思決定を行うのに役立ちます。これらのガイドラインは、健康的なグループで、体積の分析と脳異常検出だけでなく、機能的、解剖学的、およびtractographic分析のための手順をローカライズなど、MTLの構造的および/または機能的MRIの調査を伴う研究に適用することができます。本プロトコルは、主要な解剖学的標識は、比較的保存されている場合、(萎縮例えば 、患者)の患者のためにMTL構造のセグメンテーションを通知するために使用することができる。臨床対象のトレースS 'のデータが萎縮および/または解剖学的変化の重症度に応じて、追加の時間と労力がかかることがあります。
これは、ROIを定義する際に脳回と皮質の違いを考慮することが重要である。皮質が問題だ灰色に言及しているが、解剖学的に、ここ状回は、白質と灰白質の両方を指す。 ROIの使用目的に応じて、セグメンテーションは、白質を含むか、それを除外することがあります。
私たちは、一度に連続して実行されるトレース、下部構造によって下部構造、一方の半球をお勧めします。特定のソフトウェアパッケージ34は、後続のスライス、プロセスを高速化機能の上に貼り付ける1スライス上に概説され、国境をトレースすることができます。それは、必要に応じて(解剖学的ランドマークを検出する際に、 例えば )双方間の一貫性をチェックするために、反対側の半球を参照するためには、常にお勧めします。 2半球内の同じ構造の別の方法として、並列トレースsが行うこともできる。にかかわらず、プロセスが完了すると、トレースが、順次または並列であるかどうかに、トレーサーは最終結果を再確認し、必要に応じて調整を行い、両半球および複数の平面図を参照する必要があります。トレーサーの経験と撮影データの解像度に応じて、健常者データのためのMTLの手動セグメント化は、8〜10時間以上から、初心者トレーサーの場合、3〜4時間後に、取り込むことができる経験豊富な1例。
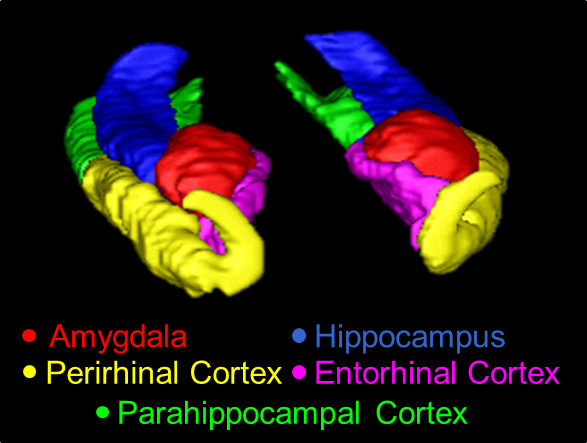
現在のプロトコルを使用して、トレースされた中央構造線の図1。の3Dの概要、ここに示された構造は、AMY(赤)、HC(青)、中国(黄)、ERC(ピンク)、およびPHC(緑)である。
プロトコル
1。扁桃体
- AMYの前方スライス
- 前頭葉と側頭葉の間に白質接続が連続して30見える閾の島が最初に表示されるAMYの最初のスライスを特定します。冠状図では、エイミーの下外側の境界線として、角バンドルを使用しています。
- AMYの出現のためのランドマークとして視交叉の位置を確認します。周囲のuncusからその初期のスライスでAMYを区別するために、軸方向とサジタルビューを使用します。嗅内エリア32を除外するために、軸方向ビューでエイミーの周りの白質路に従ってください。
- 後方に移動し、前交連エイミーは、その典型的な形状で表示されている両半球28、全体で連続である第1のスライスを識別します。 semianular sulcuの眼底から仮想線、superomedialボーダーとして嗅内溝を使用してAMYを反時計回りにトレーストレース31を完了するために戻って嗅内溝にinferomedial境にAMYの劣る先端、外側縁などの一時的なステムとの白質に沿ってS。
- AMYの後スライス
- このレベルで、エイミーとHCの両方が同じスライス(S)で表示されていることに注意してください。
- まだ冠状ビューで、鉤状回、突起および横方向(心室が存在しない場合、または白板)構造が側脳室36の時間的なホーンの内側延長よりも優れているAMYの最後のスライスを識別HCの頭の。正確で一貫性のあるトレースの矢状および軸方向のビューを確認してください。
- 島の劣った円形の溝の底からも淡蒼球と被殻の灰白質と区別AMY 31の上縁として視索に仮想線を描画します。
- に沿ってたどるsuperomedial境に半月状回と鉤状回32を除外します。側脳室の下角と横描写のための一時的なステムを使用してください。
- 前後方向にAMYの連続したスライス
- 体系的に上記の関連するガイドラインを使用したAMYスライスごとにトレースします。 AMYの前方部分には、最前方のスライスと同じ境界を使用します。逆に、エイミーの後方部分で、最も後方のスライスと同じ境界を使用しています。
- 定義し、さらにAMYの境界線を調整を助けるために、軸方向とサジタルビューを採用し続けています。
2。海馬
- HCのローカライズ
- 側脳室の時間的なホーンエイミーの下外側の境界線に沿って表示されたときに、HCのトレースを開始。側脳室の時間的なホーンが前のスライス上に既に存在している場合は、その目に注意してくださいHCのE発症、その後、側脳室が拡大しsuperolaterallyストレッチの時間的なホーンによって示されている。
- 側脳室31の三角にinferomedialその最後の出現とHCのトレースを終了します。常にHCや国境をローカライズ支援するための代替ビューを利用している。
- HCのボーダーの定義
- 一時的なホーンに対して横方向のHCを描く。側脳室の時間的なホーンが十分に知覚でない場合には、それを示すために、セグメンテーションからボクセルの1行を除外します。
- 下方、PHGからのHCを分離するために、心室腔に角度バンドル(またはその延長線)を使用します。上縁として采と一緒に白板を使用してください。全体で同じ定義を使用して、HCをトレースします。
- さらに、それは内側PHGの白質バンドル、上方整列と国境を接するようにセグメンテーションに鉤状回を含めるuncusの曲線と、およびHC 37から主に水平に延びている。 calcarineの溝が介入するまで後方にトレース、これらの定義を維持する。
- HCの注目に部門
- 頭、胴体、および尾:HCは3つのセグメントに分割することができることに留意されたい。
- HCテールの外観を示すために、通常、脳弓の下腿の出現と一致する、サイズのHC本体にHCヘッドからの移行、および迅速な昇順と拡大をマークするUNCAL頂点の外観を使用してください23,30,38。
- 以下の構造をトレースする際に特に注意してください。
- セグメンテーションにおける事後uncusが含まれています。
- これは低解像度の画像で可能ではないかもしれないが、冠状スライス上のセグメンテーションから白板上の脈絡叢を省略します。
- Cの尾の混入を避けるために、二つの別のビューを参照してください。audateおよびHCテールの優れた側面の視床枕。
- 最初はそれが肝蛭·シネレアによって海馬尾から分離されている脳弓の下腿のレベルでその出現を記録することによって束状回の混入を避け、より多くのことは後方calcarineの溝32よりも優れて灰白質になる。
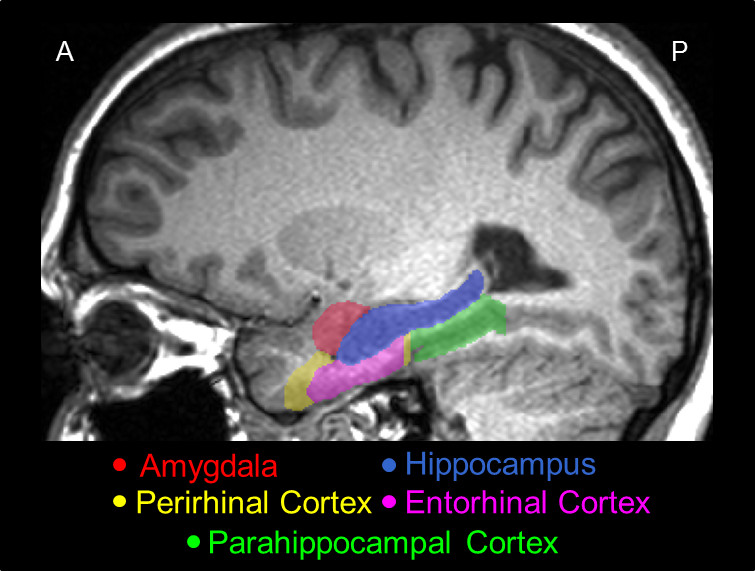
図2。 脳内での実際の位置を示す、本プロトコルを用いてトレースさMTL、その主構造体間の相対位置を表す矢状スライス、 即ち、AMY(赤)、HC(青)、PRC(イエロー) ERC(ピンク)、およびPHC(緑)。
3。海馬傍回
- PHGの注目に部門
- 尚、PHGのCA前方PHG( すなわち 、PRCおよびERC)、および後方PHG( すなわち 、PHC):nは二つの主要なセグメントに分割する。
- 前眼部において、PRCは、ERCより前に表示され、そのコース全体を通して横方向にそれに隣接することに注意してください。
- ERCが消えた後、中国はPHGにその場所を包摂し、3ミリメートルのために継続することに注意してください。
- このセグメントを超えて、PHCが終わり30までPHGの幅を引き継ぐ後部PHGをトレース。
- PHGの前方スライス
- CS 25,39の出現と中国の最初のスライスを定義します。シュワルベの2脳回が存在する場合、ERCの開始前に、CSの左右のバンクの内側縁から横シュワルベの回の眼底、または内側1のそれに中国をトレースするかの中間点この回25,39が存在しない場合にtemporopolar面背側。
- ERC 5ミリメートルのAをトレースを開始nterior 40,41島閾へ。
- AMYが表示された後、優れた端部40、及び半円溝の底のように内側temporopolar溝の底を使用して、ERCをトレースし続ける、あるいは半円溝がある場合は、角の束の延長線が心室空洞を満たしている点25見分けがつかない。それは直接、心室腔または軟膜表面を満たすために下方に延びていることに注意してください。
- 中国とERCの境界をスライスするスライスとは異なる場合があります。
- CSは(≥1.5センチメートル) の深されると、その横の銀行25の中間点に、この溝の内側銀行の内側縁からPRCをトレースします。
- 定期的な CS(1〜センチ深さ)との例では、溝25の横方向の土手の内側の端に担保溝の内側銀行の中間点から領域としてPRCをトレースします。
- と浅いCS(<1 cm)は、紡錘状回25のクラウンの中間点に、この溝の底からPRCをトレースします。
- CSが中断されたとき、通常UNCAL頂点のレベルで、その眼底から出てくる小さな回により、横方向溝25の底にPRCをトレースする。投資収益率の目標に応じて白質が含まれるか、除外します。
- 1.5ミリメートルのUNCAL頂点までの後方、または42 intralimbicus状回が終了するまで、ERCをトレースします。
- 後者の定義は、4.5ミリメートルのUNCAL頂点までの後方、または42 intralimbicus状回が終了するまで、引き続き適用され、その終了後に、ERCの場所を占めるように内側に中国のトレースを拡張します。中国はその後PHC 25,30で置換されている。
- PHGの後スライス
- Tに4ミリメートルの後部まで、中国の最後にスライス後部にPHCをトレースし始める彼は、HCテール32の端。文献からの代替定義は議論の項に記載されている。もう一度、目標に応じて白質を含めたり除外。
- ERCの消失した後、中国の後方部分に記載したのと同じ方法を使用してPHCを描く。それが表示されたら、また上縁として基底結節の白質を使用しています。溝30の下縁にsuperomedially PHCを制限calcarineの溝の登場まで、この方法でトレースを継続する。
- ミニ溝は、セグメンテーションに含め、calcarineの溝の出現の前に表示されますが、calcarineの溝からそれを区別するには慎重でなければなりません。
結果
手動および自動セグメント間の可能な違いの実例
AMY、HC、PRC、ERC及びPHCの手動セグメンテーションの3Dモデルを図1に示されており、セグメント化のサジタル断面が図2に示されている。手動と自動との間の可能な極端な違いを説明する目的のためにトレーシングは、誤った自動化されたセグメント化を担当者対象からAMYのスライスは...
ディスカッション
従来、手動セグメンテーションは、多くの研究者によってゴールドスタンダードと考えられてきた。それにもかかわらず、個々の構造の正確な描写は、MTL構造の高度に可変形態学によって複雑、かつ、周囲の神経組織と非神経領域に対するこれらの構造の通常弱いのMRIコントラストによってされています。歴史的に、いくつかのMTL構造についての文献に矛盾する記述があった。 40,41?...
開示事項
The authors have no conflicts of interest to declare.
謝辞
This research was supported by funds to FD. MM was supported by an IGERT Fellowship under National Science Foundation Grant No. 0903622. The authors wish to thank the Dolcos Lab members for assistance with data collection and preparation.
資料
| Name | Company | Catalog Number | Comments |
| ITK-SNAP | ITK-SNAP Team at University of Pennsylvania and University of Utah | ITK-SNAP v2.2 | |
| FSL | Functional Magnetic Resonance Imaging of the Brain (FMRIB) Analysis Group | FSL v4.1 | |
| Siemens Magnetom Trio 3T MR Scanner | Siemens | Magnetom Trio 3T |
参考文献
- Amaral, D. G. Introduction: what is where in the medial temporal lobe. Hippocampus. 9, 1-6 (1999).
- Squire, L. R., Zola-Morgan, S. The medial temporal lobe memory system. Science. 253 (5026), 1380-1386 (1991).
- Eichenbaum, H., Otto, T., Cohen, N. J. The hippocampus: what does it do. Behavioral & Neural Biology. 57 (1), 2-36 (1992).
- Henke, K., Buck, A., Weber, B., Wieser, H. G. Human hippocampus establishes associations in memory. Hippocampus. 7 (3), 249-256 (1997).
- Tulving, E., Markowitsch, H. J. Episodic and declarative memory: role of the hippocampus. Hippocampus. 8 (3), 198-204 (1998).
- Dolcos, F., Iordan, A. D., Dolcos, S. Neural correlates of emotion–cognition interactions: a review of evidence from brain imaging investigations. Journal of Cognitive Psychology. 23 (6), 669-694 (2011).
- Davidson, R. J., Irwin, W. The functional neuroanatomy of emotion and affective style. Trends in Cognitive Sciences. 3 (1), 11-21 (1999).
- Lindquist, K. A., Wager, T. D., Kober, H., Bliss-Moreau, E., Barrett, L. F. The brain basis of emotion: a meta-analytic review. The Behavioral and Brain Sciences. 35 (3), 121-143 (2012).
- Phan, K. L., Wager, T., Taylor, S. F., Liberzon, I. Functional neuroanatomy of emotion: a meta-analysis of emotion activation studies in PET and fMRI. Neuroimage. 16 (2), 331-348 (2002).
- Wager, T. D., Phan, K. L., Liberzon, I., Taylor, S. F. Valence, gender, and lateralization of functional brain anatomy in emotion: a meta-analysis of findings from neuroimaging. Neuroimage. 19, 513-531 (2003).
- Zald, D. H. The human amygdala and the emotional evaluation of sensory stimuli. Brain Research Reviews. 41, 88-123 (2003).
- DeYoung, C. G., Hirsh, J. B., Shane, M. S., Papademetris, X., Rajeevan, N., Gray, J. R. Testing predictions from personality neuroscience: brain structure and the big five. Psychological Science. 21 (6), 820-828 (2010).
- Visser, P. J., Verhey, F. R., Hofman, P. A., Scheltens, P., Jolles, J. Medial temporal lobe atrophy predicts Alzheimer’s disease in patients with minor cognitive impairment. Journal of Neurology, Neurosurgery, & Psychiatry. 72 (4), 491-497 (2002).
- Ezekiel, F., et al. Comparisons between global and focal brain atrophy rates in normal aging and Alzheimer disease. Alzheimer Disease & Associated Disorders. 18 (4), 196-201 (2004).
- de Leon, M. J., et al. Imaging and CSF studies in the preclinical diagnosis of Alzheimer’s disease. Annals of the New York Academy of Sciences. 1097, 114-145 (2007).
- Boccardi, M., et al. Survey of protocols for the manual segmentation of the hippocampus: preparatory steps towards a joint EADC-ADNI harmonized protocol. Journal of Alzheimer's Disease. 26, 61-75 (2011).
- Konrad, C., Ukas, T., Nebel, C., Arolt, V., Toga, A. W., Narr, K. L. Defining the human hippocampus in cerebral magnetic resonance images-an overview of current segmentation protocols. Neuroimage. 47 (4), 1185-1195 (2009).
- Hasboun, D., et al. MR determination of hippocampal volume: comparison of three methods. American Journal of Neuroradiology. 17 (6), 1091-1098 (1996).
- Pantel, J., et al. A new method for the in vivo volumetric measurement of the human hippocampus with high neuroanatomical accuracy. Hippocampus. 10, 752-758 (2000).
- Entis, J. J., Doerga, P., Barrett, L. F., Dickerson, B. C. A reliable protocol for the manual segmentation of the human amygdala and its subregions using ultra-high resolution MRI. Neuroimage. 60 (2), 1226-1235 (2012).
- Goncharova, I. I., Dickerson, B. C., Stoub, T. R., deToledo-Morrell, L. MRI of human entorhinal cortex: a reliable protocol for volumetric measurement. Neurobiology of Aging. 22, 737-745 (2001).
- Watson, C., et al. Anatomic basis of amygdaloid and hippocampal volume measurement by magnetic resonance imaging. Neurology. 42 (9), 1743-1750 (1992).
- Duvernoy, H. The human hippocampus: functional anatomy, vascularization, and serial sections with MRI. Third Edition. , (2005).
- Amaral, D. G., Witter, M. P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 31 (3), 571-591 (1989).
- Insausti, R., et al. MR volumetric analysis of the human entorhinal, perirhinal, and temporopolar cortices. American Journal of Neuroradiology. 19 (4), 659-671 (1998).
- Dolcos, F., LaBar, K. S., Cabeza, R. Interaction between the amygdala and the medial temporal lobe memory system predicts better memory for emotional events. Neuron. 42 (5), 855-863 (2004).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Bonilha, L., Kobayashi, E., Cendes, F., Li, M. L. Protocol for volumetric segmentation of medial temporal structures using high-resolution 3-D magnetic resonance imaging. Human Brain Mapping. 22 (2), 145-154 (2004).
- Bronen, R. A., Cheung, G. Relationship of hippocampus and amygdala to coronal MRI landmarks. Magnetic Resonance Imaging. 9 (3), 449-457 (1991).
- Pruessner, J. C., et al. Volumetry of temporopolar, perirhinal, entorhinal and parahippocampal cortex from high-resolution MR images: considering the variability of the collateral sulcus. Cerebral Cortex. 12 (12), 1342-1353 (2002).
- Pruessner, J. C., et al. Volumetry of hippocampus and amygdala with high-resolution MRI and three-dimensional analysis software: minimizing the discrepancies between laboratories. Cerebral Cortex. 10 (4), 433-442 (2000).
- Duvernoy, H. . The human brain: surface, three-dimensional sectional anatomy with MRI, and blood supply. Second Edition. , (1999).
- Amaral, D. G., Lavenex, P., et al. . in The hippocampus book. Hippocampal neuroanatomy. , (2006).
- Blaizot, X., et al. The human parahippocampal region: I. temporal pole cytoarchitectonic and MRI correlation. Cerebral Cortex. 20 (9), 2198-2212 (2010).
- Ding, S. -. L., Van Hoesen, G. W. Borders, extent, and topography of human perirhinal cortex as revealed using multiple modern neuroanatomical and pathological markers. Human Brain Mapping. 31 (9), 1359-1379 (2010).
- Ding, S. -. L., Van Hoesen, G. W., Cassell, M. D., Poremba, A. Parcellation of human temporal polar cortex: a combined analysis of multiple cytoarchitectonic, chemoarchitectonic, and pathological markers. The Journal of Comparative Neurology. 514 (6), 595-623 (2009).
- Frankó, E., Insausti, A. M., Artacho-Pérula, E., Insausti, R., Chavoix, C. Identification of the human medial temporal lobe regions on magnetic resonance images. Human Brain Mapping. 35 (1), 248-256 (2014).
- Lehmann, M., et al. Atrophy patterns in Alzheimer's disease and semantic dementia: a comparison of FreeSurfer and manual volumetric measurements. Neuroimage. 49 (3), 2264-2274 (2010).
- Winterburn, J. L., et al. A novel in vivo atlas of human hippocampal subfields using high-resolution 3T magnetic resonance imaging. Neuroimage. 74, 254-265 (2013).
- Malykhin, N. V., Bouchard, T. P., Ogilvie, C. J., Coupland, N. J., Seres, P., Camicioli, R. Three-dimensional volumetric analysis and reconstruction of amygdala and hippocampal head, body and tail. Psychiatry research. Neuroimaging. 155 (2), 155-165 (2007).
- Patenaude, B., Smith, S. M., Kennedy, D. N., Jenkinson, M. A Bayesian model of shape and appearance for subcortical brain segmentation. Neuroimage. 56 (3), 907-922 (2011).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. Neuroimage. 23, (2004).
- Woolrich, M. W., et al. Bayesian analysis of neuroimaging data in FSL. Neuroimage. 45, (2009).
- Smith, S. M. Fast robust automated brain extraction. Human Brain Mapping. 17 (3), 143-155 (2002).
- Morey, R. A., et al. A comparison of automated segmentation and manual tracing for quantifying hippocampal and amygdala volumes. Neuroimage. 45 (3), 855-866 (2009).
- Baldassano, C., Beck, D. M., Fei-Fei, L. Differential connectivity within the parahippocampal place area. Neuroimage. 75, 228-237 (2013).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychological Bulletin. 86 (2), 420-428 (1979).
- Bland, J. M., Altman, D. G. A note on the use of the intraclass correlation coefficient in the evaluation of agreement between two methods of measurement. Computers in Biology and Medicine. 20, 337-340 (1990).
- Yushkevich, P. A., et al. A high-resolution computational atlas of the human hippocampus from postmortem magnetic resonance imaging at 9.4 T. Neuroimage. 44 (2), 385-398 (2009).
Erratum
Formal Correction: Erratum: A Comprehensive Protocol for Manual Segmentation of the Medial Temporal Lobe Structures
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A Comprehensive Protocol for Manual Segmentation of the Medial Temporal Lobe Structures. Table 1 and its legend were updated. References 10 and 14 were also updated.
The references were updated from:
- Wager, T. D. & Smith, E. E. Neuroimaging studies of working memory: a meta-analysis. Cognitive, Affective & Behavioral Neuroscience. 3(4), 255-274 (2003).
- Scheltens, Ph, et al. Atrophyofmedialtemporallobeson MRIin 'probable' Alzheimer's disease and normal ageing: diagnostic value and neuropsychological correlates. Journal of Neurology, Neurosurgery, and Psychiatry. 55(10), 967-972, (1992).
to:
- Wager, T. D., Phan, K. L., Liberzon, I., & Taylor, S. F. Valence, gender, and lateralization of functional brain anatomy in emotion: a meta-analysis of findings from neuroimaging. Neuroimage. 19 (3), 513-31, doi:10.1016/S1053-8119(03)00078-8 (2003).
- de Leon, M. J. et al. Imaging and CSF studies in the preclinical diagnosis of Alzheimer's disease. Annals of the New York Academy of Sciences. 1097, 114-145, doi:10.1196/annals.1379.012 (2007).
Table 1 had its legend updated from:
Table 1. Representative volumetric results of the bilateral AMY and the HC of a single subject, from manual tracing using the present protocol and automatic segmentation. Automatic segmentation has underestimated the volume of each of the four structures compared. Corrected volume was calculated as the ratio between Voxel volume and Intracranial volume (ICV). For this subject, ICV = 1446616.73 mm3.
to:
Table 1. Representative volumetric results of the bilateral AMY and the HC of a single subject, from manual tracing using the present protocol and automatic segmentation. Automatic segmentation has misestimated the volume of each of the four structures compared. Corrected volume was calculated as the ratio between Voxel volume and ICV. For this subject, ICV = 1599482.11 mm3. Please click here to view a larger version of this figure.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved