Method Article
乳腺癌的一种新的转基因小鼠模型:转移性乳腺癌通过瞄准导管上皮与腺病毒Cre重组酶的启动
* 这些作者具有相同的贡献
Erratum Notice
摘要
活化的潜在的突变腺病毒Cre重组到乳腺导管系统的结果在一个临床相关的转移性乳腺癌。注册一个YFP的启动子可以让远端转移性肿瘤细胞的跟踪。这个模型是研究潜转移,抗肿瘤免疫力,而为设计新颖的免疫疗法治疗乳腺癌有用。
摘要
乳腺癌是一种涉及显影肿瘤和免疫系统之间的复杂的相互作用的细胞异质性疾病,最终导致指数肿瘤生长和转移至远侧组织的抗肿瘤免疫的崩溃。许多有用的动物模型存在研究乳腺癌,但没有完全概括了发生在人类疾病的进展。为了更好地理解这导致潜在转移的形成,降低生存的细胞相互作用的,我们已经产生了性成熟后开发的免疫能力的小鼠和驱动YFP表达性导管癌的诱导转基因小鼠模型由一致,内分泌无关癌基因的表达。激活YFP,p53蛋白的消融,和K-ras基因的致癌形式表达,表达Cre重组酶进入性成熟,交配过的雌性小鼠的乳腺导管腺病毒的传递来实现。肿瘤开始致癌事件的开始6周后出现。后肿瘤变得明显,他们进步慢约两周开始成倍增长,才。 7-8周后,腺病毒注射后,脉管系统中观察到的肿瘤块连接到远端淋巴结,与YFP +肿瘤细胞的最终淋巴管浸润到远侧腋窝淋巴结。浸润白细胞种群类似于那些在人乳腺癌,包括αβ和γδT细胞,巨噬细胞和MDSCs的存在下找到。这种独特的模式将有利于参与潜伏的转移和休眠除了是设计新颖的免疫干预治疗浸润性乳腺癌有用细胞和免疫机制的研究。
引言
乳腺癌是最常见的恶性肿瘤发生在全世界妇女1,2和癌症相关死亡2的第二大原因。复杂的遗传3,4,组织学5,和临床表型6用于乳腺癌的各种亚型的特征和经常被用作预测存活的一种手段。妇女患乳腺癌的大型队列研究的分析表明,多数认为死亡的患者(约80%)曾在10年后切除原发肿瘤7的复发。对于大多数侵袭性乳腺癌,淋巴管浸润已被证明是紧密相关的不良预后和疾病8的更积极的临床过程。
因为患乳腺癌的遗传和表型的复杂性,但仍没有概括疾病的整个过程的动物模型。人乳腺肿瘤细胞系已经频繁作为异种移植或免疫缺陷小鼠原位9款车型侵袭性和转移性乳腺癌。虽然信息,这些模型发生在缺乏免疫压力和因为它是一个跨物种接枝,扭曲整个肿瘤微环境的影响。通过乳腺特异性启动子如小鼠乳腺肿瘤病毒(MMTV)和乳清酸性蛋白(WAP)驱动可诱导的基因突变都有助于认识乳腺癌的遗传性质的巨大数量。然而,这些启动子的组织特异性表达是通过它们的反应性受到影响内分泌系统10-16,从而导致诱导的基因突变,不能反映癌基因通常过度表达在人乳腺癌细胞中的表达的变量表达。为了克服癌基因MMTV驱动表达的内分泌调节,穆迪等产生的条件,强力霉素诱导模型在乳房过度NEU上皮17。这个模型在肿瘤形成研究回归和复发后deinducing NEU有用的,但需要不断给予强力霉素对一致的,长期的癌基因的表达。现有的许多有关乳腺肿瘤模型的综合讨论中可以通过瓦戈- Gogola 等 10审查发现
我们的目标是开发可溯源乳腺癌的小鼠模型上的一个完整的C57BL / 6背景下,永磁感应突变事件,模型的新生肿瘤中的免疫压力的存在下形成之后。我们引入了表达Cre重组到含有TP53的两侧装接loxP的等位基因,和K-ras基因的致癌形式,和YFP的转基因小鼠的乳腺导管的腺病毒。的Cre表达烧蚀TP53,在许多乳腺癌18一个常见的突变基因并诱导K-ras基因的致癌基因除了YFP表达明确在乳腺导管上皮细胞。虽然在K-ras突变很少发生在乳腺癌中只有6.5%的乳腺癌患者19,20的存在,上游激酶如Her2/neu的和EGFR结果在人类乳腺肿瘤的Ras信号通路的组成性激活的过表达21-23。的Ras信号通路的许多乳房肿瘤细胞系的活化也有报道24,25。我们将描述肿瘤形成的起始和导管内注入表达Cre重组酶进入性成熟,交配过的雌性小鼠的腺病毒的技术。乳腺癌这种模式的发展明显病变,经过约8周缓慢的肿瘤进展的成倍增长,与淋巴管浸润和转移到腋窝淋巴结7-8个星期。由于这些老鼠是在一个完整的C57BL / 6背景和YFP表达的肿瘤细胞是可追溯的远端淋巴结,这种模式提供了研究ce的一本相关工具潜伏转移llular和免疫机制,将有助于开发新的治疗方法用于治疗转移性乳腺导管癌的治疗。
研究方案
所有的动物实验已获Wistar研究所动物护理和使用委员会。
1。转基因小鼠的产生和维护
- 繁殖LSL-K-ras基因tm4Tyj 26和TRP53 tm1Brn 27(从上一个混合的背景人类癌症协会的NCI小鼠模型得到的),以一个完整的C57BL / 6背景28通过回交至少10代与C57BL / 6小鼠。要跟踪肿瘤转移,培育B6.129X1-GT(ROSA)26Sor TM1(EYFP)产地来源证 / J(LSL-EYFP,从杰克逊实验室在一个完整的C57BL / 6背景获得)与双转基因LSL-K-ras基因G12D / + P53 的loxP / loxP小鼠。
注意:转基因LSL-K-ras基因G12D / + p53基因的loxP / loxP小鼠有loxP位点侧翼的致癌基因K-ras基因和内源性的p53基因座的转录沉默的等位基因,从而当Cre重组酶介导的切除,致癌K-ras基因的过表达突变和p53的消融是阿智eved。
注意:LSL-EYFP小鼠包含一个终止密码子侧翼的基因对于增强型黄色荧光蛋白(YFP),该经Cre重组酶介导的切除导致YFP在那里的YFP停止盒被切除的组织中的表达。- 培育转基因小鼠获得LSL-K-ras基因G12D / + p53基因的loxP / loxP小鼠或LSL-K-ras基因G12D / + p53基因的loxP / loxP位 LSL-EYFP老鼠导管内注射。
注:小鼠LSL-K-ras基因G12D / +,因为小鼠纯合缺失的K-ras的死在子宫内繁殖的纯合子p53基因的loxP / loxP位和杂。用天真的处女雌至少六个星期大的导管内注射。
注意:该引物进行基因分型的纯合子两侧装接loxP的p53等位基因是p53基因- T010-FWD(5'-AAGGGGTATGAGGGACAAGG-3')和p53-T011-反向(5'-GAAGACAGAAAAGGGGAGGG-3')。他们生产的野生型等位基因在391 bp和p53基因在461 bp的29,30两侧装接loxP等位基因。
注意:用于检测K-ras基因的突变形式的引物是oIMR8273(5'-CGCAGACTGTAGAGCAGCG-3')和oIMR8274(5'-CCATGGCTTGAGTAAGTCTGC-3')。它们产生于600bp的检测突变带。
注意:对于YFP记者三重转基因小鼠中,引物以检测ROSA盒(5'-AAGACCGCGAAGAGTTTGTC-3'),野生型等位基因(5'-GGAGCGGGAGAAATGGATATG-3'),和一个共享等位基因(5'-AAAGTCGCTCTGAGTTGTTAT 3'),导致频带在320 bp处两侧装接loxP的等位基因和600 bp的野生型等位基因扩增。
- 培育转基因小鼠获得LSL-K-ras基因G12D / + p53基因的loxP / loxP小鼠或LSL-K-ras基因G12D / + p53基因的loxP / loxP位 LSL-EYFP老鼠导管内注射。
2。手术准备
- 洁净手术材料用75%的乙醇和之前和之后的所有注射高压灭菌。
- 在一个干净整洁的实验室长凳内的动物设施经过消毒室进行手术。擦拭所有表面,包括手术显微镜具有广谱消毒剂溶液,然后用75%乙醇的阶段和拨号。
- 称重并通过腹膜内注射氯胺酮(80-100毫克/千克)和赛拉嗪(8-10毫克/千克)在无菌盐水的混合物的麻醉小鼠。
- 轻轻将小鼠放回笼子里静置5分钟,而他们去麻醉下。在这段时间内产生的病毒沉淀物(见协议3)。
- 验证缺乏对疼痛的反应由脚趾捏的。轻轻覆盖麻醉小鼠的眼睛兽医药膏,以防止过度角膜干燥。
- 为了防止体温过低,将麻醉小鼠到一个加热垫在手术过程中设置为低热量 ,直到他们开始复苏。
- 对于疼痛的管理,管理的小鼠皮下美洛昔康在1毫克/千克的手术和24小时前后。
3。病毒沉淀物的生成
注意:腺病毒载体,虽然它们已被修改,无法复制,带来的风险感染。腺病毒处理谨慎。所有人员应根据处理BSL2剂导管内注射后,按照BSL2规定进行处置腺病毒的机构的指导方针进行适当的培训。
- 店铺腺病毒浓缩病毒储存在-80℃下冻结的每个4×10 8 pfu的,足够的等分试样注入16动物用3ml的腺病毒颗粒的2.5×10 7 pfu的。
- 储存干冰腺病毒等分,直到开始注射前约15-20分钟。
注意:避免反复冻融,病毒滴度每个周期之间的显著下降。
注:腺病毒沉淀物通过修改协议形成之前31说明。 - 重建504毫克MEM粉末用50ml无菌分子级水,补充有244毫克碳酸氢钠和过滤器在无菌条件下并储存于4℃。
- <立>通过加入1.5克氯化钙至50ml的分子级水过滤器和在无菌条件下并储存在4℃下制备的氯化钙溶液
- 混合含有4×10 8 pfu的腺病毒Cre重组酶在无菌水足3%蔗糖为10毫升的最终体积等分试样。添加34毫升MEM的病毒,轻轻混匀。然后加入4毫升的CaCl 2溶液中,轻轻混合,并在室温下孵育15-20分钟。
- 腺病毒储存干冰,直到准备形成沉淀。避免了腺病毒的解冻并存储在冰上或室温下延长的时间,除非沉淀物的形成。
注意:也可以混合使用蔗糖,MEM和氯化钙2之前的手术,如果它是不可能的解冻腺病毒等分并开始制作除去从-80℃后,立即沉淀蔗糖,MEM,和钙的等分试样可以保存在干冰,直到准备添加的腺病毒。
注意:病毒颗粒是稳定约1小时。 - 在此之前每次注射,轻轻一抖管,以确保病毒颗粒混合。拟定病毒颗粒3毫升(2.5×10 7 PFU)到10 ml注射器,并准备进行鼠标的导管内注入。
4。病毒颗粒导管内注入
- 轻轻将鼠标放在其返回到一个干净的解剖显微镜的照明阶段。照亮腹部侧与一个额外的光源和皮草围绕每个乳头的白色小斑块(在C57BL / 6雌性可见)定位左侧4 个或向右9 日腹股沟乳腺。
- 用无菌乙醇浸泡棉花轻轻擦乳头涂药器,以清除从乳头头发和消毒注射部位。如果他们是很难找到,轻轻涂抹一层厚厚的脱毛膏或使用剪刀,露出乳头。
- 除去角栓 ,一层致密的死皮细胞,其覆盖所述奶嘴。一旦乳头露出,角质栓必须容易看到的解剖显微镜下。
- 固定乳头用细手术钳,拉光力以去除角栓。
- 稳定钳之间的乳头。
- 轻轻插入镊子之间的针,cannulating管道管90°。进入乳头微微过去的针(未超过2mm)的斜面,以防止渗透通过乳房组织和成腹侧体腔的浆膜。
- 不要插入针过深。为了确保注射适当的深度,将其插入导管管腔后轻轻拉出针上,绘制乳头向上沿针的边缘,因为它是拉高。
注意:在注射可视化是困难的,因此实用篇PracticE的这一步是使用台盼蓝推荐。
- 不要插入针过深。为了确保注射适当的深度,将其插入导管管腔后轻轻拉出针上,绘制乳头向上沿针的边缘,因为它是拉高。
- 当针被适当地放置到乳腺导管,释放3毫升病毒沉淀物(2.5×10 7 pfu的腺病毒Cre重组酶的),轻轻推插与手握住注射器的拇指注射器。乳头应略微膨胀的液体被添加。
5。恢复小鼠
- 将小鼠放回注射后的加热垫,直到它开始从麻醉中恢复过来。
- 当鼠标被收回,把它重新放入干净的笼子和监测全面复苏和运动。
- 24小时的导管内注射后,皮下给药美洛昔康在1毫克/千克。
6。监测肿瘤进展
- 触诊注入乳腺第30天为扩大和肿胀。
- 监测肿瘤进展每5-7天一次,肿胀,增大乳腺格兰d被观察到。
- 测量肿瘤体积每3-4天对肿瘤生长动力学一度触及的肿瘤出现(约50-60天后腺病毒注射液)。
- 安乐死的小鼠时,肿瘤体积超过的小鼠体重的10%。
结果
乳腺导管树的成功目标可以通过制备乳腺整个坐骑先前注射台盼蓝(验证正确的注射技术( 图1A)或表达的mCherry(以确认正确的病毒制备和感染腺病毒后32描述可视化导管上皮细胞, 图1B)。
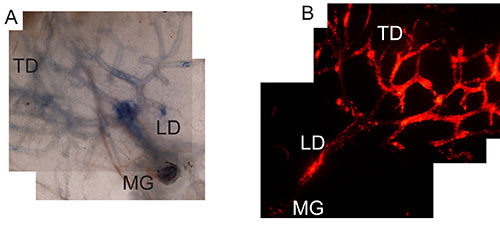
图1:乳腺注射用台盼蓝或腺病毒的mCherry A)导管内靶向整装,如前注射乳腺#4后报32乳腺,用台盼蓝制备3小时后注射到整个导管的可视化/确认目标树。图像是通过注入2.5×10 7 pfu的腺病毒表达的mCherry放大4倍。 二)感染的导管上皮与腺病毒。小鼠intraductally注射4天注射后,乳腺的整体安装的制备,以确认导管树的病毒感染。图像放大4倍。 MG是乳腺,LD是输乳,或主风道,而TD是终末导管。 点击这里查看大图。
当肿瘤诱导的p53 的loxP / loxP位 LSL-K-ras基因G12D / +转基因小鼠,肿瘤不会很明显,直到大约每天40时,乳腺会成为扩大和肿胀。有必要开始触诊时,这是观察,监测肿瘤的生长每隔5-7天。在我们的手中,乳腺硬化总是先于肿瘤发展的发作。肿瘤进展缓慢的一个额外的2个星期。大约56天开始,肿瘤将开始成倍增长( 图2B)。在这一点上,重要的是,如果动力学研究是理想的,因为会出现轻微的鼠标鼠标变异性在肿瘤进展,这是正常的( 图2A和3A)来测量肿瘤体积,每3天。大腹部肿块将是显而易见由80天( 图2A,2B和3A),在这之后的小鼠应安乐死如果肿瘤超过其体重的10%以上。的从荷瘤小鼠3个克隆的cDNA分析表明间皮素的表达,细胞角蛋白8,Her2/neu的,而雌激素受体-α( 图2C)。
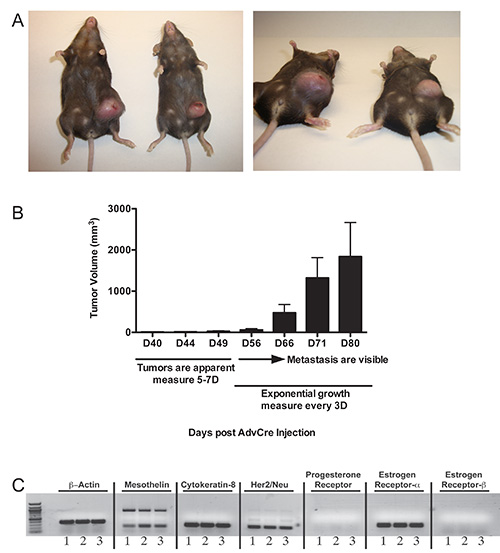
p53基因的loxP>图2。肿瘤发展/ loxP位 LSL-K-ras基因G12D / +小鼠intraductally注射注射腺病毒表达Cre 80天后腺病毒的Cre A)两个例子肿瘤。小鼠给予重组腺病毒表达Cre的2.5×10 7 PFU和80天后的肿瘤启动,大扪群众可以可视化来自动物。 乙 )典型肿瘤动力学和诱导的p53基因的loxP肿瘤触诊日程表的腹部侧突出/从p53基因的loxP / loxP位 LSL-K-ras基因G12D / +小鼠的相同匀浆肿瘤源性三种肿瘤细胞克隆的loxP LSL-K-ras基因G12D / +小鼠。C)表征。 RNA的提取和cDNA合成的用于RT-PCR分析使用特定于β-肌动蛋白,间皮素,细胞角蛋白8,Her2/neu的,孕激素受体,雌激素受体-α,雌激素受体-β的引物。TPS :/ / www.jove.com/files/ftp_upload/51171/51171fig2highres.jpg“目标=”_blank“>点击这里查看大图。
类似于在人乳腺癌细胞微环境中,我们已经观察到αβ和γδT细胞的浸润以及髓源抑制细胞和巨噬细胞进入肿瘤( 图4)。血管引流至腋窝淋巴结就会开始大吃之前,肿瘤已发展到包括整个乳腺组织在其中执行注射( 图3A)。淋巴管浸润的肿瘤细胞和转移可以通过穿越LSL-K-ras基因G12D / + p53基因的loxP / loxP小鼠与LSL-EYFP小鼠进行跟踪。 Cre重组酶介导的切除后,表达YFP(高,低)的肿瘤细胞在肿瘤中检测到,并可以追溯到转移性到引流淋巴结( 图3B)。转移到远端腋窝淋巴结被证实通过培养成功从该网站一个肿瘤细胞系中肿瘤轴承LSL-K-ras基因G12D / + P53 型loxP / loxP位鼠标(数据未显示)。
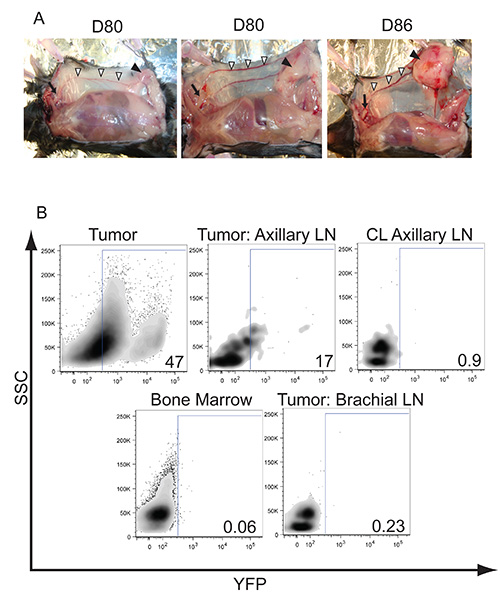
图3。肿瘤的形成和潜在转移到腋窝淋巴结。三个先进的乳腺肿瘤与肿瘤进展的不同费率的 )例子。甲固体物,由箭头,形式和最终表示生长到整个腹部的乳腺组织的大小。肿瘤保持局限在乳腺组织和没有观察到侵入或附加到肌肉覆盖腹腔。还有就是腹股沟和腋窝淋巴结肿大,记为白色箭头之间的腹壁浅静脉怒张明显。经过7-8周,日ë腋窝淋巴结开始成为扩大由于淋巴管浸润的肿瘤细胞中,由箭头B所示),YFP阳性肿瘤细胞的转移可以流式细胞仪进行可视化在腋窝淋巴结流动。 LSL-K-ras基因G12D / + p53基因的loxP / loxP位 LSL-EYFP小鼠使用导管内交付腺病毒的Cre的诱导肿瘤和激活YFP的。以验证淋巴管浸润肿瘤细胞进入淋巴结的80天后注射腺病毒,所指示的淋巴结和器官收获和染色细胞标记物,并检测YFP表达。 CL表示对侧非肿瘤引流淋巴结。结果代表门上的CD45阴性的肿瘤细胞,这表明在肿瘤细胞侵入的远端腋窝淋巴结。数字代表从总人口百分之YFP阳性细胞。 点击这里查看LARG呃形象。
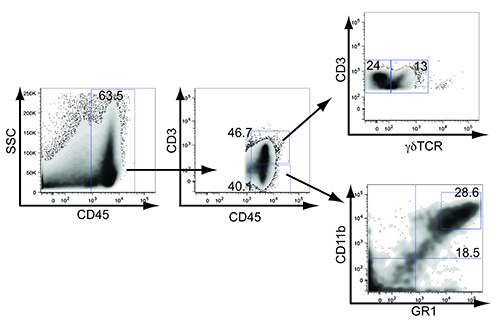
图4。免疫浸润在转基因小鼠乳腺肿瘤。小鼠乳腺肿瘤匀浆和染色CD45,CD3,γδTCR,CD11b和GR1。数字代表在整个肿瘤(63.5)阳性白细胞百分比,总CD3 +(46.7),总CD3为阴性(40.1),总CD3 +γδ+(γδT细胞,13),CD3 +γδnegative(24),总GR1高细胞CD11b(MDSC,28.6)和总的CD11b GR1低(巨噬细胞,18.5)。 点击这里查看大图。
由于鼠标和导管内注射技术的解剖,我们发现针对Øf乳腺4和9( 图5),得到最一致的结果和可靠的注射。然而,任何腺可以根据执行手术的技术人员的喜好,有针对性。
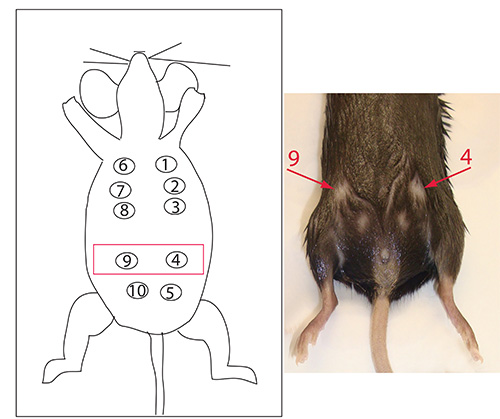
图5。编号乳腺导管。乳腺导管4和9以红色突出显示在图上,用鼠标箭头表示。在我们手中,我们发现,打针是最容易在这些乳腺导管进行,我们有针对性的制定与肿瘤相似的动力学。然而所有其他的乳腺组织点此查看大图。
讨论
这个过程的成功在导管内注入取决于适当的技术,这将是困难的未经训练的实验者。经验丰富的研究人员在我们的实验室通常获得的乳房肿块他们管理腺病毒注射时间的79%。与注入的问题可能会导致显著延迟,可变或不存在肿瘤的发展。如果针头插入过深或不恰当的角度,乳腺导管管可能被错过。进入乳头微微过去的针(未超过2mm)的斜面,以防止渗透通过乳房组织和成腹侧体腔的浆膜是很重要的。另外,大于3毫升病毒析出物的针或注射过浅放置可导致病毒制备的乳腺和无意肿瘤的诱导外的泄漏。为克服这些问题的一种方法是插入针插入乳头微微deeper除3毫米,慢慢抽出注射器备份出来的管道,直到2 mm从该斜面的前端。这将确保乳腺组织对象,而不是周围的小鼠腹腔( 图1A)的肌肉。这也将沿着注射器的边缘舒展的乳头,这样,当病毒被排出到管道,存在的病毒沉淀物的无泄漏和损耗。
注射的可视化是困难的,实践建议使用此步骤。我们观察到增加成功的注射下面的练习,导致肿瘤发展的一个更高的渗透率。因为这种技术利用非泌乳处女雌性,关键是要去除角栓覆盖乳头以露出下面的导管管。我们建议您通过注射台盼蓝或其它无菌可追溯染料在管道内,并准备整个乳腺坐骑,以确认导管TR的瞄准练习这一步EE。此外,描述了导管内注入试剂的其它协议已经公布33,34,其可以用于开发适当的技术是有用的。用病毒制剂的导管管腔或感染的问题也可以通过使用的mCherry表达腺病毒的影响。非转基因小鼠可用于每一种用途,直到注射技术进行了优化。
虽然任何乳腺可以用来发起的肿瘤,我们已经通过靶向乳腺4或9,我们相信这是因为它更容易在这些腺体进行适当的注入,导致了更有效的定位来实现最稳定的生长速率风管。左边第 4的附近或右侧9 个腹股沟乳腺至排放腹股沟淋巴结也是有用的在肿瘤进展的不同的时间点来检查抗肿瘤免疫反应。建模和跟踪潜在转移到远端站点,Transgenic小鼠越过LSL-EYFP小鼠。随着肿瘤的进展,血管瘤连接到腋窝淋巴结,会产生轻微肿胀以大约5周后,肿瘤开始成倍增长( 图3A)之前。最终,7-8周后,淋巴管浸润,将导致肿瘤生长的腋淋巴结( 图3A和3B)内。记者用小鼠和酶Cre-loxP位技术,YFP注册成立创建了一个平台来追踪肿瘤细胞的转移性到远端站点在肿瘤进展。这有助于研究旨在阐明促进潜在转移的细胞和表观遗传机制。在我们的手中,乳腺肿瘤细胞系表达细胞角蛋白8,间皮素,雌激素受体α和Her2/neu的,证实的乳腺导管上皮目标。然而,根据诱发突变和由于难度和注射剂的变异性,建议一旦肿瘤模型的组织学特征是公认的实验室。
因为乳腺癌是这样一个致命的和普遍的疾病1,2,它使用的动物模型,准确地概括肿瘤和宿主之间复杂的相互作用是很重要的。在这里,我们描述了乳腺肿瘤的完全回交C57BL / 6小鼠模型。首先,从原生细胞诱导的肿瘤,我们使肿瘤在一个完整的免疫微环境的自然演变。在先进的小鼠乳腺肿瘤的免疫微概括αβ的人群和γδT细胞,髓细胞源性抑制细胞和巨噬细胞在人乳腺癌中观察到( 图4)。正如我们以前所使用的腺病毒Cre重组诱发卵巢肿瘤公布,我们发现病毒注射液对相应的肿瘤浸润和肿瘤进展28的影响可以忽略。二,内分泌独立癌基因的表达,确保肿瘤细胞有持续高水平的靶基因的表达。第三,通过利用潜突变优点,我们可以控制肿瘤发生的时间,以促进肿瘤演进的精确时间跟踪。该模型的应用包括对肿瘤细胞生物学的研究,对因子在肿瘤微环境中,抗肿瘤免疫反应,甚至功效的新疗法的评价研究。通过酶Cre-loxP系统的可用性,这种技术可以用作用于调查的额外的突变在乳腺肿瘤的发生和发展一个多样化的平台。我们希望使用这种模式将提高乳腺癌生物学的理解,并最终导致新的治疗目的是治疗转移性乳腺癌。
披露声明
作者宣称没有竞争的财务权益。
致谢
这项工作是由美国国立癌症研究所资助RO1CA157664和RO1CA124515支持和乳腺癌联盟奖。我们要感谢杰弗里·浮士德,大卫·安布罗斯和斯科特韦斯从只Wistar流式细胞仪核心设施,从只Wistar成像设备詹姆斯·海登和Wistar研究所动物基金提供了宝贵的技术支持的全体工作人员。
材料
| Name | Company | Catalog Number | Comments |
| Trp53tm1Brn Transgenic mice K-rastm4Tyj Transgenic mice | Obtained from NCI mouse models of human cancer consortium | Mice were backcrossed ten times to a full C57BL/6 background | |
| B6.129X1- Gt(ROSA)26Sortm1(EYFP)Cos/J Transgenic mice | Jackson Labs | 006148 | |
| Primers p53loxP/loxP | Integrated DNA Technologies | 5'-AAGGGGTATGAGGGACAAGG-3' 5'-GAAGACAGAAAAGGGGAGGG-3' | |
| Primers LSL-K-rasG12D/+ | Integrated DNA Technologies | 5'-CGCAGACTGTAGAGCAGCG-3' 5'-CCATGGCTTGAGTAAGTCTGC-3' | |
| Primers for LSL-EYFP to detect Rosa promoter | Integrated DNA Technologies | 5'-AAGACCGCGAAGAGTTTGTC-3' 5'-GGAGCGGGAGAAATGGATATG-3' 5'-AAAGTCGCTCTGAGTTGTTAT-3' | |
| Primers for detection of Mesothelin expression | Integrated DNA Technologies | 5'-TTGGGTGGATACCACGTCTG-3' 5'-CGGAGTGTAATGTTCTTCTGTC-3' | |
| Primers for detection of Progesterone Receptor expression | Integrated DNA Technologies | 5'-GCAATGGAAGGGCAGCATAA-3' 5'-TGGCGGGACCAGTTGAATTT-3' | |
| Primers for detection of Cytokeratin 8 expression | Integrated DNA Technologies | 5'-ATCAGCTCTTCCAGCTTTTCCC-3' 5'-GAAGCGCACCTTGTCAATGAAGG-3' | |
| Primers for detection of Erbb2 expression | Integrated DNA Technologies | 5'-ACCTGCCCCTACAACTACCT-3' 5'-AAATGCCAGGCTCCCAAAGA-3' | |
| Primers for detection of Estrogen Receptor A expression | Integrated DNA Technologies | 5'-ATGAAAGGCGGCATACGGAA-3' 5'-GCGGTTCAGCATCCAACAAG-3' | |
| Primers for detection of Estrogen Receptor B expression | Integrated DNA Technologies | 5'-ACCCAATGTGCTAGTGAGCC-3' 5'-TGAGGACCTGTCCAGAACGA-3' | |
| Primers for detection of B-Actin expression | Integrated DNA Technologies | 5'-GCCTTCCTTCTTGGGTATGG-3' 5'-CAGCTCAGTAACAGTCCGCC-3' | |
| Adenovirus-Cre | Gene Transfer Vector Core from the University of Iowa | Ad5CMVCre | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Adenovirus-mCherry | Gene Transfer Vector Core from the University of Iowa | Ad5CMVmCherry | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Hamilton syringe | Hamilton company | 701RN | 10 μl syringe, RN series. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Custom needle | Hamilton company | 7803-05 | 33 G 0.5 in long RN needle, with a 12° bevel. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Surgical forceps | Dumont | 52100-58 | Dumostar No. 5 forceps. Clean with 75% ethanol after each use, followed by autoclaving |
| MEM powder | Cellgro | 50 012 PB | Store at 4 °C in powder and reconstituted form |
| Sodium Bicarbonate | Fisher | S233 | Add to MEM and filter stearilize |
| Calcium Chloride | Sigma | C4901 | Minimum 96%, anhydrous |
参考文献
- Youlden, D., et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival and mortality. Cancer Epidemiol. 36, 237-248 (2012).
- Siegel, R., Naishadham, D. Cancer statistics, 2012. Cancer J. Clin. 62, 10-29 (2012).
- Sorlie, T., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc. Natl. Acad. Sci. U.S.A. 98, 10869-10874 (2001).
- Gatza, M., et al. A pathway-based classification of human breast cancer. Proc. Natl. Acad. Sci. U.S.A. 107, 6994-6999 (2010).
- Bastien, R., et al. PAM50 breast cancer subtyping by RT-qPCR and concordance with standard clinical molecular markers. BMC Med. Genom. 5, 44 (2012).
- Montagna, E., et al. Heterogeneity of triple-negative breast cancer: histologic subtyping to inform the outcome. Clin. Breast Cancer. 13, 31-39 (2013).
- Karrison, T. G., Ferguson, D. J., Meier, P. Dormancy of mammary carcinoma after mastectomy. J. Natl. Cancer Inst. 91, 80-85 (1999).
- Rakha, E., et al. The prognostic significance of lymphovascular invasion in invasive breast carcinoma. Cancer. 118, 3670-3680 (2012).
- Kim, I., Baek, S. Mouse models for breast cancer metastasis. Biochem. Biophys. Res. Commun. 394, 443-447 (2010).
- Vargo-Gogola, T., Rosen, J. Modelling breast cancer: one size does not fit all. Nat. Cancer. 7, 659-672 (2007).
- Archer, T., et al. Steroid hormone receptor status defines the MMTV promoter chromatin structure in vivo. J. Steroid Biochem. Mol. Biol. 53, 421-429 (1995).
- Cato, A., Henderson, D., Ponta, H. The hormone response element of the mouse mammary tumour virus DNA mediates the progestin and androgen induction of transcription in the proviral long terminal repeat region. EMBO J. 6, 363-368 (1987).
- Schoenenberger, C., Zuk, A., Groner, B., Jones, W., Andres, A. Induction of the endogenous whey acidic protein (Wap) gene and a Wap-myc hybrid gene in primary murine mammary organoids. Dev. Biol. , 327-337 (1990).
- Li, Y., et al. Deficiency of Pten accelerates mammary oncogenesis in MMTV-Wnt-1 transgenic mice. BMC Mol. Biol. 2, 2 (2001).
- Martelli, C., et al. In vivo imaging of lymph node migration of MNP- and (111)In-labeled dendritic cells in a transgenic mouse model of breast cancer (MMTV-Ras). Mol. Imaging Biol. 14, 183-196 (2012).
- Klover, P. J., et al. Loss of STAT1 from mouse mammary epithelium results in an increased Neu-induced tumor burden. Neoplasia. 12, 899-905 (2010).
- Moody, S. E., et al. Conditional activation of Neu in the mammary epithelium of transgenic mice results in reversible pulmonary metastasis. Cancer Cell. 2, 451-461 (2002).
- Banerji, S., et al. Sequence analysis of mutations and translocations across breast cancer subtypes. Nature. 486, 405-409 (2012).
- Miyakis, S., Sourvinos, G., Spandidos, D. A. Differential expression and mutation of the ras family genes in human breast cancer. Biochem. Biophys. Res. Commun. 251, 609-612 (1998).
- Malaney, S., Daly, R. J. The ras signaling pathway in mammary tumorigenesis and metastasis. J. Mammary Gland Biol. Neoplasia. 6, 101-113 (2001).
- Loboda, A., et al. A gene expression signature of RAS pathway dependence predicts response to PI3K and RAS pathway inhibitors and expands the population of RAS pathway activated tumors. BMC Med. Genomics. 3, 26 (2010).
- von Lintig, F. C., et al. Ras activation in human breast cancer. Breast Cancer Res. Treat. 62, 51-62 (2000).
- Downward, J. Targeting RAS signalling pathways in cancer therapy. Nat. Rev. Cancer. 3, 11-22 (2003).
- Eckert, L. B., et al. Involvement of Ras activation in human breast cancer cell signaling, invasion, and anoikis. Cancer Res. 64, 4585-4592 (2004).
- Hollestelle, A., Elstrodt, F., Nagel, J., Kallemeijn, W., Schutte, M. Phosphatidylinositol-3-OH kinase or RAS pathway mutations in human breast cancer cell lines. Mol. Cancer Res. 5, 195-201 (2007).
- Jackson, E., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes Dev. 15, 3243-3248 (2001).
- Jonkers, J., et al. Synergistic tumor suppressor activity of BRCA2 and p53 in a conditional mouse model for breast cancer. Nat. Genet. 29, 418-425 (2001).
- Scarlett, U., et al. Ovarian cancer progression is controlled by phenotypic changes in dendritic cells. Exp. Med. 209, 495-506 (2012).
- Vooijs, M., Jonkers, J., Berns, A. A highly efficient ligand-regulated Cre recombinase mouse line shows that LoxP recombination is position dependent. EMBO Rep. 2, 292-297 (2001).
- Young, N., Crowley, D., Jacks, T. Uncoupling cancer mutations reveals critical timing of p53 loss in sarcomagenesis. Cancer Res. 71, 4040-4047 (2011).
- Dinulescu, D., et al. Role of K-ras and Pten in the development of mouse models of endometriosis and endometrioid ovarian cancer. Nat. Med. 11, 63-70 (2005).
- Landua, J., Visbal, A., Lewis, M. Methods for preparing fluorescent and neutral red-stained whole mounts of mouse mammary glands. J. Mammary Gland Biol. Neoplasia. 14, 411-415 (2009).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. J. Vis. Exp. , e4030 (2012).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
Erratum
Formal Correction: Erratum: Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer
Posted by JoVE Editors on 10/20/2014. Citeable Link.
A correction was made to Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer. Protocol sections 3.1, 3.3.2, 3.4, and 4.7 were updated. The materials table was also updated.
Protocol section 3.1 was updated from:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 ml of 2.5 x 107 pfu of adenovirus particles.
to:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 µl of 2.5 x 107 pfu of adenovirus particles.
Protocol section 3.3.2 was updated from:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 ml. Add 34 ml of MEM to the virus and gently mix. Then add 4 ml of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
to:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 µl. Add 34 µl of MEM to the virus and gently mix. Then add 4 µl of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
Protocol section 3.4 was updated from:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 ml (2.5 x 107 pfu) of virus particles into the 10 ml syringe and prepare the mouse for the intraductal injection.
to:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 µl (2.5 x 107 pfu) of virus particles into the 10 µl syringe and prepare the mouse for the intraductal injection.
Protocol section 4.7 was updated from:
When the needle is appropriately placed into the mammary duct, release the 3 ml of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
to:
When the needle is appropriately placed into the mammary duct, release the 3 µl of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
Item 15 in the Materials table under Comments was updated from:
10ml syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
to:
10µl syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。