Method Article
乳癌の新規トランスジェニックマウスモデル:アデノ-Creを持つ乳管上皮の標的とすることにより、転移性乳癌の開始
* これらの著者は同等に貢献しました
Erratum Notice
要約
臨床的に関連する転移性乳癌における乳管系の結果へのアデノウイルス-Creを持つ潜在変異の活性化。 YFPプロモーターの組み込みは、遠位の転移性腫瘍細胞の追跡を可能にする。このモデルは、潜在性転移、抗腫瘍免疫、および乳癌を治療するための新規な免疫療法を設計するための研究に有用である。
要約
乳癌は、最終的に遠位の組織および抗腫瘍免疫の崩壊指数関数的腫瘍増殖および転移を生じる、現像腫瘍および免疫系の細胞の間の複雑な相互作用を伴う不均一な疾患である。多くの有用な動物モデルは、乳癌を研究するために存在するが、どれも完全にヒトで起こる疾患進行を再現しない。潜在性転移の形成をもたらし、生存率の低下細胞相互作用をより良く理解するために、我々は免疫コンピテントマウスにおいて、性的に成熟した後に現像するYFPを発現する乳管癌の誘導性トランスジェニックマウスモデルを生成して駆動される一貫性のある、内分泌依存しない癌遺伝子発現による。 YFP、p53のアブレーションの活性化、およびK-rasの発癌形式の式は、性的に成熟した、処女雌マウスの乳房ダクト内のCreリコンビナーゼを発現するアデノウイルスの送達によって達成された。腫瘍は6週間発癌イベント開始後現れ始める。腫瘍が明白になった後、彼らが指数関数的に成長し始める前に、彼らは約2週間ゆっくりと進行する。 7-8週間後にアデノウイルス注射後、血管系は、遠位腋窩リンパ節へのYFP +腫瘍細胞の最終的なリンパ管浸潤と、遠位リンパ節に腫瘍塊を連結観察される。白血球集団を浸透させることはαβおよびγδT細胞、マクロファージとのMDSCの存在を含む、ヒトの乳癌で見られるものと同様である。このユニークなモデルは、浸潤性乳癌を治療するための新規免疫療法の介入を設計するために有用であることに加えて潜在性転移および休眠に関与する細胞及び免疫学的メカニズムの研究を促進する。
概要
乳がんは世界で1,2および癌関連死2原因の第2位を通して女性で最も一般的に発生する悪性腫瘍である。複雑な遺伝3,4、5学的、および臨床表現型6は、乳癌の様々なサブタイプを特徴付けるために使用され、しばしば生存を予測するための手段として使用される。乳がんの女性の大規模コホートの分析は、死亡した患者の(約80%)ほとんどが原発腫瘍7の10年後の除去以内に再発したことを示した。浸潤性乳癌の大部分については、リンパ管浸潤が強く不良転帰および疾患8のより攻撃的な臨床経過と相関することが示されている。
なぜなら、乳癌の遺伝的および表現型の複雑さは、疾患の全過程を再現ない動物モデルは存在しない。ヒト乳房腫瘍細胞株がしばしばあった異種移植や免疫不全マウスでの浸潤性および転移性乳癌の同所9モデルとして使用。有益であるが、これらのモデルは、免疫圧力の非存在下で起こり、それは異種間移植片であるため、全体の腫瘍微小環境の影響を歪める。例えばマウス乳癌ウイルス(MMTV)および乳清酸性タンパク質(WAP)などの乳腺特異的プロモーターによって駆動誘導性の遺伝子変異は、乳癌の遺伝的性質についての知識の膨大な量を貢献しています。しかしながら、これらのプロモーターの組織特異的発現は、典型的にはヒトの乳癌において過剰発現癌遺伝子の発現をミラーリングしない誘導性遺伝子突然変異の可変発現をもたらす、内分泌系10-16への応答性によって損なわれる。癌遺伝子のMMTV駆動発現の内分泌制御を克服するために、ムーディーズらは 、乳房内のノイを過剰発現する条件、ドキシサイクリン誘導可能なモデルを生成した上皮17。このモデルは、回帰、再発を研究するため、腫瘍形成後のノイをdeinducingするのに便利ですが、一貫性のある長期的な癌遺伝子発現のために一定のドキシサイクリンを投与することを必要とします。利用可能な多くの関連乳房腫瘍モデルの包括的な議論はVargo-Gogola らによる審査で見つけることができます。10
私たちの目標は、完全なC57BL / 6背景にトレーサブル乳癌のマウスモデルを開発したことを、変異事象、モデル免疫圧力の存在下で発生期の腫瘍の形成の恒久的な誘導後。私たちは、TP53のフロックス対立遺伝子、およびK-rasの発癌性形、およびYFPを含むトランスジェニックマウスの乳管にはCre-リコンビナーゼを発現するアデノウイルスを導入しました。 Cre発現はTP53、多くの乳癌18で頻繁に変異した遺伝子を切除すると、具体的YFP発現に加えて、K-rasの発癌性対立遺伝子を誘導する乳管上皮内。 K-rasの中の突然変異は、乳癌患者19,20のわずか6.5%に発生し、乳癌において低頻度であるが、例えば、ヒト乳房腫瘍中のRasシグナル伝達経路の構成的活性化EGFRおよびHer2/neuの結果として、上流のキナーゼの過剰発現21〜23。多くの乳房腫瘍細胞株でのRasシグナル伝達経路の活性化はまた、24,25報告されている。我々は、腫瘍形成の開始および性的に成熟した、処女雌マウスへのCreリコンビナーゼを発現するアデノウイルスの注入管内の手法について説明する。乳癌のこのモデルは、7〜8週までに腋窩リンパ節へのリンパ浸潤および転移に、遅い腫瘍進行の約8週間後に指数関数的に成長する明白な病変を発症する。これらのマウスは、完全なC57BL / 6バックグラウンド上にあり、YFP発現腫瘍細胞は、遠位リンパ節に追跡可能であるので、このモデルは、CEの関連性を研究するためのツールを提供llularおよび免疫学的潜在性転移のメカニズムとは、転移性乳管癌の治療のための新規な治療アプローチを開発するのに役立ちます。
プロトコル
全ての動物実験は、ウィスター研究所動物実験委員会によって承認された。
1。トランスジェニックマウスの作製とメンテナンス
- C57BL / 6マウスと少なくとも10世代戻し交配でフルC57BL / 6バックグラウンド28にLSL-K-RAS tm4Tyj 26と(混合背景にヒトがんコンソーシアムのNCIのマウスモデルから得た)Trp53のtm1Brn 27を飼育。腫瘍転移を追跡するために、品種B6.129X1-GT(ROSA)26Sor TM1(EYFP)のCos / J(フルC57BL / 6背景にジャクソン研究所から入手したLSL-EYFP、)ダブルトランスジェニックLSL-K-RASのG12Dと/ +のp53 のloxP / loxP配列マウス 。
注:トランスジェニックLSL-K-RAS G12D / +のp53 のloxP / loxP配列マウスは、発癌性のK-rasと内在性のp53遺伝子座の転写沈黙対立遺伝子に隣接するloxP部位を持っているのCre媒介切除、発癌性のK-rasの過剰発現時とそう変異体およびp53のアブレーションは、阿智ですeved。
注意:LSL-EYFPマウスはYFP停止カセットが切除された組織内のYFPの発現におけるCre介在切除結果に強化された黄色蛍光タンパク質(YFP)、そのための遺伝子に隣接する終止コドンを含んでいます。- 管内注射用のLSL-K-RAS G12D / +のp53 のloxP / loxP配列マウスやLSL-K-RAS G12D / +のp53 のloxP / loxP配列 LSL-EYFPマウスを得るために、トランスジェニックマウスを繁殖。
注意:K-rasのホモ接合性欠失を持つマウスは子宮内で死亡しているため、マウスをLSL-K-RAS G12D / +用のp53 のloxP / loxP配列およびヘテロ接合のためのホモ接合として飼育されています。管内注射のために、少なくとも6週齢のナイーブ処女雌を使用してください。
注:ジェノタイピングホモ接合のためのプライマーは、p53対立遺伝子をフロックスはp53である- T010-FWD(5'-AAGGGGTATGAGGGACAAGG-3 ')およびp53-T011-REV(5'-GAAGACAGAAAAGGGGAGGG-3')。彼らは、391塩基対の野生型対立遺伝子を生成し、p53は461塩基対29,30の対立遺伝子をフロックス。
注:K-rasの突然変異型を検出するためのプライマーはoIMR8273(5'-CGCAGACTGTAGAGCAGCG-3 ')およびoIMR8274(5'-CCATGGCTTGAGTAAGTCTGC-3')である。彼らは600BPで検出変異体のバンドを作る。
注:YFPレポーター三重トランスジェニックマウスでは、プライマーは、ROSAカセット(5'-AAGACCGCGAAGAGTTTGTC-3 ')、野生型対立遺伝子(5'-GGAGCGGGAGAAATGGATATG-3')、および共有対立遺伝子(5'-AAAGTCGCTCTGAGTTGTTATを検出すること-3 ')フロックス対立遺伝子と野生型対立遺伝子600塩基対のための320塩基対のバンドの増幅をもたらす。
- 管内注射用のLSL-K-RAS G12D / +のp53 のloxP / loxP配列マウスやLSL-K-RAS G12D / +のp53 のloxP / loxP配列 LSL-EYFPマウスを得るために、トランスジェニックマウスを繁殖。
2。外科的準備
- 75%のエタノールと、外科材料をきれいにし、すべての注射の前後にそれらをオートクレーブ。
- 動物施設内で消毒室できれいな整頓された実験室のベンチに手術を行う。 75パーセントエタノールに続く広域スペクトル消毒液で手術用顕微鏡のステージやダイヤルなど、すべての表面を拭いてください。
- 秤量した滅菌生理食塩水中のケタミン(80〜100ミリグラム/ kg)およびキシラジン(8〜10 mg / kg)の混合物の腹腔内注射によりマウスを麻酔。
- 彼らは麻酔下で行っている間、静かに5分間乱さケージに戻すマウスを置く。この間にウイルス沈殿物を生成(プロトコル3を参照)。
- つま先つまんで痛みに対する応答がないことを確認してください。静かに過度の角膜の乾燥を防ぐために、獣医軟膏で麻酔したマウスの目をカバーしています。
- 低体温症を防ぐには、外科手術中、彼らが回復し始めるまで、 弱火に設定された加熱パッド上に麻酔したマウスを置く。
- 疼痛の管理のために、マウスは、手術と24時間後にする前に1 mg / kgの皮下メロキシカム管理。
3。ウイルス沈殿物の生成
注意:アデノウイルスベクターは、それらが変形して複製することができないれているが、危険性をもたらす感染症。慎重に、アデノウイルスを処理します。すべての担当者が適切にBSL2ガイドラインに従ってアデノウイルスを処分、管内注入後BSL2エージェントを処理するための機関のガイドラインに従って訓練を受けなければならない。
- 店のアデノウイルスは、アデノウイルス粒子の2.5×10の3ミリリットル7 PFUで16匹を注入するための十分な4×10 8 PFU各アリコートで凍結-80℃、でウイルスストックを濃縮した。
- 注射を開始する前に、約15〜20分まで、ドライアイス上アデノずつ保管してください。
注意:ウイルス力価は各サイクルの間で大きく低下すると、繰り返される凍結融解を避ける。
注:アデノウイルス沈殿物は、プロトコルを修正することによって形成されている、以前に記載31。 - 無菌の分子グレードの水50ml、4℃で無菌状態とストア内の重炭酸ナトリウムおよび244mgのフィルタを有するサプリメントとMEM粉末504 mgの再構成
- <李>無菌条件下、4℃で保存中の分子グレードの水及びフィルタ50mlに塩化カルシウム1.5gを添加することによって塩化カルシウム溶液を調製する
- 10mlの最終体積のための滅菌水中に十分な3%スクロースに4×10 8 pfuのアデノウイルス-Creリコンビナーゼを含有するアリコートを混合する。ウイルスにMEMの34ミリリットルを加え、穏やかに混合します。その後、 塩化カルシウム溶液4mlを加え穏やかに混合し、15〜20分間、室温でインキュベートする。
- ストアは沈殿物を形成するのに準備ができるまで、ドライアイス上のアデノウイルス。アデノウイルスの融解を回避し、沈殿物が形成されていない限り、延長回氷や室温で保存する。
注意:これは、アデノウイルスのアリコートを解凍し、すぐに-80℃から取り出した後の沈殿物を作る開始することができない場合は、先行手術にショ糖、MEMおよびCaCl 2を混合することも可能であるショ糖、MEM、カルシウムのこの分量は、アデノウイルスを追加する準備が整うまで、ドライアイス上で保存することができます。
注:ウイルス粒子がほぼ1時間安定である。 - 各注射の前に、静かにウイルス粒子が混在していることを確認するために、チューブをフリック。 10ミリリットル注射器にウイルス粒子の3ミリリットル(2.5×10 7 PFU)を策定し、管内注射のためにマウスを準備します。
4。ウイルス粒子の管内注入
- 優しくクリーンな解剖顕微鏡の照明されたステージに仰向けにマウスを置きます。余分な光源を用いて腹部側を照らすと、各ニップルを囲む(C57BL / 6雌の上に見える)毛皮の小さな白い斑点が残した4 番目または右9 番目の鼠径部乳腺を探します。
- 離れて乳頭から髪をクリアするために、注射部位を滅菌する滅菌したエタノールに浸した綿棒で軽く乳首をこする。彼らは見つけることが困難な場合は、ゆっくり脱毛クリームの厚い層を適用したり、乳首を露出するためにハサミを使用しています。
- 乳首をカバーしている角栓 、密な死んだ皮膚細胞の層を、 削除してください 。乳首が露出されると、ケラチンプラグは解剖顕微鏡下で容易に見ることでなければなりません。
- 細かい外科鉗子で乳首を確保し、角栓を除去して軽い力で引き上げます。
- 鉗子間の乳首を安定させる。
- 静かに90°で、ダクト管をカニューレ挿入、鉗子の間に針を挿入します。乳房組織を通って腹側体腔の漿膜への浸透を防止するために、わずかに針(2mm以下)のベベルを越えてニップルを入力する。
- 深すぎる針を挿入しないでください。注射の適切な深さを確保するためには、ゆっくりと引き上げているように、針のエッジに沿って乳首を策定、ダクトの内腔に挿入した後、針を引き上げる。
注:注射の可視化が困難であるためpracticこのステップのeは、トリパンブルーを使用してお勧めします。
- 深すぎる針を挿入しないでください。注射の適切な深さを確保するためには、ゆっくりと引き上げているように、針のエッジに沿って乳首を策定、ダクトの内腔に挿入した後、針を引き上げる。
- 針が適切に乳管に置かれたとき、そっと注射器を持った手の親指と注射器の急落によって(アデノウイルスのCreの2.5×10 7 PFU)ウイルス析出物の3ミリリットルをリリース。液体が追加されるように乳首が少し膨らませる必要があります。
5。マウスのリカバリー
- それは麻酔から回復し始めるまで注射の後に戻って加熱パッドの上にマウスを置きます。
- マウスが回復した後は、清潔なケージに戻ってそれを置いて、完全に回復し、動きを監視します。
- 管内注射の24時間後には、皮下に1 mg / kgのでメロキシカムを管理します。
6。監視腫瘍プログレッション
- 拡大や腫れのために30日目で注入乳腺を触診。
- 一度腫れと拡大乳腺グラン5〜7日ごとに腫瘍の進行を監視dが観察される。
- 触知可能な腫瘍(約50から60日後、アデノウイルス注射)が表示されたら、腫瘍の成長速度のために3〜4日ごとに腫瘍体積を測定します。
- 腫瘍体積はマウスの体重の10%を超えたときにマウスを安楽死させる。
結果
乳管ツリーの首尾よい標的化は、以前に、トリパンブルー(適切な注入技術( 図1A)または(適切なウイルスの調製および感染を確認するためにmCherryを発現するアデノウイルスを検証するの注射後32記載のように乳腺のホールマウントを調製することによって視覚化することができる乳管上皮細胞の、 図1B)。
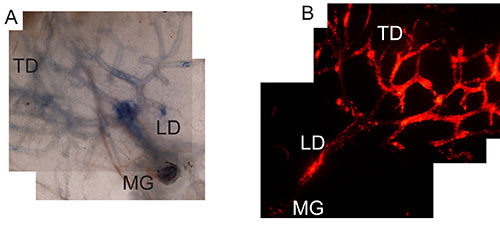
図1。パンブルーまたはアデノウイルス-mCherry。A)と注射による乳腺の管内ターゲティングホールマウント、パンブルーがに3時間後に注入を準備したと以前に乳腺#4の注入後、乳腺の32を 、報告されているように全体乳管の標的を確認/視覚化ツリー。画像は4倍の倍率である。B)mCherryを発現するアデノウイルスの2.5×10 7 PFUを注入することによりアデノウイルスによる乳管上皮の感染。マウスは、管内に注入し、4日後、注射、乳腺のホールマウントは、乳管ツリーのウイルス感染を確認するために調製した。画像は4倍の倍率である。 MGは乳腺で、LDは乳汁を分泌するか、メインダクトであり、TDは、端末のダクトです。 拡大画像を表示するにはここをクリックしてください。
腫瘍はp53のloxP配列/ loxP配列 LSL-K-RAS G12D / +トランスジェニックマウスにおいて誘導される場合、腫瘍は乳腺が拡大し、腫れになります周りの40日目までは明らかにならないでしょう。これは、これが観察されたときに5〜7日ごとに腫瘍成長をモニターする、触診を開始する必要がある。我々の手では、乳腺の硬化は、常に腫瘍発生の発症に先行する。腫瘍はさらに2週間、ゆっくり進行します。 56日を中心に開始して、腫瘍が( 図2B)が指数関数的に成長し始めます。 ( 図2Aおよび3A)が正常である腫瘍の進行、マウス変動にわずかなマウスが存在するので、この時点では、速度論的研究が望まれる場合、3日ごとに腫瘍体積を測定することが重要である。大きな腹部の塊は、それらの腫瘍が体重の10%以上を超えた場合にマウスが安楽死されるべき後に、( 図2A、2B、および3A)80日によって明らかになるであろう。担癌マウスからの3つのクローンのcDNAの分析はメソセリンの発現を明らかにし、サイトケラチン8、のHer2/neu、エストロゲン受容体-α( 図2C)。
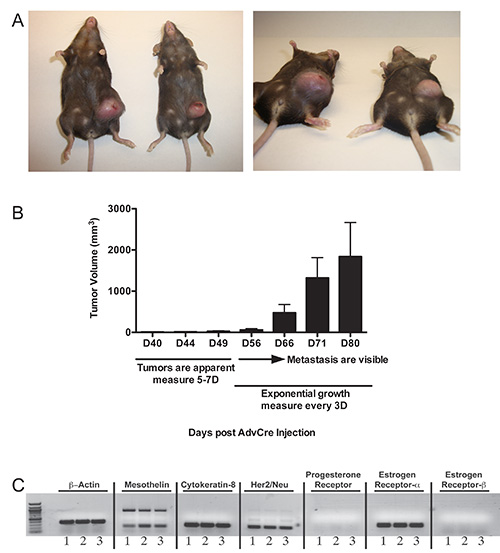
p53のloxP配列内の > 図2。腫瘍の開発/ loxP配列 LSL-K-RAS G12D / +マウスは、80日にCreを発現するアデノウイルスを注射した後の腫瘍のアデノウイルスのCre。A)二つの例を管内に注入した 。マウスを、Creリコンビナーゼおよび80日後に腫瘍イニシエーションを発現するアデノウイルスの7 PFUを2.5×10与えた、大触知塊は、動物の腹側から突出し視覚化することができる。B)代表的な腫瘍動態および触診スケジュールのp53 のloxPに誘導された腫瘍のための/のloxP LSL-K-RAS G12D / +マウスのp53 のloxP / loxP配列 LSL-K-RAS G12D / +マウスの同じ均質化された腫瘍に由来する3腫瘍細胞クローンの。C)キャラ。 RNAを抽出し、RT-PCR分析のために合成されたcDNAは、メソテリン、サイトケラチン8、Her2/neuの、プロゲステロン受容体、エストロゲン受容体αおよびエストロゲン受容体-β、β-アクチンに特異的なプライマーを使用した。TPS :/ / www.jove.com/files/ftp_upload/51171/51171fig2highres.jpg "ターゲット=" _blank ">拡大画像を表示するにはここをクリックしてください。
ヒト乳癌における細胞の微小環境と同様に、我々は、αβおよびγδのT細胞の浸潤、ならびに腫瘍への骨髄由来サプレッサー細胞およびマクロファージ( 図4)を観察した。腋窩リンパ節への排水血管系、腫瘍が注入が( 図3A)を実施した全体の乳腺組織を包含するように成長している前に、うっ血を開始します。腫瘍細胞のリンパ管浸潤や転移はLSL-EYFPマウスとLSL-K-RAS G12D / +のp53 のloxP / loxP配列マウスを交配することによって追跡することができます。 Cre介在切除後、YFP(ハイとローの両方)を発現する腫瘍細胞は、腫瘍内で検出されており、排出腋窩リンパ節( 図3B)に転移さかのぼることができる。遠位腋窩リンパ節への転移が確認された正常担癌LSL-K-rasのG12D / +のp53 のloxP / loxP配列マウス(データは示さず)、この部位からの腫瘍細胞株を培養することによる。
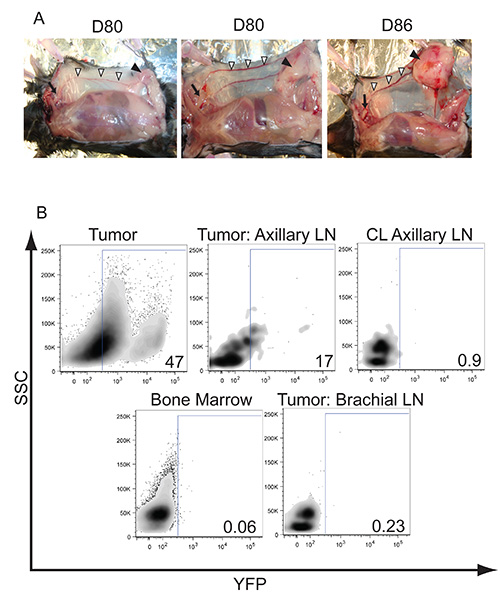
腫瘍進行の異なる速度を有する3つの高度な乳房腫瘍の図3腋窩リンパ節への腫瘍および潜在性転移の形成。A)の例。実線の矢印で示される質量、フォームや最終的には全体の腹部、乳腺組織の大きさに成長する。腫瘍は乳腺組織に閉じ込められたままで、侵入や腹膜腔を覆っている筋肉に付着することが観察されていません。白い矢印で示さ鼠径部および腋窩リンパ節、間の表面的な上腹部静脈の明らか充血があります。 7-8週間後、目電子腋窩リンパ節は、YFP陽性腫瘍細胞の転移は、フローサイトメトリーにより腋窩リンパ節に可視化することができる矢印Bで示す腫瘍細胞のリンパ管浸潤、)に肥大化し始める。 LSL-K-RAS G12D / +のp53 のloxP / loxP配列 LSL-EYFPマウスにアデノウイルスのCreの管内送達によって腫瘍およびYFPの活性化を誘導するために使用された。腋窩リンパ節、80日後に、アデノウイルス注射、腫瘍細胞のリンパ管浸潤を確認するために、示されたリンパ節や臓器を採取し、リンパ球のマーカーについて染色し、YFP発現について調べた。 CLは、流入領域リンパ節対側非腫瘍を表す。結果は、腫瘍細胞が遠位腋窩リンパ節に侵入していることを示す、CD45陰性腫瘍細胞に対してゲーティングを表す。数字は総人口からのパーセントYFP陽性細胞を表す。 LARGを見るにはここをクリックしてくださいERイメージ。
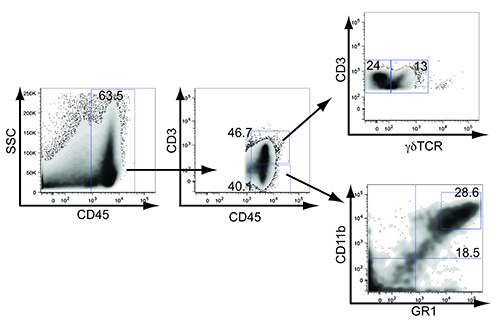
図4。免疫は、マウストランスジェニック乳腺腫瘍に浸透する。マウスの乳腺腫瘍は、CD45、CD3、γδTCR、CD11bおよびGR1均質化し、染色した。数字は、腫瘍全体で陽性白血球(63.5)、総CD3 +(46.7)、総CD3陰性(40.1)、総CD3 +γδ+(γδT細胞、13)、CD3 +の γδnegative(24)、高い総GR1の割合を表すのCD11b(MDSC、28.6)及び合計のCD11b GR1低い(マクロファージ、18.5)。 拡大画像を表示するにはここをクリックしてください。
原因管内注射のマウスと技術の解剖学的構造に、我々はOをターゲットに見つけるF乳腺4,9( 図5)は、最も一貫性のある結果で信頼性の注射をもたらす。しかし、任意の腺は、手術を行う技術者の好みに応じて標的化することができる。
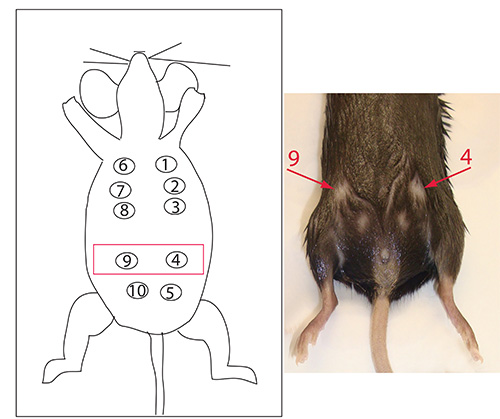
図5。乳管の番号。乳管4と9は、図に赤で強調表示され、マウスの矢印で示されている。私たちの手では、注射は、これらの乳管に実行するために、我々は同じような速度論で開発された腫瘍を対象とした。しかし、他のすべての乳腺の組織が 最も簡単であることがわかった拡大画像を表示するにはここをクリックしてください。
ディスカッション
この手順の成功は、訓練されていない実験者のために困難になるであろう、管内注射の際に適切な技術にかかっている。私たちの研究室での経験豊富な研究者は、一般的に乳房腫瘍塊を、彼らは、アデノウイルス注射を管理する時間の79%を取得。インジェクションの問題は大幅に遅れて、変数、または存在しない腫瘍発生につながることができます。針が深すぎたり、不適切な角度で挿入されている場合は、乳管運河が見逃されることがあります。それは乳房組織を通って腹側体腔の漿膜への浸透を防止するために、わずかに針(2mm以下)のベベルを過ぎ乳首を入力することが重要である。また、ウイルス析出物より大きい3ミリリットルの注射針や注射の浅すぎる配置は、乳腺と意図的でない腫瘍の誘発外のウイルス予備校のこぼれになることがあります。これらの問題を克服する1つの方法は、わずかにdeepe乳首に針を挿入することであるR 3ミリメートル、ゆっくりと斜面の先端から2ミリメートルまでバックアップダクトのうち、注射器を描くよりも。これは乳腺組織ではなく、マウスの腹腔( 図1A)を囲む筋肉ターゲットにしていることを確認します。ウイルスがダクト内に排出されるときに、ウイルスの析出物のこぼれないと損失がないように、また、これは、注射器の縁に沿ってニップルを伸ばすであろう。
注射の可視化は困難であり、このステップの練習をお勧めします。我々は、腫瘍発生のより高い浸透度で、その結果、実際に成功した次の注射の増加を観察した。この技術は処女雌を非授乳使用するため、基本となるダクト管を明らかにするためにニップルをカバー角栓を除去することが重要です。私たちは、ダクトの内側にパンブルーまたは他の滅菌トレーサブルの色素を注入し、乳管TRのターゲットを確認するために、全乳腺マウントを用意することで、このステップを実践することをお勧めしますEE。さらに、試薬の注入管内を説明する他のプロトコルは、適切な技術を開発するために有用であり得る、33,34公表されている。乳管腔のウイルス調製または感染の問題もmCherry発現するアデノウイルスを使って調べることができます。注入技術が最適化されるまで非トランスジェニックマウスは、これらの目的の各々のために使用することができる。
任意の乳腺腫瘍を開始するために使用することができますが、我々はそれがより効率的にターゲティングで、その結果、これらの腺に適切な注射を行うことが容易であるためであると考えて乳腺4や9を標的とすることによって、最も一貫性の成長率を達成しているダクト。左の第 4の近傍又は排水鼠径リンパ節への右鼠径部9 番目の乳腺腫瘍進行の異なる時間点の間に、抗腫瘍免疫応答を検討することも有用である。遠位部位に潜在転移をモデル化し、追跡するために、TransgenicマウスをLSL-EYFPマウスと交配させた。腫瘍が進行するにつれて、腫瘍は指数関数的に( 図3A)、成長し始める前に、腋窩リンパ節に腫瘍血管系を接続するには、少なくとも約5週間少し充血となるであろう。最終的に、7〜8週間後、リンパ管浸潤は、腋窩リンパ節( 図3Aおよび図3B)内で腫瘍増殖をもたらす。レポーターマウスとのCre-loxP配列技術を用いて、YFPの取り込みは、腫瘍進行を通して遠位部位に転移する腫瘍細胞を追跡するためのプラットフォームを作成する。これにより、潜在的な転移を促進する細胞およびエピジェネティックなメカニズムの解明を目的とした研究を容易にすることができる。我々の手では、乳房腫瘍細胞株は、乳管上皮のターゲティングを確認し、サイトケラチン8、メソテリン、エストロゲン受容体-α、およびHer2/neuのを表明した。しかし、誘導され、難易度の注射の変動に起因する突然変異のに応じて、お勧めモデルに一度腫瘍の組織学的特徴付けはよく研究室で確立されている。
乳癌は、このような致命的で広範な疾患1,2であるので、正確に腫瘍と宿主との間の複雑な相互作用を再現する動物モデルを使用することが重要である。ここでは、乳房腫瘍の完全戻し交配C57BL / 6マウスモデルを説明します。まず、ネイティブの細胞から腫瘍を誘発することによって、我々は、腫瘍は完全な免疫微小環境の中で自然に進化することができます。高度なマウスの乳房の腫瘍における免疫微小環境は、一般的に( 図4)、ヒト乳癌で観察αβの集団とγδT細胞、骨髄に由来するサプレッサー細胞、およびマクロファージを再現。我々は卵巣腫瘍を誘発するために、アデノウイルスのCreを使用して、以前に公開したように、我々はウイルス注射は、対応する腫瘍の浸潤や腫瘍の進行28にほとんど影響を持っていたことが分かった。第二に、内分泌依存しない癌遺伝子の発現は、腫瘍細胞が標的遺伝子発現の持続的に高いレベルを有することを保証する。第三に、潜在性の変異を利用することによって、我々は、腫瘍の進展の正確な時間的な追跡を容易にするために、腫瘍形成のタイミングを制御することができる。このモデルのアプリケーションは、腫瘍細胞生物学の研究を含む、腫瘍微小環境、抗腫瘍免疫応答、および新規治療薬の有効性の評価においてさえ因子に関する研究。 Creリコンビナーゼ-loxPシステムの可用性を介して、この技術は、乳房腫瘍の開始および進行におけるさらなる変異の多様なアレイを調査するためのプラットフォームとして使用することができる。我々は、このモデルの使用が乳癌生物学の理解を高め、最終的には転移性乳癌の治療を目的とした新しい治療法につながることを願っています。
開示事項
著者らは、競合する経済的利益を宣言していません。
謝辞
この作品は、NCI助成RO1CA157664とRO1CA124515、および乳癌アライアンス賞によってサポートされていました。私たちは、ウィスターフローサイトメトリーの中核施設、ウィスターイメージング施設からジェームズ·ヘイデン、そして彼らの貴重な技術サポートのためのウィスター研究所の動物施設のスタッフ全員からジェフリー·ファウスト、デビッド·アンブローズ、スコットワイスに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Trp53tm1Brn Transgenic mice K-rastm4Tyj Transgenic mice | Obtained from NCI mouse models of human cancer consortium | Mice were backcrossed ten times to a full C57BL/6 background | |
| B6.129X1- Gt(ROSA)26Sortm1(EYFP)Cos/J Transgenic mice | Jackson Labs | 006148 | |
| Primers p53loxP/loxP | Integrated DNA Technologies | 5'-AAGGGGTATGAGGGACAAGG-3' 5'-GAAGACAGAAAAGGGGAGGG-3' | |
| Primers LSL-K-rasG12D/+ | Integrated DNA Technologies | 5'-CGCAGACTGTAGAGCAGCG-3' 5'-CCATGGCTTGAGTAAGTCTGC-3' | |
| Primers for LSL-EYFP to detect Rosa promoter | Integrated DNA Technologies | 5'-AAGACCGCGAAGAGTTTGTC-3' 5'-GGAGCGGGAGAAATGGATATG-3' 5'-AAAGTCGCTCTGAGTTGTTAT-3' | |
| Primers for detection of Mesothelin expression | Integrated DNA Technologies | 5'-TTGGGTGGATACCACGTCTG-3' 5'-CGGAGTGTAATGTTCTTCTGTC-3' | |
| Primers for detection of Progesterone Receptor expression | Integrated DNA Technologies | 5'-GCAATGGAAGGGCAGCATAA-3' 5'-TGGCGGGACCAGTTGAATTT-3' | |
| Primers for detection of Cytokeratin 8 expression | Integrated DNA Technologies | 5'-ATCAGCTCTTCCAGCTTTTCCC-3' 5'-GAAGCGCACCTTGTCAATGAAGG-3' | |
| Primers for detection of Erbb2 expression | Integrated DNA Technologies | 5'-ACCTGCCCCTACAACTACCT-3' 5'-AAATGCCAGGCTCCCAAAGA-3' | |
| Primers for detection of Estrogen Receptor A expression | Integrated DNA Technologies | 5'-ATGAAAGGCGGCATACGGAA-3' 5'-GCGGTTCAGCATCCAACAAG-3' | |
| Primers for detection of Estrogen Receptor B expression | Integrated DNA Technologies | 5'-ACCCAATGTGCTAGTGAGCC-3' 5'-TGAGGACCTGTCCAGAACGA-3' | |
| Primers for detection of B-Actin expression | Integrated DNA Technologies | 5'-GCCTTCCTTCTTGGGTATGG-3' 5'-CAGCTCAGTAACAGTCCGCC-3' | |
| Adenovirus-Cre | Gene Transfer Vector Core from the University of Iowa | Ad5CMVCre | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Adenovirus-mCherry | Gene Transfer Vector Core from the University of Iowa | Ad5CMVmCherry | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Hamilton syringe | Hamilton company | 701RN | 10 μl syringe, RN series. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Custom needle | Hamilton company | 7803-05 | 33 G 0.5 in long RN needle, with a 12° bevel. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Surgical forceps | Dumont | 52100-58 | Dumostar No. 5 forceps. Clean with 75% ethanol after each use, followed by autoclaving |
| MEM powder | Cellgro | 50 012 PB | Store at 4 °C in powder and reconstituted form |
| Sodium Bicarbonate | Fisher | S233 | Add to MEM and filter stearilize |
| Calcium Chloride | Sigma | C4901 | Minimum 96%, anhydrous |
参考文献
- Youlden, D., et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival and mortality. Cancer Epidemiol. 36, 237-248 (2012).
- Siegel, R., Naishadham, D. Cancer statistics, 2012. Cancer J. Clin. 62, 10-29 (2012).
- Sorlie, T., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc. Natl. Acad. Sci. U.S.A. 98, 10869-10874 (2001).
- Gatza, M., et al. A pathway-based classification of human breast cancer. Proc. Natl. Acad. Sci. U.S.A. 107, 6994-6999 (2010).
- Bastien, R., et al. PAM50 breast cancer subtyping by RT-qPCR and concordance with standard clinical molecular markers. BMC Med. Genom. 5, 44 (2012).
- Montagna, E., et al. Heterogeneity of triple-negative breast cancer: histologic subtyping to inform the outcome. Clin. Breast Cancer. 13, 31-39 (2013).
- Karrison, T. G., Ferguson, D. J., Meier, P. Dormancy of mammary carcinoma after mastectomy. J. Natl. Cancer Inst. 91, 80-85 (1999).
- Rakha, E., et al. The prognostic significance of lymphovascular invasion in invasive breast carcinoma. Cancer. 118, 3670-3680 (2012).
- Kim, I., Baek, S. Mouse models for breast cancer metastasis. Biochem. Biophys. Res. Commun. 394, 443-447 (2010).
- Vargo-Gogola, T., Rosen, J. Modelling breast cancer: one size does not fit all. Nat. Cancer. 7, 659-672 (2007).
- Archer, T., et al. Steroid hormone receptor status defines the MMTV promoter chromatin structure in vivo. J. Steroid Biochem. Mol. Biol. 53, 421-429 (1995).
- Cato, A., Henderson, D., Ponta, H. The hormone response element of the mouse mammary tumour virus DNA mediates the progestin and androgen induction of transcription in the proviral long terminal repeat region. EMBO J. 6, 363-368 (1987).
- Schoenenberger, C., Zuk, A., Groner, B., Jones, W., Andres, A. Induction of the endogenous whey acidic protein (Wap) gene and a Wap-myc hybrid gene in primary murine mammary organoids. Dev. Biol. , 327-337 (1990).
- Li, Y., et al. Deficiency of Pten accelerates mammary oncogenesis in MMTV-Wnt-1 transgenic mice. BMC Mol. Biol. 2, 2 (2001).
- Martelli, C., et al. In vivo imaging of lymph node migration of MNP- and (111)In-labeled dendritic cells in a transgenic mouse model of breast cancer (MMTV-Ras). Mol. Imaging Biol. 14, 183-196 (2012).
- Klover, P. J., et al. Loss of STAT1 from mouse mammary epithelium results in an increased Neu-induced tumor burden. Neoplasia. 12, 899-905 (2010).
- Moody, S. E., et al. Conditional activation of Neu in the mammary epithelium of transgenic mice results in reversible pulmonary metastasis. Cancer Cell. 2, 451-461 (2002).
- Banerji, S., et al. Sequence analysis of mutations and translocations across breast cancer subtypes. Nature. 486, 405-409 (2012).
- Miyakis, S., Sourvinos, G., Spandidos, D. A. Differential expression and mutation of the ras family genes in human breast cancer. Biochem. Biophys. Res. Commun. 251, 609-612 (1998).
- Malaney, S., Daly, R. J. The ras signaling pathway in mammary tumorigenesis and metastasis. J. Mammary Gland Biol. Neoplasia. 6, 101-113 (2001).
- Loboda, A., et al. A gene expression signature of RAS pathway dependence predicts response to PI3K and RAS pathway inhibitors and expands the population of RAS pathway activated tumors. BMC Med. Genomics. 3, 26 (2010).
- von Lintig, F. C., et al. Ras activation in human breast cancer. Breast Cancer Res. Treat. 62, 51-62 (2000).
- Downward, J. Targeting RAS signalling pathways in cancer therapy. Nat. Rev. Cancer. 3, 11-22 (2003).
- Eckert, L. B., et al. Involvement of Ras activation in human breast cancer cell signaling, invasion, and anoikis. Cancer Res. 64, 4585-4592 (2004).
- Hollestelle, A., Elstrodt, F., Nagel, J., Kallemeijn, W., Schutte, M. Phosphatidylinositol-3-OH kinase or RAS pathway mutations in human breast cancer cell lines. Mol. Cancer Res. 5, 195-201 (2007).
- Jackson, E., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes Dev. 15, 3243-3248 (2001).
- Jonkers, J., et al. Synergistic tumor suppressor activity of BRCA2 and p53 in a conditional mouse model for breast cancer. Nat. Genet. 29, 418-425 (2001).
- Scarlett, U., et al. Ovarian cancer progression is controlled by phenotypic changes in dendritic cells. Exp. Med. 209, 495-506 (2012).
- Vooijs, M., Jonkers, J., Berns, A. A highly efficient ligand-regulated Cre recombinase mouse line shows that LoxP recombination is position dependent. EMBO Rep. 2, 292-297 (2001).
- Young, N., Crowley, D., Jacks, T. Uncoupling cancer mutations reveals critical timing of p53 loss in sarcomagenesis. Cancer Res. 71, 4040-4047 (2011).
- Dinulescu, D., et al. Role of K-ras and Pten in the development of mouse models of endometriosis and endometrioid ovarian cancer. Nat. Med. 11, 63-70 (2005).
- Landua, J., Visbal, A., Lewis, M. Methods for preparing fluorescent and neutral red-stained whole mounts of mouse mammary glands. J. Mammary Gland Biol. Neoplasia. 14, 411-415 (2009).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. J. Vis. Exp. , e4030 (2012).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
Erratum
Formal Correction: Erratum: Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer
Posted by JoVE Editors on 10/20/2014. Citeable Link.
A correction was made to Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer. Protocol sections 3.1, 3.3.2, 3.4, and 4.7 were updated. The materials table was also updated.
Protocol section 3.1 was updated from:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 ml of 2.5 x 107 pfu of adenovirus particles.
to:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 µl of 2.5 x 107 pfu of adenovirus particles.
Protocol section 3.3.2 was updated from:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 ml. Add 34 ml of MEM to the virus and gently mix. Then add 4 ml of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
to:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 µl. Add 34 µl of MEM to the virus and gently mix. Then add 4 µl of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
Protocol section 3.4 was updated from:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 ml (2.5 x 107 pfu) of virus particles into the 10 ml syringe and prepare the mouse for the intraductal injection.
to:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 µl (2.5 x 107 pfu) of virus particles into the 10 µl syringe and prepare the mouse for the intraductal injection.
Protocol section 4.7 was updated from:
When the needle is appropriately placed into the mammary duct, release the 3 ml of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
to:
When the needle is appropriately placed into the mammary duct, release the 3 µl of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
Item 15 in the Materials table under Comments was updated from:
10ml syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
to:
10µl syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved