Method Article
Инициирование метастатического рака молочной железы с помощью таргетинга из эпителия протоков с аденовируса-Cre: роман Трансгенные мыши Модель рака молочной железы
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Активация скрытых мутаций с аденовируса-Cre в молочных системы приводит протоков в клинически значимом метастатическим раком молочной железы. Включение промоутера YFP позволяет отслеживать дистальных метастатических опухолевых клеток. Эта модель полезна для изучения скрытого метастазирования, противоопухолевого иммунитета, и для разработки новых иммунотерапии для лечения рака груди.
Аннотация
Рак молочной железы является гетерогенным заболеванием включают в себя сложные клеточные взаимодействия между развивающейся опухоли и иммунной системы, в конечном счете, приводит к экспоненциальному росту опухоли и метастазов в дистальных тканях и распада противоопухолевого иммунитета. Многие полезные модели животных существуют для изучения рака молочной железы, но никто полностью не повторять прогрессирование заболевания, что происходит в организме человека. Для того, чтобы получить лучшее понимание клеточных взаимодействий, которые приводят к образованию скрытого метастазирования и снизилась выживание, мы сформировали индуцибельную трансгенных модель мыши YFP-выражающей раком протоков, которая развивается после половой зрелости в иммунокомпетентных мышей и приводится последовательной, эндокринной независимый выражения онкогенов. Активация YFP, абляции р53, и выражение онкогенной виде K-Ras было достигнуто за счет доставки аденовируса, выражающей CRE-рекомбиназу в молочную канала половозрелых, девственных самок мышей. Опухолиначинают появляться через 6 недель после начала онкогенных событий. После опухоли становятся очевидными, они прогрессируют медленно в течение примерно двух недель, прежде чем они начинают расти в геометрической прогрессии. После 7-8 недель после аденовирус инъекций, сосудистой наблюдается подключения массы опухоли в дистальных лимфатических узлов, с возможным лимфоваскулярной вторжения опухолевых клеток YFP + в дистальных подмышечных лимфатических узлов. Проникновения популяции лейкоцитов аналогичны тем, которые найдены в карциномах молочной железы человека, в том числе присутствии αβ и γδ Т-клеток, макрофагов и MDSCs. Эта уникальная модель облегчит изучение клеточных и иммунологических механизмов, вовлеченных в скрытой метастазов и покоя в дополнение к тому, полезны для разработки новых иммунотерапевтические вмешательства для лечения инвазивного рака молочной железы.
Введение
Рак молочной железы является наиболее часто встречающихся злокачественных опухолей у женщин во всем мире 1,2 и второй ведущей причиной онкологической смертности 2. Комплекс генетический 3,4, гистологическое 5, и клинические фенотипы 6 используются для характеристики различных подтипов рака молочной железы и часто используются в качестве средства для прогнозирования выживаемости. Анализ большой когорты женщин с раком молочной железы показал, что большинство (около 80%) пациентов, которые умерли возобновились в 10 год после удаления первичной опухоли 7. Для большинства инвазивных карцином молочной железы, лимфоваскулярная инвазия было показано, что сильно коррелирует с неблагоприятным исходом и более агрессивной клинического течения заболевания 8.
Из-за генетической и фенотипической сложности рака молочной железы, нет животной модели, которая повторяет весь ход болезни. Грудь опухолевые клеточные линии человека были частоиспользуется в качестве ксенотрансплантата или ортотопических 9 моделей инвазивной и метастатическим раком молочной железы в иммунодефицитных мышей. Хотя информативным, эти модели происходить в отсутствие иммунного давлении и потому, что это трансплантат поперечного виды, искажать эффекты всей микроокружения опухоли. Индуцибельные генетические мутации движимые молочных конкретных промоутеров, таких как мыши вирус опухоли молочной железы (MMTV) и сывороточного кислого белка (WAP) способствовали огромное количество знаний о генетической природе рака молочной железы. Однако конкретные ткани экспрессия этих промоторов скомпрометированы их способности реагировать на эндокринную систему 10-16, в результате чего переменной экспрессии индуцированных генетических мутаций, которые не отражают экспрессию онкогенов, как правило, избыточно экспрессируется в рака молочной железы человека. Для преодоления эндокринной контроль приводом ВОМЖМ выражения онкогенов, Moody и др.. Генерируется условное, доксициклин индуцибельную модель сверхэкспрессирующие Neu в грудиэпителий 17. Эта модель полезна для deinducing Neu после образования опухоли для изучения регрессии и повторения, но требует постоянного администрирования доксициклин для последовательной, долгосрочной выражения онкогенов. Всестороннее обсуждение многих соответствующих моделях опухолей молочной доступных можно найти в обзоре Варго-Gogola др. 10.
Наша цель заключается в разработке модель мыши прослеживаемым рака молочной железы на полном C57BL / 6 фоне, что после постоянного индукции мутационные события, модели формирования зарождающегося опухоли в присутствии иммунной давления. Мы ввели аденовирус, выразив CRE-рекомбиназу в молочных протоках трансгенных мышей, содержащих floxed аллелей TP53 и онкогенного форму K-Ras и YFP. Выражение Cre ablates TP53, а часто видоизмененный ген во многих рака молочной железы 18 и индуцирует онкогенного аллель K-Ras в дополнение к YFP выражения конкретнов молочной эпителия протоков. Хотя мутации в K-Ras являются нечастыми при раке молочной железы, происходит только в 6,5% больных раком молочной железы 19,20, избыточная экспрессия вверх по течению киназ, таких как Her2/neu и EGFR результате в конститутивной активации сигнального Рас пути в опухолях молочной железы человека 21-23. Активация сигнального пути Ras во многих молочной железы опухолевых клеточных линий также сообщалось 24,25. Мы опишем инициацию образования опухоли и технику внутрипротокового инъекции аденовируса, выражающей CRE-рекомбиназу в половозрелых, девственных самок мышей. Эта модель рака молочной железы развивается явные повреждения, которые растут в геометрической прогрессии после 8 недель медленного прогрессирования опухоли, с лимфоваскулярной инвазии и метастазирования в подмышечные лимфатического узла на 7-8 недель. Потому что эти мыши на полном C57BL / 6 фоновом режиме и YFP-выражающие опухолевые клетки прослеживается в дистальных лимфатических узлов, эта модель обеспечивает соответствующую инструмент для изучения сеllular и иммунологические механизмы скрытого метастазирования и будет способствовать развитию новых терапевтических подходов для лечения метастатического протоков рака молочной железы.
протокол
Все эксперименты на животных были утверждены Комитетом по уходу и использованию животных Института Вистар в.
1. Генерация и обслуживание трансгенных мышей
- Порода LSL-K-Ras tm4Tyj 26 и Trp53 tm1Brn 27 (полученный из моделей NCI мыши консорциума рака человека на смешанном фоне) до полного C57BL / 6 фоне 28 обратным скрещиванием не менее 10 поколений с мышей C57BL / 6. Для отслеживания метастазы опухоли, порода B6.129X1-Гт (РОСА) 26Sor tm1 (EYFP) Cos / J (LSL-EYFP, получены из Лаборатории Джексона на полном C57BL / 6 фоне) с двойным трансгенных LSL-K-Ras G12D / + р53 LoxP / LoxP мышей.
Примечание: мышей Трансгенные LSL-K-Ras G12D / + р53 LoxP / LoxP есть LoxP сайтов фланговые транскрипционно замолчать аллель онкогенных K-Ras и эндогенного p53 локуса, так что при Cre-опосредованной удаления, избыточной экспрессии онкогенных K-Ras мутант и абляция р53 Ачиэвед.
Примечание: LSL-EYFP мышь содержит фланкирующие стоп-кодон гена для повышения желтого флуоресцентного белка (YFP), что при Cre-опосредованных результатов иссечения в экспрессии YFP в тканях, где остановка кассета YFP иссекают.- Порода трансгенных мышей, чтобы получить LSL-K-Ras G12D / + р53 LoxP / LoxP мышей или LSL-K-Ras G12D / + p53 LoxP / LoxP LSL-EYFP мышей для внутрипротокового инъекций.
Примечание: Мыши разводят как гомозиготные по р53 LoxP / LoxP и гетерозиготных по LSL-K-Ras G12D / +, потому что мыши с гомозиготной делеции K-Ras умереть в утробе матери. Используйте наивных девственных самок по крайней мере шесть-недель старые для внутрипротокового инъекций.
Примечание: праймеры для генотипирования гомозиготных floxed p53 аллель являются р53 - T010-FWD (5'-AAGGGGTATGAGGGACAAGG-3 ') и p53-T011-об (5'-GAAGACAGAAAAGGGGAGGG-3'). Они производят аллеля дикого типа на 391 б.п. и р53 floxed аллель на 461 б.п. 29,30.
Примечание: праймеры для обнаружения мутантной формы K-Ras являются oIMR8273 (5'-CGCAGACTGTAGAGCAGCG-3 ') и oIMR8274 (5'-CCATGGCTTGAGTAAGTCTGC-3'). Они производят мутантный группу, обнаруженную в 600bp.
Примечание: Для YFP репортер тройных трансгенных мышей, праймеры для обнаружения кассету ROSA (5'-AAGACCGCGAAGAGTTTGTC-3 '), дикого типа аллель (5'-GGAGCGGGAGAAATGGATATG-3'), а также общая аллель (5'-AAAGTCGCTCTGAGTTGTTAT 3 ') приводит к амплификации полос при 320 п.н. для floxed аллеля и 600 п.н. для аллеля дикого типа.
- Порода трансгенных мышей, чтобы получить LSL-K-Ras G12D / + р53 LoxP / LoxP мышей или LSL-K-Ras G12D / + p53 LoxP / LoxP LSL-EYFP мышей для внутрипротокового инъекций.
2. Хирургическая подготовка
- Чистые хирургические материалы с 75% этанола и автоклав их до и после всех инъекций.
- Выполните операцию на чистую лаконичную лабораторном столе в продезинфицированный номере в течение объекта животного. Протрите все поверхности, включая стадии и циферблатов хирургического микроскопа с раствором широкого спектра действия дезинфицирующего последующим 75% этанола.
- Взвесить и анестезию мышей путем внутрибрюшинной инъекции смеси кетамина (80-100 мг / кг) и ксилазина (8-10 мг / кг) в стерильном физиологическом растворе.
- Аккуратно поместите мышей обратно в их клетках в покое на 5 мин, пока они идут под наркозом. За это время генерации вирусов осадки (см. протокол 3).
- Проверьте отсутствие реакции на боль, ног щипать. Аккуратно покрыть глаза под наркозом мышей с ветеринарной мази для предотвращения чрезмерного роговицы сушки.
- Чтобы предотвратить переохлаждение, разместить наркозом мышей на грелку, установленным в слабом огне во время хирургической процедуры и, пока они не начинают восстанавливаться.
- Для управления боли, управлять мышей мелоксикам подкожно в дозе 1 мг / кг до операции и через 24 часа после.
3. Генерация Касперского осадки
ВНИМАНИЕ: аденовирусных векторов, хотя они были изменены и не в состоянии воспроизвести, представляют рискинфекции. Ручка аденовирус с осторожностью. Весь персонал должен пройти соответствующую подготовку в соответствии с руководящими принципами учреждения для обработки BSL2 агентов После внутрипротокового инъекции, распоряжаться аденовируса в соответствии с руководящими BSL2.
- Магазин аденовирус концентрировали с запасами вируса при -80 ° С в аликвотах замораживали в 4 х 10 8 БОЕ каждый, достаточном для инъекций 16 животных с 3 мл 2,5 × 10 7 КОЕ из аденовирусных частиц.
- Храните аденовируса аликвоты на сухом льду до примерно 15-20 мин до начала инъекции.
Примечание: Избегайте повторных циклов замораживания-размораживания, а титр вируса значительно падает между каждым циклом.
Примечание: аденовируса осадки образуются путем модификации протокола описано выше 31. - Развести 504 мг порошка MEM с 50 мл стерильной воды молекулярный класса, добавка с 244 мг бикарбоната натрия и фильтруют в стерильных условиях и хранить при 4 ° С.
- <литий> Приготовьте раствор хлорида кальция, добавив 1,5 г хлорида кальция в 50 мл молекулярной класса воды и фильтра в стерильных условиях и хранить при 4 ° С.
- Смешайте аликвоты, содержащие 4 × 10 8 БОЕ аденовируса-Cre с достаточной 3% сахарозы в стерильной воде до конечного объема 10 мл. Добавить 34 мл MEM к вирусу и осторожно перемешать. Затем добавляют 4 мл раствора CaCl 2, осторожно перемешать и инкубировать при комнатной температуре в течение 15-20 мин.
- Магазин не аденовирус на сухом льду до момента образовывать осадки. Избегайте таяние аденовируса и хранения на льду или при комнатной температуре в течение длительного времени, если осадки не образуются.
Примечание: Можно также смешать сахарозу, MEM и CaCl 2 до начала операции, если это не возможно, чтобы растопить аденовируса аликвоты и начать изготовление выпадает в осадок сразу после удаления от -80 ° С Это Аликвота сахароза, MEM и кальция не могут быть сохранены на сухом льду до готовности добавить аденовирус.
Примечание: Вирусные частицы стабильны в течение приблизительно 1 часа. - До каждой инъекции, мягко Флик трубку, чтобы убедиться, вирусные частицы смешиваются. Составьте 3 мл (2,5 х 10 7 PFU) вирусных частиц в шприц 10 мл и подготовить мышь для внутрипротокового инъекции.
4. Внутрипротоковый Инъекция вирусных частиц
- Аккуратно поместите мышь на спине на освещенную стадии чистой микроскопом рассечение. Освещать брюшной стороне с дополнительным источником света и найдите Left 4-й или правую 9-й паховой молочную железу небольшими белыми пятнами меха (видимых на C57BL / 6 женщин), сопровождающих каждое сосок.
- Натрите сосок мягко стерильным этанола, смоченной ватной палочки, чтобы очистить волосы от соска и стерилизовать место инъекции. Если их трудно найти, мягко нанесите толстый слой Крем для депиляции или использования ножниц, чтобы разоблачить соски.
- Снимите кератина вилку, а слой плотных мертвых клеток кожи, которая, охватывающий сосок. Как только сосок подвергается, кератин вилка должна быть хорошо видны под микроскопом рассечение.
- Безопасность сосок с мелкими хирургическими щипцами и тянуть с небольшим усилием, чтобы удалить кератина вилку.
- Стабилизировать сосок между щипцами.
- Аккуратно вставьте иглу между щипцами, cannulating клейкую канал под углом 90 °. Введите сосок слегка мимо скоса иглы (не более 2 мм), чтобы предотвратить проникновение через ткани молочной железы и в серозной оболочки брюшной полости тела.
- Не вставляйте иглу слишком глубоко. Для обеспечения надлежащей глубины инъекции, осторожно потяните иглу после вставки его в просвет канала, рисунок сосок вдоль краев иглы, как это подъехал.
Примечание: Визуализация инъекции трудно, поэтому практическаяэ для этого шага рекомендуется с использованием трипанового синего.
- Не вставляйте иглу слишком глубоко. Для обеспечения надлежащей глубины инъекции, осторожно потяните иглу после вставки его в просвет канала, рисунок сосок вдоль краев иглы, как это подъехал.
- Когда игла целесообразно поместить в молочную канала, отпустите 3 мл вирусных выделений (2,5 х 10 7 КОЕ аденовируса-Cre), осторожно погружая шприц с большим пальцем руки, держащей шприц. Сосок должен слегка надуть как жидкость добавляется.
5. Восстановление мышей
- Наведите мышь обратно на грелку после инъекции, пока он не начнет восстанавливаться от анестезии.
- Как только мышь восстанавливается, поместить его обратно в чистую клетку и монитор для полного восстановления и движения.
- 24 ч после внутрипротокового инъекции, подкожно вводить мелоксикам в дозе 1 мг / кг.
6. Мониторинг опухоли Прогрессирование
- Пропальпируйте вводят молочную железу на 30 день для расширения и набухания.
- Монитор прогрессии опухоли каждые 5-7 дней один раз в опухшие и увеличенный молочной Glanг наблюдается.
- Измерьте объемы опухолей каждые 3-4 дня для кинетики роста опухоли, как только ощутимые опухоли появляются (примерно 50-60 дней после аденовирусная инъекции).
- Эвтаназии мышей, когда объем опухоли более 10% от массы тела мышей.
Результаты
Успешное нацеливание протоков молочной дерева могут быть визуализированы путем подготовки тотальных молочной железы, как описано выше 32 после инъекции трипанового синего (чтобы проверить правильную технику инъекции (фиг.1А) или аденовирус, экспрессирующих mCherry (для проверки правильности вирусную инфекцию и подготовку из эпителиальных клеток протоков, фиг.1В).
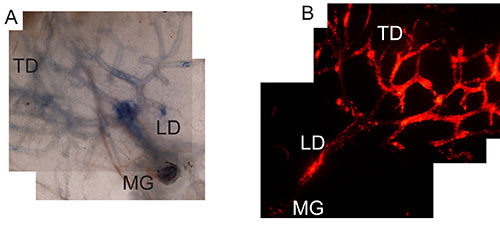
Рисунок 1. Intraductal нацеливание молочных желез путем инъекции с трипановым синим или аденовирус-mCherry. А) весь крепление, как сообщалось ранее, 32 молочной железы после инъекции молочной железы # 4 с трипанового синего, получали после инъекции 3 ч до визуализировать / подтверждение адресности всей протоковдерево. Изображения 4X увеличение. Б) Заражение эпителия протоков с аденовируса путем введения 2,5 х 10 7 КОЕ аденовируса выражая mCherry. Мышам вводили intraductally и 4 дн после инъекции, в целом крепление молочной железы, получали, чтобы подтвердить вирусную инфекцию протоков дерева. Изображение 4X увеличение. МГ молочной железы, Л. Д. является молокогонное или основной канал, и ТД является выводной проток. Кликните здесь, чтобы посмотреть увеличенное изображение.
При опухолях индуцируются в p53 LoxP / LoxP LSL-K-Ras G12D / + трансгенных мышей, опухоли не не будет очевидным, пока вокруг 40-й день, когда молочные железы станет увеличенный и опухшие. Надо начать пальпации, когда это наблюдается, мониторинг роста опухоли каждые 5-7 дней. В наших руках, упрочнение молочной железы всегда предшествует развитию развития опухоли. Опухоли будет прогрессировать медленно в течение дополнительных 2 недель. Начиная примерно с 56-й день, опухоли начнут расти в геометрической прогрессии (рис. 2В). В этот момент, очень важно, чтобы измерить объемы опухолей каждые 3 дня, если кинетические исследования желательны, потому что там будет небольшим мыши к изменчивости мыши в опухолевой прогрессии, которая является нормальным (рис. 2А и 3А). Большие массы брюшной будут очевидны по 80-й день (фиг. 2A, 2B, 3A и), после чего мышей должны быть умерщвлены, если опухоли превышать более чем на 10% от их веса тела. кДНК анализ трех клонов из несущей опухоль мыши показали экспрессию mesothelin, цитокератин-8, Her2/neu, и эстроген рецептор-α (рис. 2С).
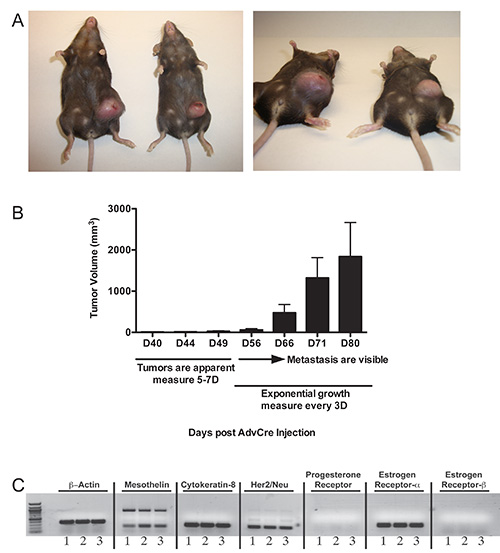
> Рисунок 2. Развитие опухолей у р53 LoxP / LoxP LSL-K-Ras G12D / + мышей вводили intraductally с аденовирус-Cre. A) Два примера опухолей 80 дней после инъекции с аденовируса, выражающей Cre. Мыши были даны 2.5 х 10 7 PFU аденовируса, выражающей Cre и 80 дней после опухоли инициация, большие ощутимые массы могут быть визуализированы, выступающий из брюшной стороне животного. B) Типичный опухолевые кинетики и графика пальпации опухолей, индуцированных в p53 LoxP / LoxP LSL-K-Ras G12D / + мышей. C) Характеристика трех клонов опухолевых клеток, полученных из той же гомогенизированный опухоли p53 LoxP / LoxP LSL-K-Ras G12D / + мыши. РНК экстрагировали и кДНК, синтезированные для анализа RT-PCR с использованием праймеров, специфичных к β-актин, mesothelin, цитокератин-8, Her2/neu, рецептор прогестерона, эстрогена рецепторов-α и рецептора эстрогена-β.TPS :/ / www.jove.com/files/ftp_upload/51171/51171fig2highres.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть увеличенное изображение.
По аналогии с сотовой микросреды при раке молочной железы человека, мы наблюдали инфильтрацию αβ и γδ Т-клеток, а также миелоидного получены супрессоров и макрофаги в опухоли (рис. 4). Сосудистой слива в подмышечных лимфатических узлов начнет поглощать до опухоли выросли, чтобы охватить всю ткань молочной железы, где была выполнена инъекция (рис. 3А). Лимфоваскулярная инвазия и метастазирование опухолевых клеток могут быть отслежены, пересекая мышей LSL-K-Ras G12D / + р53 LoxP / LoxP с LSL-EYFP мышей. После Cre-опосредованной удаления, опухолевые клетки, экспрессирующие YFP (высокого и низкого) обнаруживаются в опухоли и может быть прослежена метастазы сливной подмышечных лимфатических узлов (рис. 3В). Метастазы в дистальном подмышечных лимфатических узлов было подтверждено, успешно культивирование клеточной линии опухоли с этого сайта в опухолью LSL-K-Ras G12D / + p53 LoxP / LoxP мыши (данные не показаны).
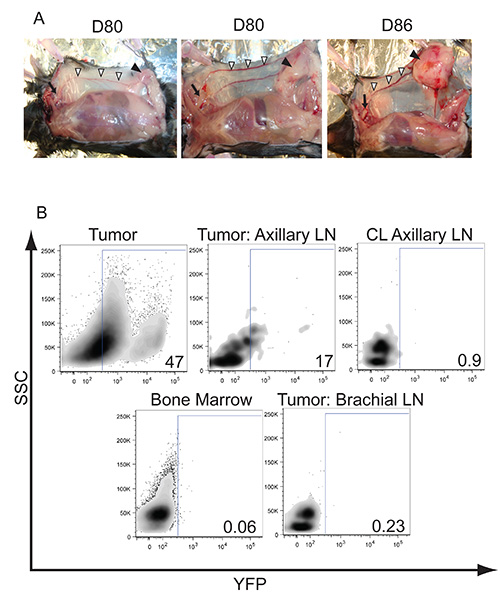
Рисунок 3. Формирование опухолей и скрытой метастазов в подмышечных лимфатических узлов.) Пример из трех передовых опухолей молочной железы с различными скоростями опухолевой прогрессии. Твердую массу, обозначено стрелкой форм и в конечном итоге растет до размеров всей брюшной ткани молочных желез. Опухоль остается ограничивается ткани молочной железы и не наблюдается для вторжения или прикрепить к мышце, покрывающей брюшную полость. Существует очевидно нагрубание поверхностной эпигастральной вены между паховых и подмышечных лимфатических узлов, обозначенных белыми стрелками. После 7-8 недель, тыс.э подмышечных лимфатических узлов начинает увеличиваются из-за лимфоваскулярной вторжения в опухолевых клетках, указанном стрелкой. B) Метастазы YFP положительных опухолевых клеток может быть визуализированы в подмышечных лимфатических узлов с помощью проточной цитометрии. Мышей LSL-K-Ras G12D / + р53 LoxP / LoxP LSL-EYFP были использованы, чтобы вызвать опухоли и активацию YFP на внутрипротокового доставки аденовируса-Cre. Чтобы проверить лимфоваскулярная инвазия опухолевых клеток в подмышечных лимфатических узлов, 80 дней после инъекции аденовируса, указанные лимфатические узлы и органы собирали и окрашивали в течение маркеров лимфоцитов и исследованы на экспрессию YFP. CL представляет контралатеральный неопухолевой слива лимфатический узел. Результаты представляют стробирования на CD45 негативных опухолевых клеток, что указывает на опухолевые клетки вторгаются дистального подмышечных лимфатических узлов. Цифры представляют процентов YFP положительные клетки от общей численности населения. Щелкните здесь для просмотра крупэ изображения.
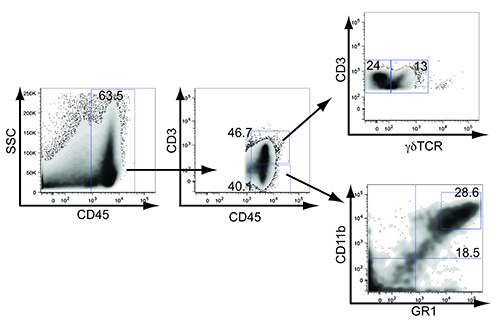
Рисунок 4. Иммунная инфильтраты в мыши трансгенных опухолей молочной железы. Опухоли молочной железы мыши гомогенизируют и окрашивали для CD45, CD3, γδTCR, CD11b и GR1. Цифры представляют процентов положительных лейкоцитов в всей опухоли (63,5), общее CD3 + (46.7), общий отрицательный CD3 (40.1), всего CD3 + γδ + (Т-клеток γδ, 13), CD3 + γδnegative (24), общий GR1 высокой CD11b (MDSC, 28.6) и всего CD11b GR1 низкие (макрофаги, 18.5). Кликните здесь, чтобы посмотреть увеличенное изображение.
Благодаря анатомии мыши и техники внутрипротокового инъекций, мы находим ориентации Oе молочные железы 4 и 9 (рис. 5) дает наиболее стабильные результаты и надежные инъекции. Однако любой железа могут быть направлены в зависимости от предпочтений технике, выполняющего операцию.
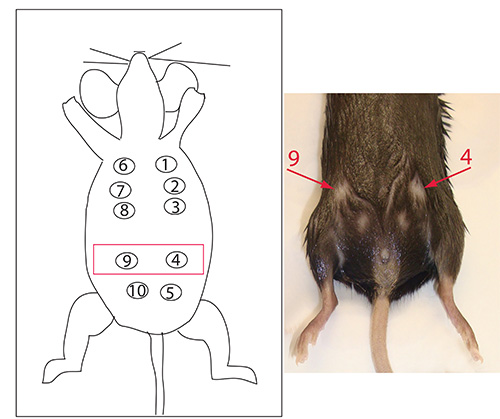
Рисунок 5. Нумерация молочных протоков. Молочные протоки 4 и 9, выделены красным цветом на схеме и указаны стрелками на мыши. В наших руках, мы обнаружили, что инъекции были легче всего выполнить на следующих молочных протоков, однако все другие молочные ткани, которые мы целевые разработанные опухоли с аналогичными кинетики. Кликните здесь, чтобы посмотреть увеличенное изображение.
Обсуждение
Успех этой процедуры зависит от правильной техники во время внутрипротокового инъекций, которые будет трудно для неподготовленных экспериментаторов. Опытные исследователи в нашей лаборатории как правило, получают опухоли молочной железы массам 79% времени они управляют аденовирусные инъекции. Проблемы с инъекции может привести к значительной задержкой, переменной или отсутствующего развития опухоли. Если игла вводится слишком глубоко или в неподходящий углом, протоков канал может быть упущен. Важно, чтобы ввести сосок слегка мимо скоса иглы (не более 2 мм), чтобы предотвратить проникновение через ткани молочной железы и в серозной оболочки брюшной полости тела. Кроме того, слишком мелкой размещение иглы или инъекции больше, чем 3 мл вирусных выделений может привести к утечке вирусного преп вне молочной железы и индукции непреднамеренных опухолей. Одним из способов преодоления этих проблем, это вставить иглу в сосок слегка deepeг более 3 мм, и медленно нарисовать шприц обратно из канала до 2 мм от кончика фаски. Это гарантирует, что ткань молочной железы предназначен вместо мышцы, окружающей брюшную полость мышей (фиг. 1а). Это также растягивать сосок вдоль краев шприца так, что, когда вирус выталкивается в канал, нет утечка и потеря вирусных выделений.
Визуализация инъекции трудно и практика для этого шага рекомендуется. Мы наблюдали увеличение успешных инъекций следующее практике приводит к более высокой пенетрантности развития опухоли. Поскольку этот метод использует nonlactating девственные самки, очень важно, чтобы удалить кератина вилку, охватывающий сосок, чтобы выявить основные воздуховода канал. Мы рекомендуем практиковать этот шаг, вводя трипановым синим или какой-либо другой стерильной прослеживается краситель внутри канала и подготовка целые молочные крепления для подтверждения адресности протоков трEE. Кроме того, другие протоколы, описывающие внутрипротокового инъекции реагентов были опубликованы 33,34, которые могут быть полезны для разработки правильной техники. Проблемы с вирусного препарата или инфекции из протоков просвет также могут быть исследованы с помощью mCherry выражающее аденовирус. Нетрансгенных мыши могут быть использованы для каждой из этих целей, пока методика инъекции не оптимизирован.
Хотя любой молочной железы может быть использован, чтобы инициировать опухоли, мы добились наиболее последовательные темпы роста, направляя молочную железу 4 или 9, которому мы верим, потому что это легче выполнять соответствующие инъекции на этих желез, что способствует повышению эффективности адресности канал. Близость левой 4-го или вправо 9-й паховых молочных желез к сливной пахового лимфатического узла также полезно изучить противоопухолевые иммунные реакции во время различных временных точках опухолевой прогрессии. Для моделирования и отслеживать скрытую метастазы в дистальных сайтов, тransgenic мыши были скрещены с мышами LSL-EYFP. По мере прогрессирования опухоли, сосудистой подключения опухоль в подмышечной лимфатического узла станет слегка наполненный приблизительно в 5 недель, прежде чем опухоль начинает расти в геометрической прогрессии (рис. 3А). В конце концов, через 7-8 недель, лимфоваскулярная вторжение приведет к росту опухоли в подмышечных лимфатических узлов (фиг. 3A и 3B). Использование репортер мышей и технологии Cre-LoxP, включение YFP создает платформу для отслеживания опухолевые клетки метастазы дистальных участков по всей опухолевой прогрессии. Это может облегчить исследования, направленные на выяснение клеточные и эпигенетические механизмы, которые способствуют скрытую метастаз. В наших руках, опухолевые линии клеток молочной железы выразил цитокератин-8, mesothelin, эстроген рецептор-α и Her2/neu, подтверждая адресности эпителия протоков. Тем не менее, в зависимости от мутаций, индуцированных и в связи с трудностью и изменчивости инъекций, мы рекомендуемгистологическое характеристика опухолей После того как модель хорошо известна в лаборатории.
Потому что рак молочной железы является таким смертоносным и всепроникающей заболевание 1,2, важно использовать животные модели, которые точно воспроизводят сложное взаимодействие между опухолью и принимающей стороной. Здесь мы описываем полностью обратному скрещиванию C57BL / 6 мышиной модели опухоли молочной железы. Во-первых, за счет индукции опухолей из родных клеток, мы позволяем опухоль развиваться естественно в полной иммунной микросреды. Иммунная микросреда в развитых мыши опухолей молочной железы повторяет популяции αβ и γδ Т-клетки, миелоидные полученные супрессоров и макрофаги обычно наблюдаемые в человеческой молочной железы (рис. 4). Как мы уже ранее опубликованные с помощью аденовируса-Cre, чтобы вызвать опухоли яичников, мы обнаружили, что вирусная инъекция была пренебрежимо малое влияние на соответствующие инфильтратов опухоли и опухолевой прогрессии 28. Во-вторых, эндокринной независимымвыражение онкогенов гарантирует, что опухолевые клетки имеют упорно высокий уровень экспрессии гена-мишени. В-третьих, воспользовавшись скрытых мутаций, мы можем контролировать сроки опухолей, чтобы облегчить точную временную отслеживание эволюции опухоли. Применение этой модели включают исследования по опухолевых клеток биологии, исследования по факторам в опухолевую микросреду, противоопухолевых иммунных реакций и даже эффективности оценки новых терапии. Через наличия системы Cre-LoxP, эта методика может быть использована в качестве основы для исследования разнообразное множество дополнительных мутаций в инициации и развитии опухолей молочной железы. Мы надеемся, что использование этой модели позволит повысить понимание рака молочной железы биологии и в конечном итоге привести к новым терапии, направленных на лечении метастатического рака молочной железы.
Раскрытие информации
Авторы заявляют каких конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана NCI грантов RO1CA157664 и RO1CA124515, и награда груди Союз Рака. Мы хотели бы поблагодарить Джеффри Фауст, Дэвид Эмброуз, и Скотт Вайсс из основного объекта Вистар проточной цитометрии, Джеймс Хейден от объекта Вистар с изображениями, и весь персонал вивария Института Вистар за неоценимую техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Trp53tm1Brn Transgenic mice K-rastm4Tyj Transgenic mice | Obtained from NCI mouse models of human cancer consortium | Mice were backcrossed ten times to a full C57BL/6 background | |
| B6.129X1- Gt(ROSA)26Sortm1(EYFP)Cos/J Transgenic mice | Jackson Labs | 006148 | |
| Primers p53loxP/loxP | Integrated DNA Technologies | 5'-AAGGGGTATGAGGGACAAGG-3' 5'-GAAGACAGAAAAGGGGAGGG-3' | |
| Primers LSL-K-rasG12D/+ | Integrated DNA Technologies | 5'-CGCAGACTGTAGAGCAGCG-3' 5'-CCATGGCTTGAGTAAGTCTGC-3' | |
| Primers for LSL-EYFP to detect Rosa promoter | Integrated DNA Technologies | 5'-AAGACCGCGAAGAGTTTGTC-3' 5'-GGAGCGGGAGAAATGGATATG-3' 5'-AAAGTCGCTCTGAGTTGTTAT-3' | |
| Primers for detection of Mesothelin expression | Integrated DNA Technologies | 5'-TTGGGTGGATACCACGTCTG-3' 5'-CGGAGTGTAATGTTCTTCTGTC-3' | |
| Primers for detection of Progesterone Receptor expression | Integrated DNA Technologies | 5'-GCAATGGAAGGGCAGCATAA-3' 5'-TGGCGGGACCAGTTGAATTT-3' | |
| Primers for detection of Cytokeratin 8 expression | Integrated DNA Technologies | 5'-ATCAGCTCTTCCAGCTTTTCCC-3' 5'-GAAGCGCACCTTGTCAATGAAGG-3' | |
| Primers for detection of Erbb2 expression | Integrated DNA Technologies | 5'-ACCTGCCCCTACAACTACCT-3' 5'-AAATGCCAGGCTCCCAAAGA-3' | |
| Primers for detection of Estrogen Receptor A expression | Integrated DNA Technologies | 5'-ATGAAAGGCGGCATACGGAA-3' 5'-GCGGTTCAGCATCCAACAAG-3' | |
| Primers for detection of Estrogen Receptor B expression | Integrated DNA Technologies | 5'-ACCCAATGTGCTAGTGAGCC-3' 5'-TGAGGACCTGTCCAGAACGA-3' | |
| Primers for detection of B-Actin expression | Integrated DNA Technologies | 5'-GCCTTCCTTCTTGGGTATGG-3' 5'-CAGCTCAGTAACAGTCCGCC-3' | |
| Adenovirus-Cre | Gene Transfer Vector Core from the University of Iowa | Ad5CMVCre | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Adenovirus-mCherry | Gene Transfer Vector Core from the University of Iowa | Ad5CMVmCherry | Store aliquots of virus (4 x 108 pfu/aliquot) at -80 °C to avoid repeated freeze thaw cycles. |
| Hamilton syringe | Hamilton company | 701RN | 10 μl syringe, RN series. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Custom needle | Hamilton company | 7803-05 | 33 G 0.5 in long RN needle, with a 12° bevel. Autoclave before and after each use. Clean with PBS and 75% ethanol. |
| Surgical forceps | Dumont | 52100-58 | Dumostar No. 5 forceps. Clean with 75% ethanol after each use, followed by autoclaving |
| MEM powder | Cellgro | 50 012 PB | Store at 4 °C in powder and reconstituted form |
| Sodium Bicarbonate | Fisher | S233 | Add to MEM and filter stearilize |
| Calcium Chloride | Sigma | C4901 | Minimum 96%, anhydrous |
Ссылки
- Youlden, D., et al. The descriptive epidemiology of female breast cancer: an international comparison of screening, incidence, survival and mortality. Cancer Epidemiol. 36, 237-248 (2012).
- Siegel, R., Naishadham, D. Cancer statistics, 2012. Cancer J. Clin. 62, 10-29 (2012).
- Sorlie, T., et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc. Natl. Acad. Sci. U.S.A. 98, 10869-10874 (2001).
- Gatza, M., et al. A pathway-based classification of human breast cancer. Proc. Natl. Acad. Sci. U.S.A. 107, 6994-6999 (2010).
- Bastien, R., et al. PAM50 breast cancer subtyping by RT-qPCR and concordance with standard clinical molecular markers. BMC Med. Genom. 5, 44 (2012).
- Montagna, E., et al. Heterogeneity of triple-negative breast cancer: histologic subtyping to inform the outcome. Clin. Breast Cancer. 13, 31-39 (2013).
- Karrison, T. G., Ferguson, D. J., Meier, P. Dormancy of mammary carcinoma after mastectomy. J. Natl. Cancer Inst. 91, 80-85 (1999).
- Rakha, E., et al. The prognostic significance of lymphovascular invasion in invasive breast carcinoma. Cancer. 118, 3670-3680 (2012).
- Kim, I., Baek, S. Mouse models for breast cancer metastasis. Biochem. Biophys. Res. Commun. 394, 443-447 (2010).
- Vargo-Gogola, T., Rosen, J. Modelling breast cancer: one size does not fit all. Nat. Cancer. 7, 659-672 (2007).
- Archer, T., et al. Steroid hormone receptor status defines the MMTV promoter chromatin structure in vivo. J. Steroid Biochem. Mol. Biol. 53, 421-429 (1995).
- Cato, A., Henderson, D., Ponta, H. The hormone response element of the mouse mammary tumour virus DNA mediates the progestin and androgen induction of transcription in the proviral long terminal repeat region. EMBO J. 6, 363-368 (1987).
- Schoenenberger, C., Zuk, A., Groner, B., Jones, W., Andres, A. Induction of the endogenous whey acidic protein (Wap) gene and a Wap-myc hybrid gene in primary murine mammary organoids. Dev. Biol. , 327-337 (1990).
- Li, Y., et al. Deficiency of Pten accelerates mammary oncogenesis in MMTV-Wnt-1 transgenic mice. BMC Mol. Biol. 2, 2 (2001).
- Martelli, C., et al. In vivo imaging of lymph node migration of MNP- and (111)In-labeled dendritic cells in a transgenic mouse model of breast cancer (MMTV-Ras). Mol. Imaging Biol. 14, 183-196 (2012).
- Klover, P. J., et al. Loss of STAT1 from mouse mammary epithelium results in an increased Neu-induced tumor burden. Neoplasia. 12, 899-905 (2010).
- Moody, S. E., et al. Conditional activation of Neu in the mammary epithelium of transgenic mice results in reversible pulmonary metastasis. Cancer Cell. 2, 451-461 (2002).
- Banerji, S., et al. Sequence analysis of mutations and translocations across breast cancer subtypes. Nature. 486, 405-409 (2012).
- Miyakis, S., Sourvinos, G., Spandidos, D. A. Differential expression and mutation of the ras family genes in human breast cancer. Biochem. Biophys. Res. Commun. 251, 609-612 (1998).
- Malaney, S., Daly, R. J. The ras signaling pathway in mammary tumorigenesis and metastasis. J. Mammary Gland Biol. Neoplasia. 6, 101-113 (2001).
- Loboda, A., et al. A gene expression signature of RAS pathway dependence predicts response to PI3K and RAS pathway inhibitors and expands the population of RAS pathway activated tumors. BMC Med. Genomics. 3, 26 (2010).
- von Lintig, F. C., et al. Ras activation in human breast cancer. Breast Cancer Res. Treat. 62, 51-62 (2000).
- Downward, J. Targeting RAS signalling pathways in cancer therapy. Nat. Rev. Cancer. 3, 11-22 (2003).
- Eckert, L. B., et al. Involvement of Ras activation in human breast cancer cell signaling, invasion, and anoikis. Cancer Res. 64, 4585-4592 (2004).
- Hollestelle, A., Elstrodt, F., Nagel, J., Kallemeijn, W., Schutte, M. Phosphatidylinositol-3-OH kinase or RAS pathway mutations in human breast cancer cell lines. Mol. Cancer Res. 5, 195-201 (2007).
- Jackson, E., et al. Analysis of lung tumor initiation and progression using conditional expression of oncogenic K-ras. Genes Dev. 15, 3243-3248 (2001).
- Jonkers, J., et al. Synergistic tumor suppressor activity of BRCA2 and p53 in a conditional mouse model for breast cancer. Nat. Genet. 29, 418-425 (2001).
- Scarlett, U., et al. Ovarian cancer progression is controlled by phenotypic changes in dendritic cells. Exp. Med. 209, 495-506 (2012).
- Vooijs, M., Jonkers, J., Berns, A. A highly efficient ligand-regulated Cre recombinase mouse line shows that LoxP recombination is position dependent. EMBO Rep. 2, 292-297 (2001).
- Young, N., Crowley, D., Jacks, T. Uncoupling cancer mutations reveals critical timing of p53 loss in sarcomagenesis. Cancer Res. 71, 4040-4047 (2011).
- Dinulescu, D., et al. Role of K-ras and Pten in the development of mouse models of endometriosis and endometrioid ovarian cancer. Nat. Med. 11, 63-70 (2005).
- Landua, J., Visbal, A., Lewis, M. Methods for preparing fluorescent and neutral red-stained whole mounts of mouse mammary glands. J. Mammary Gland Biol. Neoplasia. 14, 411-415 (2009).
- Barham, W., Sherrill, T., Connelly, L., Blackwell, T. S., Yull, F. E. Intraductal injection of LPS as a mouse model of mastitis: signaling visualized via an NF-kappaB reporter transgenic. J. Vis. Exp. , e4030 (2012).
- Murata, S., et al. Ductal access for prevention and therapy of mammary tumors. Cancer Res. 66, 638-645 (2006).
Erratum
Formal Correction: Erratum: Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer
Posted by JoVE Editors on 10/20/2014. Citeable Link.
A correction was made to Initiation of Metastatic Breast Carcinoma by Targeting of the Ductal Epithelium with Adenovirus-Cre: A Novel Transgenic Mouse Model of Breast Cancer. Protocol sections 3.1, 3.3.2, 3.4, and 4.7 were updated. The materials table was also updated.
Protocol section 3.1 was updated from:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 ml of 2.5 x 107 pfu of adenovirus particles.
to:
3.1) Store adenovirus concentrated virus stocks at -80°C frozen in aliquots of 4 x 108 pfu each, sufficient for injecting 16 animals with 3 µl of 2.5 x 107 pfu of adenovirus particles.
Protocol section 3.3.2 was updated from:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 ml. Add 34 ml of MEM to the virus and gently mix. Then add 4 ml of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
to:
Mix aliquots containing 4 x 108 pfu adenovirus-Cre with sufficient 3% sucrose in sterile water for a final volume of 10 µl. Add 34 µl of MEM to the virus and gently mix. Then add 4 µl of the CaCl2 solution, gently mix, and incubate at room temperature for 15-20 min.
Protocol section 3.4 was updated from:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 ml (2.5 x 107 pfu) of virus particles into the 10 ml syringe and prepare the mouse for the intraductal injection.
to:
Prior to each injection, gently flick the tube to make sure virus particles are mixed. Draw up 3 µl (2.5 x 107 pfu) of virus particles into the 10 µl syringe and prepare the mouse for the intraductal injection.
Protocol section 4.7 was updated from:
When the needle is appropriately placed into the mammary duct, release the 3 ml of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
to:
When the needle is appropriately placed into the mammary duct, release the 3 µl of virus precipitates (2.5 x 107 pfu of adenovirus-Cre) by gently plunging the syringe with the thumb of the hand holding the syringe. The nipple should slightly inflate as the liquid is added.
Item 15 in the Materials table under Comments was updated from:
10ml syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
to:
10µl syringe, RN series Autoclave before and after each use. Clean with PBS and 75% ethanol.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены