Method Article
疟疾蚊子中的二维和三维染色体绘画
摘要
染色体绘图是研究细胞核组织与卡约型演化的有用方法。在这里,我们演示了一种方法,将特定感兴趣的区域从单聚酯染色体中分离和放大,这些染色体随后用于 原位 杂交 (FISH) 的二维和三维荧光。
摘要
全臂染色体探针 原位 杂交(FISH)荧光是绘制感兴趣的基因组区域图谱、检测染色体重新排列以及研究细胞核染色体的三维(3D)组织方面的一项强有力的技术。激光捕获微分(LCM)和全基因组扩增(WGA)的出现使得从单个细胞获得大量的DNA。WGA试剂盒的灵敏度提高促使我们开发染色体涂料,并将其用于探索非模型生物体的染色体组织和进化。在这里,我们提出了一个简单的方法,从非洲疟疾蚊子 阿诺菲莱斯甘比亚的卵巢护士细胞分离和放大单多态染色体手臂的真色段。此过程为获取染色体涂料提供了一个高效的平台,同时降低了将外来DNA引入样本的总体风险。使用 WGA 允许进行几轮重新放大,从而产生大量 DNA,可用于多个实验,包括 2D 和 3D FISH。我们证明,研制的染色体涂料可以成功地用于建立 安冈比亚多色体和线粒体手臂的多色部分之间的对应关系。总的来说,LCM和单染色体WGA的结合为未来细胞遗传学和基因组学研究提供了一个有效的工具,用于创建大量的目标DNA。
引言
染色体绘画是研究卡约型1-5的进化和通过荧光标记染色体DNA1,6-8的杂交可视化细胞遗传异常的有用技术。 该方法还应用于研究染色体区域在开发9和病理学10的3D动力学。差别标记染色体涂料用于可视化单个线粒体11、12、美感13、14或相间非聚酯15、16和聚酯9、11、17染色体。获得染色体油漆的简单而有力的协议对于将这项技术扩展到蚊子等非模型生物是非常有用的。冈比亚阿诺菲莱斯综合体由七种形态上无法区分的蚊子组成,在行为和适应能力上各不相同,包括传播疟疾的能力。 这些蚊子是一个很好的模型,以更好地了解密切相关的物种的进化,它们的载体能力差异很大。 大多数疟疾蚊子的细胞遗传学研究都是使用发育良好、高度聚化的染色体进行的(18、19年回顾)。多态染色体的可读带状模式使研究人员能够证明多态反转与安诺菲莱斯甘比亚20的生态适应之间的关联。此外,3D多丁基染色体组织的组织特异性和物种特异性22特征在安马库利彭尼斯综合体中具有特征。然而,研究线粒体染色体可以提供额外的重要信息。例如,在线粒体染色体中观察到的异色素多态性水平较高,与安冈比亚23年交配活动和生育能力下降有关。聚氨酯和线粒体染色体手臂的真色段之间的对应性可能仅通过比较其相对长度来确定。这是因为异色素在线粒体染色体中占很大比例,但在多丁染色体24中所占比例不足。疟疾蚊子的染色体涂料的提供将使研究人员能够显著扩大细胞遗传学研究,包括更多的物种,同时大大减少在这组流行病学上重要的昆虫中对染色体的卡约蒂奇进化和3D动力学分析的成本和时间。
为了获得大量的染色体,微分流已成为操纵和隔离染色体补充的特定感兴趣区域的一种综合技术。 当与全基因组扩增(WGA)相结合时,微分流会产生强大的下游应用,包括FISH 11、12和下一代基因组测序25-27。以前,该技术需要使用专门的微分针,必须由经验丰富的用户28手动控制。 激光捕获微分(LCM)的进步,使简化的工具更适合分离单细胞29,30或个别染色体31-33,减少污染风险。这种方法允许用户研究单个细胞中发生的遗传异质性和染色体异常,而不是通过将多个细胞聚集在一起34-36的结果形成的共识景观。已使用多种方法放大从微分量中产生的DNA。 DOP-PCR,一种可用于放大高度重复序列的技术,已被用于放大来自物种的微分色体,包括蝗虫37,尖鳗38,尼罗拉皮亚39。 最近,基于PCR的基因组Plex WGA4单细胞套件和基于多位移放大(MDA)的回复-G单细胞套件已成为实验的宝贵工具,涉及单人细胞的遗传分析以及40-42染色体,包括蝗虫37和蝗虫43的B染色体系统。这两个套件各有优缺点,但它们明显优于其他可用的放大系统已证明44。
从单个染色体或染色体段获得的DNA数量明显低于整个细胞核。因此,对单个染色体的微分、放大和后续分析更具挑战性,尤其是在像德罗索菲拉或阿诺菲尔斯这样的小基因组生物中。 虽然油漆是由人类33号和黄蜂45号的单微分色体开发而成的,但成功的FISH实验需要果蝇11号的多条(至少10-15条)微分层染色体。然而,微分和放大单染色体的能力对于(一) 减少不同染色体材料受到污染的机会很重要:(二) 尽量减少微分所需的染色体制剂数量:(三) 降低鱼产和测序下游应用中微分化样品的核苷酸和结构多态性。在许多迪普特兰物种中发现的聚氨酯染色体为获得更高的DNA起始量提供了独特的机会。它们还提供了更高的分辨率和染色体结构,而这种结构是无法通过使用线性染色体来实现的。此添加的分辨率对于可视化染色体重新排列、染色质结构和染色体段进行微分化28,46至关重要。
在这里,我们提出了一个程序,有效地隔离一个多肽染色体手臂的真色段,放大DNA,并将其用于疟疾蚊子的下游FISH应用。 首先,我们应用 LCM 从特别准备的膜滑梯中分离和提取单个染色体手臂。其次,WGA用于从微分化材料中放大DNA。第三,在FISH实验中将放大的DNA杂交到聚丁壁球制剂47、元相和相间染色体滑动48,以及3D卵巢整体安装样本。这个过程已经成功地画了大部分的欧洲色素在安冈比亚的染色体手臂。
研究方案
1) 聚氨酯染色体幻灯片准备激光捕获微分
- 在血液喂养后 25 小时解剖半贪图的 阿诺菲莱斯 女性。在室温下将大约五个女性的卵巢修复成 500 μl 的新鲜改性卡诺伊溶液 (100% 甲醇:冰川醋酸,3:1),在室温下 24 小时。将卵巢转移到-20°C进行长期存储。
- 在制作染色体滑梯之前,准备卡诺伊的溶液(100%乙醇:冰川醋酸,3:1)和50%丙酸。
- 将一对卵巢放在蔡司 1.0 PET 膜幻灯片上,将一滴卡诺伊溶液放在一滴卵巢中。根据大小,将卵巢分成大约2-4个部分,用解剖针头,并将它们放入解剖显微镜下干净滑梯上50%的丙酸下降。
- 在解剖立体显微镜下使用纸巾分离卵泡并去除剩余的组织。在毛囊中加入50%的丙酸新滴,使其在室温下静坐3-5分钟。
- 将硅化盖片放在液滴顶部。让幻灯片站立约1分钟。
- 用吸水材料盖住滑梯(使用滤纸用于此方法),在使用铅笔橡皮擦侧时,通过多次使用橡皮擦敲击滑梯,对滑梯施加大量压力。
- 在滑梯变性/杂交系统上将滑梯加热至 60 °C 15-20 分钟,以帮助平整聚酯染色体。将滑入湿室,在4°C过夜,使酸进一步扁平染色体。
- 将幻灯片置于冷50%乙醇中10分钟。轻轻取出盖子,在冷50%乙醇中再更换10分钟。
- 脱水在70%,90%,100%乙醇中滑动5分钟。空气干燥滑梯。
- 通过在 1 升蒸馏水中添加单个缓冲片来准备 GURR 缓冲解决方案。高压 釜。
- 通过在 50 毫升 GURR 缓冲器中添加 1 毫升吉姆萨染色溶液来准备 Giemsa 解决方案。
- 将空气干燥的滑梯放在 Giemsa 溶液中 10 分钟,在 1X PBS 中洗三次。空气干燥再次在受控的无菌气候中滑动,以避免污染。
2) 激光捕捉单个多肽染色体手臂的微分
本节详细介绍了 PALMRobo 软件的使用,该软件附带PALM 微束激光微解剖 系统。
- 用100%乙醇清洁显微镜。在紫外线交叉链接器中用紫外线对手套和管子进行消毒。
- 为 PALM 微束激光微分显微镜供电并打开激光。打开激光解剖套件 PALMRobo,并在必要时配置"电源"和"焦点"设置。
- 搜索感兴趣的多态性染色体手臂。
- 使用"铅笔"工具勾勒出所选区域的轮廓。
- 从菜单栏打开"元素窗口"。
- 选择"绘制元素",确保您选择了"切割"。
- 将胶粘剂帽管安装到支架上,放在滑梯上方,留下一个1毫米大小 <的小缝隙,然后启动激光切割。
- 将"弹射选择"放置在切割部位,在边缘和染色体之间留出空间。
- 从下拉选项中选择"LPC"并开始弹射。
- 检查以确保样品通过按下"Eye"图标弹射成盖子。
3) 从单个微分体多肽染色体手臂中净化DNA
按照 QIAamp DNA 微工具包的说明释放和净化采集的 DNA。第 3.1 步进行了修改,以适应倒管。
- 在倒管(盖内)中加入15μl缓冲器ATL和10μl蛋白酶K,在56°C孵育3小时。
- 添加 25 μl 缓冲 ATL、50μl 缓冲 AL 和 1 μl 载体 RNA;混合。 添加 50μl 100% Etoh;混合。
- 将利萨特转移到QIAamp列:离心机。通过添加500μl缓冲器AW1进行清洗;离心机。将列放入新的收集管中,添加 500 μl 缓冲器 AW2;离心机。将柱子放入新管中:离心机去除多余的液体。
- 将柱子放入 1.5μl 微中微管中,并加入 20μl 的水以稀释:离心机。
- 使用真空吸尘器将新鲜蒸发的DNA蒸发到最终体积为 9 μl。
4) 从单个微分隔的多肽染色体手臂上放大DNA
单染色体手臂的 WGA 使用了两种不同的协议。
- 通过基因组Plex WGA进行DNA扩增和探针制备
- 按照基因组丛单细胞WGA4套件协议,产生第一批放大的DNA:
- 在 9 μl 样品中加入新鲜准备的蛋白酶 K 溶液;混合。在50°C孵化DNA1小时,然后加热到99°C4分钟。继续冰上
- 添加 2 μl 1X 单细胞库准备缓冲区和 1 μl 库稳定解决方案;混合。加热样品到 95 °C 2 分钟。在冰上和离心机上冷却。
- 添加1μl的图书馆准备酶;混合和离心机。孵化如下:
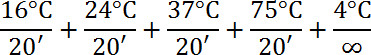
- 加入 7.5 μl 10X 放大主混合,48.5 μl 水。5.0 μl WGA 脱氧核糖核酸聚合酶;混合和离心机。
- 恒温器如下:
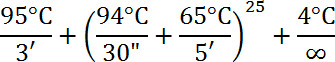
- 使用基因组脱氧核糖核酸清洁和浓缩剂套件净化DNA。协议如下:
- 添加 5:1 DNA 结合缓冲器:DNA 样本(特别是小于 2 kb 的基因组脱氧核糖核酸)。如果样本DNA大于2 kb,请使用2:1的比例),并转移到提供的旋转柱。离心机。
- 添加 200 μl 脱氧核糖核酸清洗缓冲区和离心机。重复洗涤步骤。然后,加入50微克的水,将DNA稀释到新的1.5毫升管中。
- 使用基因组Plex WGA3再放大套件重新放大样本DNA如下:
- 在 PCR 管中加入 10μl DNA(该试剂盒建议总共 10 ng DNA),其中 49.5 μl 水、7.5 μl 10x 放大主混合、3.0 μl 10 mM DNTP 混合和 5.0 μl WGA 脱氧核糖核酸聚合酶。混合离心机。
- 使用以下配置文件进行反应:
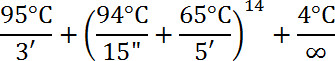
- 将DNA储存在-20°C。
- 使用基因组Plex WGA3再放大套件为鱼贴上标签DNA如下:
- 通过在 PCR 管中加入 10μl DNA 和 49.5 μl 水,从基因组Plex WGA3再放大套件中创建主组合, 7.5 μl 10X 放大主混合,3.0 μl 1 mM dNTP 混合 (1 mM dATP、dCTP、dGTP、0.3 μl 1 mM dTTP - 如果使用标记的 dUTP),1 μl 25 nM 标记 dUTP和5.0μl WGA脱氧核糖核酸聚合酶。
- 使用以下配置文件进行反应:
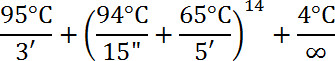
- 乙醇通过添加 1/10 最终反应量(7.5 μl 代表 75 μl 反应)的 3 M 醋酸钠 pH 5.2 和 2-3 卷 100% 乙醇来沉淀标记的探头。在-80°C下冷却DNA样本至少30分钟。
- 离心机样品在 4 °C 10 分钟内创建标记颗粒并去除超自然和空气干燥颗粒。
- 创建混合缓冲区如下:
0.2 g 德克斯特伦硫酸盐
1200 μl 除离子化形式酰胺
580 微升 H2O
120μl 20X SSC - 在空气干燥的颗粒中加入 40 μl 的杂交缓冲。
- 按照基因组丛单细胞WGA4套件协议,产生第一批放大的DNA:
- DNA 放大和探针准备通过回复 - G 单细胞 Wga 然后进行刻痕翻译
- 按照回复-g 单细胞 WGA 套件协议生成放大的 DNA:
- 准备缓冲区 D2(3 μl 的 1 M DTT + 33μl 缓冲区 DLB)。
- 将 4 μl 纯化微分化材料与 3μl 缓冲 D2 混合。轻拂管混合。在 65 °C 下孵育 10 分钟。 添加3μl的停止解决方案;混合。
- 在样品中加入 9μl H2O、29μl 回复-g 反应缓冲器和 2 μl 的 REPLI-g DNA 聚合酶。在30°C孵育8小时。通过加热到 65 °C 3 分钟来灭活 DNA 聚合酶。将DNA储存在-20°C。
- 按照尼克翻译协议标记回复 - g 放大的 Dna:
- 准备以下标签组合:
1μg 的放大脱氧核糖核酸
5 μl 10X 脱氧聚合酶缓冲区
5μl 10X dNTP
5μl 1X BSA
1μl 1 mM 标记 dNTP
4 μl 1 U/μl 德纳塞 I
1μl 10 U/μl 脱氧核糖核酸聚合酶 I
H2O 至 50μl - 在15°C孵育2小时。添加 2μl 的 0.5 M EDTA 以停止反应。通过在凝胶上运行来检查DNA片段大小。
- 按照从 4.1.4.3-4.1.4.6 开始的步骤沉淀和溶解颗粒。
- 准备以下标签组合:
- 按照回复-g 单细胞 WGA 套件协议生成放大的 DNA:
5) 多肽和线粒体壁球制剂的 2D 鱼
请参阅 FISH 关于多丁酸挤压 47和线粒体滑动48的制备的详细协议。在这里,我们提供简短的协议。
- 多肽染色体壁球制剂上的鱼
- 在 RT 将幻灯片浸入 1X PBS 中 20 分钟,在 1X PBS 中修复 4% 的副甲醛滑梯 1 分钟。
- 脱水通过乙醇洗涤滑动: 50%, 70%, 90%, 100% 每个 5 分钟在 Rt. 空气干燥幻灯片。
- 在 37 °C 的混合缓冲区预热探针。 添加 10-20 μl 的探头以滑动。盖上22 X 22毫米盖面。使用移液器尖端按压任何气泡。
- 在90°C下脱色染色体和探针10分钟。用橡胶水泥密封盖片边缘。将滑梯转移到潮湿的室内,并在39°C的夜间孵化。
- 在 39 °C 下用 1X SSC 清洗幻灯片 20 分钟。在 RT 使用 1X SSC 清洗幻灯片 20 分钟。在 1 倍 PBS 中冲洗幻灯片,然后用 DAPI 添加延长防褪色。盖上盖子,在可视化前至少一小时将幻灯片盒存放在 4 °C 的幻灯片盒中。
- 线粒体染色体壁球制剂上的鱼
- 从安冈比亚第4星幼虫的假想盘中提取线粒体染色体。
- 准备适合鱼的染色体幻灯片。
- 在管子中的杂交缓冲器中加入 2-3 μl 的标记 DNA 探头,并通过管道轻轻混合。
- 将探头混合物的 10μl 涂抹在滑梯上,并盖上 22 X 22 mm 盖片。使用移液器尖端按压任何气泡。
- 对于防污和检测,请在制备中应用使用 DAPI 延长防褪色功能,并在可视化前在黑暗中保持至少一小时。
6) 全山卵巢组织的3D鱼
- 准备以下缓冲区 A 组合:
60米千克
15毫米纳克
0.5米精氨酸
0.15米精氨酸
2米埃德塔
0.5米埃格塔
15米管道 - 通过在正方形图案中添加一层钉子,以匹配盖片的大小,为核可视化准备幻灯片。这创建一个凸起的表面,以防止将来放置在盖片上的核挤压。
- 从克里斯托弗的第三阶段女性解剖新鲜卵巢,并保持在150-250μl缓冲器A的解决方案与0.5%的数字宁。在毛囊上运行较大的解剖针(带缓冲区 A 的管状物,0.5% 数字诺宁),以破坏卵泡膜。
- 漩涡5-10分钟,以进一步扰乱毛囊。以 每分钟 500 转的最低设置 (RPM) 刮下任何大型叶片和离心管 30 秒。将超自然物转移到新的 2 毫升 Eppendorf 管中,并添加 100 μl 的缓冲区 A. 在 5-7 次之间重复步骤 6.3,直到可见组织被分解成小颗粒。
- 在 2,000 RPM 下旋转两根管子 10 分钟。在两个管中丢弃超自然物。 注意:两个管子将用于制作最终的核可视化幻灯片。含有收集的超自然体的管子应包含主要提取的核,而具有组织的原始管将包含嵌入在护士细胞中的组织和核的混合物。 添加200μl缓冲区A–0.1%特里顿,并在4°C的夜间孵育。 离心机 5 分钟,在 10,000 RPM (10,621 x G) 下,并去除超自然。
- 在 PBS 中添加 200 μl 4% 准甲醛。在热混合器中孵化30分钟,在450 RPM混合。离心机 5 分钟,在 5,000 RPM (2,655 x G) 和删除超自然。用缓冲区 A 洗涤 0.1% Triton 5 分钟, 在热水混合器中混合 450 RPM 。离心机 5 分钟,在 5,000 RPM (2,655 G) 和删除超自然。
- 将预热的 37 °C 标记探头添加到管中。在热混合器中以 95 °C 的速度脱形,在 450 RPM 中混合,10 分钟。在 80 °C 下继续变性 15 分钟,继续混合。在热混合器中以 37 °C 的温带孵化,450 RPM 混合过夜。离心机 5 分钟,5,000 RPM (2,655 x G)。去除超自然。
- 用缓冲区 A 洗涤 0.1% 特里顿 5 分钟。离心机 5 分钟,5,000 RPM (2,655 x G)。重复2次。使用 DAPI 应用延长反褪色滴。
- 小心地将核/DAPI 溶液(避免气泡)移出,应用于滑动,并盖上盖子。
结果
图 1 描述了本文中描述的协议的总体流程。 用户最初从从膜滑梯微分染色体DNA样本开始。 微分化材料被提取和纯化。然后,纯化的DNA被放大,重新放大,标记,然后用于FISH标记染色体点差。
LCM 协议可分为三个整体步骤:1) 查找感兴趣的染色体,并准备切割区域 (图 2A),2) 通过激光切割和弹射感兴趣的染色体区域 (图 2B), 和 3) 检查以确定样本是否真的弹射到粘合帽 (图 2C)。在 安冈比亚 苏亚应变多肽染色体上使用的 LCM 过程显示在视频 1 中。该视频详细介绍了从程序启动开始的整个过程,包括重要的软件功能和提示。
本协议中使用的基因组Plex和RED-g单细胞WGA套件在由此产生的产品尺寸和总体产量上差异很大。 图3 显示了基因组丛和REPLE-g试剂盒的凝胶电泳结果,以及纳米滴对样品的量化。
微分化材料已用于创建鱼探针,瞄准染色体的真色区域。 图4 展示了由 安冈比亚多晶硅染色体上的微分体材料产生的五个探针的鱼。 使用 WGA3 套件标记了四个自动染色体手臂,其中 3R 染色体以绿色(荧光素)标记,3L 染色体以红色(Cy-3)和黄色(Cy-5)混合,2R 染色体为黄色(Cy-5),2L 染色体为红色(Cy-3)。X染色体在单独的实验中使用REPE-g材料的刻痕翻译以橙色(Cy-3)标记。为了建立多面体和线粒体染色体手臂的超色部分之间的对应关系,染色体油漆被杂交到 安冈比亚 的相间、前兆、质子和元相染色体(图5)。 为了可视化细胞核中单一多肽染色体手臂的3D组织,在 安甘比亚 苏亚应变卵巢护士细胞上进行了整个安装 FISH(视频 2)。 不同的染色体手臂区域清楚地看到与相间(图5D)和多丁(视频2)染色体的核。
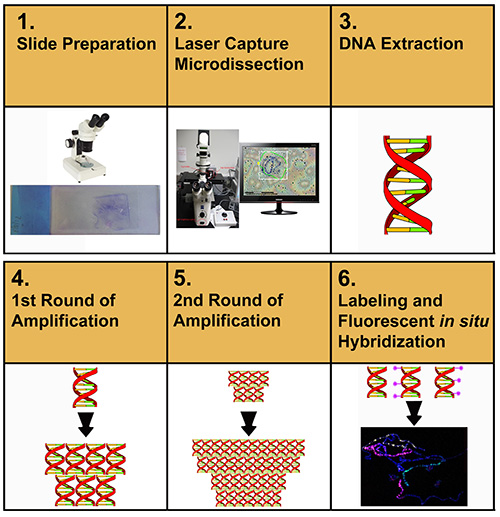
图1。 用于制备染色体涂料的实验程序的示意图表示。 单击此处查看更大的图像。
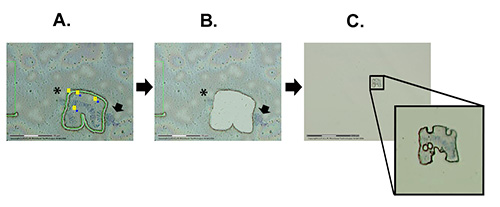
图2。 染色体微分的主要步骤。A) 激光辅助切割通过膜感兴趣的染色体区域。B) 弹射后带孔的膜。C) 弹射膜的视图,其中有染色体段连接到胶粘剂盖上。箭头表示留在幻灯片上的 X 染色体的异色素。星号显示另一条留在幻灯片上的染色体。 单击此处查看更大的图像。

图3。 在WGA之后显示DNA的阿加罗斯凝胶图像。A) 使用 WGA4 和 WGA3 基因组丛套件后,手臂 3R 中的低分子量 (200-500 bp) DNA。B) 重新回答 - g 放大后手臂 2L 的高分子量 (10-20 kb) DNA。100 bp 梯子显示在左车道上。凝胶图像下方的表格显示纳米滴测量的DNA浓度。 单击此处查看更大的图像。
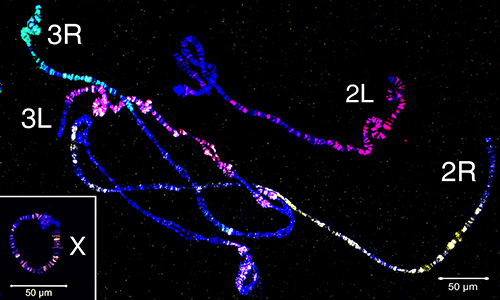
图4。 使用从微分化材料产生的四个探针绘制 来自安冈比亚 卵巢护士细胞的多肽染色体。X 染色体通过重新标记的 REPLI-g 材料的刻痕翻译以橙色 (Cy-3) 标记。2R 臂以黄色标记(Cy-5);2L臂为红色(Cy-3):3R臂以绿色标记(荧光素);3L 臂以红色(Cy-3)和黄色(Cy-5)的混合物标记。自动体标有 WGA3 放大套件。色板染成蓝色 (DAPI)。染色体名称被放置在端粒区域附近。 单击此处查看更大的图像。
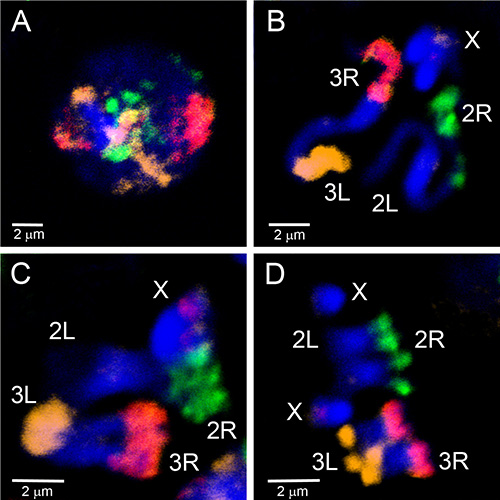
图5。 使用由 WGA3 标记的微分层材料生成的三个探头绘制来自 安甘比亚 莫普蒂菌株幼虫想象盘的相间 (A)、分阶段 (B)、序义 (C) 和元相 (D) 染色体。2R臂以绿色标记(氟辛):2L臂未贴标签;3R臂为粉红色,混合为红色(Cy-3)和橙色(Cy-5):3L臂标有橙色(Cy-5)。X染色体具有与 18S rDNA 探头对应的红色标签。色板染成蓝色 (DAPI)。染色体的污渍区域与异色素相对应。 单击此处查看更大的图像。
视频 1.安冈比亚多肽染色体 LCM 的过程。单击此处查看视频 1。
视频 2. 在 冈比亚 卵巢护士细胞上执行整个安装 3D 鱼。探针标有Cy-3(蓝色描述),由微分的2R染色体手臂制成。 色度素沾染了DAPI,由青色伪着色(浅蓝色)描绘。 单击此处查看视频 2。
讨论
有许多步骤对于成功放大微分聚酯染色体样本中的DNA至关重要。该协议采用LCM,这种方法既能提高整体效率,又能通过去除物理工具与样品的相互作用来减少接触异物DNA。然而,外来DNA的扩增仍然是这一实验的最大潜在陷阱。因此,在整个过程中,必须保护样品免受污染。在整个幻灯片准备和微分段阶段,乙醇洗解剖针、滑梯、盖滑以及工作空间至关重要。 建议在使用前使用紫外线处理所有适用设备(针头、滑梯、盖片)。
解剖幻灯片上的膜使染色体的扩散非常困难。 在制作这些幻灯片时,使用更多的卵巢(一半到一对完整的卵巢)很重要,以提供更大的机会找到一个分布良好的细胞核。 还建议在做幻灯片时使用新鲜组织,因为随着 49 岁的组织和染色体的扩散变得更加具有挑战性,放大率似乎在下降。 为微分量准备幻灯片是本协议中最耗时的步骤。 染色体必须很好地传播,以避免意外获得不需要的材料。 Giemsa 染色允许用户在使用微分检测系统之前使用相位对比显微镜检查传播质量。
微分和放大的结合提供了提取和分析染色体片段的机会,从感兴趣的小区域到大多数手臂的大小不等。 该协议允许用户从形态上不同的区域(如反转、特定的欧色带和跨带、端粒、中微星和间异色素)获取DNA。用户可以将生成的绘图应用于检查异常染色体、研究特定部位的物种间同源性,或在完整的 3D 核中描述染色体的空间组织。为了开发染色体涂料,我们选择了真色段,以避免重复DNA与多个染色体区域杂交。因此,我们获得了手臂特定的绘画,没有使用竞争对手,如总基因组DNA或C0t-1DNA分数。
我们选择使用基因组Plex WGA和REPLE-G套件基于审查,比较效率和辍学率的多个放大套件40,44。 这两种试剂盒在两种辍学率的可用方法中表现最好(GenomePlex 的辍学率为 12.5%,而 REPLI-g 的辍学率为 37.5%)放大标记的百分比(GenomePlex 的放大率为 45.24%,而回复 - g 的放大率为 30.0%)40. 基因组Plex套件也提供了更高数量的DNA,从而使它成为多种下游技术的更好候选者。 基因组丛系统还提供重新放大套件,以便进一步放大DNA。然而,必须指出,放大并不完美。 成功放大可能会带来错误或偏向目标 DNA 中的特定位置的可能性仍然存在。重要的是要考虑现有基因组扩增方法的最终片段大小。 GenomePlex 碎片化导致库中的碎片范围为 200-500 bp,而 REPLI-g 套件产生大约 10-20 kb 大小的片段。此协议的下游应用是 FISH,从而使 GenomePlex 套件成为更可行的选项,因为它提供了所需的片段大小和直接通过 WGA 标记 DNA 片段的能力。由 REPLI-g 放大产生的长 DNA 分子必须在下游刻痕转换标记反应中分化。
此协议已被调整,以成功地放大DNA从单一的聚酯染色体手臂。 其他协议要求汇集许多(通常为10-30)染色体片段,以便成功放大样本7,11,28,40。 虽然使用我们的方法可以汇集多个染色体,但样品污染的可能性增加强调了开始使用尽可能少的染色体进行实验的重要性。如果多子染色体不可用,我们的协议可以适应线性染色体的使用。然而,在成功进行FISH 11的放大之前,可能需要汇集10-15条线粒体染色体。放大偏差较低,具有大量启动模板DNA 50。聚通染色体提供大约512个单个DNA序列的拷贝和1024个同源DNA序列的拷贝。 因此,汇集线粒体将有助于放大后DNA产品的整体质量。
此程序在细胞遗传学和基因组学研究中有许多潜在的用途。在这里,我们使用染色体油漆来建立多色体和线粒体手臂的多色段之间的对应关系。同样的绘画探针可以应用于安甘比亚细胞系的细胞遗传特征。广泛的基因组重新排列和染色体数量的变化是细胞系51,52的共同特征。在不同的蚊子细胞系53、54中检测到异常、多倍体和染色体重新排列,如转位、反转、删除和环状染色体。经典细胞遗传学观测55和物理映射56表明,在疟疾蚊子的进化过程中,全臂染色体异位的发生。因此,微分材料可以与FISH实验相结合,比较物种间染色体区域的同源性。我们成功地在全安装卵巢护士细胞的多丁体染色体上用2R涂漆探头进行了3D FISH。这种方法将有助于追踪染色体轨迹和研究阿诺菲尔斯的核结构。DNA基因平定57、58、下一代基因组测序26、27、物理和联动图谱开发、染色体绘图33、59等技术都可以从手臂和区域特定微分而受益。通过结合 LCM 技术和推进单细胞 WGA,我们演示了一种高效、实用的方法,可从单个聚氨酯染色体手臂中产生合理数量的 DNA。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院1R21AI094289对伊戈尔·沙拉霍夫的赠款的支持
材料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Fisher Scientific | A491-212 | |
| Methanol | Fisher Scientific | A412-4 | |
| Propionic acid | Sigma-Aldrich | 402907 | |
| Membrane slides 1.0 PET | Zeiss | 415190-9051-000 | |
| Buffer tablets “GURR” | Life Technologies | 10582-013 | |
| KaryoMAX Giemsa Stain | Life Technologies | 10092-013 | |
| ThermoBrite Slide Denaturation/Hybridization System | Abbott Molecular | 30-144110 | |
| Vacufuge vacuum concentrator | Eppendorf | 22820001 | |
| Spectroline Microprocessor-Controlled UV Crosslinker XL-1000 | Fisher Scientific | 11-992-89 | |
| Thermo Scientific NanoDrop | Fisher Scientific | ND-2000 | |
| REPLI-g Single Cell Kit | Qiagen | 150343 | |
| GenomePlex Single Cell Kit (WGA4) | Sigma-Aldrich | WGA4-10RXN | |
| GenomePlex WGA Reamplification Kit (WGA3) | Sigma-Aldrich | WGA3-50RXN | |
| MZ6 Leica stereomicroscope | Leica | VA-OM-E194-354 | A different stereomicroscope can be used |
| Olympus CX41 Phase Microscope | Olympus | CX41RF-5 | A different phase microscope can be used |
| PALM MicroBeam Laser Microdissection Microscope | Zeiss | ||
| Thermomixer | Eppendorf | 22670000 | |
| 10x PBS | Invitrogen | P5493 | |
| 50x Denhardt’s solution | Sigma-Aldrich | D2532 | |
| 99% Formamide | Fisher Scientific | BP227500 | |
| Dextran sulfate sodium salt | Sigma | D8906 | |
| 20x SSC buffer | Invitrogen | AM9765 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| dATP, dCTP, dGTP, dTTP | Fermentas | R0141, R0151, R0161, R0171 | |
| Cy3-dUTP, Cy5-dUTP | GE Healthcare | PA53022, PA55022 | |
| BSA | Sigma-Aldrich | A3294 | |
| DNA polymerase I | Fermentas | EP0041 | |
| DNase I | Fermentas | EN0521 | |
| Spermine | Sigma-Aldrich | S3256-1G | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP3581 | |
| EGTA | Sigma-Aldrich | E0396-25G | |
| PIPES | Sigma-Aldrich | P6757-25G | |
| EDTA | Fisher Scientific | S311-500 | |
| Digitonin | Sigma-Aldrich | D141-100MG | |
| Triton-X100 | Fisher Scientific | BP151-100 | |
| AdhesiveCap 500 clear | Zeiss | 415190-9211-000 | |
| QIAamp DNA Micro Kit (50) | Qiagen | 56304 | |
| Genomic DNA Clean and Concentrator Kit | Zymo Research | D4010 | |
| 37% Paraformaldehyde | Fisher Scientific | F79-500 |
参考文献
- Ried, T., Schrock, E., Ning, Y., Wienberg, J. Chromosome painting: a useful art. Human molecular genetics 7. , 1619-1626 (1998).
- Yang, F., et al. Reciprocal chromosome painting illuminates the history of genome evolution of the domestic cat, dog and human. Chromosome Res. 8, 393-404 (2000).
- Badenhorst, D., Dobigny, G., Robinson, T. J. Karyotypic evolution of hapalomys inferred from chromosome painting: a detailed characterization contributing new insights into the ancestral murinae karyotype. Cytogenet Genome Res 136. , 83-88 (2012).
- Trifonov, V. A., et al. Chromosomal evolution in Gekkonidae. I. Chromosome painting between Gekko and Hemidactylus species reveals phylogenetic relationships within the group. Chromosome Res. 19, 843-855 (2011).
- Nie, W., et al. Chromosomal rearrangements and karyotype evolution in carnivores revealed by chromosome painting. Heredity (Edinb. , 108-1017 (2012).
- Guan, X. Y., et al. Detection of chromosome 6 abnormalities in melanoma cell lines by chromosome arm painting probes). Cancer Genet Cytogenet. 107, 89-92 (1998).
- Guan, X. Y., et al. Characterization of a complex chromosome rearrangement involving 6q in a melanoma cell line by chromosome microdissection. Cancer genetics and cytogenetics 134. , 65-70 (2002).
- Breen, M., et al. Detection of equine X chromosome abnormalities in equids using a horse X whole chromosome paint probe (WCPP). Vet J. 153, 235-238 (1997).
- Kokhanenko, A. A., Anan'ina, T. V., Stegniy, V. N. The changes in chromosome 6 spatial organization during chromatin polytenization in the Calliphora erythrocephala Mg. (Diptera: Calliphoridae) nurse cells. Protoplasma 250. , 141-149 (2013).
- Timme, S., et al. Nuclear position and shape deformation of chromosome 8 territories in pancreatic ductal adenocarcinoma. Anal Cell Pathol (Amst. 34, 21-33 (2011).
- Drosopoulou, E., et al. Sex chromosomes and associated rDNA form a heterochromatic network in the polytene nuclei of Bactrocera oleae (Diptera: Tephritidae). Genetica. 140, 169-180 (2012).
- Pazian, M. F., Shimabukuro-Dias, C. K., Pansonato-Alves, J. C., Oliveira, C., Foresti, F. Chromosome painting of Z and W sex chromosomes in Characidium (Characiformes). Crenuchidae). Genetica. 141, 1-9 (2013).
- Howe, E. S., Murphy, S. P., Bass, H. W. Three-dimensional acrylamide fluorescence in situ hybridization for plant cells. Methods Mol Biol 990. , 53-66 (2013).
- Lysak, M. A., Mandakova, T. Analysis of plant meiotic chromosomes by chromosome painting. Methods Mol Biol 990. , 13-24 (2013).
- Ji, Z., Zhang, L. Chromosomics: detection of numerical and structural alterations in all 24 human chromosomes simultaneously using a novel OctoChrome FISH assay. J Vis Exp. 10, (2012).
- Idziak, D., et al. Painting the chromosomes of Brachypodium: current status and future prospects. Chromosoma. 120, 469-479 (2011).
- Fuchs, J., Kuhfittig, S., Reuter, G., Schubert, I. Chromosome painting in Drosophila. Chromosome Res. 6, 335-336 (1998).
- Zhimulev, I. F. . Morphology and structure of polytene chromosomes. 34, 1-490 (1996).
- Sharakhov, I. V., Sharakhova, M. V. in Chromosome Mapping Research Developments eds. J.F. Verrity & L.E. Abbington) (Nova Science. , (2008).
- Coluzzi, M., Sabatini, A., Torre, d. e. l. l. a., Di Deco, A., A, M., Petrarca, V. A polytene chromosome analysis of the Anopheles gambiae species complex). Science. 298, 1415-1418 (2002).
- Stegnii, V. N. Systemic reorganization of the architectonics of polytene chromosomes in the onto- and phylogenesis of malaria mosquitoes. Genetika. 23, 821-827 (1987).
- Stegnii, V. N. Systemic reorganization of the architectonics of polytene chromosomes in the onto- and phylogenesis of malarial mosquitoes. II. Species specificity in the pattern of chromosome relations with the nuclear envelope of nutrient ovarian cells. Genetika. 23, 1194-1199 (1987).
- Bonaccorsi, S., Santini, G., Gatti, M., Pimpinelli, S., Colluzzi, M. Intraspecific polymorphism of sex chromosome heterochromatin in two species of the Anopheles gambiae complex. Chromosoma. 76, 57-64 (1980).
- Zhimulev, I. F. Polytene chromosomes, heterochromatin, and position effect variegation. Adv Genet. 37, 1-566 (1998).
- Seifertova, E., et al. Efficient high-throughput sequencing of a laser microdissected chromosome arm. BMC Genomics. 14, 1471-2164 (2013).
- Weise, A., et al. High-throughput sequencing of microdissected chromosomal regions. European journal of human genetics. EJHG. 18, 457-462 (2010).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA research : an international journal for rapid publication of reports on genes and genomes 19. , 395-406 (2012).
- Moshkin, Y. M., et al. Microdissection and sequence analysis of pericentric heterochromatin from the Drosophila melanogastermutant Suppressor of Underreplication. Chromosoma. 111, 114-125 (2002).
- Decarlo, K., Emley, A., Dadzie, O. E., Laser Mahalingam, M. capture microdissection: methods and applications. Methods Mol Biol 755. , 1-15 (2011).
- Iyer, E. P., Cox, D. N. Laser capture microdissection of Drosophila peripheral neurons. J Vis Exp. 10, (2010).
- Kubickova, S., Cernohorska, H., Musilova, P., Rubes, J. The use of laser microdissection for the preparation of chromosome-specific painting probes in farm animals. Chromosome Res. 10, 571-577 (2002).
- Fukova, I., et al. Probing the W chromosome of the codling moth, Cydia pomonella, with sequences from microdissected sex chromatin. Chromosoma. 116, 135-145 (2007).
- Thalhammer, S., Langer, S., Speicher, M. R., Heckl, W. M., Geigl, J. B. Generation of chromosome painting probes from single chromosomes by laser microdissection and linker-adaptor PCR. Chromosome Res. 12, 337-343 (2004).
- Sims, C. E., Allbritton, N. L. Analysis of single mammalian cells on-chip. Lab on a chip 7. , 423-440 (2007).
- Hutchison, C. A., 3rd, J. C., Venter, Single-cell genomics. Nature biotechnology. 24, 657-658 (2006).
- Lasken, R. S., Egholm, M. Whole genome amplification: abundant supplies of DNA from precious samples or clinical specimens. Trends in biotechnology 21. , 531-535 (1016).
- Teruel, M., et al. Microdissection and chromosome painting of X and B chromosomes in the grasshopper Eyprepocnemis plorans. Cytogenet Genome Res. 125, 286-291 (2009).
- Liu, J. D., et al. Sex chromosomes in the spiny eel (Mastacembelus aculeatus) revealed by mitotic and meiotic analysis. Cytogenet Genome Res. 98, 291-297 (2002).
- Harvey, S. C., et al. Molecular-cytogenetic analysis reveals sequence differences between the sex chromosomes of Oreochromis niloticus: evidence for an early stage of sex-chromosome differentiation. Cytogenet Genome Res. 97, 76-80 (2002).
- Hockner, M., Erdel, M., Spreiz, A., Utermann, G., Kotzot, D. Whole genome amplification from microdissected chromosomes. Cytogenet Genome Res. 125, 98-102 (2009).
- Kitada, K., Taima, A., Ogasawara, K., Metsugi, S., Aikawa, S. Chromosome-specific segmentation revealed by structural analysis of individually isolated chromosomes. Genes Chromosomes Cancer. 50, 217-227 (2011).
- Ma, L., et al. Direct determination of molecular haplotypes by chromosome microdissection. Nature methods. 7, 299-301 (2010).
- Teruel, M., et al. Microdissection and chromosome painting of X and B chromosomes in Locusta migratoria. Chromosome Res. 17, 11-18 (2009).
- Treff, N. R., Su, J., Tao, X., Northrop, L. E., Scott, R. T. Single-cell whole-genome amplification technique impacts the accuracy of SNP microarray-based genotyping and copy number analyses. Molecular human reproduction 17. , 335-343 (2011).
- Rutten, K. B., et al. Chromosomal anchoring of linkage groups and identification of wing size QTL using markers and FISH probes derived from microdissected chromosomes. in Nasonia(Pteromalidae : Hymenoptera). Cytogenetic and Genome Research 105. , 126-133 (2004).
- Post, R. J., Kruger, A., Somiari, S. B. Laser-assisted microdissection of polytene chromosomes from Diptera for the development of molecular markers. Molecular Ecology Notes. 6, 634-637 (2006).
- George, P., Sharakhova, M. V., Sharakhov, I. V. High-throughput physical mapping of chromosomes using automated in situ hybridization. Journal of visualized experiments : JoVE. 10, (2012).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ Hybridization on Mitotic Chromosomes of Mosquitoes. J Vis Exp. 10, (2012).
- Frumkin, D., et al. Amplification of multiple genomic loci from single cells isolated by laser micro-dissection of tissues. BMC biotechnology. 8, 10-1186 (2008).
- Raghunathan, A., et al. Genomic DNA amplification from a single bacterium. Applied and environmental microbiology 71. , 3342-3347 (2005).
- Cassio, D. Long term culture of MDCK strains alters chromosome content. BMC Res Notes. 6, 162-1610 (2013).
- Landry, J. J., et al. The Genomic and Transcriptomic Landscape of a HeLa Cell Line. G3. , (1534).
- Steiniger, G. E., Mukherjee, A. B. Insect chromosome banding: technique for G- and Q-banding pattern in the mosquito Aedes albopictus. Can J Genet Cytol. 17, 241-244 (1975).
- Brown, S. E., et al. Toward a physical map of Aedes aegypti. Insect Mol Biol. 4, 161-167 (1995).
- Green, C., Hunt, R. Interpretation of variation in ovarian polytene chromosomes of Anopheles funestus Giles. A. parensis Gillies, and A. aruni? Genetica. 51, 187-195 (1980).
- Sharakhova, M. V., Xia, A., Leman, S. C., Sharakhov, I. V. Arm-specific dynamics of chromosome evolution in malaria mosquitoes. BMC evolutionary biology. 11, 10-1186 (2011).
- Gu, L. H., et al. DNA genotyping of oral epithelial cells by laser capture microdissection]. Fa yi xue za zhi 22. , 196-197 (2006).
- Rook, M. S., Delach, S. M., Deyneko, G., Worlock, A., Wolfe, J. L. Whole genome amplification of DNA from laser capture-microdissected tissue for high-throughput single nucleotide polymorphism and short tandem repeat genotyping. The American journal of pathology 164. , 23-33 (2004).
- Houen, A., Field, B. L., Saunders, V. A. Microdissection and chromosome painting of plant B chromosomes. Methods in cell science : an official journal of the Society for In. Vitro Biology. 23, 115-124 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。