Method Article
2D und 3D Chromosom Malerei in Malaria-Mücken
In diesem Artikel
Zusammenfassung
Chromosomenmalerei ist eine nützliche Methode, um die Organisation des Zellkerns und die Evolution des Karyotyps zu untersuchen. Hier zeigen wir einen Ansatz zur Isolierung und Verstärkung bestimmter Interessenbereiche von einzelnen Polytenchromosomen, die anschließend für die zwei- und dreidimensionale Fluoreszenz-In-situ-Hybridisierung (FISH) verwendet werden.
Zusammenfassung
Die fluoreszierende In-situ-Hybridisierung (FISH) von Ganzarm-Chromosomsonden ist eine robuste Technik zur Kartierung genomischer Regionen von Interesse, zur Erkennung chromosomaler Umlagerungen und zur Untersuchung der dreidimensionalen (3D) Organisation von Chromosomen im Zellkern. Das Aufkommen der Lasercapture-Mikrodissektion (LCM) und der gesamten Genomverstärkung (WGA) ermöglicht die Gewinnung großer DNA-Mengen aus einzelnen Zellen. Die erhöhte Empfindlichkeit von WGA-Kits veranlasste uns, Chromosomenfarben zu entwickeln und sie für die Erforschung der Chromosomenorganisation und Evolution in Nicht-Modellorganismen zu verwenden. Hier stellen wir eine einfache Methode zur Isolierung und Verstärkung der euchromatischen Segmente einzelner polytener Chromosomenarme aus Eierstock-Ammenzellen der Afrikanischen Malariamücke Anopheles gambiaevor. Dieses Verfahren bietet eine effiziente Plattform für die Gewinnung von Chromosomfarben bei gleichzeitiger Verringerung des Gesamtrisikos der Einführung fremder DNA in die Probe. Die Verwendung von WGA ermöglicht mehrere Runden der Re-Amplifikation, was zu hohen Mengen an DNA führt, die für mehrere Experimente verwendet werden können, einschließlich 2D und 3D FISH. Wir haben gezeigt, dass die entwickelten Chromosomfarben erfolgreich eingesetzt werden können, um die Übereinstimmung zwischen euchromatischen Teilen von Polyten und mitotischen Chromosomenarmen in An. gambiaeherzustellen. Insgesamt bietet die Vereinigung von LCM und Single-Chromosom WGA ein effizientes Werkzeug, um signifikante Mengen an Ziel-DNA für zukünftige zytogenetische und genomische Studien zu erstellen.
Einleitung
Chromosomenmalerei ist eine nützliche Technik zur Untersuchung der Evolution der Karyotypen 1-5 und zur Visualisierung zytogenetischer Anomalien durch Hybridisierung fluoreszierend markierter chromosomaler DNA 1,6-8. Diese Methode wird auch angewendet, um die 3D-Dynamik von Chromosomengebieten in der Entwicklung 9 und Pathologie 10zu untersuchen. Differentialbeschriftete Chromosomfarben werden zur Visualisierung einzelner mitotischer 11,12,meiotischer 13,14oder interphasenweiser Nichtpolyten 15,16 und Polyten 9,11,17 Chromosomen verwendet. Ein einfaches und robustes Protokoll zur Gewinnung von Chromosomfarben wäre sehr nützlich, um diese Technik auf Nicht-Modellorganismen wie Mücken auszuweiten. Der Anopheles gambiae Komplex ist eine Gruppe von sieben morphologisch nicht unterscheidbaren Mücken, die in Verhalten und Anpassung variieren, einschließlich der Fähigkeit, Malaria zu übertragen. Diese Mücken dienen als ausgezeichnetes Modell, um die Evolution eng verwandter Arten besser zu verstehen, die sich in ihrer Vektorkapazität stark unterscheiden. Die meisten zytogenetischen Studien an Malariamücken wurden mit gut entwickelten, hochpolytenisierten Chromosomen durchgeführt (rezensiert in 18,19). Die lesbaren Banding-Muster von Polytenchromosomen ermöglichten es den Forschern, den Zusammenhang zwischen polymorphen Inversionen und ökologischen Anpassungen in Anopheles gambiae 20zu demonstrieren. Auch gewebespezifische 21 und artspezifische 22 Merkmale der 3D-Polytenchromosom-Organisation wurden im An. macullipennis-Komplex charakterisiert. Die Untersuchung von mitotischen Chromosomen könnte jedoch zusätzliche wichtige Informationen liefern. Zum Beispiel wurde ein höheres Niveau des Heterochromatin-Polymorphismus, das in mitotischen Chromosomen beobachtet wurde, mit einer reduzierten Paarungsaktivität und Fruchtbarkeit in An. gambiae 23korreliert. Die Übereinstimmung zwischen euchromatischen Segmenten von Polyten und mitotischen Chromosomenarmen könnte nur durch einen Vergleich ihrer relativen Längen schwer zu ermitteln sein. Dies liegt daran, dass Heterochromatin einen signifikanten Teil der mitotischen Chromosomen ausmacht, aber in Polytenchromosomen unterrepräsentiert ist 24. Die Verfügbarkeit von Chromosomenfarben für Malariamücken würde es den Forschern ermöglichen, zytogenetische Studien durch die Einbeziehung zusätzlicher Arten deutlich zu erweitern und gleichzeitig die Kosten und die Zeit bei der Analyse der karyotypischen Evolution und der 3D-Dynamik von Chromosomen in dieser Gruppe epidemiologisch wichtiger Insekten erheblich zu reduzieren.
Um große Chromosomenabschnitte zu erhalten, ist die Mikrodissektion zu einer integralen Technik geworden, um bestimmte Interessenbereiche des Chromosomenkomplementes zu manipulieren und zu isolieren. In Verbindung mit der gesamten Genomverstärkung (WGA) führt die Mikrodissektion zu leistungsstarken nachgeschalteten Anwendungen wie FISH 11,12 und genome Sequenzierung der nächsten Generation 25-27. Zuvor erforderte die Technik die Verwendung von speziellen Mikrodissektionsnadeln, die manuell von einem erfahrenen Benutzer kontrolliert werden mussten 28. Die Weiterentwicklung der Lasercapture-Mikrodissektion (LCM) hat zu einem vereinfachten Werkzeug geführt, das besser geeignet ist, einzelne Zellen 29,30 oder einzelne Chromosomen 31-33 mit einem verringerten Kontaminationsrisiko zu isolieren. Dieser Ansatz ermöglicht es dem Benutzer, die genetischen Heterogenitäten und Chromosomenanomalien zu untersuchen, die in einzelnen Zellen auftreten, anstatt einer Konsenslandschaft, die sich aus der Zusammenlegung mehrerer Zellen ergibt 34-36. Mehrere Methoden wurden verwendet, um die DNA aus Mikrodissektion zu verstärken. DOP-PCR, eine Technik, die für die Verstärkung von sehr repetitiven Sequenzen nützlich ist, wurde verwendet, um mikrosezierte Chromosomen von Arten wie dem Grashüpfer 37, dem Stachelaal 38und dem Niltilapia 39zu verstärken. In jüngerer Zeit sind das PCR-basierte GenomePlex WGA4 Single Cell Kit und das Multiple Displacement Amplification based (MDA) Repli-G Single Cell Kit zu wertvollen Werkzeugen für Experimente geworden, bei denen einzelne menschliche Zellen genetisch analysiert wurden, sowie Chromosomen40-42, einschließlich der B-Chromosomensysteme in Heuschrecken 37 und Heuschrecken 43. Diese beiden Kits haben jeweils Vor- und Nachteile, aber ihre scheinbare Überlegenheit gegenüber anderen verfügbaren Verstärkungssystemen wurde 44demonstriert.
Die DNA-Menge, die aus einem einzelnen Chromosom oder einem Chromosomensegment gewonnen werden kann, ist deutlich geringer als die eines ganzen Kerns. Daher sind Mikrodissektion, Amplifikation und anschließende Analyse eines einzelnen Chromosoms viel anspruchsvoller, insbesondere bei Organismen mit kleinen Genomen wie in Drosophila oder Anopheles. Obwohl Farben aus einzelnen mikrosezierten Chromosomen eines Menschen 33 und einer Wespe 45entwickelt wurden, erforderte ein erfolgreiches FISH-Experiment mehrere (mindestens 10-15) mikrosezierte mitotische Chromosomen einer Fruchtfliege 11. Die Fähigkeit, ein einzelnes Chromosom zu mikrosektieren und zu verstärken, wäre jedoch wichtig, um (i) die Wahrscheinlichkeit einer Kontamination mit Material aus einem anderen Chromosom zu verringern, (ii) die Anzahl der Chromosomenpräparate, die für die Mikrodissektion benötigt werden, (iii) Senkung des Nukleotids und strukturellen Polymorphismus der mikrodissezierten Probe sowohl in FISH- als auch bei sequenziumierenden nachgeschalteten Anwendungen zu minimieren. Polytenchromosomen, die in vielen Dipteran-Arten gefunden werden, bieten eine einzigartige Gelegenheit, eine viel höhere Ausgangsmenge an DNA zu erwerben. Sie bieten auch eine höhere Auflösung und Chromosomenstruktur, die nicht durch die Verwendung von mitotischen Chromosomen erreicht werden kann. Diese zusätzliche Auflösung kann bei der Visualisierung chromosomaler Umlagerungen, Chromatinstruktur und zu mikrodissektierender Chromosomensegmente von entscheidender Bedeutung sein 28,46.
Hier stellen wir ein Verfahren vor, um ein euchromatisches Segment effizient von einem einzelnen polytenen Chromosomenarm zu isolieren, die DNA zu verstärken und in nachgelagerten FISH-Anwendungen bei Malariamücken einzusetzen. Zuerst wenden wir LCM an, um einen einzelnen Chromosomenarm aus speziell präparierten Membrangrutschen zu isolieren und zu extrahieren. Zweitens wird WGA verwendet, um die DNA aus dem mikrosezierten Material zu verstärken. Drittens hybridisieren wir die verstärkte DNA in FISH-Experimenten zu Polyten-Squashpräparaten 47, Metaphasen- und Interphasenchromosom-Dias 48sowie 3D-Eierstock-Vollmontageproben. Dieses Verfahren wurde durchgeführt, um erfolgreich einen Großteil des Euchromatins in chromosomalen Armen von An. gambiaezu malen.
Protokoll
1) Polyten-Chromosom-Dia-Vorbereitung für Laser-Capture-Mikrodissektion
- Sezieren Sie halbgrad Anopheles Weibchen bei 25 Stunden post-Blut-Fütterung. Fix Ovarien von ca. fünf Weibchen in 500 l frisch modifizierte Carnoy-Lösung (100% Methanol: Eisessigsäure, 3:1) bei Raumtemperatur für 24 Stunden. Ovarien für eine Langzeitlagerung auf -20 °C übertragen.
- Bereiten Sie Carnoys Lösung (100% Ethanol: Eisessigsäure, 3:1) und 50% Propionsäure kurz vor der Herstellung von Chromosomrutschen vor.
- Legen Sie ein Paar Eierstöcke in einen Tropfen von Carnoys Lösung auf einem Zeiss 1.0 PET Membranschlitten. Je nach Größe die Eierstöcke in ca. 2-4 Abschnitte mit Sezierenvonnadeln teilen und in einen Tropfen von 50% Propionsäure auf sauberen Dias unter einem Seziermikroskop legen.
- Trennen Sie Follikel und entfernen Sie das restliche Gewebe mit Papiertuch unter einem Dissektionsstereomikroskop. Fügen Sie einen neuen Tropfen von 50% Propionsäure zu den Follikel und lassen Sie sie für 3-5 min bei Raumtemperatur sitzen.
- Legen Sie einen silikonisierten Deckelaufschub auf das Tröpfchen. Lassen Sie die Rutsche ca. 1 min stehen.
- Bedecken Sie den Schlitten mit einem saugfähigen Material (für diese Methode wird Filterpapier verwendet), und wenden Sie bei Verwendung der Radiererseite eines Bleistifts einen großzügigen Druck auf den Deckelzettel an, indem Sie wiederholt mit dem Radierer darauf tippen.
- Erhitzen Sie den Schlitten auf 60 °C auf einem Dia-Denaturierungs-/Hybridisierungssystem für 15-20 min, um die Polytenchromosomen abzuflachen. Dias bei 4 °C über Nacht in eine feuchte Kammer legen, damit die Säure die Chromosomen weiter abflachen kann.
- Dias in kaltem 50% Ethanol für 10 min legen. Entfernen Sie vorsichtig den Deckelschlupf, und ersetzen Sie in kaltem 50% Ethanol für 10 mehr min.
- Dehydrieren gleitet in 70%, 90%, 100% Ethanol für je 5 min. Lufttrockene Rutschen.
- Bereiten Sie eine Lösung der GURR-Pufferlösung vor, indem Sie 1 L destilliertem Wasser eine einzelne Puffertablette hinzufügen. Autoklaven.
- Bereiten Sie die Giemsa-Lösung vor, indem Sie 1 ml Giemsa-Färbelösung zu 50 ml GURR-Puffer hinzufügen.
- Air getrocknete Dias 10 min in Giemsa-Lösung aufstellen und dreimal in 1X PBS waschen. Lufttrockenrutschen in einem kontrollierten sterilen Klima, um Eine Kontamination zu vermeiden.
2) Laser-Capture-Mikrodissektion eines einzelnen Polyten-Chromosomarms
In diesem Abschnitt wird die Verwendung der PALMRobo-Software beschrieben, die mit dem PALM MicroBeam Laser Microdissection System ausgestattet ist.
- Reinigen Sie das Mikroskop mit 100% Ethanol. Sterilisieren Sie Handschuhe und Schläuche mit UV-Licht in einem UV-Vernetzen.
- Schalten Sie das PALM MicroBeam Laser Microdissection Mikroskop ein und schalten Sie den Laser ein. Öffnen Sie die Laser-Sektions-Suite, PALMRobo, und konfigurieren Sie die Einstellungen "Power" und "Focus" bei Bedarf.
- Suchen Sie nach einem polytenen Chromosomarm von Interesse.
- Umreißen Sie mit dem Werkzeug "Bleistift" den ausgewählten Bereich.
- Öffnen Sie das Fenster "Elemente" in der Menüleiste.
- Wählen Sie das "Gezeichnete Element" aus, stellen Sie sicher, dass Sie "Ausschneiden" ausgewählt haben.
- Installieren Sie das Klebekappenrohr in den Halter und platzieren Sie es über dem Schlitten, so dass ein kleiner Spalt <1 mm größe, und starten Sie den Laserschnitt.
- Platzieren Sie die "Katapultauswahl" innerhalb der Schnittstelle und lassen Sie Platz zwischen Kante und Chromosom.
- Wählen Sie "LPC" aus der Dropdown-Option und beginnen Sie mit dem Katapultieren.
- Stellen Sie sicher, dass die Probe in die Kappe katapultiert wurde, indem Sie das "Auge"-Symbol drücken.
3) Reinigung der DNA aus einem einzelnen mikrosezierten Polyten-Chromosomarm
Folgen Sie den Anweisungen des QIAamp DNA Micro Kits, um die gesammelte DNA freizugeben und zu reinigen. Schritt 3.1 wurde geändert, um das invertierte Rohr aufzunehmen.
- Fügen Sie dem invertierten Röhrchen (innerhalb der Kappe) 15 l Puffer ATL und 10 l Proteinase K hinzu und inkubieren Sie bei 56 °C für 3 Stunden.
- Fügen Sie 25 l Puffer ATL, 50 l Puffer AL und 1 l Träger-RNA; Mischen. Fügen Sie 50 l 100% EtOH; Mix.
- Lysat in QIAamp-Spalte übertragen; Zentrifuge. Waschen durch Zugabe von 500 l Puffer AW1; Zentrifuge. Säule in neues Sammelrohr legen, 500 l Puffer AW2 hinzufügen; Zentrifuge. Platzieren Sie die Spalte in einem neuen Rohr; Zentrifuge, um überschüssige Flüssigkeit zu entfernen.
- Die Säule in ein 1,5-l-Mikrozentrifugenrohr geben und 20 l Wasser zu Elute hinzufügen; Zentrifuge.
- Verdampfen Sie frisch vereiste DNA bis zu einem Endvolumen von 9 l mit einer Vakuumfuge.
4) Amplifikation der DNA aus einem einzelnen mikrosezierten Polyten-Chromosomarm
Für die WGA eines einzelnen Chromosomenarms wurden zwei verschiedene Protokolle verwendet.
- DNA-Verstärkung und Sondenvorbereitung über GenomePlex WGA
- Folgen Sie dem GenomePlex Single Cell WGA4 Kit Protokoll, um die erste Charge der verstärkten DNA zu produzieren:
- Fügen Sie der 9-l-Probe eine frisch zubereitete Proteinase-K-Lösung hinzu; Mischen. INkubieren SIE DIE DNA bei 50 °C für 1 Stunde, dann erhitzen Sie auf 99 °C für 4 min. Auf Eis bleiben.
- Fügen Sie 2 1X Single Cell Library Preparation Buffer und 1 l Bibliotheksstabilisierungslösung hinzu; Mischen. Probe auf 95 °C für 2 min erhitzen. Auf Eis und Zentrifuge abkühlen.
- Fügen Sie 1 l von Library Preparation Enzyme hinzu; Und Zentrifuge. Wie folgt inkubieren:
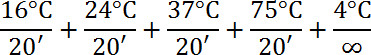
- Fügen Sie 7,5 l 10X Amplification Master Mix, 48,5 l Wasser hinzu. 5,0 l WGA DNA Polymerase; Und Zentrifuge.
- Thermozyklus wie folgt:
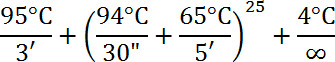
- Reinigen Sie DNA mit dem Genomic DNA Clean & Concentrator Kit. Das Protokoll ist wie folgt:
- Fügen Sie 5:1 DNA-Bindungspuffer hinzu:DNA-Probe (speziell für genomische DNA von weniger als 2 kb. Wenn die Dna der Probe größer als 2 kb ist, verwenden Sie ein Verhältnis von 2:1) und übertragen Sie sie in die bereitgestellte Spin-Spalte. Zentrifuge.
- Fügen Sie 200 l DNA Wash Buffer und Zentrifuge hinzu. Wiederholen Sie den Waschschritt. Fügen Sie dann 50 l Wasser hinzu und fügen Sie die DNA in eine neue 1,5 ml-Röhre.
- Amplify Proben-DNA mit dem GenomePlex WGA3 Reamplification Kit wie folgt:
- Fügen Sie der PCR-Röhre (das Kit empfiehlt 10 ng DNA) mit 49,5 l Wasser, 7,5 l 10x Amplifikations-Master-Mix, 3,0 l 10 mM DNTP-Mix und 5,0 l WGA-DNA-Polymerase 10 ng DNA-Mischung hinzu. Mischen und Zentrifugen.
- Verwenden Sie für die Reaktion das folgende Profil:
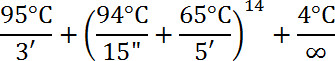
- DNA bei -20 °C aufbewahren.
- Beschriften Sie DNA für FISH mit dem GenomePlex WGA3 Reamplification Kit wie folgt:
- Erstellen Sie einen Master-Mix aus dem GenomePlex WGA3 Reamplification Kit, indem Sie der PCR-Röhre mit 49,5 l Wasser 10 l DNA hinzufügen. 7,5 l 10X Amplifikations-Master-Mix, 3,0 l 1 mM dNTP-Mischung (1 mM dATP, dCTP, dGTP, 0,3 l 1 mM dTTP - bei Verwendung mit beschrifteter dUTP), 1 l mit 25 nM mit dUTP und 5,0 l WGA DNA Polymerase.
- Verwenden Sie für die Reaktion das folgende Profil:
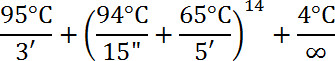
- Ethanol gefällt der markierten Sonde, indem 1/10 das endige Reaktionsvolumen (7,5 l für 75 l Reaktion) von 3 M Natriumacetat pH 5,2 und 2-3 Volumen von 100% Ethanol hinzugefügt wird. DNA-Probe bei -80 °C für mindestens 30 min abkühlen.
- Zentrifugenprobe bei 4 °C für 10 min, um beschriftetes Pellet zu erzeugen und überstandes und lufttrockenes Pellet zu entfernen.
- Erstellen Sie den Hybridisierungspuffer wie folgt:
0,2 g Dextransulfat
1200 l Deionisiertes Formamid
580 l H2O
120 l 20X SSC - Fügen Sie dem luftgetrockneten Pellet 40 l Hybridisierungspuffer hinzu.
- Folgen Sie dem GenomePlex Single Cell WGA4 Kit Protokoll, um die erste Charge der verstärkten DNA zu produzieren:
- DNA-Verstärkung und Sondenvorbereitung über REPLI-G Single Cell WGA gefolgt von Nick-Translation
- Folgen Sie dem REPLI-g Single Cell WGA Kit Protokoll, um die verstärkte DNA zu erzeugen:
- Vorbereiten Sie Puffer D2 (3 l von 1 M DTT + 33 l Puffer DLB).
- Mischen Sie 4 l gereinigtes mikrodiseziertes Material mit 3 l Puffer D2. Flick Rohr zu mischen. 10 min bei 65 °C inkubieren. Fügen Sie 3 l Stop-Lösung hinzu; Mix.
- Fügen Sie der Probe 9 L H2O, 29 l REPLI-g Reaktionspuffer und 2 l REPLI-g DNA-Polymerase hinzu. Bei 30 °C für 8 Stunden inkubieren. Inaktivieren Sie die DNA-Polymerase durch Erhitzen auf 65 °C für 3 min. DNA bei -20 °C aufbewahren.
- Folgen Sie dem Nick-Übersetzungsprotokoll, um REPLI-g-verstärkte DNA zu kennzeichnen:
- Bereiten Sie den folgenden Beschriftungsmix vor:
1 g verstärkte DNA
5 l 10X DNA-Polymerase-Puffer
5 l 10X dNTP
5 l 1X BSA
1 l 1 mM Beschriftet dNTP
4 l 1 U/l DNase I
1 l 10 U/l DNA-Polymerase I
H2O bis 50 l - Bei 15 °C für 2 Stunden inkubieren. Fügen Sie 2 l 0,5 M EDTA hinzu, um die Reaktion zu stoppen. Überprüfen Sie die Größe des DNA-Fragments, indem Sie auf Gel laufen.
- Folgen Sie den Schritten von 4.1.4.3-4.1.4.6, um Pellets auszufällen und zu löslich.
- Bereiten Sie den folgenden Beschriftungsmix vor:
- Folgen Sie dem REPLI-g Single Cell WGA Kit Protokoll, um die verstärkte DNA zu erzeugen:
5) 2D FISH auf Polyten und mitotische Chromosomen-Squash-Präparate
Bitte beachten Sie detaillierte Protokolle für FISH über Präparate von Polyten-Squashes 47 und mitotischen Chromosomen-Dias 48. Hier stellen wir kurze Protokolle zur Verfügung.
- FISH auf Polytenchromosom-Squash-Präparate
- Tauchen Sie in 1X PBS für 20 min bei RT. Fix Dias in 4% Paraformaldehyd in 1X PBS für 1 min.
- Dehydrieren gleitet durch Ethanolwäsche: 50%, 70%, 90%, 100% für je 5 min bei RT. Lufttrockene Rutschen.
- Die Sonde im Hybridisierungspuffer bei 37 °C vorwärmen. Fügen Sie 10-20 l Sonde zum Dia hinzu. Abdeckung mit 22 X 22 mm Deckelschlupf. Drücken Sie alle Luftblasen mit einer Pipettenspitze heraus.
- Denaturenchromosomen und Sonde bei 90 °C für 10 min. Dichtungskanten von Coverslip mit Gummizement. Transferrutsche in feuchte Kammer und inkubieren bei 39 °C über Nacht.
- Waschen Sie die Dias mit 1X SSC bei 39 °C für 20 min. Waschen Sie die Dias mit 1X SSC bei RT für 20 min. Spülen Sie Dias in 1X PBS, dann fügen Sie Prolong Anti-Fade mit DAPI hinzu. Abdeckung mit Deckelfolie und mindestens eine Stunde vor der Visualisierung bei 4 °C lagern.
- FISH auf mitotischen Chromosom-Squash-Präparaten
- Extrahieren Sie mitotische Chromosomen aus imaginären Scheiben der4. Instarlarve von An. gambiae.
- Bereiten Sie Chromosomenschlitten vor, die für FISH geeignet sind.
- Fügen Sie dem Hybridisierungspuffer in einem Rohr 2-3 l beschriftete DNA-Sonde hinzu und mischen Sie sie vorsichtig durch Pipettieren.
- 10 l des Sondengemisches auf den Schlitten auftragen und mit einem 22 x 22 mm Abdeckschlupf abdecken. Drücken Sie alle Luftblasen mit einer Pipettenspitze heraus.
- Für die Gegenfärbung und Detektion, wenden Sie Anti-Fade mit DAPI auf die Vorbereitung und halten Sie im Dunkeln für mindestens eine Stunde vor der Visualisierung.
6) 3D FISH auf vollwertigem Eierstockgewebe
- Bereiten Sie die folgende Buffer-A-Mischung vor:
60 mM KCl
15 mM NaCl
0,5 mM Spermidin
0,15 mM Spermin
2 mM EDTA
0,5 mM EGTA
15 mMROHR - Bereiten Sie Folien für die kerntechnische Visualisierung vor, indem Sie eine Ebene aus Nagellack in einem quadratischen Muster hinzufügen, um der Größe der Abdeckungen zu entsprechen. Dadurch entsteht eine erhöhte Oberfläche, um das Zerquetschen von Kernen zu verhindern, wenn sie in Zukunft auf Deckelschlupf platziert werden.
- Sezieren Sie frische Eierstöcke von Christophers Stufe 3 Weibchen und halten Sie in einer Lösung von 150-250 l Puffer A mit 0,5% Digitonin. Führen Sie größere Seziernadel über Follikel (in Tube mit Puffer A mit 0,5% Digitonin) laufen, um follikelische Membran zu zerstören.
- Wirbel für 5-10 min, um Follikel weiter zu stören. Zerkleinern Sie alle großen Follikelstücke und Zentrifugenrohre für 30 Sek. bei der niedrigsten Einstellung von 500 Umdrehungen pro Minute (RPM). Überstand auf ein neues 2 ml Eppendorf-Rohr übertragen und 100 l Puffer A hinzufügen. Schritt 6,3 zwischen 5-7 Mal wiederholen, bis das sichtbare Gewebe in kleine Partikel gebrochen wird.
- Drehen Sie beide Rohre für 10 min bei 2.000 U/min. Überstand in beiden Röhren entsorgen. Hinweis: Beide Röhren werden für die Erstellung von kerntechnischen Visualisierungsfolien verwendet. Die Röhre mit gesammeltem Überstand sollte hauptsächlich extrahierte Kerne enthalten, während die ursprüngliche Röhre mit Gewebe eine Mischung aus Gewebe und Kernen enthalten wird, die in Pflegezellen eingebettet sind. Fügen Sie 200 l Puffer A – 0,1% Triton hinzu und brüten sie über Nacht bei 4 °C. Zentrifuge 5 min bei 10.000 U/min (10.621 x G) und Entfernen von Überstand.
- Fügen Sie 200 l 4% Paraformaldehyd in PBS hinzu. Inkubieren Sie in Thermomixer für 30 min, Mischen bei 450 RPM. Zentrifuge 5 min bei 5.000 U/min (2.655 x G) und Entfernen von Überstand. Mit Puffer A mit 0,1% Triton für 5 min waschen, bei 450 Umdrehungen pro Minute im Thermomixer mischen. Zentrifuge 5 min bei 5.000 U/min (2.655 G) und Entfernen überstand.
- Vorgewärmte, bei 37 °C beschriftete Sonde in stube hinzufügen. Denatur bei 95 °C im Thermomixer, Mischen bei 450 Umdrehungen für 10 min. Die Denaturierung bei 80 °C 15 min mit fortgesetztem Mischen fortsetzen. Inkubieren Bei 37 °C im Thermomixer, mit 450 Umdrehungen über Nacht. Zentrifuge 5 min bei 5.000 U/min (2.655 x G). Entfernen Sie Überstand.
- Mit Puffer A mit 0,1% Triton für 5 min waschen. Zentrifuge 5 min bei 5.000 U/min (2.655 x G). Wiederholen Sie dies 2 Mal. Tragen Sie Drop von Prolong Anti-fade mit DAPI auf.
- Pipetten Sie Kerne / DAPI Lösung sorgfältig (Vermeidung von Blasen), auf Schieben auftragen und abdeckung mit Deckelschlupf.
Ergebnisse
Abbildung 1 beschreibt den gesamten Durchfluss des in diesem Artikel beschriebenen Protokolls. Der Benutzer beginnt zunächst mit der Mikrosezieren von Chromosom-DNA-Proben aus Membrandias. Mikroseziertes Material wird extrahiert und gereinigt. Die gereinigte DNA wird dann verstärkt, reverstärkt, gekennzeichnet und dann für FISH verwendet, um Chromosomenaufstriche zu kennzeichnen.
Das LCM-Protokoll kann in drei Allgemeine Schritte unterteilt werden: 1) Finden von Interessenschromosomen und Vorbereitung der Region zum Schneiden (Abbildung 2A), 2) Schneiden und Katapultieren des chromosomen bereichs von Interesse per Laser (Abbildung 2B), und 3) Überprüfung, um festzustellen, ob die Probe tatsächlich in Eine Klebekappe katapultiert wird ( Abbildung2C). Der Prozess von LCM, der auf den Polytenchromosomen des An. gambiae Sua-Stamms verwendet wird, wird in Video 1 gezeigt. Das Video beschreibt den gesamten Prozess vom Programmstart an, einschließlich wichtiger Softwarefunktionen und Tipps.
GenomePlex und REPLI-g Einzelzellen-WGA-Kits, die in diesem Protokoll verwendet werden, unterscheiden sich stark in der resultierenden Produktgröße sowie der Gesamtausbeute. Abbildung 3 zeigt die Ergebnisse der Gelelektrophorese für die GenomePlex- und REPLI-g-Kits sowie die Quantifizierung der Proben durch Nanodrop.
Mikroseziertes Material wurde verwendet, um FISH-Sonden zu erstellen, die euchromatische Regionen eines Chromosoms aufvisieren. Abbildung 4 zeigt FISH von fünf Sonden, die aus mikrodissektiertem Material auf Polytenchromosomen von An. gambiaeerzeugt werden. Vier autosomale Arme wurden mit drei Fluorophoren mit dem WGA3-Kit beschriftet: Das 3R-Chromosom ist grün (Fluorescein) gekennzeichnet, das 3L-Chromosom ist in einer Mischung aus Rot (Cy-3) und Gelb (Cy-5), das 2R-Chromosom ist gelb (Cy-5) und das 2L-Chromosom ist in rot (Cy-3). Das X-Chromosom wurde in einem separaten Experiment mit einer Nick-Übersetzung des REPLI-g-Materials in Orange (Cy-3) beschriftet. Um die Übereinstimmung zwischen euchromatischen Teilen von Polyten und mitotischen Chromosomenarmen herzustellen, wurden Chromosomenfarben zu Interphasen-, Prophasen-, Prometaphasen- und Metaphasenchromosomen von An. gambiae (Abbildung 5) hybridisiert. Um die 3D-Organisation eines einzelnen polytenchromosomen Arms im Zellkern zu visualisieren, wurde der gesamte Mount FISH auf An. gambiae Sua Stamm-Ovarial-Ammenzellen durchgeführt (Video 2). Deutliche Chromosomenarmgebiete sind deutlich in Kernen mit Interphase (Abbildung 5D) und Polyten (Video 2) Chromosomen zu sehen.
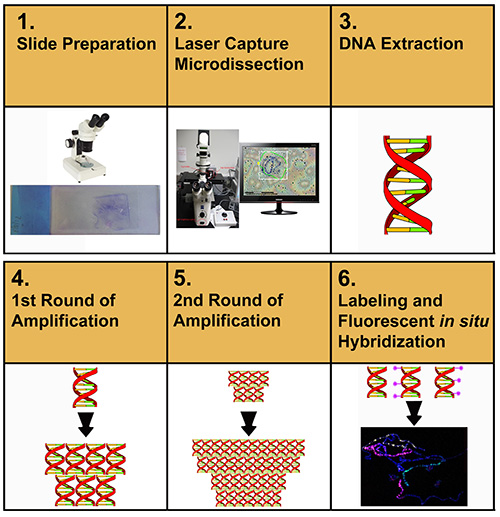
Abbildung 1. Schematische Darstellung der experimentellen Verfahren zur Herstellung von Chromosomenfarben. Klicken Sie hier, um ein größeres Bild anzuzeigen.
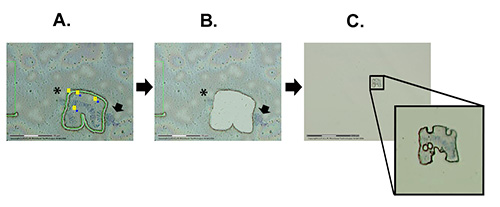
Abbildung 2. Die wichtigsten Schritte in der Chromosomen-Mikrodissektion. A) Laserunterstütztes Schneiden der chromosomalen Region von Interesse durch die Membran. B) Die Membran mit einem Loch nach der Katapultierung durchgeführt wird. C) Die Ansicht des katapultierten Membranstücks mit einem Chromosomensegment, das an der Klebekappe befestigt ist. Der Pfeil zeigt das Heterochromatin des X-Chromosoms an, das auf dem Dia verblieb. Das Sternchen zeigt ein Stück eines anderen Chromosoms, das auf der Folie verblieb. Klicken Sie hier, um ein größeres Bild anzuzeigen.

Abbildung 3. Agarose-Gel-Bilder, die DNA nach WGA zeigen. A) Niedermolekulare (200-500 bp) DNA aus Arm 3R nach Verwendung der WGA4 und WGA3 GenomePlex Kits. B) Hochmolekulare (10-20 kb) DNA aus Arm 2L nach REPLI-g-Verstärkung. Die 100 bp Leiter ist in den linken Bahnen dargestellt. Die Tabellen unten zeigen DNA-Konzentrationen, die mit Nanodrop gemessen werden. Klicken Sie hier, um ein größeres Bild anzuzeigen.
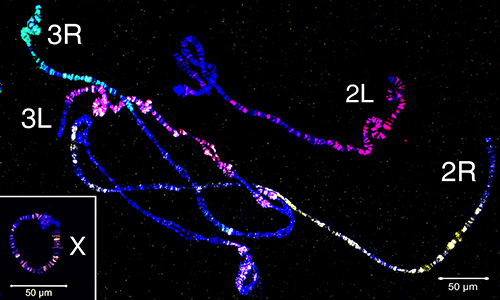
Abbildung 4. Lackierung von Polytenchromosomen aus Eierstock-Ammenzellen von An. gambiae mit vier Sonden, die aus mikrodissektiertem Material erzeugt werden. Das X-Chromosom ist orange (Cy-3) durch Nick-Translation des REPLI-g-Materials gekennzeichnet. Der 2R-Arm ist gelb beschriftet (Cy-5); der 2L-Arm ist rot (Cy-3); der 3R-Arm ist grün (Fluorescein) gekennzeichnet; Der 3L-Arm ist in einer Mischung aus Rot (Cy-3) und Gelb (Cy-5) gekennzeichnet. Autosomen sind mit dem WGA3-Verstärkungskit gekennzeichnet. Chromatin ist blau gefärbt (DAPI). Chromosomennamen werden in der Nähe von telomerischen Regionen platziert. Klicken Sie hier, um ein größeres Bild anzuzeigen.
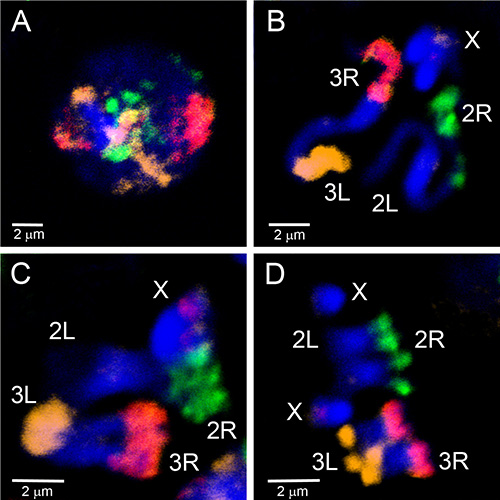
Abbildung 5. Malerei von Interphasen(A), Prophase (B), Prometaphase (C) und Metaphase (D) Chromosomen aus Larven-Imaginalscheiben des An. gambiae Mopti-Stamms mit drei Sonden, die aus mikrodissektiertem Material mit WGA3 gekennzeichnet werden. Der 2R-Arm ist grün (fluorescein) gekennzeichnet; der 2L-Arm ist nicht beschriftet; der 3R-Arm ist in rosa, eine Mischung aus rot (Cy-3) und Orange (Cy-5); der 3L-Arm ist orange (Cy-5) gekennzeichnet. Das X-Chromosom hat ein rotes Etikett, das der 18S rDNA-Sonde entspricht. Chromatin ist blau gefärbt (DAPI). Hell gefärbte Chromosomenbereiche entsprechen dem Heterochromatin. Klicken Sie hier, um ein größeres Bild anzuzeigen.
Video 1. Der Prozess der LCM der An. gambiae Polytenchromosomen. Klicken Sie hier, um Video 1 anzuzeigen.
Video 2. Ganze Halterung 3D FISH durchgeführt auf An. gambiae Eierstock Krankenschwester Zellen. Die Sonde ist mit Cy-3 (blau dargestellt) beschriftet und wurde aus einem mikrosezierten 2R-Chromosomarm hergestellt. Chromatin wurde mit DAPI gebeizt und wird durch Cyan-Pseudofärbung (hellblau) dargestellt. Klicken Sie hier, um Video 2 anzuzeigen.
Diskussion
Es gibt mehrere Schritte, die entscheidend sind, um DIE DNA aus mikrosezierten Polytenchromosomproben erfolgreich zu verstärken. Das Protokoll verwendet die Verwendung von LCM, einer Methode, die sowohl die Gesamteffizienz erhöht als auch die Exposition gegenüber fremder DNA reduziert, indem die Interaktion von physikalischen Werkzeugen mit der Probe entfernt wird. Die Amplifikation fremder DNA ist jedoch nach wie vor die größte potenzielle Falle dieses Experiments. Daher ist es während des gesamten Prozesses wichtig, die Proben vor Verunreinigungen zu schützen. Während der gesamten Gleitvorbereitungs- und Mikrodissektionsphase ist es wichtig, Dass Ethanol Seziernadeln, Rutschen, Deckelscheine sowie den Arbeitsbereich zu waschen. Es wird auch empfohlen, UV behandeln alle anwendbaren Geräte (Nadeln, Rutschen, Deckellips) vor der Verwendung.
Die Membran auf den Sezierschlitten erschwert die Ausbreitung der Chromosomen. Es ist wichtig, mehr vom Eierstock (halb bis ein volles Paar Eierstöcke) zu verwenden, wenn sie diese Dias machen, um eine größere Chance zu bieten, einen gut verteilten Zellkern zu finden. Es wird auch empfohlen, frisches Gewebe bei der Herstellung von Dias zu verwenden, da die Amplifikationsraten zu sinken scheinen, da Gewebe im Alter von 49 Jahren und die Chromosomenausbreitung schwieriger wird. Die Vorbereitung von Dias für die Mikrodissektion ist der zeitaufwändigste Schritt in diesem Protokoll. Chromosomen müssen gut gestreut sein, um den zufälligen Erwerb von unerwünschtem Material zu vermeiden. Die Giemsa-Färbung ermöglicht es dem Anwender, die Streuqualität mit einem Phasenkontrastmikroskop vor der Verwendung des Mikrodissektionssystems zu überprüfen.
Die Kombination von Mikrodissektion und Amplifikation bietet die Möglichkeit, Chromosomenfragmente von kleinen Interessengebieten bis hin zu einem Großteil der Arme zu extrahieren und zu analysieren. Dieses Protokoll ermöglicht es dem Benutzer, DNA aus morphologisch unterschiedlichen Regionen wie Inversionen, spezifischen euchromatischen Bändern und Interbands, telomerischen, zentrotorischen und interkalären Heterochromatin zu erhalten. Der Benutzer kann die erzeugten Malsonden auf die Untersuchung von abnormen Chromosomen anwenden, die studienweise speziesübergreifende Homologie an bestimmten Loci oder die räumliche Organisation von Chromosomen in einem intakten 3D-Kern charakterisieren. Für die Entwicklung von Chromosomenfarben haben wir euchromatic Segmente ausgewählt, um eine Hybridisierung von sich wiederholender DNA mit mehreren Chromosomenregionen zu vermeiden. Als Ergebnis erhielten wir eine armspezifische Lackierung ohne Verwendung eines Konkurrenten, wie der gesamten genomischen DNA oder derC0t-1 DNA-Fraktion.
Wir haben uns für die GenomePlex WGA und REPLI-G Kits entschieden, basierend auf Bewertungen, die die Effizienz und Dropout-Rate von mehreren Amplifikationskits 40,44verglichen haben. Beide Kits schnitten bei beiden Abbrechern am besten ab (GenomePlex hatte eine Rate von 12,5 % im Vergleich zu 37,5% von REPLI-g). und Prozentsatz der verstärkten Marker (GenomePlex hatte eine Amplifikationsrate von 45,24% im Vergleich zu REPLI-g 30,0%) 40. Das GenomePlex-Kit lieferte auch eine höhere Menge an DNA und machte es zu einem besseren Kandidaten für mehrere nachgeschaltete Techniken. Ein Re-Amplifikationskit für das GenomePlex-System ist ebenfalls verfügbar, das eine weitere Amplifikation der DNA ermöglicht. Es ist jedoch wichtig zu beachten, dass die Verstärkung nicht perfekt ist. Es bleibt die Möglichkeit, dass eine erfolgreiche Verstärkung Zufall von Fehlern oder eine Neigung zu bestimmten Loci in der Ziel-DNA haben kann. Es ist wichtig, die endgültige Fragmentgröße der verfügbaren Genomverstärkungsmethoden zu berücksichtigen. Die GenomePlex-Fragmentierung führt zu einer Bibliothek mit Fragmenten von 200-500 bp, während das REPLI-g-Kit Fragmente mit einer Größe von etwa 10-20 kb produziert. Die beabsichtigte nachgeschaltete Anwendung dieses Protokolls ist FISH, wodurch das GenomePlex-Kit eine praktikablere Option wird, da es die gewünschte Fragmentgröße und die Möglichkeit bietet, DNA-Fragmente direkt über WGA zu kennzeichnen. Lange DNA-Moleküle, die durch die REPLI-g-Amplifikation entstehen, müssen in der nachgeschalteten Nick-Translation-Etikettierungsreaktion fragmentiert werden.
Dieses Protokoll wurde angepasst, um die DNA eines einzelnen Polyten-Chromosomarms erfolgreich zu verstärken. Andere Protokolle erfordern das Pooling vieler (typischerweise 10-30) Chromosomenfragmente, um die Probe erfolgreichzu verstärken 7,11,28,40. Obwohl die Bündelung mehrerer Chromosomen mit unserer Methode möglich ist, unterstreicht die erhöhte Wahrscheinlichkeit einer Probenkontamination die Bedeutung des Versuchs mit so wenig Chromosomen wie möglich. Wenn Polytenchromosomen nicht verfügbar sind, könnte unser Protokoll für den Einsatz in mitotischen Chromosomen angepasst werden. Es kann jedoch notwendig sein, 10-15 mitotische Chromosomen vor der Amplifikation für erfolgreiche FISH 11zu bündeln. Amplifikationsverzerrung ist niedriger mit hohen Mengen an Startschablon DNA 50. Polytenchromosomen liefern etwa 512 Kopien einer einzigen DNA-Sequenz und 1024 Kopien von zwei homologen DNA-Sequenzen. So wird das Pooling von mitotischen Chromosomen dazu beitragen, die Gesamtqualität des DNA-Produkts nach der Amplifikation zu erhöhen.
Dieses Verfahren hat viele mögliche Anwendungen in zytogenetischen und genomischen Studien. Hier haben wir Chromosomfarben verwendet, um die Übereinstimmung zwischen euchromatischen Segmenten von Polyten und mitotischen Chromosomenarmen in An. gambiaezu ermitteln. Die gleichen Malsonden können auf die zytogenetische Charakterisierung von An. gambiae Zelllinien angewendet werden. Umfangreiche genomische Umlagerungen und Veränderungen der Chromosomenzahlen sind häufige Merkmale der Zelllinien 51,52. Aneuploidie, Polyploidie und chromosomale Umlagerungen wie Translokationen, Inversionen, Deletionen und Ringchromosomen wurden in verschiedenen Mückenzelllinien 53,54nachgewiesen. Klassische zytogenetische Beobachtungen 55 und physikalische Kartierung 56 haben das Auftreten von ganzarm-chromosomalen Translokationen in der Evolution von Malariamücken gezeigt. Daher kann mikroseziertes Material in Verbindung mit FISH-Experimenten verwendet werden, um die Homologie chromosomaler Regionen zwischen Denspezies zu vergleichen. Wir haben erfolgreich 3D FISH mit der 2R-Malsonde auf Polytenchromosomen in ganzen Mount-Ovarial-Pflegezellen durchgeführt. Diese Methode wird die Rückverfolgung von Chromosomenbahnen und das Studium der Kernarchitektur in Anopheleserleichtern. Techniken wie DNA-Genotypisierung 57,58, Genomsequenzierung der nächsten Generation 26,27, physikalische und Linkage-Kartenentwicklung und die Erzeugung von Sonden für die Chromosomenmalerei 33,59 können alle von der arm- und regionsspezifischen Mikrodissektion profitieren. Durch die Kombination der LCM-Technologie und die Weiterentwicklung der einzelligen WGA zeigen wir eine effiziente, praktische Methode zur Herstellung angemessener DNA-Mengen aus einem einzelnen Polyten-Chromosomarm.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch den Zuschuss der National Institutes of Health 1R21AI094289 an Igor V. Sharakhov unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid | Fisher Scientific | A491-212 | |
| Methanol | Fisher Scientific | A412-4 | |
| Propionic acid | Sigma-Aldrich | 402907 | |
| Membrane slides 1.0 PET | Zeiss | 415190-9051-000 | |
| Buffer tablets “GURR” | Life Technologies | 10582-013 | |
| KaryoMAX Giemsa Stain | Life Technologies | 10092-013 | |
| ThermoBrite Slide Denaturation/Hybridization System | Abbott Molecular | 30-144110 | |
| Vacufuge vacuum concentrator | Eppendorf | 22820001 | |
| Spectroline Microprocessor-Controlled UV Crosslinker XL-1000 | Fisher Scientific | 11-992-89 | |
| Thermo Scientific NanoDrop | Fisher Scientific | ND-2000 | |
| REPLI-g Single Cell Kit | Qiagen | 150343 | |
| GenomePlex Single Cell Kit (WGA4) | Sigma-Aldrich | WGA4-10RXN | |
| GenomePlex WGA Reamplification Kit (WGA3) | Sigma-Aldrich | WGA3-50RXN | |
| MZ6 Leica stereomicroscope | Leica | VA-OM-E194-354 | A different stereomicroscope can be used |
| Olympus CX41 Phase Microscope | Olympus | CX41RF-5 | A different phase microscope can be used |
| PALM MicroBeam Laser Microdissection Microscope | Zeiss | ||
| Thermomixer | Eppendorf | 22670000 | |
| 10x PBS | Invitrogen | P5493 | |
| 50x Denhardt’s solution | Sigma-Aldrich | D2532 | |
| 99% Formamide | Fisher Scientific | BP227500 | |
| Dextran sulfate sodium salt | Sigma | D8906 | |
| 20x SSC buffer | Invitrogen | AM9765 | |
| ProLong Gold antifade reagent with DAPI | Invitrogen | P-36931 | |
| dATP, dCTP, dGTP, dTTP | Fermentas | R0141, R0151, R0161, R0171 | |
| Cy3-dUTP, Cy5-dUTP | GE Healthcare | PA53022, PA55022 | |
| BSA | Sigma-Aldrich | A3294 | |
| DNA polymerase I | Fermentas | EP0041 | |
| DNase I | Fermentas | EN0521 | |
| Spermine | Sigma-Aldrich | S3256-1G | |
| Spermidine | Sigma-Aldrich | S0266-1G | |
| Potassium Chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | BP3581 | |
| EGTA | Sigma-Aldrich | E0396-25G | |
| PIPES | Sigma-Aldrich | P6757-25G | |
| EDTA | Fisher Scientific | S311-500 | |
| Digitonin | Sigma-Aldrich | D141-100MG | |
| Triton-X100 | Fisher Scientific | BP151-100 | |
| AdhesiveCap 500 clear | Zeiss | 415190-9211-000 | |
| QIAamp DNA Micro Kit (50) | Qiagen | 56304 | |
| Genomic DNA Clean and Concentrator Kit | Zymo Research | D4010 | |
| 37% Paraformaldehyde | Fisher Scientific | F79-500 |
Referenzen
- Ried, T., Schrock, E., Ning, Y., Wienberg, J. Chromosome painting: a useful art. Human molecular genetics 7. , 1619-1626 (1998).
- Yang, F., et al. Reciprocal chromosome painting illuminates the history of genome evolution of the domestic cat, dog and human. Chromosome Res. 8, 393-404 (2000).
- Badenhorst, D., Dobigny, G., Robinson, T. J. Karyotypic evolution of hapalomys inferred from chromosome painting: a detailed characterization contributing new insights into the ancestral murinae karyotype. Cytogenet Genome Res 136. , 83-88 (2012).
- Trifonov, V. A., et al. Chromosomal evolution in Gekkonidae. I. Chromosome painting between Gekko and Hemidactylus species reveals phylogenetic relationships within the group. Chromosome Res. 19, 843-855 (2011).
- Nie, W., et al. Chromosomal rearrangements and karyotype evolution in carnivores revealed by chromosome painting. Heredity (Edinb. , 108-1017 (2012).
- Guan, X. Y., et al. Detection of chromosome 6 abnormalities in melanoma cell lines by chromosome arm painting probes). Cancer Genet Cytogenet. 107, 89-92 (1998).
- Guan, X. Y., et al. Characterization of a complex chromosome rearrangement involving 6q in a melanoma cell line by chromosome microdissection. Cancer genetics and cytogenetics 134. , 65-70 (2002).
- Breen, M., et al. Detection of equine X chromosome abnormalities in equids using a horse X whole chromosome paint probe (WCPP). Vet J. 153, 235-238 (1997).
- Kokhanenko, A. A., Anan'ina, T. V., Stegniy, V. N. The changes in chromosome 6 spatial organization during chromatin polytenization in the Calliphora erythrocephala Mg. (Diptera: Calliphoridae) nurse cells. Protoplasma 250. , 141-149 (2013).
- Timme, S., et al. Nuclear position and shape deformation of chromosome 8 territories in pancreatic ductal adenocarcinoma. Anal Cell Pathol (Amst. 34, 21-33 (2011).
- Drosopoulou, E., et al. Sex chromosomes and associated rDNA form a heterochromatic network in the polytene nuclei of Bactrocera oleae (Diptera: Tephritidae). Genetica. 140, 169-180 (2012).
- Pazian, M. F., Shimabukuro-Dias, C. K., Pansonato-Alves, J. C., Oliveira, C., Foresti, F. Chromosome painting of Z and W sex chromosomes in Characidium (Characiformes). Crenuchidae). Genetica. 141, 1-9 (2013).
- Howe, E. S., Murphy, S. P., Bass, H. W. Three-dimensional acrylamide fluorescence in situ hybridization for plant cells. Methods Mol Biol 990. , 53-66 (2013).
- Lysak, M. A., Mandakova, T. Analysis of plant meiotic chromosomes by chromosome painting. Methods Mol Biol 990. , 13-24 (2013).
- Ji, Z., Zhang, L. Chromosomics: detection of numerical and structural alterations in all 24 human chromosomes simultaneously using a novel OctoChrome FISH assay. J Vis Exp. 10, (2012).
- Idziak, D., et al. Painting the chromosomes of Brachypodium: current status and future prospects. Chromosoma. 120, 469-479 (2011).
- Fuchs, J., Kuhfittig, S., Reuter, G., Schubert, I. Chromosome painting in Drosophila. Chromosome Res. 6, 335-336 (1998).
- Zhimulev, I. F. . Morphology and structure of polytene chromosomes. 34, 1-490 (1996).
- Sharakhov, I. V., Sharakhova, M. V. in Chromosome Mapping Research Developments eds. J.F. Verrity & L.E. Abbington) (Nova Science. , (2008).
- Coluzzi, M., Sabatini, A., Torre, d. e. l. l. a., Di Deco, A., A, M., Petrarca, V. A polytene chromosome analysis of the Anopheles gambiae species complex). Science. 298, 1415-1418 (2002).
- Stegnii, V. N. Systemic reorganization of the architectonics of polytene chromosomes in the onto- and phylogenesis of malaria mosquitoes. Genetika. 23, 821-827 (1987).
- Stegnii, V. N. Systemic reorganization of the architectonics of polytene chromosomes in the onto- and phylogenesis of malarial mosquitoes. II. Species specificity in the pattern of chromosome relations with the nuclear envelope of nutrient ovarian cells. Genetika. 23, 1194-1199 (1987).
- Bonaccorsi, S., Santini, G., Gatti, M., Pimpinelli, S., Colluzzi, M. Intraspecific polymorphism of sex chromosome heterochromatin in two species of the Anopheles gambiae complex. Chromosoma. 76, 57-64 (1980).
- Zhimulev, I. F. Polytene chromosomes, heterochromatin, and position effect variegation. Adv Genet. 37, 1-566 (1998).
- Seifertova, E., et al. Efficient high-throughput sequencing of a laser microdissected chromosome arm. BMC Genomics. 14, 1471-2164 (2013).
- Weise, A., et al. High-throughput sequencing of microdissected chromosomal regions. European journal of human genetics. EJHG. 18, 457-462 (2010).
- Murphy, S. J., et al. Mate pair sequencing of whole-genome-amplified DNA following laser capture microdissection of prostate cancer. DNA research : an international journal for rapid publication of reports on genes and genomes 19. , 395-406 (2012).
- Moshkin, Y. M., et al. Microdissection and sequence analysis of pericentric heterochromatin from the Drosophila melanogastermutant Suppressor of Underreplication. Chromosoma. 111, 114-125 (2002).
- Decarlo, K., Emley, A., Dadzie, O. E., Laser Mahalingam, M. capture microdissection: methods and applications. Methods Mol Biol 755. , 1-15 (2011).
- Iyer, E. P., Cox, D. N. Laser capture microdissection of Drosophila peripheral neurons. J Vis Exp. 10, (2010).
- Kubickova, S., Cernohorska, H., Musilova, P., Rubes, J. The use of laser microdissection for the preparation of chromosome-specific painting probes in farm animals. Chromosome Res. 10, 571-577 (2002).
- Fukova, I., et al. Probing the W chromosome of the codling moth, Cydia pomonella, with sequences from microdissected sex chromatin. Chromosoma. 116, 135-145 (2007).
- Thalhammer, S., Langer, S., Speicher, M. R., Heckl, W. M., Geigl, J. B. Generation of chromosome painting probes from single chromosomes by laser microdissection and linker-adaptor PCR. Chromosome Res. 12, 337-343 (2004).
- Sims, C. E., Allbritton, N. L. Analysis of single mammalian cells on-chip. Lab on a chip 7. , 423-440 (2007).
- Hutchison, C. A., 3rd, J. C., Venter, Single-cell genomics. Nature biotechnology. 24, 657-658 (2006).
- Lasken, R. S., Egholm, M. Whole genome amplification: abundant supplies of DNA from precious samples or clinical specimens. Trends in biotechnology 21. , 531-535 (1016).
- Teruel, M., et al. Microdissection and chromosome painting of X and B chromosomes in the grasshopper Eyprepocnemis plorans. Cytogenet Genome Res. 125, 286-291 (2009).
- Liu, J. D., et al. Sex chromosomes in the spiny eel (Mastacembelus aculeatus) revealed by mitotic and meiotic analysis. Cytogenet Genome Res. 98, 291-297 (2002).
- Harvey, S. C., et al. Molecular-cytogenetic analysis reveals sequence differences between the sex chromosomes of Oreochromis niloticus: evidence for an early stage of sex-chromosome differentiation. Cytogenet Genome Res. 97, 76-80 (2002).
- Hockner, M., Erdel, M., Spreiz, A., Utermann, G., Kotzot, D. Whole genome amplification from microdissected chromosomes. Cytogenet Genome Res. 125, 98-102 (2009).
- Kitada, K., Taima, A., Ogasawara, K., Metsugi, S., Aikawa, S. Chromosome-specific segmentation revealed by structural analysis of individually isolated chromosomes. Genes Chromosomes Cancer. 50, 217-227 (2011).
- Ma, L., et al. Direct determination of molecular haplotypes by chromosome microdissection. Nature methods. 7, 299-301 (2010).
- Teruel, M., et al. Microdissection and chromosome painting of X and B chromosomes in Locusta migratoria. Chromosome Res. 17, 11-18 (2009).
- Treff, N. R., Su, J., Tao, X., Northrop, L. E., Scott, R. T. Single-cell whole-genome amplification technique impacts the accuracy of SNP microarray-based genotyping and copy number analyses. Molecular human reproduction 17. , 335-343 (2011).
- Rutten, K. B., et al. Chromosomal anchoring of linkage groups and identification of wing size QTL using markers and FISH probes derived from microdissected chromosomes. in Nasonia(Pteromalidae : Hymenoptera). Cytogenetic and Genome Research 105. , 126-133 (2004).
- Post, R. J., Kruger, A., Somiari, S. B. Laser-assisted microdissection of polytene chromosomes from Diptera for the development of molecular markers. Molecular Ecology Notes. 6, 634-637 (2006).
- George, P., Sharakhova, M. V., Sharakhov, I. V. High-throughput physical mapping of chromosomes using automated in situ hybridization. Journal of visualized experiments : JoVE. 10, (2012).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ Hybridization on Mitotic Chromosomes of Mosquitoes. J Vis Exp. 10, (2012).
- Frumkin, D., et al. Amplification of multiple genomic loci from single cells isolated by laser micro-dissection of tissues. BMC biotechnology. 8, 10-1186 (2008).
- Raghunathan, A., et al. Genomic DNA amplification from a single bacterium. Applied and environmental microbiology 71. , 3342-3347 (2005).
- Cassio, D. Long term culture of MDCK strains alters chromosome content. BMC Res Notes. 6, 162-1610 (2013).
- Landry, J. J., et al. The Genomic and Transcriptomic Landscape of a HeLa Cell Line. G3. , (1534).
- Steiniger, G. E., Mukherjee, A. B. Insect chromosome banding: technique for G- and Q-banding pattern in the mosquito Aedes albopictus. Can J Genet Cytol. 17, 241-244 (1975).
- Brown, S. E., et al. Toward a physical map of Aedes aegypti. Insect Mol Biol. 4, 161-167 (1995).
- Green, C., Hunt, R. Interpretation of variation in ovarian polytene chromosomes of Anopheles funestus Giles. A. parensis Gillies, and A. aruni? Genetica. 51, 187-195 (1980).
- Sharakhova, M. V., Xia, A., Leman, S. C., Sharakhov, I. V. Arm-specific dynamics of chromosome evolution in malaria mosquitoes. BMC evolutionary biology. 11, 10-1186 (2011).
- Gu, L. H., et al. DNA genotyping of oral epithelial cells by laser capture microdissection]. Fa yi xue za zhi 22. , 196-197 (2006).
- Rook, M. S., Delach, S. M., Deyneko, G., Worlock, A., Wolfe, J. L. Whole genome amplification of DNA from laser capture-microdissected tissue for high-throughput single nucleotide polymorphism and short tandem repeat genotyping. The American journal of pathology 164. , 23-33 (2004).
- Houen, A., Field, B. L., Saunders, V. A. Microdissection and chromosome painting of plant B chromosomes. Methods in cell science : an official journal of the Society for In. Vitro Biology. 23, 115-124 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten