Method Article
评估的HIV-1感染的CD4的先天传感
摘要
不像无细胞的HIV-1颗粒,感染的CD4 + T细胞是由浆细胞样树突细胞(pDC细胞)有效地感测。这个手稿描述了一种方法,其中外周血单核细胞(PBMC)或分离的pDC是共培养的HIV-1感染的T细胞的pDC评估先天感测的评估,I型干扰素的释放。
摘要
HIV-1的固有感测需要感染的CD4 + T细胞与浆细胞样树突细胞(pDC细胞)直接接触。为了研究这个过程中,此处所描述的协议使用新鲜分离的人外周血单核细胞(PBMC)或浆细胞样树突细胞(pDC细胞)以感测在任一T细胞系(MT4)或异源的原代CD4 + T细胞感染。为了确保正确的感测,至关重要的是,将PBMC采血和被感染的T细胞的所使用的最佳百分比后立即分离。此外,多参数流式细胞染色可用于确认PBMC样品含有不同细胞谱系在生理比率。一些控制也可包括评估生存能力和的pDCs的功能。这些包括,特定表面标志物的存在下,评估细胞反应Toll样受体激动剂已知(TLR)的途径,和确认缺乏斯波的taneous I型干扰素(IFN)的生产。在这个系统中,新鲜分离的PBMC或pDC细胞共培养与HIV-1感染的细胞在96孔板为18-22小时。从这些共培养物的上清液,然后用于通过监测ISGF3通路在HEK-蓝IFN-α/β细胞的活化,以确定生物活性的I型IFN的水平。事先和在共培养条件下,靶细胞可以经过流式细胞仪分析,以确定多个参数,包括感染细胞的杀伤差动感染细胞的百分比,特定表面标志物的水平,和。虽然这些协议最初开发到后续的I型干扰素的产生,它们可能被用来研究来自pDC细胞释放其他imuno-调节分子,并进一步了解理事HIV-1先天敏感的分子机制。
引言
I型干扰素生成的pDC表示防御病毒感染的第一道防线,并且因此作为先天免疫和适应性免疫1之间的重要环节。而不含细胞的HIV-1的颗粒是通过先天免疫系统检测到不良的HIV-1感染的 CD4 + T细胞通过的pDC 2有效地检测到。所述感测机构,需要在PDC上,然后接着病毒捕获和内由PDC被感染的T细胞和CD4分子的表面上的病毒包膜糖蛋白(gp120的)之间的初始接触。由TLR7后续识别的转移的HIV-1 RNA的触发MYD88 / IRF7途径的活化,并最终导致I型IFN的产生3。重要的是,第二感测途径中存在的pDCs,这是由TLR9介导的,由病毒糖蛋白,gp120的相互作用的抑制,与PDC特异性表面标记BDCA2 4。
的pDC的TLR7和TLR9传感途径可以潜在地负面BST2的接合(也被指定Tetherin或CD317)与称为ILT7 5另一个的pDC-比表面抑制性受体调制。 BST2被以高水平表达的pDC在和一些癌细胞的表面上,但在相对较低的水平,其他类型的细胞,如B细胞,巨噬细胞和T细胞。重要的是,BST2可以通过I型干扰素在一些转化细胞系的,以及在人类和小鼠起源6的原代细胞培养诱导。除了 其免疫调节功能,BST2最近发现抑制HIV-1的释放和其它包膜病毒颗粒由交联新生病毒颗粒到感染细胞表面 7。在HIV-1的情况下,该病毒编码辅助蛋白U(VPU)被证明作为BST2拮抗剂。据信,VPU下调BST2来自HIV-1感染的细胞的细胞表面上,它的系绳的部位荷兰国际集团的活性,其结果增强了病毒释放和传播7,虽然这一概念已被质疑8,9。在没有VPU,大量的完全成形的和成熟的子代的HIV-1颗粒被保留在细胞表面。无论这些拴颗粒可能代表免疫检测有效的目标仍然是一个悬而未决的问题。此外,目前还不清楚VPU是否能够通过调节表面BST2水平dysregulate I型IFN的产生从pDC细胞。
旨在评估HIV-1的感测早期研究用无细胞HIV-1的颗粒,其一般被认为是I型干扰素3,10-12的差诱导剂进行。鉴于最近的研究显示,PBMC和pDC的有效检测HIV感染的CD4 + T淋巴细胞2,13,14,我们在这里介绍一个简单的方法来衡量在识别HIV-1感染细胞的体外pDC的触发先天的反应。
研究方案
一般注意事项
它来保持培养中的细胞,没有任何抗生素,因为即使控制细菌感染可以由PBMC的感测是非常重要的。细菌等组件的感测会诱发一个背景干扰素的产生,不能从由特定的HIV-1感测触发的区分。此外,所有的细胞都必须定期地测试用于支原体污染是否存在。
始终使用无内毒素的解决方案,只要有可能。
在共培养中使用的不同的细胞的流式细胞术表征(PBMC中,的pDC,MT4和CD4 + T细胞)是一个可选的步骤,但强烈建议,因为它可以提供所需的给定的实验的正确解释的有价值的信息。
1.准备感染的靶细胞
- 维持人体的 CD4 + T细胞系MT4在RPMI 1640 MEDI一个补充有10%胎牛血清(FBS),从现在起称为RPMI-1640完全培养基中。
- 隔离原代CD4 + T细胞 。
- 通过密度梯度离心分离从人外周血单核细胞。
- 隔离用CD4 + T细胞的阴性选择的试剂盒,按照生产商的建议的 CD4 + T淋巴细胞。
- 激活的CD4 + T淋巴细胞用PHA-L(5微克/毫升)48小时,然后维持细胞在RPMI-1640完全培养基中补充有重组IL-2(100U / ml)中。原发性感染T细胞后5天的隔离。
- 感染靶细胞(MT4 T细胞系或异源的原代CD4 + T细胞 )的。
- 前两天共培养,感染的T细胞与HIV-1病毒。在这里描述的特定示例pNL4.3-GFP_ires_Nef野生型(WT)或pNL4.3-GFP_ires_Nef增量VPU(dVpu)病毒被使用。这些病毒株代表GRE恩荧光蛋白(GFP)-marked仅会有不同的表达VPU能力等基因感染性分子克隆。
- 使用感染(MOI病毒)不同的多重选择的文化有类似感染水平的联合培养。共培养的天,确定的GFP +细胞通过流式细胞百分比术作为感染的标志物。使用仅培养了一系列20-50%感染细胞用于共培养物。
任选的步骤:执行流式细胞染色在这一点上,以评估感兴趣分子/配体,例如BST2,和CD4的表面表达。对于细胞表面染色,悬浮0.5×10 6 T细胞在100微升洗涤液,加入1微升抗CD4_PerCP /经Cy5.5和1微升抗BST2_A660的。孵育管45分钟,在4℃,用流式细胞仪洗涤溶液洗涤之前。如果研究的目的是评估VPU介导BST2拮抗作用,进行HIV-1颗粒在这个时候释放测定先前所描述的15。
2.隔离感测单元(整体或外周血单个核细胞富集的pDC)的富集
注意:当的PBMC用于传感,开始采血后半小时内分离和及时进行它。立即用于共培养物或浓缩的pDC使用的PBMC。
- 通过密度梯度离心分离从人外周血单核细胞。
任选的步骤:执行多参数流式细胞术染色,以确认新分离的PBMC包含不同细胞谱系在生理比率。对于细胞表面染色,重悬在100微升的Fc阻断溶液10 6 PBMC中,并孵育15分钟,在4℃。封闭后,加入1微升抗CD3_Pacific蓝色(T细胞),1微升抗CD14-PE_Texas红(对骨髓细胞),4微升抗BDCA2_APC和1微升抗ILT7_PE的(为的pDCs)的。孵化管中在4℃下45分钟,用流式细胞仪洗涤溶液洗涤之前。 - 丰富使用PDC的阴性选择试剂盒,按照制造商的建议的pDCs。建议在工作速度快,保持细胞的冷,并用预冷的解决方案。这将防止在细胞表面上和非特异性细胞标记的抗体的封盖,以及确保最大的pDC活性。
- 执行新鲜分离的pDC的多参数流式细胞仪分析,以证实纯度,富集的百分比,以及了pdc-特定表面标志物的相对量(如ILT7和BDCA2)。对于细胞表面染色,重悬在100微升的Fc封闭液10 4的pDCs,并孵育15分钟,在4℃。封闭后,加入1微升抗CD3_Pacific蓝,1微升抗CD14_PE_Texas红,4微升抗BDCA2_APC和1微升抗ILT7_PE的。孵育管45分钟,在4℃,用洗涤流术洗涤液(PBS,5前毫摩尔EDTA,5%FBS)中。最低40%的pDC纯度建议(如果起始材料具有0.4%的pDC,这将相当于100倍富集)。
3.共培养感染的CD4 + T细胞和感测单元(整体或外周血单个核细胞富集的pDCs)的
- 混合220微升的PBMC(稀释为850000个细胞/ ml)或220微升的pDCs的(在一个浓度范围为10万至50万个细胞/ ml)与30μl的感染的T细胞(稀释在10 6个细胞/ ml),每孔中一个U型底96孔板。
- 作为对照,板外周血单个核细胞或PDC和T细胞的孤独。调整好,以250微升的RPMI 1640完全培养基的体积。
- 评估细胞反应的TLR7和TLR9途径的已知激动剂。为此,板220微升的PBMC(稀释为850000个细胞/ ml),每孔或200微升的pDCs的(在一个浓度范围为10万至50万个细胞/ ml)在U型底96孔板中并添加TLR7激动剂(伊米quimod,最终浓度:2.5微克/毫升)或TLR9激动剂(ODN 2216的CpG-A中,最终浓度:5微米)。孵育细胞,在37℃和5%CO 2的18至22小时,并以类似于下面描述的共培养物的方式处理它们。
- 孵育共培养物在37℃和5%CO 2的18至22小时,然后将它们传输到V型底96孔板中。离心5分钟,在400×g下。
- 转移上清液至平底96孔板中。上清液可以储存在-80℃或立即用于I型干扰素的检测。
- 悬浮共培养细胞在2%多聚甲醛,并使用流式细胞仪分析它们。由于在规模和造粒的差异,MT4细胞是从基于其侧散射(SS)与前向散射(FS)型材外周血单个核细胞或pDC细胞容易辨别。如果初级T细胞被用作靶感染的细胞中,这些可以与任何细胞追踪染料染色,如CSFE之前,共培养。
- 使用HEK-蓝的IFN-α/β报道细胞的生物活性的I型干扰素的测量。
注:由HEK293细胞与人类STAT2和IRF9基因稳定转染生成这些细胞获得充分活跃I型IFN信号通路。它们还包含IFN-α/β诱导性ISG54启动子控制之下的分泌型碱性磷酸酶(SEAP)的报道基因。这些细胞与I型干扰素的刺激激活JAK / STAT / ISGF3通路,诱导产生SEAP的。- 保持的HEK-蓝IFN-α/β细胞在DMEM补充有10%FBS中。板他们以每孔50,000个细胞的一个平底96孔板的密度,在180微升的最终体积。
- 加入20微升共培养物上清液至每个孔一式两份。每块板还需要一套内部标准控件(人干扰素α,从100 U /终浓度毫升至2500单位/毫升)。孵育所述板在37℃和5%CO 2的18-22小时。
- 确定碱性磷酸酶活性用孔定量蓝溶液,将其从粉红色变成紫色/蓝色在酶的存在下的水平。准备量化蓝以下制造商的建议。添加180微升的该溶液到平底96孔板的每个孔中。到每个孔中也加入20微升的诱导的HEK-蓝IFN-α/β细胞的上清液,并孵育所述板在37℃培养箱,直到颜色在标准的IFN的对照孔的发展。
- 评价SEAP的使用分光光度计水平620-655纳米和确定I型干扰素的浓度通过外推法从干扰素标准曲线的线性部分。
结果
在图1中所描述的共培养系统允许HIV-1的固有感测的对照研究。由于主电池的可变性质,重要的是,髓样细胞和T细胞(CD14分别+和CD3 +)的正常比率观察到,如在图 2A所示的例子中此外,只有一个(与非活化的T细胞更高FS和更高水平的CD3)活化T细胞的数目低是所希望的,在新鲜分离的PBMC培养物。的PBMC与不同细胞类型之间的不正常的比率往往无法安装在体外 ,有可能适当的先天免疫反应,由于已激活的表型作为正在进行的感染的结果。最重要的是,需要的pDC的相对百分比,如图2B进行评估。虽然这个百分比可以变化从0.2%至1.2%,异常检测的表型,也观察到与两个奥妙该范围MES。使用阴性选择的pDC的富集往往产生50-95%的pDC纯度,如在两个例子中,从图2B(92%和72%)看出。的原型实例为整体实验示于图3和4。在这个例子中,MT4细胞用pNL4.3-GFP_ires_Nef WT或增量VPU达到30%的感染在共培养(图3A)的时间。如先前所描述,仅与WT病毒的感染导致显著下调表面BST2(图3B)。由于它们在尺寸和粒度的差异,MT4细胞可从外周血单个核细胞通过流式细胞术(图4A)容易辨别。共培养温育后,与已知的TLR7或TLR9激动剂和PBMC中的接触与HIV-1感染的细胞释放显著量的I型干扰素(图4B)的接触只的PBMC。在外周血单个核细胞中未检测到IFN独自一人,在外周血单个核细胞合铜ltured与模拟感染的MT4细胞中,或在单独感染的MT4 细胞 (图4B)。在这里介绍的实例中,HIV-1感染的MT4细胞的PBMC的固有感测被发现在VPU的存在下显著降低。
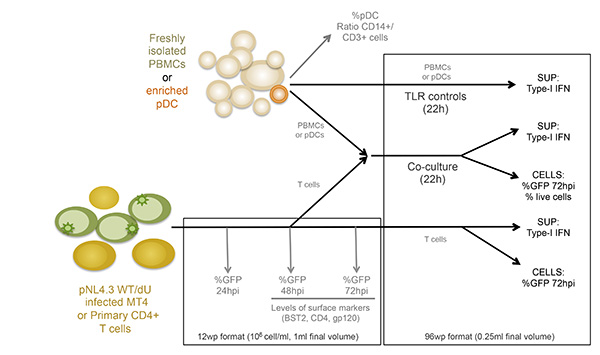
图1:实验设计的示意图 SUP:上清点击这里查看大图 。
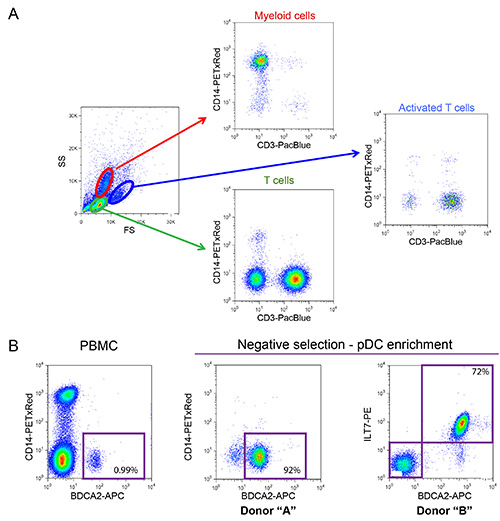
图2:新鲜分离的PBMC和ENR表型特征iched的pDC。(A)的骨髓细胞,并在PBMC中从健康供体分离的观察T细胞的普通分布(骨髓细胞的百分比应之间在10-20%之间和T细胞55-65%的范围内)。使用识别表面CD14(髓系标志物)和CD3(T细胞标志物)荧光标记的抗体外周血单个核细胞样本进行染色。 (B)的pDCs的表型特征。之间细胞的PBMC中的总数(在实施例0.99%示出)的0.2-1.2%之前富集的pDC表示。这些细胞可以基于特定的标记,如BDCA2和ILT7,存在于细胞表面的表达来鉴定。负选择可以用来显著丰富的pDC的数量,并消除潜在的有害污染物,如CD14 +髓样细胞(浓缩达到92%和72%,在两个例子示出)。Cli的CK这里查看大图。
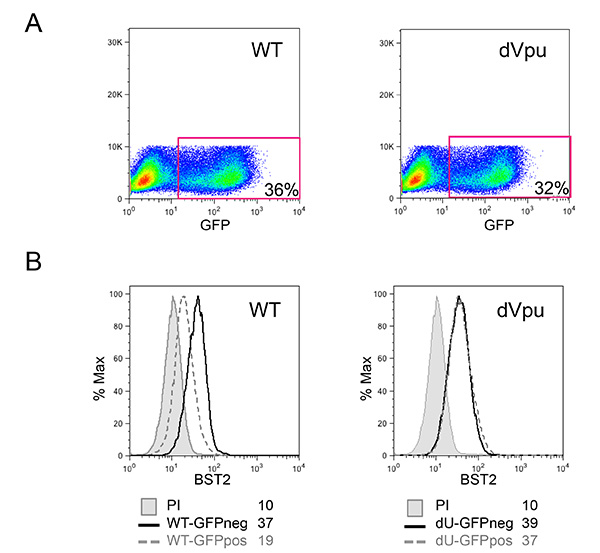
图3:感染细胞的感染pNL4.3-GFP_ires_Nef WT或dVpu的MT4文化中的HIV-1感染靶细胞MT4表征(A)的百分比由GFP阳性细胞的百分比来确定。表面染色后,在感染的细胞(B)的BST2细胞表面表达进行评价。灰色实心直方图代表染色的免疫前兔血清(未染色的对照)假感染细胞;剩余的直方图代表染色的细胞用抗BST2多克隆兔血清。直方图用实线表示控制GFP负(负)细胞;而直方图用虚线对应于受感染的GFP阳性(正)的细胞。平均感orescence强度(MFI)值是表示各样品。流式细胞仪,如图2所述进行分析。 点击这里查看大图 。
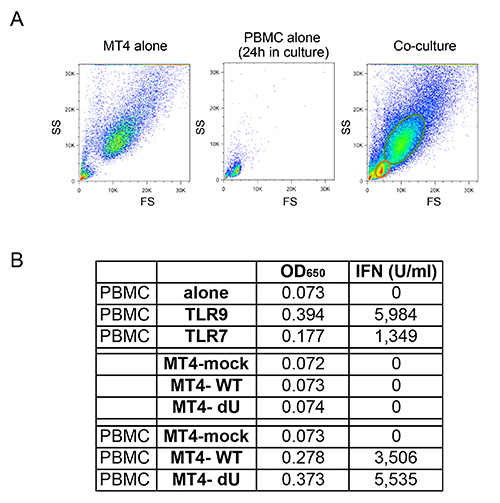
图4:新鲜分离的PBMC和感染的MT4 T细胞共培养流式细胞PBMC和MT4 T细胞之间的观察到的单独的MT4 T细胞的FS / SS型材,单独的PBMC,或共培养物的(A)的比较。由于在大小和粒度的差异,MT4 T细胞可以是从在使用流式细胞仪共培养的PBMC容易辨别。 (B)中的I型干扰素的PBMC的刺激TLR后释放的量的代表性例子7或TLR9激动剂(前),或在共培养与模拟或感染pNL4.3-GFP_ires_Nef WT或dVpu指定的MT4细胞。如图OD原始数据650值及其相应的converseion到I型干扰素的浓度以U表示/毫升。 点击这里查看大图 。
讨论
这里所描述的协议测检测感染了GFP标记的HIV-1病毒仅会有不同的表达VPU能力,在我们最近的一份报告18中描述的T细胞。但是,这些方法可以很容易地进行修改,以研究传感未标记病毒以及缺乏其它病毒基因可能潜在调节先天传感病毒。如果使用不表达GFP的病毒,感染的靶细胞的百分比应通过共同培养,如p24的(衣壳)细胞内染色和流式细胞术或通过p24的ELISA现有的另一种手段来确定。此外,这些协议可以使用不同的靶T细胞在内的各种可用的细胞系和原代细胞。
时相比,用于研究HIV-1的感测方法早在本手稿中描述的方法具有许多优点。首先它已经建立由多个基团的无细胞的HIV-1 P文章是I型干扰素2,13,14不良诱导。此外,早期的研究依赖于较旧的IFNα基于ELISA的方法来量化的I型干扰素的产生量。这种检测技术的局限性是,大多数老IFNαELISA试剂盒仅测量一种类型的IFNα,而忽略了其他类型的IFNα和IFNβ的。使用所描述的报道细胞系的克服了这一限制作为人类I型IFN的所有生物活性形式的浓度可以一次进行测定。该技术是高度敏感的,比新产生的IFN ELISA试剂盒和用于许多捐助者可以很容易地检测出大量的I型干扰素的成本更低。然而,该协议可以很容易地适于与其他的I型干扰素的读出的方法,如ELISA中使用。
关键步骤:重要的是,所有的细胞成分(包括靶和效应)的质量进行严格控制。潜在的污染,即使当asymptomatic,需要被监视和控制。正如我们前面所提到的,抗生素控制无症状细菌污染,以及潜在的其他细胞内病原体如支原体,可以产生类似的免疫应答的那些后HIV-1感染,即生产的I型干扰素的观察。此外,所有的试剂需要自由LPS或其他潜在的内毒素。同样,监测PBMC和的pDCs也是很重要的,因为人类样本通常可以通过底层持续感染,这可能会影响正常传感打底。我们建议总是包括建议的阴性对照,例如没有靶细胞,以及与模拟感染的细胞共培养。受感染的细胞的存活力也是正确的pDC传感自I型干扰素不产生以下共培养细胞凋亡2,14重要。
该技术的一个重要的限制是需要新鲜分离的原代细胞。这一程序是不使用要么以前冻结或保存在培养外周血单个核细胞或pDC的测试。的PBMC的分离是劳动密集型的,并且这些细胞具有非常有限的寿命。此外,虽然与人血液的工作应当用于防止血源性病原体标准协议。经常有变异性的几个来源与工作相关联的涉及新鲜分离的人细胞。其中是实施以分离这些细胞的不同的程序,和从供体到供体中遇到的遗传变异性。而这是不可能的,以避免供体间变异性,使用了建议的阳性对照,如测量响应于TLR7和TLR9的途径已知激动剂,将用于这些实验的一个重要的内部控制。我们观察到,一个强大的响应于TLR9途径的激动剂可以与健康的pDC响应相关联,而一个响应TLR7通路所需的抗HIV-1 3的适当的反应。
根据美国提出的意见和其他2,通常不需要从外周血单个核细胞富集的pDC的。然而,如果实验设计需要时(例如在上下文在需要的特定的pDC表面标志物耗竭)负选择是优选超过正选择,作为细胞选择过程后保持自由的抗体。孤立的pDC进行文化迅速凋亡。对于需要这些细胞的实验是在延长的时间周期中培养,培养基可以补充有IL-3。这种细胞因子诱导的pDC细胞增殖并抑制其凋亡16。然而,IL-3的使用需要被严格控制,因为它可能导致的pDC成熟或分化。
这里所描述的方法结合,以重新创建先天传感期间所涉及的初始步骤的目标HIV-1感染细胞的新鲜分离的PBMC或pDC细胞。这种方法无疑是有益的EXPLOR与HIV感染有关ê早期先天免疫活动。虽然相关协议的目的是测量I型干扰素,他们可以很容易地进行修改,以衡量在识别受感染细胞的pDC细胞释放的其它生物活性分子。这些可包括:III型干扰素(IFN-λ),促炎细胞因子(如TNF-α和IL-6)和趋化因子CXCL10,CCL4,CCL5和17。
致谢
我们感谢E. Massicotte和J.主的过程中流式细胞仪和细胞分选实验,专家技术援助。此外,我们要感谢的红外对抗诊所的工作人员和所有捐助者提供血液样本。外周血样本来自谁签署知情同意书,根据赫尔辛基下批准德研究所15-9诊所RECHERCHES蒙特利尔(IRCM)的研究伦理审查委员会的研究方案宣言健康成年供体。下列试剂是通过美国国立卫生研究院艾滋病试剂计划,艾滋病,NIAID,NIH司获得的:从道格拉斯里奇曼博士的MT4细胞;与人类重组IL-2莫里斯·盖特利博士,霍夫曼 - 罗氏公司
科恩博士是加拿大首席科学家在人类反转录病毒学的收件人。这项工作是由CIHR(CIHR 111226)科恩博士和来自全宗德RECHERCHE魁北克 - 桑特(FRQ-S)艾滋病网络BEGO博士和Cohen博士支持拨款。
材料
| Name | Company | Catalog Number | Comments |
| MT4 cells | NIH AIDS Reagent Program | 120 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: MT-4 from Dr. Douglas Richman. |
| HEK-Blu IFN-α/β reporter cells | Invivogen | HKB-IFNAB | |
| RPMI | Wisent | 350-000-CL | |
| DMEM | Wisent | 319-005-CL | |
| FBS | Wisent | 080-150 | |
| Ficoll-Pâque Plus | Myltenyi | 17-1440-03 | |
| CD4+ T cell isolation kit II | Myltenyi | 130-091-155 | |
| Diamond Plasmacytoid Dendritic Cell Isolation Kit II | Myltenyi | 130-097-240 | |
| PHA-L | Sigma-Aldrich | O2769 | |
| Human rIL-2 | NIH AIDS Reagent Program | 136 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: Human rIL-2 from Dr. Maurice Gately, Hoffmann - La Roche Inc. |
| Imiquimod | Invivogen | TLRL-IMQS | |
| ODN 2216 CpG-A | Hycult Biotec | HC4037 | |
| Human IFNα | PBL Interferon source | 11100-1 | |
| QUANTI-Blue | Cedarlane | REP-QB2 | |
| Flow cytometry (Antibodies/reagents) | |||
| Fc blocking solution (composition below): | Note: make in washing solution (PBS, 5mM EDTA, 5% FBS) | ||
| 10% Goat serum | Sigma-Aldrich | G 9023 | |
| 10% Rabbit serum | Sigma-Aldrich | R 9133 | |
| 10% Mouse serum | Sigma-Aldrich | M 5909 | |
| 2.5 mg/ml human IgG | Sigma-Aldrich | I 4506 | |
| anti-CD3_Pacific Blue | Biolegend | 300417 | |
| anti-CD14_PE-TxRed | Life Technologie | MHCD1417 | |
| anti-BDCA2_APC | Myltenyi | 130-090-905 | |
| anti-ILT7_PE | Biolegend | 326408 | |
| anti-CD4_PerCP/Cy5.5 | Biolegend | 317427 | |
| anti-BST2_Alexa 660 | eBioscience | 50-3179 | |
| Paraformaldehyde | Sigma-Aldrich | P 6148 | |
| Cell strainer | BD Falcon | 352340 | |
| Cyan ADP instrument | Beckman Coulter | CY20030 |
参考文献
- Colonna, M., Trinchieri, G., Liu, Y. J. Plasmacytoid dendritic cells in immunity. Nature immunology. 5, 1219-1226 (2004).
- Lepelley, A., et al. Innate sensing of HIV-infected cells. PLoS pathogens. 7, e1001284 (2011).
- Beignon, A. S., et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor-viral RNA interactions. The Journal of clinical investigation. 115, 3265-3275 (2005).
- Martinelli, E., et al. HIV-1 gp120 inhibits TLR9-mediated activation and IFN-{alpha} secretion in plasmacytoid dendritic cells. Proceedings of the National Academy of Sciences of the United States of America. 104, 3396-3401 (2007).
- Cao, W., et al. Regulation of TLR7/9 responses in plasmacytoid dendritic cells by BST2 and ILT7 receptor interaction. The Journal of experimental medicine. 206, 1603-1614 (2009).
- Bego, M. G., Mercier, J., Cohen, E. A. Virus-activated interferon regulatory factor 7 upregulates expression of the interferon-regulated BST2 gene independently of interferon signaling. Journal of virology. 86, 3513-3527 (2012).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Miyagi, E., Andrew, A. J., Kao, S., Strebel, K. Vpu enhances HIV-1 virus release in the absence of Bst-2 cell surface down-modulation and intracellular depletion. Proceedings of the National Academy of Sciences of the United States of America. 106, 2868-2873 (2009).
- McNatt, M. W., Zang, T., Bieniasz, P. D. Vpu binds directly to tetherin and displaces it from nascent virions. PLoS pathogens. 9, e1003299 (2013).
- Manel, N., et al. A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells. Nature. 467, 214-217 (2010).
- Yan, N., Regalado-Magdos, A. D., Stiggelbout, B., Lee-Kirsch, M. A., Lieberman, J. The cytosolic exonuclease TREX1 inhibits the innate immune response to human immunodeficiency virus type 1. Nature immunology. 11, 1005-1013 (2010).
- Fonteneau, J. F., et al. Human immunodeficiency virus type 1 activates plasmacytoid dendritic cells and concomitantly induces the bystander maturation of myeloid dendritic cells. Journal of virology. 78, 5223-5232 (2004).
- Ankel, H., Capobianchi, M. R., Frezza, F., Castilletti, C., Dianzani, F. Interferon induction by HIV-1-infected cells: a possible role of sulfatides or related glycolipids. Virology. 221, 113-119 (1996).
- Schmidt, B., Ashlock, B. M., Foster, H., Fujimura, S. H., Levy, J. A. HIV-infected cells are major inducers of plasmacytoid dendritic cell interferon production, maturation, and migration. Virology. 343, 256-266 (2005).
- Bego, M. G., Dube, M., Mercier, J., Cohen, E. A. Effect of calcium-modulating cyclophilin ligand on human immunodeficiency virus type 1 particle release and cell surface expression of tetherin. Journal of virology. 83, 13032-13036 (2009).
- Grouard, G., et al. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand. The Journal of experimental medicine. 185, 1101-1111 (1997).
- Fitzgerald-Bocarsly, P., Jacobs, E. S. Plasmacytoid dendritic cells in HIV infection: striking a delicate balance. Journal of leukocyte biology. 87, 609-620 (2010).
- Bego MG, ., Côté, &. #. 2. 0. 1. ;., Aschman, N., Mercier, J., Weissenhorn, W. Cohen ÉA. Exploits the Cross-Talk between BST2 and the ILT7 Receptor to Suppress Anti-HIV-1 Responses by Plasmacytoid Dendritic Cells. PLoS Pathog. 11 (7), e1005024 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。