Method Article
L'évaluation de l'Innate détection du VIH-1 CD4 infectés
Dans cet article
Résumé
Contrairement aux particules du VIH-1 sans cellules, les cellules T CD4 + infectées sont effectivement détectés par des cellules dendritiques plasmacytoïdes (pDC). Ce manuscrit décrit une méthode où les cellules périphériques mononucléaires du sang (PBMC) ou des pDC isolées sont co-cultivées avec le VIH-1 des cellules T infectées par détection d'évaluer innée par les pDC évaluée par la libération de l'IFN de type I.
Résumé
VIH-1 détection innée nécessite un contact direct des cellules T CD4 + infectées avec des cellules dendritiques plasmacytoïdes (pDC). Afin d'étudier ce processus, les protocoles décrits ici utilisent des cellules fraîchement isolées humains périphériques mononucléaires du sang (CMSP) ou des cellules dendritiques plasmacytoïdes (pDC) afin de détecter les infections dans les deux lignée de cellules T (MT4) ou des cellules primaires hétérologues T CD4 +. Afin d'assurer une bonne détection, il est essentiel que les PBMC sont isolés immédiatement après la collecte de sang et que le pourcentage optimal de cellules T infectées sont utilisés. De plus, la coloration multi-paramétrique par cytométrie de flux peut être utilisée pour confirmer que les échantillons de PBMC contiennent les différentes lignées cellulaires à des taux physiologiques. Un certain nombre de commandes peuvent également être inclus pour évaluer la viabilité et la fonctionnalité des pDC. Ceux-ci comprennent la présence de marqueurs de surface spécifiques, l'évaluation de la réponse cellulaire à agoniste connu des récepteurs Toll-like (TLR) voies, et confirmant l'absence de Spontané interféron de type I (IFN) production. Dans ce système, des PBMC fraîchement isolées ou des pDC sont co-cultivées avec des VIH-1 des cellules infectées dans des plaques à 96 puits pour 18 à 22 h. Les surnageants provenant de ces co-cultures sont ensuite utilisées pour déterminer les niveaux d'IFN de type I bioactives en contrôlant l'activation de la voie de ISGF3 dans des cellules HEK-Blue cellules / ß IFN-a. Avant et pendant des conditions de co-culture, les cellules cibles peuvent être soumis à une analyse par cytométrie flux afin de déterminer un certain nombre de paramètres, y compris le pourcentage de cellules infectées, les niveaux de marqueurs de surface spécifiques, et de tuer différentielle des cellules infectées. Bien que, ces protocoles ont été initialement développées pour suivre la production d'IFN de type I, ils pourraient être utilisés pour étudier d'autres molécules Imuno-modulatrices libérés de PDC et pour mieux comprendre les mécanismes moléculaires qui régissent le VIH-1 détection innée.
Introduction
Type I IFN-production pDCs représentent la première ligne de défense contre les infections virales, et en tant que telle servent de lien vital entre l'immunité innée et adaptative 1. Bien que le VIH-1 sans cellule particules sont mal détectées par le système immunitaire inné, cellules T CD4 + HIV-1-infected sont effectivement détectés par les pDC 2. Le mécanisme de détection nécessite un contact initial entre la glycoprotéine d'enveloppe virale (gp120) à la surface de la cellule T infectée et molécules de CD4 sur le contrôleur principal, qui est ensuite suivie de la capture du virus et l'internalisation par les pDC. La reconnaissance ultérieure de transfert ARN VIH-1 par TLR7 déclenche l'activation de la / voie de IRF7 MyD88 et conduit à de type I production d'IFN 3 en fin de compte. Fait important, la seconde voie présente dans pDC de détection, qui est médiée par TLR9, est inhibé par l'interaction de la glycoprotéine virale gp120, avec le PDC spécifique marqueur de surface BDCA2 4.
Les TLR7 et TLR9 voies de détection de pDC peuvent éventuellement être modulés négativement par l'engagement de BST2 (également désigné Tetherin ou CD317) avec un autre inhibiteur de récepteur de surface spécifique pDC-ILT7 5. BST2 est exprimé à des niveaux élevés à la surface des pDC et certaines cellules cancéreuses, mais à des niveaux relativement plus bas à d'autres types de cellules, comme les cellules B, les macrophages et les lymphocytes T. Fait important, BST2 peut être induite par l'IFN de type I dans un certain nombre de lignées de cellules transformées ainsi que dans des cultures de cellules primaires d'origines humaines et murines 6. Outre sa fonction de régulation immunitaire, BST2 a récemment été trouvée pour inhiber la libération de VIH-1 et d'autres particules virales enveloppé par des particules virales naissantes de reticulation sur la surface des cellules infectées 7. Dans le cas du VIH-1, la protéine codée par le virus accessoire U (Vpu) a été représenté à agir comme un antagoniste de BST2. On pense que Vpu BST2 régule à la baisse de la surface cellulaire de cellules VIH-1 infectées par le site de son attacheing activité et par conséquent augmente le dégagement et la propagation virale 7, bien que cette notion a été contestée 8,9. En l'absence de Vpu, un grand nombre de descendants entièrement formés et matures du VIH-1 à particules sont retenues la surface de la cellule. Que ces particules captifs pourraient représenter des cibles efficaces pour la détection immunitaire reste encore une question ouverte. En outre, il est difficile de savoir si Vpu pourrait dysréguler production d'IFN-I Type de pDC par la surface moduler BST2 niveaux.
Les premières études visant à évaluer le VIH-1 de détection ont été menées en utilisant sans cellules du VIH-1 particules, qui sont généralement considérés comme des inducteurs pauvres de type I IFN 3,10-12. Étant donné que les études récentes suggèrent que les CMSP et pDCs détectent efficacement infecté par le VIH lymphocytes T CD4 + 2,13,14, que nous décrivons ici une méthode simple pour mesurer les réponses innées déclenchées par pDCs sur la reconnaissance des cellules VIH-1-infected in vitro.
Protocole
Notes générales
Il est important de garder les cellules en culture sans antibiotique, puisque les infections bactériennes, même contrôlées peuvent être détectées par les CMSP. Cette détection de composants bactériens va induire une production d'interféron de fond qui ne peut être distinguée de celle déclenchée par spécifique du VIH-1 sensible. En outre, toutes les cellules doivent être testés en routine pour l'absence de contamination par des mycoplasmes.
Utilisez toujours des solutions sans endotoxine chaque fois que possible.
Cytométrie en flux caractérisation des différentes cellules pour être utilisé dans les co-cultures (CMSP, pDC, MT4 et des cellules T CD4 +) est une étape facultative, mais fortement recommandée car elle peut fournir de précieuses informations nécessaires pour une interprétation correcte d'une expérience donnée.
1. Préparation des cellules cibles infectées
- Maintenir la lignée cellulaire T CD4 + humains MT4 dans RPMI 1640 mediun supplémenté avec 10% de sérum fœtal bovin (FBS), visé à partir de maintenant que milieu RPMI-1640 complet.
- Isolement de cellules T CD4 + primaires.
- Isoler les cellules mononucléaires du sang périphérique humain par gradient de densité centrifugation.
- Isoler lymphocytes T CD4 + en utilisant un kit de sélection négative des cellules T CD4 +, suivant les recommandations du fabricant.
- Activer les lymphocytes avec PHA-L (5 ug / ml) T CD4 + pendant 48 heures, puis de maintenir les cellules dans du milieu RPMI-1640 complet additionné de IL-2 recombinante (100 U / ml). Infecter les cellules T 5 jours après l'isolement primaire.
- L'infection des cellules cibles (lignée cellulaire MT4 T ou des cellules hétérologues primaires CD4 + T).
- Deux jours avant de co-culture, infecter les cellules T avec virus VIH-1. Dans l'exemple spécifique décrit ici pNL4.3-GFP_ires_Nef type sauvage (WT) ou virus pNL4.3-GFP_ires_Nef delta Vpu (dVpu) ont été utilisés. Ces souches virales représentent green protéine fluorescente (GFP) marqué de clones moléculaires infectieux isogéniques qui diffèrent seulement par leur capacité à exprimer Vpu.
- Utilisez différentes multiplicités d'infection (MOI) et sélectionnez les cultures ayant des niveaux d'infection pour les co-cultures. Le jour de la co-culture, à déterminer le pourcentage de cellules GFP + par cytométrie en flux en tant que marqueur de l'infection. Utilisez uniquement des cultures avec une gamme de 20-50% de cellules infectées pour co-cultures.
Étapes Facultatif: Procédez flux coloration par cytométrie à ce stade d'évaluer l'expression de surface des molécules / ligands d'intérêt tels que BST2, et CD4. Pour la coloration de surface cellulaire, remettre en suspension 0,5 x 10 6 cellules T dans 100 ul de solution de lavage, ajouter 1 pl d'anti-CD4_PerCP / Cy5.5 et 1 ul d'anti-BST2_A660. Incuber les tubes pendant 45 min à 4 ° C, avant de le laver avec de cytométrie de flux de solution de lavage. Si les études visent à évaluer le rôle de Vpu médiation antagonisme BST2, effectuer un VIH-1 particulesdosage de libération à ce moment, comme décrit précédemment 15.
2. Isolement et l'enrichissement des cellules de détection (CMSP entiers ou enrichis pDC)
Remarque: Lorsque CMSP sont utilisés pour la détection, commencer isolement au sein demi-heure après la collecte de sang et de mener en temps opportun. Utilisez CMSP immédiatement pour co-cultures ou l'enrichissement de pDC.
- Isoler les cellules mononucléaires du sang périphérique humain par gradient de densité centrifugation.
Etape facultative: Effectuez multi-paramétrique coloration de la cytométrie de flux pour confirmer que les PBMC fraîchement isolés contiennent les différentes lignées cellulaires à des taux physiologiques. Pour la coloration de surface cellulaire, la remise en suspension de 10 6 cellules PBMC dans 100 ul de solution de blocage Fc, et incuber pendant 15 min à 4 ° C. Après le blocage, ajouter 1 pl de l'anti-CD3_Pacific Bleu (pour les cellules T), 1 pl de l'anti-CD14-PE_Texas rouge (pour les cellules myéloïdes), 4 ul d'anti-BDCA2_APC et 1 pi d'anti-ILT7_PE (pour pDC). Incubertubes pendant 45 min à 4 ° C, avant de les laver avec de cytométrie en flux solution de lavage. - Enrichissez pDCs en utilisant un kit de sélection négative pDC, suivant les recommandations du fabricant. Il est recommandé de travailler vite, garder les cellules du froid, et utiliser des solutions pré-refroidi. Cela permettra d'éviter le bouchage des anticorps sur la surface cellulaire et marquage des cellules non spécifiques tout en assurant l'activité maximale de pDC.
- Effectuer multi-paramétrique analyse de cytométrie de flux des pDC fraîchement isolés pour confirmer la pureté, le pourcentage d'enrichissement, et les quantités relatives de pDC- marqueurs de surface spécifiques (comme ILT7 et BDCA2). Pour la coloration de surface cellulaire, les pDC 4 10 remettre en suspension dans 100 ul de solution de blocage Fc, et incuber pendant 15 min à 4 ° C. Après le blocage, ajouter 1 pl de l'anti-CD3_Pacific Bleu, 1 pl de l'anti-CD14_PE_Texas Rouge, 4 ul d'anti-BDCA2_APC et 1 pi d'anti-ILT7_PE. Incuber les tubes pendant 45 minutes à 4 ° C, avant de le laver avec de cytométrie de flux de solution de lavage (PBS, 5mM d'EDTA, 5% de FBS). Un minimum de 40% de pureté PDC est recommandé (si le matériau de départ a 0,4% pDC, ce serait l'équivalent d'un enrichissement de 100 fois).
3. Co-culture de cellules infectées CD4 + T et les cellules de détection (CMSP entiers ou enrichis pDC)
- Mélanger 220 pi de CMSP (dilué à 850.000 cellules / ml) ou 220 pi de pDC (à une concentration allant de 100.000 à 500.000 cellules / ml) avec 30 pi de cellules infectées T (dilué à 10 6 cellules / ml) par puits dans une plaque de fond en U 96.
- Comme témoins, CMSP de plaque ou PDC et les cellules T seules. Ajuster le volume dans le puits 250 pi avec du milieu RPMI 1640 complet.
- Évaluez les réponses cellulaires aux agoniste connu des voies TLR7 et TLR9. À cette fin, la plaque 220 pl de CMSP (dilué à 850.000 cellules / ml) ou 200 pi de pDC (à une concentration allant de 100.000 à 500.000 cellules / ml) par puits dans un fond en U plaque de 96 puits et ajouter TLR7 agoniste ( Imiquimod, concentration finale: 2,5 ug / ml) ou agoniste TLR9 (ODN CpG-A 2216, concentration finale: 5 uM). Incuber les cellules à 37 ° C et 5% de CO2 pendant 18 à 22 h et de les traiter d'une manière similaire aux co-cultures décrites ci-dessous.
- Incuber co-cultures à 37 ° C et 5% de CO 2 pendant 18-22 h, puis de les transférer à une plaque de 96 puits de V-bas. Centrifuger pendant 5 minutes à 400 x g.
- Transfert surnageants à une plaque bien-fond plat 96. Les surnageants peuvent être stockés à -80 ° C ou utilisés pour la détection d'IFN de type I immédiatement.
- Remettre en suspension les cellules co-cultivées dans du paraformaldehyde à 2% et de les analyser en utilisant la cytométrie en flux. En raison des différences de taille et de granulation, des cellules MT4 sont facilement distingués des CMSP ou pDCs en fonction de leur dispersion latérale (SS) par rapport à l'avant-scatter (FS) profils. Si les cellules T primaires sont utilisées comme cellules cibles infectées, elles peuvent être colorées avec du colorant de traçage quelconque de cellules, par exemple CSFE, de co-culture préalable.
- Mesure de bioactif de type I IFN en utilisant des cellules ß rapporteurs HEK-Bleu IFN-a /.
Note: Ces cellules ont été produites par transfection stable de cellules HEK293 avec les gènes humains IRF9 STAT2 et d'obtenir un type entièrement active I IFN voie de signalisation. Ils contiennent également le gène rapporteur de la phosphatase alcaline sécrétée (SEAP) sous le contrôle de l'IFN-α / ß promoteur inductible ISG54. La stimulation de ces cellules avec l'IFN de type I active la voie JAK / STAT / ISGF3 voie et induit la production de SEAP.- Maintenir des cellules HEK-IFN-α Bleu / ß dans du DMEM supplémenté avec 10% de FBS. Plate eux à une densité de 50.000 cellules par puits dans une plaque à fond plat 96, dans un volume final de 180 pi.
- Ajouter 20 pi de surnageant de co-culture de chaque puits en double. Chaque plaque exige également un ensemble de contrôles internes standard (de l'IFNa humaine, concentration finale de 100 U / ml à 2,500 U / ml). Incuber les plaques à 37 ° C et 5% de CO2 pendant 18-22 H.
- Déterminer les niveaux d'activité de la phosphatase alcaline en utilisant une solution de Quanti-Bleu, qui change du rose au violet / bleu dans la présence de l'enzyme. Préparer QUANTI-Bleu en suivant les recommandations du fabricant. Ajouter 180 pi de cette solution à chaque puits d'une plaque à fond plat 96. Pour chaque puits, ajouter également 20 pl des HEK-IFN-α Bleu / ß cellules surnageants induits, et incuber la plaque dans un incubateur à 37 ° C jusqu'à ce que la couleur se développe dans les puits standards de contrôle IFN.
- Évaluer les niveaux de SEAP l'aide d'un spectrophotomètre à 620-655 nm et déterminer la concentration de type I IFN par extrapolation à partir de la partie linéaire de la courbe standard IFN.
Résultats
Le système de co-culture décrite sur la figure 1 permet une étude contrôlée de détection du VIH-1 inné. En raison de la nature variable des cellules primaires, il est important que les taux normaux de myéloïdes et les cellules T (cellules CD14 + et CD3 +, respectivement) sont observés, comme dans l'exemple représenté sur la figure 2A. En outre, seul un faible nombre de cellules T activées (FS niveaux plus élevés et plus élevés par rapport CD3 de cellules T non activées) sont souhaitables dans les cultures PBMC fraîchement isolées. PBMC avec des rapports anormaux entre les différents types de cellules sont souvent incapables de monter une réponse immunitaire innée approprié in vitro, probablement due à un phénotype déjà activé en tant que conséquence d'une infection en cours. Plus important encore, le pourcentage relatif de pDC doit être évaluée comme illustré dans la figure 2B. Bien que ce pourcentage peut varier de 0,2 à 1,2%, un phénotype anormal de détection est également observée avec les deux extremes de cette gamme. Enrichissement des PDC en utilisant la sélection négative donne souvent 50-95% pDC pureté, comme on le voit dans les deux exemples de la figure 2B (92% et 72%). Un exemple typique pour l'expérience globale est montrée sur les figures 3 et 4. Dans cet exemple, des cellules MT4 ont été infectées avec pNL4.3 GFP_ires_Nef-WT ou delta Vpu infection pour atteindre 30% au moment de la co-culture (figure 3A). Comme décrit précédemment, uniquement les infections par le virus WT donné lieu à une régulation à la baisse significative de BST2 de surface (Figure 3B). En raison de leurs différences de taille et la granularité, des cellules MT4 peuvent être facilement distingués des PBMC par cytométrie de flux (Figure 4A). Après l'incubation de co-culture, seuls les CMSP en contact avec connue TLR7 ou TLR9 agoniste et CMSP en contact avec le VIH-1 quantités importantes cellules infectées libérés de type I IFN (figure 4B). N IFN a été détecté dans des PBMC seul, dans les CMSP cu co-ltured avec des cellules MT4 pseudo-infectées ou dans les cellules MT4 infectées seulement de (figure 4B). Dans l'exemple présenté ici, la détection inné de cellules MT4 VIH-1 infectées par des PBMC a été trouvé être sensiblement réduite en présence de Vpu.
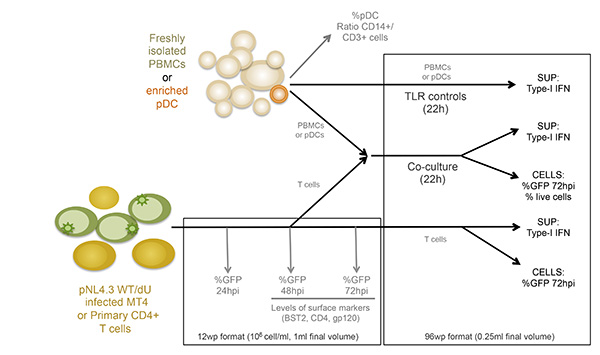
Figure 1:. Aperçu schématique de la conception expérimentale SUP: surnageant Cliquez ici pour agrandir l'image.
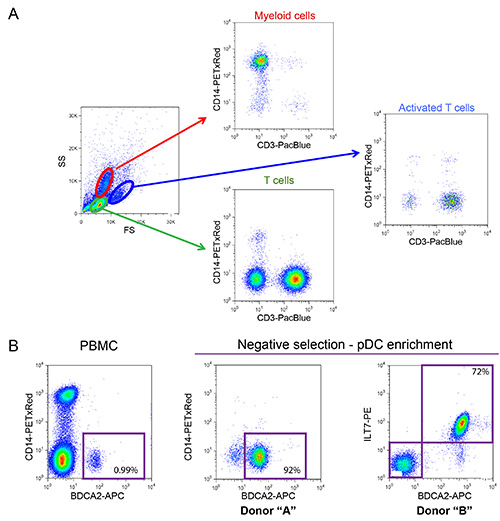
Figure 2: La caractérisation phénotypique des CMSP et enr fraîchement isoléspDCs iched. (A) de la distribution normale des cellules myéloïdes et les cellules T observées dans les CMSP isolées à partir d'un donneur sain (Pourcentage de cellules myéloïdes devraient varier entre 10-20% et les cellules T comprise entre 55-65%). Échantillon PBMC ont été colorées en utilisant des anticorps conjugués à un fluorophore qui reconnaissent CD14 de surface (marqueur de lignée myéloïde) et CD3 (marqueur des cellules T). (B) de la caractérisation phénotypique des PDC. Avant pDC enrichissement représentent entre 0,2 à 1,2% du nombre total de cellules dans les PBMC (0,99% dans l'exemple représenté). Ces cellules peuvent être identifiées sur la base de l'expression de marqueurs spécifiques tels que BDCA2 et ILT7, présents à la surface cellulaire. La sélection négative peut être utilisé pour enrichir de manière significative le nombre de PDC et d'éliminer les contaminations potentiellement nuisibles, tels que CD14 + cellules myéloïdes (enrichissement atteignant 92% et 72% dans les deux exemples représentés). Click ici pour agrandir l'image.
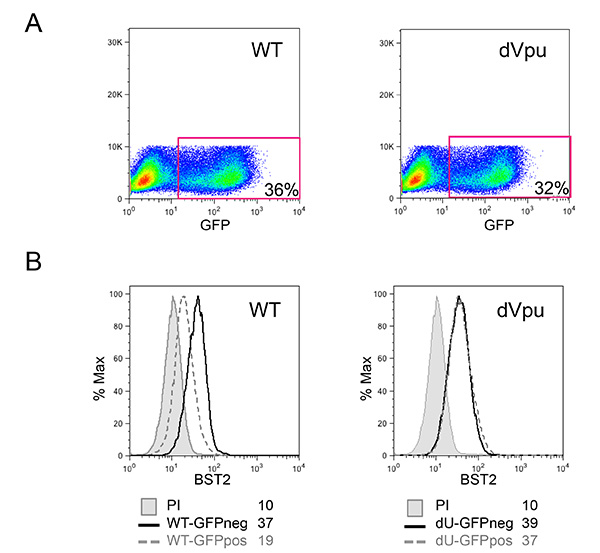
Figure 3:. Caractérisation des cellules MT4 cibles HIV-1-infected (A) Pourcentage de cellules infectées dans les cultures de MT4 infectées par pNL4.3 GFP_ires_Nef-WT ou dVpu tel que déterminé par le pourcentage de cellules GFP-positives. (B) les cellules de surface BST2 expression dans les cellules infectées a été évaluée après coloration de surface. Les histogrammes gris rempli représentent des cellules pseudo-infectées colorées avec du sérum de lapin pré-immun (témoin non coloré); les histogrammes restants représentent cellules colorées avec anti-BST2 sérum polyclonal de lapin. Histogrammes avec des lignes pleines représentent contrôle négatif de la GFP (neg) des cellules; tout en histogrammes avec pointillés correspondent à (POS) des cellules infectées GFP positives. Grippe moyennel'intensité de orescence (IMF) valeurs sont indiquées pour chaque échantillon. La cytométrie en flux a été réalisée et analysée comme décrit dans la figure 2. Cliquez ici pour agrandir l'image.
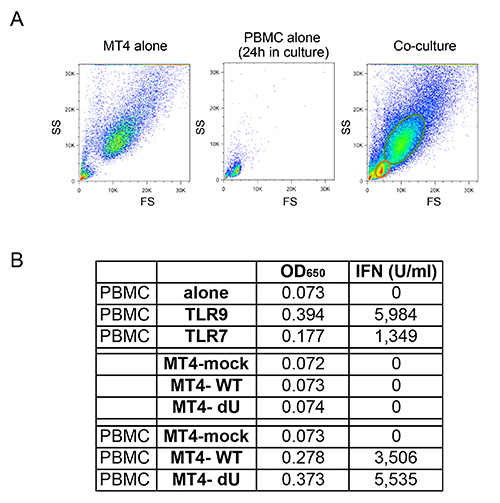
Figure 4:. Co culture des PBMC fraîchement isolés et des cellules MT4 infectées T (A) Comparaison de cytométrie en flux profils FS / SS observés pour les cellules MT4 T seul, seul CMSP, ou co-cultures entre les CMSP et des cellules MT4 T. En raison des différences de taille et de granularité, les cellules MT4 T peuvent être facilement distingués des CMSP en co-cultures en utilisant la cytométrie de flux. (B) d'un exemple représentatif de la quantité de type I IFN libéré après stimulation de PBMC avec TLR7 ou TLR9 agoniste (il ya), ou après co-cultures avec maquette ou les cellules MT4 indiqués infectées par pNL4.3-GFP_ires_Nef WT ou dVpu. Les données brutes présentés comme OD 650 valeurs et de leur converseion correspondant au type I IFN concentration exprimée en U / ml. Cliquez ici pour agrandir l'image.
Discussion
Les protocoles décrits ici mesurent détection de cellules T infectées par le GFP-tagged virus VIH-1 qui diffèrent seulement par leur capacité à exprimer Vpu, comme décrit dans notre récent rapport 18. Cependant, ces méthodes pourraient facilement être modifiés pour étudier détection de virus non marqués ainsi que les virus dépourvus d'autres gènes viraux qui pourraient moduler détection innée. Si les virus utilisés ne pas exprimer la GFP, le pourcentage de cellules cibles infectées doivent être déterminés par un autre moyen avant la co-culture, comme p24 (capside) coloration intracellulaire et cytométrie en flux ou par ELISA p24. Par ailleurs, ces protocoles peuvent être utilisés avec différentes cellules T cibles, y compris une variété de lignées cellulaires et des cellules primaires disponibles.
Les méthodes décrites dans ce manuscrit ont un certain nombre d'avantages par rapport aux premières méthodes utilisées pour étudier le VIH-1 de détection. Tout d'abord, il a été établi par un certain nombre de groupes que acellulaire VIH-1 pdes articles sont des inducteurs pauvres de type I IFN 2,13,14. En outre, les premières études comptaient sur les méthodes basées sur ELISA IFNa âgés de quantifier la quantité de type I IFN produit. Une limitation de cette technique de détection est que la plupart des kits ELISA IFNa âgés seule mesure un type d'IFNa, tout en donnant sur les autres types de IFNa et IFNß. L'utilisation des lignées de cellules rapporteurs décrits surmonte cette limitation que la concentration de toutes les formes bioactives de IFN humains de type I peut être mesurée à la fois. La technique est très sensible, moins cher que la nouvelle génération de kit ELISA IFN et pour de nombreux donateurs de grandes quantités d'IFN de type I peuvent être facilement détectés. Néanmoins, ce protocole peut être facilement adapté pour une utilisation avec d'autres type I IFN méthodes de lecture tels que ELISA.
Les étapes critiques: Il est important que la qualité de tous les composants cellulaires (deux cibles et effecteurs) être étroitement contrôlée. Contamination potentielle, même lorsque asympmatique, doit être surveillée et contrôlée. Comme nous l'avons mentionné précédemment, antibiotiques contrôlé contamination bactérienne asymptomatique, et potentiellement d'autres pathogènes intracellulaires tels que les mycoplasmes, peut générer des réponses immunitaires similaires à ceux observés après infection VIH-1, à savoir la production d'IFN de type I. En outre, tous les réactifs doivent être libres de LPS ou d'autres endotoxines potentiels. De même, le suivi des CMSP et pDC est également important car les échantillons humains peuvent souvent être amorcés par des infections en cours sous-jacents, qui peuvent affecter la détection normale. Nous vous recommandons de toujours, y compris les contrôles négatifs proposées, telles l'absence de cellules cibles ainsi que les co-cultures avec des cellules pseudo-infectées. La viabilité des cellules infectées est également important pour une détection correcte pDC depuis l'IFN de type I ne se produit après co-culture avec des cellules apoptotiques 2,14.
Une limitation importante de la technique est la nécessité pour les cellules primaires fraîchement isolées. Cette procédure n'a pas ététesté en utilisant CMSP ou pDCs qui ont été soit préalablement congelés ou maintenues en culture. L'isolement des PBMC est de main-d'oeuvre et ces cellules ont une durée de vie très limitée. En outre, des protocoles standards pour la protection contre les agents pathogènes transmissibles par le sang devraient être utilisées tout en travaillant avec du sang humain. Il ya souvent plusieurs sources de variabilité associées au travail impliquant des cellules humaines fraîchement isolées. Parmi eux se trouvent les différentes procédures mises en œuvre pour isoler ces cellules, et la variabilité hérité rencontrées du donneur à donneur. Bien qu'il soit impossible d'éviter la variabilité entre les bailleurs de fonds, l'utilisation des contrôles positifs proposées, telles que la mesure réponse à des agonistes connus de TLR7 et TLR9 voies, serait de fournir un contrôle interne important pour ces expériences. Nous avons observé qu'une réponse robuste à des agonistes TLR9 de la voie pourrait être corrélée avec une réponse pDC en bonne santé, tandis qu'une voie TLR7 sensibles est nécessaire pour une bonne réponse contre le VIH-1 3.
Basé sur les observations faites par les États-Unis et d'autres 2, l'enrichissement des PDC à partir de PBMC est souvent pas nécessaire. Toutefois, si le protocole expérimental l'exige (par exemple dans le contexte où l'épuisement des marqueurs spécifiques de la surface est nécessaire pDC) sélection négative est préférable à une sélection positive, les cellules restent libres de l'anticorps après le processus de sélection. PDCs isolés apoptose rapide dans la culture. Pour les expériences qui ont besoin de ces cellules à cultiver pendant une période de temps prolongée, les milieux de culture peuvent être complétés avec de l'IL-3. Cette cytokine induit pDC prolifération et l'apoptose inhibe leur 16. Cependant, l'IL-3 utilisation doit être étroitement contrôlé car il peut conduire à la maturation des pDC ou la différenciation.
La méthode décrite ici combine cible du VIH-1 des cellules infectées avec CMSP ou pDCs fraîchement isolés afin de recréer les étapes initiales impliqués pendant la détection innée. Cette méthode sera sans doute utile de Explore événements immunitaires innées précoces associés à l'infection à VIH. Bien que les protocoles associés visent à mesurer l'IFN de type I, ils pourraient facilement être modifiés pour mesurer d'autres molécules bioactives libérées de pDC lors de la reconnaissance des cellules infectées. Celles-ci peuvent inclure: l'IFN de type III (IFN-λ), cytokines pro-inflammatoires (telles que le TNF-α et IL-6) et le chimiokines CXCL10, CCL4, CCL5 et 17.
Remerciements
Nous remercions E. et J. Massicotte Seigneur pour l'assistance technique d'experts lors de la cytométrie de flux et les expériences de triage des cellules. Aussi, nous tenons à remercier le personnel de la clinique de l'IRCM et tous les donateurs pour fournir des échantillons de sang. Échantillons de sang périphérique ont été obtenus à partir de donneurs adultes en bonne santé qui ont donné leur consentement écrit conformément à la Déclaration d'Helsinki le cadre de protocoles de recherche approuvés par l'éthique de la recherche Conseil de l'Institut de recherches cliniques de Montréal (IRCM). Les réactifs suivants ont été obtenus grâce au Programme Réactif NIH sida, Division du sida, NIAID, NIH: cellules MT4 du Dr Douglas Richman; et rIL-2 humaine du Dr Maurice Gately, Hoffmann - La Roche Inc.
Dr Cohen est le récipiendaire de la Chaire de recherche du Canada en rétrovirologie humaine. Ce travail a été financé par des subventions de l'IRSC (111226) au Dr Cohen et du Fonds de recherche du Québec-Santé (FRQ-S) réseau SIDA Dr Bego et le Dr Cohen.
matériels
| Name | Company | Catalog Number | Comments |
| MT4 cells | NIH AIDS Reagent Program | 120 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: MT-4 from Dr. Douglas Richman. |
| HEK-Blu IFN-α/β reporter cells | Invivogen | HKB-IFNAB | |
| RPMI | Wisent | 350-000-CL | |
| DMEM | Wisent | 319-005-CL | |
| FBS | Wisent | 080-150 | |
| Ficoll-Pâque Plus | Myltenyi | 17-1440-03 | |
| CD4+ T cell isolation kit II | Myltenyi | 130-091-155 | |
| Diamond Plasmacytoid Dendritic Cell Isolation Kit II | Myltenyi | 130-097-240 | |
| PHA-L | Sigma-Aldrich | O2769 | |
| Human rIL-2 | NIH AIDS Reagent Program | 136 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: Human rIL-2 from Dr. Maurice Gately, Hoffmann - La Roche Inc. |
| Imiquimod | Invivogen | TLRL-IMQS | |
| ODN 2216 CpG-A | Hycult Biotec | HC4037 | |
| Human IFNα | PBL Interferon source | 11100-1 | |
| QUANTI-Blue | Cedarlane | REP-QB2 | |
| Flow cytometry (Antibodies/reagents) | |||
| Fc blocking solution (composition below): | Note: make in washing solution (PBS, 5mM EDTA, 5% FBS) | ||
| 10% Goat serum | Sigma-Aldrich | G 9023 | |
| 10% Rabbit serum | Sigma-Aldrich | R 9133 | |
| 10% Mouse serum | Sigma-Aldrich | M 5909 | |
| 2.5 mg/ml human IgG | Sigma-Aldrich | I 4506 | |
| anti-CD3_Pacific Blue | Biolegend | 300417 | |
| anti-CD14_PE-TxRed | Life Technologie | MHCD1417 | |
| anti-BDCA2_APC | Myltenyi | 130-090-905 | |
| anti-ILT7_PE | Biolegend | 326408 | |
| anti-CD4_PerCP/Cy5.5 | Biolegend | 317427 | |
| anti-BST2_Alexa 660 | eBioscience | 50-3179 | |
| Paraformaldehyde | Sigma-Aldrich | P 6148 | |
| Cell strainer | BD Falcon | 352340 | |
| Cyan ADP instrument | Beckman Coulter | CY20030 |
Références
- Colonna, M., Trinchieri, G., Liu, Y. J. Plasmacytoid dendritic cells in immunity. Nature immunology. 5, 1219-1226 (2004).
- Lepelley, A., et al. Innate sensing of HIV-infected cells. PLoS pathogens. 7, e1001284 (2011).
- Beignon, A. S., et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor-viral RNA interactions. The Journal of clinical investigation. 115, 3265-3275 (2005).
- Martinelli, E., et al. HIV-1 gp120 inhibits TLR9-mediated activation and IFN-{alpha} secretion in plasmacytoid dendritic cells. Proceedings of the National Academy of Sciences of the United States of America. 104, 3396-3401 (2007).
- Cao, W., et al. Regulation of TLR7/9 responses in plasmacytoid dendritic cells by BST2 and ILT7 receptor interaction. The Journal of experimental medicine. 206, 1603-1614 (2009).
- Bego, M. G., Mercier, J., Cohen, E. A. Virus-activated interferon regulatory factor 7 upregulates expression of the interferon-regulated BST2 gene independently of interferon signaling. Journal of virology. 86, 3513-3527 (2012).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Miyagi, E., Andrew, A. J., Kao, S., Strebel, K. Vpu enhances HIV-1 virus release in the absence of Bst-2 cell surface down-modulation and intracellular depletion. Proceedings of the National Academy of Sciences of the United States of America. 106, 2868-2873 (2009).
- McNatt, M. W., Zang, T., Bieniasz, P. D. Vpu binds directly to tetherin and displaces it from nascent virions. PLoS pathogens. 9, e1003299 (2013).
- Manel, N., et al. A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells. Nature. 467, 214-217 (2010).
- Yan, N., Regalado-Magdos, A. D., Stiggelbout, B., Lee-Kirsch, M. A., Lieberman, J. The cytosolic exonuclease TREX1 inhibits the innate immune response to human immunodeficiency virus type 1. Nature immunology. 11, 1005-1013 (2010).
- Fonteneau, J. F., et al. Human immunodeficiency virus type 1 activates plasmacytoid dendritic cells and concomitantly induces the bystander maturation of myeloid dendritic cells. Journal of virology. 78, 5223-5232 (2004).
- Ankel, H., Capobianchi, M. R., Frezza, F., Castilletti, C., Dianzani, F. Interferon induction by HIV-1-infected cells: a possible role of sulfatides or related glycolipids. Virology. 221, 113-119 (1996).
- Schmidt, B., Ashlock, B. M., Foster, H., Fujimura, S. H., Levy, J. A. HIV-infected cells are major inducers of plasmacytoid dendritic cell interferon production, maturation, and migration. Virology. 343, 256-266 (2005).
- Bego, M. G., Dube, M., Mercier, J., Cohen, E. A. Effect of calcium-modulating cyclophilin ligand on human immunodeficiency virus type 1 particle release and cell surface expression of tetherin. Journal of virology. 83, 13032-13036 (2009).
- Grouard, G., et al. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand. The Journal of experimental medicine. 185, 1101-1111 (1997).
- Fitzgerald-Bocarsly, P., Jacobs, E. S. Plasmacytoid dendritic cells in HIV infection: striking a delicate balance. Journal of leukocyte biology. 87, 609-620 (2010).
- Bego MG, ., Côté, &. #. 2. 0. 1. ;., Aschman, N., Mercier, J., Weissenhorn, W. Cohen ÉA. Exploits the Cross-Talk between BST2 and the ILT7 Receptor to Suppress Anti-HIV-1 Responses by Plasmacytoid Dendritic Cells. PLoS Pathog. 11 (7), e1005024 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon