Method Article
Avaliando a inata Sensing de HIV-1 CD4 Infected
Neste Artigo
Resumo
Ao contrário de partículas de HIV-1 livre de células, as células T CD4 + infectadas são eficazmente detectada pelas células dendríticas plasmocitoides (PDCs). Este manuscrito descreve um método em que as células mononucleares do sangue periférico (PBMCs) ou pDCs isoladas são co-cultivadas com o HIV-1 de células T infectadas para avaliar a detecção inata por pDCs como avaliada por libertação de IFN tipo I.
Resumo
HIV-1 inato de detecção requer o contacto directo das células T CD4 + infectadas com células dendríticas plasmocitoides (PDCs). Para estudar este processo, os protocolos aqui descritos utilização de células isoladas de fresco mononucleares de sangue periférico (PBMC) ou células dendríticas plasmocitoides (PDCs) para detectar infecções em nenhuma das linhas de células T (MT4) ou células T CD4 + primárias heterólogos. A fim de garantir uma detecção adequada, é essencial que as PBMC são isoladas imediatamente após a recolha de sangue e esta percentagem óptima de células T infectadas são utilizados. Além disso, a coloração de multi-paramétrico de citometria de fluxo pode ser utilizado para confirmar que contêm as amostras de PBMC diferentes linhagens celulares em proporções fisiológicas. Um certo número de controlos, também pode ser incluída para avaliar a viabilidade e a funcionalidade das PDC. Estes incluem, a presença de marcadores de superfície específicos, para avaliar as respostas celulares agonista conhecido de Toll-like receptors (TLR) vias, e confirmando a falta de sponsimultânea tipo I interferon (IFN) de produção. Neste sistema, PBMCs isoladas de fresco ou pDCs são co-cultivadas com o HIV-1 em células infectadas placas de 96 cavidades durante 18-22 hr. Os sobrenadantes destas co-culturas são então utilizadas para determinar os níveis de IFN de tipo I bioactivos através da monitorização da activação da via em células ISGF3 / p IFN-a HEK-Blue. Antes e durante condições de co-cultura, as células alvo podem ser submetidos a análise citométrica de fluxo para determinar um número de parâmetros, incluindo a percentagem de células infectadas, os níveis de marcadores de superfície específicos, e diferencial a morte de células infectadas. Embora, estes protocolos foram desenvolvidos inicialmente para acompanhar a produção do tipo I IFN, eles poderiam potencialmente ser usado para estudar outras moléculas imuno-moduladores liberados de pDCs e obter mais conhecimentos sobre os mecanismos moleculares que regulam HIV-1 sensoriamento inata.
Introdução
Tipo I IFN-produzindo pDCs representam a primeira linha de defesa contra infecções virais, e, como tal, servir como um elo vital entre a imunidade inata e adaptativa 1. Enquanto as partículas de HIV-1 livre de células são fracamente detectada pelo sistema imune inato, células T CD4 + pelo HIV-1 infectadas são eficazmente detectada por pDCs 2. O mecanismo de detecção requer um contacto inicial entre a glicoproteína do envelope viral (gp 120) na superfície da célula T infectada e moléculas CD4 no PDC, que é então seguido pela captura do vírus e a internalização pela PDC. Reconhecimento subsequente do transferida HIV-1 RNA por TLR7 desencadeia a activação do Myd88 / via IRF7 e leva a um tipo I a produção de IFN 3. Importante, a segunda via de detecção presentes em pDCs, que é mediada por TLR9, é inibida pela interacção da glicoproteína virai, a gp120, com o marcador de superfície específico pDC-BDCA2 4.
As TLR7 e TLR9 detecção vias de pDC pode, potencialmente, ser modulada negativamente pela contratação de BST2 (também designado Tetherin ou CD317) com outro receptor inibitório superfície pDC específico chamado ILT7 5. BST2 é expresso em níveis elevados na superfície das PDC e algumas células cancerosas, mas a níveis relativamente baixos em outros tipos de células, tais como células B, macrófagos e células T. Importante, BST2 pode ser induzida por IFN tipo I em um número de linhas de células transformadas, bem como em culturas de células primárias de origens humanas e murinas 6. Para além da sua função imunitária reguladora, BST2 foi recentemente encontrada para inibir a libertação de VIH-1 e outra envolto partículas virais por partículas virais nascentes de ligação cruzada sobre a superfície da célula infectada 7. No caso do HIV-1, a proteína codificada por vírus acessório L (Vpu) foi mostrado que actua como um antagonista BST2. Acredita-se que regula negativamente Vpu BST2 a partir da superfície celular de células com HIV-1 infectadas, o local da sua cordaing atividade e como resultado aumenta a liberação viral e se espalhar 7, embora esta noção tem sido contestada 8,9. Na ausência de Vpu, um grande número de completamente formado e da progenia de HIV-1 maduro partículas são retidas na superfície da célula. Se estas partículas cativos poderiam representar alvos eficazes para detecção imunológico ainda permanece uma questão em aberto. Além disso, não está claro se Vpu poderia desregular a produção de IFN-I tipo de pDCs modulando superfície BST2 níveis.
Os primeiros estudos concebidos para avaliar o HIV-1 de detecção foram realizadas utilizando partículas de HIV-1 livre de células, que são geralmente considerados pobres indutores de IFN tipo I 3,10-12. Dado que os estudos recentes sugerem que PBMCs e pDCs detectar eficientemente linfócitos infectados pelo HIV-T CD4 + 2,13,14, descreve-se aqui um método simples para medir as respostas inatas pDCs desencadeadas por cima do reconhecimento de células com HIV-1 infectadas in vitro.
Protocolo
Notas gerais
É importante manter as células em cultura sem nenhum antibiótico, uma vez que as infecções bacterianas podem ser ainda controlados detectada por PBMC. Tal detecção de componentes bacterianos irá induzir um interferão fundo de produção que não podem ser distinguidas das que desencadeada por específica de HIV-1 de detecção. Além disso, todas as células têm de ser rotineiramente testadas quanto à ausência de contaminação por micoplasma.
Sempre use soluções livres de endotoxinas sempre que possível.
Por citometria de fluxo caracterização das diferentes células para ser utilizado no processo de co-culturas (PBMC, pDCs, MT4 e células T CD4 +) é um passo opcional, mas altamente recomendada uma vez que pode fornecer informação valiosa necessária para uma interpretação correcta de uma dada experiência.
1. Preparação de células alvo infectadas
- Manter a linha de células CD4 + T humana MT4 em RPMI 1640 medium suplementado com soro fetal bovino a 10% (FBS), a partir de agora referido como RPMI-1640 completo.
- Isolamento de células T CD4 + primárias.
- Isolar as células mononucleares a partir de sangue periférico humano por centrifugação em gradiente de densidade.
- Isolar linfócitos T CD4 + usando um kit de selecção negativa de células T CD4 +, seguindo as recomendações do fabricante.
- Activam linfócitos T CD4 + com PHA-G (5 ug / ml) durante 48 hr e, em seguida, se manter as células em meio RPMI-1640 completo suplementado com IL-2 recombinante (100 U / mL). Primária infectar células T 5 dias após o isolamento.
- A infecção de células alvo (linha celular MT4 T ou células T CD4 + primárias heterólogos).
- Dois dias antes do co-cultura, infectar as células T com vírus HIV-1. No exemplo específico descrito aqui foram usadas pNL4.3-GFP_ires_Nef tipo selvagem (WT) ou pNL4.3-GFP_ires_Nef delta Vpu (dVpu) vírus. Estas estirpes virais representam green proteína fluorescente (GFP) -marked clones moleculares infecciosos isogênicas que diferem apenas na sua capacidade de expressar Vpu.
- Use diferentes multiplicidades de infecção (MOI) e selecione culturas com níveis semelhantes de infecção para co-culturas. O dia da co-cultura, determinar a percentagem de GFP + células por citometria de fluxo como marcador de infecção. Utilize apenas as culturas com uma gama de 20-50% de células infectadas para co-culturas.
Passos opcionais: Execute citometria de fluxo coloração neste momento para avaliar a expressão de moléculas de superfície / ligantes de interesse, como BST2, e CD4. Para a coloração da superfície celular, ressuspender 0,5 x 10 6 células T em 100 ul de solução de lavagem, adicionar 1 ml de anti-CD4_PerCP / Cy5.5 e 1 uL de anti-BST2_A660. Incubar os tubos durante 45 min a 4 ° C, antes de lavar com citometria de fluxo da solução de lavagem. Se os estudos visam avaliar o papel do antagonismo BST2 Vpu-mediada, executar uma HIV-1 partículaensaio de libertação neste momento como previamente descrito 15.
2. Isolamento e Enriquecimento de células (PBMC Sentindo inteiras ou pDCs enriquecido)
Nota: Quando as PBMC são usadas para a detecção, isolamento começar dentro de meia hora após a coleta de sangue e conduzi-la em tempo hábil. Use PBMC imediatamente para colegas de culturas ou pDC enriquecimento.
- Isolar as células mononucleares a partir de sangue periférico humano por centrifugação em gradiente de densidade.
Etapa opcional: Execute coloração multi-paramétrico de citometria de fluxo para confirmar que os PBMC isolados de fresco contêm as diferentes linhagens celulares em razões fisiológicas. Para a coloração da superfície celular, ressuspender 10 6 PBMC em 100 ul de solução de bloqueio de Fc, e incubar durante 15 min a 4 ° C. Após o bloqueio, adicionar 1 ul de anti-CD3_Pacific azul (para células T), 1 uL de anti-CD14-PE_Texas Red (para células mielóides), 4 ul de anti-BDCA2_APC e 1 uL de anti-ILT7_PE (por pDCs). Incubaros tubos durante 45 min a 4 ° C, antes da lavagem com citometria de fluxo da solução de lavagem. - Enriqueça pDCs usando um kit de seleção negativa pDC, seguindo as recomendações do fabricante. Recomenda-se rapidamente ao trabalho, manter as células frio, e usar soluções pré-arrefecida. Isto impedirá que o capeamento de anticorpos na superfície da célula e rotulagem de células não-específica, bem como assegurar a actividade máxima pDC.
- Realizar análise de citometria de fluxo multi-paramétrica dos pDCs recentemente isolados para confirmar a pureza, a percentagem de enriquecimento, e quantidades relativas de pdc- marcadores de superfície específica (como ILT7 e BDCA2). Para a coloração da superfície celular, ressuspender 10 4 pDCs em 100 ul de solução de bloqueio de Fc, e incubar durante 15 min a 4 ° C. Após o bloqueio, adicionar 1 ml de anti-CD3_Pacific Azul, 1 jul de anti-CD14_PE_Texas Vermelho, 4 jul de anti-BDCA2_APC e 1 ml de anti-ILT7_PE. Incubar os tubos durante 45 min a 4 ° C, antes de lavar com citometria de fluxo da solução de lavagem (PBS, 5mM de EDTA, 5% de FBS). Um mínimo de 40% de pureza PDC é recomendado (se o material de partida tem 0,4% pdc e isso seria equivalente a um enriquecimento de 100 vezes).
3. Co-cultura de células infectadas T CD4 + e sensoriamento células (PBMC inteiras ou pDCs enriquecido)
- Misturar 220 mL de PBMC (diluído a 850.000 células / ml) ou 220 ul de pDCs (a uma concentração variando de 100.000 a 500.000 células / ml) com 30 ul de células T infectadas (diluído a 10 6 células / ml) por poço em um U-bottom placa de 96 poços.
- Como controlos, as CMSPs de placa ou pDCs e células T isoladamente. Ajustar o volume no poço para 250 ul com meio RPMI 1640 completo.
- Avaliar respostas celulares ao agonista conhecido da via de TLR7 e TLR9. Para este fim, placa 220 uL de PBMC (diluído a 850.000 células / ml) ou 200 ul de pDCs (a uma concentração variando de 100.000 a 500.000 células / ml) por poço em uma de fundo em U de 96 poços e adicionar TLR7 agonista ( Imiquimod, concentração final: 2,5 ug / ml) ou TLR9 agonista (ODN CpG-A 2216, concentração final: 5 uM). Incubar as células a 37 ° C e 5% de CO 2 durante 18-22 horas e processá-los de um modo semelhante às co-culturas descritas abaixo.
- Incubar co-culturas a 37 ° C e 5% de CO 2 durante 18-22 horas, e, em seguida, transferi-los para um fundo em V de 96 poços. Centrifugar durante 5 minutos a 400 x g.
- Transfira os sobrenadantes para uma de fundo plano de 96 poços. Os sobrenadantes podem ser armazenadas a -80 ° C ou usado para a detecção de IFN tipo I imediatamente.
- Ressuspender as células co-cultivadas em 2% de paraformaldeído e analisadas utilizando citometria de fluxo. Devido a diferenças de tamanho e de granulação, células MT4 são facilmente distinguidos dos PBMC ou pDCs com base em seu lado de dispersão (SS) versus a frente-de dispersão (FS) perfis. Se as células T primárias são utilizadas como células alvo infectadas, estas podem ser marcadas com qualquer corante rastreador de células, tais como CSFE, antes da co-cultura.
- Medição de bioactivo do tipo I IFN, utilizando células HEK repórter de p-Azul IFN-a /.
Nota: Estas células foram geradas por transfecção estável de células HEK293 com os genes STAT2 e IRF9 humanos para se obter um tipo totalmente activo I IFN via de sinalização. Eles também contêm o gene repórter de fosfatase alcalina segregada (SEAP), sob o controlo do IFN-α / p promotor indutível ISG54. A estimulação destas células com IFN tipo I activa a via JAK / STAT / ISGF3 via e induz a produção de SEAP.- Manter as células HEK-Azul de IFN-α / p em DMEM suplementado com FBS a 10%. Placa-los a uma densidade de 50.000 células por cavidade em uma de fundo plano de 96 poços, num volume final de 180 ul.
- Adicionar 20 ul de co-cultura sobrenadante de cada poço em duplicado. Cada chapa também requer um conjunto de controlos do padrão interno (IFNa humano, concentração final de 100 U / ml a 2500 U / mL). Incubar as placas a 37 ° C e 5% de CO 2 durante 18Hr -22.
- Determinar os níveis de actividade da fosfatase alcalina utilizando uma solução de quanti-azul, o qual muda de cor de rosa a violeta / azul na presença da enzima. Prepare QUANTI Azul seguir as recomendações do fabricante. Adicionar 180 ul desta solução para cada poço de um de fundo plano de 96 poços. Para cada poço também adicionar 20 ul das células sobrenadantes de células HEK-Azul de IFN-α / p induzidas, e incuba-se a placa numa incubadora a 37 ° C até que a cor se desenvolve nos poços de padrão IFN de controlo.
- Avaliar os níveis de SEAP, utilizando um espectrofotómetro a 620-655 nm, e determinar a concentração de IFN tipo I, por extrapolação a partir da parte linear da curva padrão de IFN.
Resultados
O sistema de co-cultura descrito na Figura 1 permite para um estudo controlado de VIH-1 de detecção inata. Devido à natureza variável das células primárias, é importante que a proporção normal de células T e mielóide (CD14 + respectivamente e CD3 +) são observados, tal como no exemplo mostrado na Figura 2A. Além disso, apenas um reduzido número de células T activadas (FS mais elevados e níveis mais elevados CD3, em comparação com células não-T activadas) são desejáveis nas culturas PBMC isolados de fresco. PBMC com relações anormais entre os vários tipos de células são muitas vezes incapazes de montar uma resposta imune inata adequada in vitro, provavelmente devido a um fenótipo já activada em consequência de uma infecção em curso. Mais importante ainda, a percentagem relativa de pDCs precisa de ser avaliada como se mostra na Figura 2B. Embora esta percentagem pode variar entre 0,2 e 1,2%, de um fenótipo de detecção anormal também é observada tanto com extremes desta gama. Enriquecimento de pDCs utilizando selecção negativa muitas vezes produz 50-95% pDC pureza, como pode ser visto nos dois exemplos a partir da Figura 2B (92% e 72%). Um exemplo prototípico para a experiência geral é mostrado nas Figuras 3 e 4. Neste exemplo, as células MT4 foram infectadas com pNL4.3 GFP_ires_Nef-WT ou delta Vpu para alcançar infecção de 30% no momento da co-cultura (Figura 3A). Como descrito anteriormente, apenas as infecções com vírus WT resultou numa regulação negativa significativa de BST2 superfície (Figura 3B). Devido às suas diferenças em tamanho e granularidade, as células MT4 podem ser facilmente distinguidos dos PBMC por citometria de fluxo (Figura 4A). Após a incubação de co-cultura, apenas as CMSPs em contacto com o conhecido agonista de TLR7 e TLR9 ou PBMC em contacto com HIV-1 libertadas quantidades significativas de células infectadas de tipo I IFN (Figura 4B). Não foi detectada IFN em PBMC por si só, em CMSPs de co-cultured com células MT4 não infectadas, ou em células MT4 infectadas por si só (Figura 4B). No exemplo aqui apresentado, a detecção inato de células MT4 com HIV-1 infectadas por PBMC foi encontrado para ser significativamente reduzida na presença de Vpu.
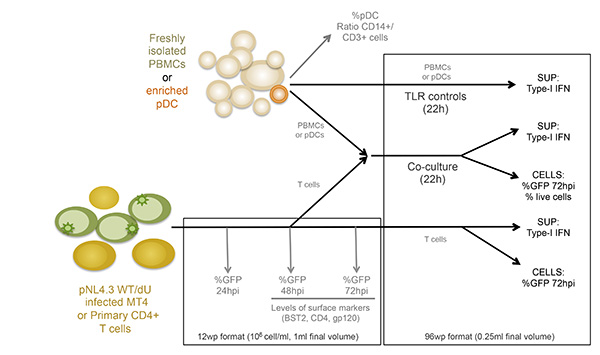
Figura 1:. Visão esquemática do desenho experimental SUP: sobrenadante Clique aqui para ver a imagem ampliada.
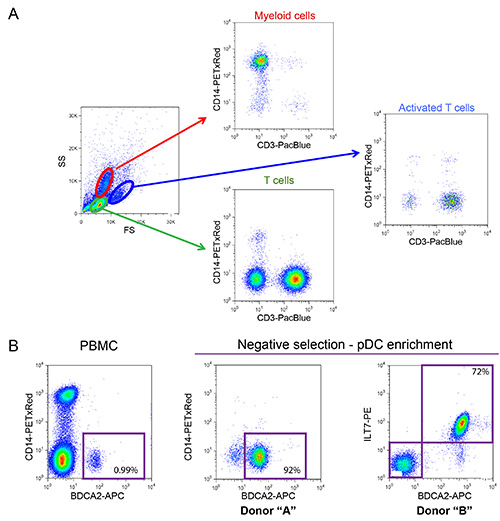
Figura 2: Caracterização fenotípica de PBMC isolados de fresco e enrpDCs iched. (a) distribuição normal de células mielóides e células T observados em PBMC isolado de um dador saudável (percentagem de células mielóides deve variar entre 10-20% e as células T entre 55-65%). Amostra PBMC foram coradas utilizando anticorpos conjugados com fluoróforos que reconhecem CD14 superfície (marcador de linhagem mielóide) e CD3 (marcador de células T). (B) Caracterização fenotípica de pDCs. Antes de pDCs enriquecimento representar entre 0,2-1,2% do número total de células dentro dos PBMC (0,99%, no exemplo mostrado). Estas células podem ser identificados com base na expressão de marcadores específicos, tais como BDCA2 e ILT7, presentes na superfície da célula. Selecção negativa pode ser utilizada para enriquecer significativamente o número de pDCs e eliminar contaminações potencialmente prejudiciais, tais como células mielóides CD14 + (enriquecimento, atingindo os 92% e 72% nos dois exemplos mostrados). Click aqui para ver a imagem ampliada.
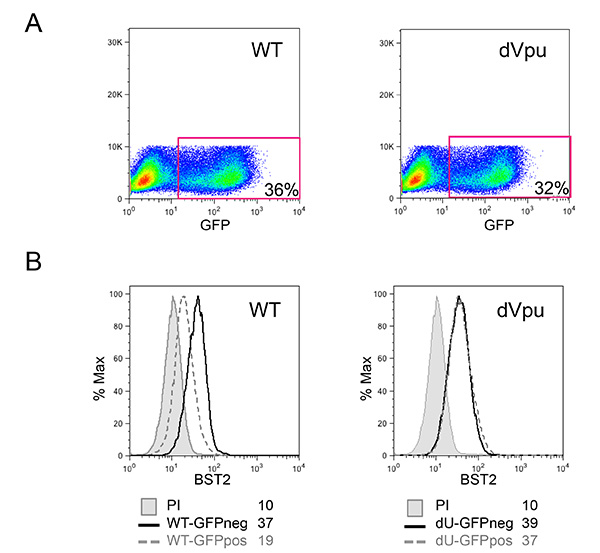
Figura 3:. Caracterização de células MT4-alvo de HIV-1-infectadas (A) Percentagem de células infectadas nas culturas MT4 infectadas com pNL4.3 GFP_ires_Nef-WT ou dVpu como determinada pela percentagem de células positivas para GFP. Expressão de superfície (B) da célula BST2 nas células infectadas foi avaliada após a coloração da superfície. As cinzas preenchido histogramas representam células falsamente infectadas coradas com o soro de coelho pré-imune (controlo unstained); os histogramas restantes representam células marcadas com anti-soro de coelho policlonal BST2. Histogramas com linhas contínuas representam controle negativo GFP (neg) células; enquanto histogramas com linhas pontilhadas correspondem a células (POS) infectados GFP positivos. Gripe dizerintensidade orescence valores (MFI) estão indicadas para cada amostra. A citometria de fluxo foi realizada e analisada como descrito na Figura 2. Clique aqui para ver a imagem ampliada.
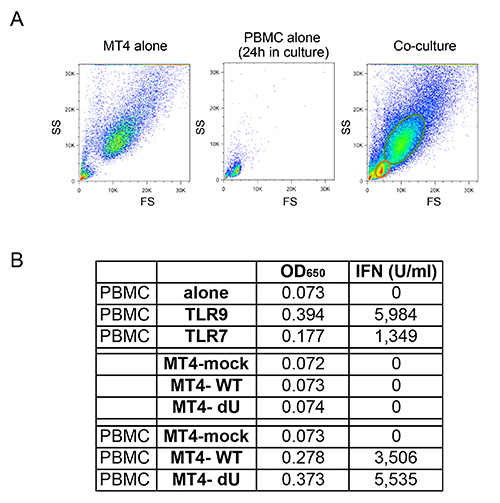
Figura 4:. Co cultura de PBMC recentemente isolados e células T infectadas MT4 (A) Comparação de citometria de fluxo perfis FS / SS observados para células T MT4 sozinho, PBMC sozinho, ou co-culturas entre PBMCs e células MT4 T. Devido a diferenças no tamanho e granulosidade, células MT4 T podem ser facilmente distinguidos dos PBMC em co-culturas, utilizando citometria de fluxo. (B) Exemplo representativo da quantidade de IFN tipo I libertada após estimulação de PBMC com TLR7 ou TLR9 agonista (atrás), ou após a co-culturas com zombaria ou as células MT4 indicados infectados com pNL4.3-GFP_ires_Nef WT ou dVpu. Os dados brutos mostrado como OD 650 valores e sua converseion correspondente ao tipo I IFN concentração expressa em U / ml. Clique aqui para ver a imagem ampliada.
Discussão
Os protocolos aqui descritos medem a detecção de células T infectadas com vírus HIV-1 GFP que diferem apenas na sua capacidade de expressar a Vpu, como descrito no nosso relatório recente 18. No entanto, estes métodos podem ser facilmente modificados para estudar a detecção de vírus não marcados, assim como outros vírus que faltam os genes virais que podem potencialmente modular a detecção inata. Se os vírus utilizados não expressam GFP, a percentagem de células alvo infectadas deve ser determinada por um outro meio antes da co-cultura, tais como p24 (capsídeo) coloração intracelular e citometria de fluxo ou por ELISA p24. Além disso, estes protocolos podem ser utilizados com células T alvo diferentes, incluindo uma variedade de linhas celulares e células primárias disponíveis.
Os métodos descritos neste manuscrito tem um número de vantagens quando comparada com as metodologias iniciais utilizados para estudar o HIV-1 de detecção. Em primeiro lugar e acima de tudo tem sido estabelecida por um número de grupos que isento de células HIV-1 partigos são indutores pobres do tipo I IFN 2,13,14. Além disso, os primeiros estudos invocado métodos baseados em ELISA IFNa mais velhos para quantificar a quantidade de IFN tipo I produzido. Uma limitação desta técnica de detecção é que a maioria dos kits mais velhos IFNct ELISA só medem um tipo de IFN, enquanto com vista para os outros tipos de IFNa e de IFNp. O uso das linhagens de células repórteres descritas ultrapassa esta limitação quanto à concentração de todas as formas bioactivos dos IFN tipo I humanos podem ser medidos ao mesmo tempo. A técnica é altamente sensível, menos caro do que a nova geração de kit de ELISA de IFN e por muitos dadores de grandes quantidades de IFN tipo I podem ser facilmente detectados. No entanto, este protocolo pode ser facilmente adaptado para utilização com outros IFN de tipo-I leitura de métodos, tais como ELISAs.
As etapas críticas: É importante que a qualidade de todos os componentes celulares (ambos os alvos e efetores) ser rigorosamente controladas. Contaminação potencial, mesmo quando asympsintomática, precisa ser monitorado e controlado. Como mencionamos anteriormente, antibiótico-controlada contaminação bacteriana assintomática, e potencialmente outros agentes patogénicos intracelulares, tais como o micoplasma, podem gerar respostas imunes semelhantes aos observados após a infecção pelo HIV-1, nomeadamente a produção de IFN tipo I. Além disso, todos os reagentes precisa de estar livre de LPS ou outras endotoxinas potenciais. De igual modo, a monitorização de PBMCs e pDCs também é importante uma vez que as amostras humanas pode muitas vezes ser preparadas por infecções contínuas subjacentes, que podem afectar de detecção normal. Nós recomendamos sempre a inclusão dos controlos negativos propostas, nomeadamente a ausência de células-alvo, bem como co-culturas com células falsamente infectadas. A viabilidade de células infectadas também é importante para a detecção pDC adequada desde o IFN tipo I não é produzida após a co-cultura com células apoptóticas 2,14.
Uma limitação importante da técnica é a necessidade de células primárias isoladas de fresco. Este procedimento não foitestado utilizando PBMC ou pDCs que ou foram previamente congelados ou mantidos em cultura. O isolamento de PBMC é de trabalho intensivo e estas células têm uma vida útil muito limitada. Além disso, protocolos padrão para a proteção contra patogénicos de origem sangue deve ser usado durante o trabalho com sangue humano. Muitas vezes há várias fontes de variabilidade associados com o trabalho envolvendo células humanas isoladas de fresco. Entre eles estão os diferentes procedimentos utilizados para isolar essas células, e a variabilidade herdada encontradas a partir de dador para dador-. Embora seja impossível evitar a variabilidade entre doador, o uso dos controlos positivos sugeridas, tais como a medição de resposta a agonistas conhecidos de TLR7 e TLR9 vias, iria proporcionar um controlo interno importante para estas experiências. Observou-se que uma resposta robusta aos agonistas da via TLR9 poderia ser correlacionada com uma resposta pDC saudável, enquanto que uma via TLR7 responsivo é necessário para uma resposta adequada contra o HIV-1 3.
Com base em observações feitas por nós e os outros 2, o enriquecimento de pDCs de PBMC muitas vezes não é necessário. No entanto, se o desenho experimental requer que (por exemplo, no contexto em que é necessária a depleção de marcadores específicos da superfície PDC) de selecção negativa é preferível a selecção positiva, as células permanecem livres de anticorpo, após o processo de selecção. Isolado pDCs sofrer rápida apoptose em cultura. Para as experiências que requerem estas células a ser cultivadas por um período prolongado de tempo, os meios de cultura pode ser suplementado com IL-3. Esta citocina induz a proliferação PDC e inibe a sua apoptose 16. No entanto, a IL-3 de utilização deve ser rigorosamente controlada, uma vez que pode levar à maturação PDC ou diferenciação.
O método aqui descrito combina alvo de HIV-1 de células infectadas com PBMCs isoladas de fresco ou pDCs para recriar as etapas iniciais envolvidas durante a detecção inata. Este método será sem dúvida útil para explore primeiros eventos imunes inatas associados com a infecção pelo HIV. Embora os protocolos associados destinam-se a medição do tipo I IFN, eles poderiam facilmente ser modificada para medir outras moléculas bioativas liberadas a partir pDCs no reconhecimento das células infectadas. Estes poderiam incluir: IFN tipo III (IFN-λ), citocinas pró-inflamatórias (tais como o TNF-α e IL-6) e a CXCL10 quimiocinas, CCL4, CCL5 e 17.
Agradecimentos
Agradecemos E. Massicotte e J. Senhor para assistência técnica especializada durante citometria de fluxo e experimentos com células de classificação. Além disso, gostaríamos de agradecer à equipe da clínica IRCM e todos os doadores para fornecer amostras de sangue. Amostras de sangue periférico foram obtidas de doadores adultos saudáveis, que assinaram termo de consentimento informado, em conformidade com a Declaração de Helsínquia ao abrigo de protocolos de pesquisa aprovados pelo Conselho de Revisão do Institut de Recherches Clínicas de Montréal (IRCM) ética em pesquisa. Os seguintes reagentes foram obtidos por meio do Programa Reagente NIH AIDS, Divisão de AIDS, NIAID, NIH: células MT4 do Dr. Douglas Richman; e rIL-2 humana do Dr. Maurice Gately, Hoffmann - La Roche Inc.
Dr. Cohen é o destinatário da Canada Research Chair em Retrovirology Humano. Este trabalho foi financiado por doações de CIHR (CIHR 111226) com o Dr. Cohen e do Fonds de recherche du Québec-Santé (FRQ-S) rede de aids para Dr. Bego e Dr. Cohen.
Materiais
| Name | Company | Catalog Number | Comments |
| MT4 cells | NIH AIDS Reagent Program | 120 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: MT-4 from Dr. Douglas Richman. |
| HEK-Blu IFN-α/β reporter cells | Invivogen | HKB-IFNAB | |
| RPMI | Wisent | 350-000-CL | |
| DMEM | Wisent | 319-005-CL | |
| FBS | Wisent | 080-150 | |
| Ficoll-Pâque Plus | Myltenyi | 17-1440-03 | |
| CD4+ T cell isolation kit II | Myltenyi | 130-091-155 | |
| Diamond Plasmacytoid Dendritic Cell Isolation Kit II | Myltenyi | 130-097-240 | |
| PHA-L | Sigma-Aldrich | O2769 | |
| Human rIL-2 | NIH AIDS Reagent Program | 136 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: Human rIL-2 from Dr. Maurice Gately, Hoffmann - La Roche Inc. |
| Imiquimod | Invivogen | TLRL-IMQS | |
| ODN 2216 CpG-A | Hycult Biotec | HC4037 | |
| Human IFNα | PBL Interferon source | 11100-1 | |
| QUANTI-Blue | Cedarlane | REP-QB2 | |
| Flow cytometry (Antibodies/reagents) | |||
| Fc blocking solution (composition below): | Note: make in washing solution (PBS, 5mM EDTA, 5% FBS) | ||
| 10% Goat serum | Sigma-Aldrich | G 9023 | |
| 10% Rabbit serum | Sigma-Aldrich | R 9133 | |
| 10% Mouse serum | Sigma-Aldrich | M 5909 | |
| 2.5 mg/ml human IgG | Sigma-Aldrich | I 4506 | |
| anti-CD3_Pacific Blue | Biolegend | 300417 | |
| anti-CD14_PE-TxRed | Life Technologie | MHCD1417 | |
| anti-BDCA2_APC | Myltenyi | 130-090-905 | |
| anti-ILT7_PE | Biolegend | 326408 | |
| anti-CD4_PerCP/Cy5.5 | Biolegend | 317427 | |
| anti-BST2_Alexa 660 | eBioscience | 50-3179 | |
| Paraformaldehyde | Sigma-Aldrich | P 6148 | |
| Cell strainer | BD Falcon | 352340 | |
| Cyan ADP instrument | Beckman Coulter | CY20030 |
Referências
- Colonna, M., Trinchieri, G., Liu, Y. J. Plasmacytoid dendritic cells in immunity. Nature immunology. 5, 1219-1226 (2004).
- Lepelley, A., et al. Innate sensing of HIV-infected cells. PLoS pathogens. 7, e1001284 (2011).
- Beignon, A. S., et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor-viral RNA interactions. The Journal of clinical investigation. 115, 3265-3275 (2005).
- Martinelli, E., et al. HIV-1 gp120 inhibits TLR9-mediated activation and IFN-{alpha} secretion in plasmacytoid dendritic cells. Proceedings of the National Academy of Sciences of the United States of America. 104, 3396-3401 (2007).
- Cao, W., et al. Regulation of TLR7/9 responses in plasmacytoid dendritic cells by BST2 and ILT7 receptor interaction. The Journal of experimental medicine. 206, 1603-1614 (2009).
- Bego, M. G., Mercier, J., Cohen, E. A. Virus-activated interferon regulatory factor 7 upregulates expression of the interferon-regulated BST2 gene independently of interferon signaling. Journal of virology. 86, 3513-3527 (2012).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Miyagi, E., Andrew, A. J., Kao, S., Strebel, K. Vpu enhances HIV-1 virus release in the absence of Bst-2 cell surface down-modulation and intracellular depletion. Proceedings of the National Academy of Sciences of the United States of America. 106, 2868-2873 (2009).
- McNatt, M. W., Zang, T., Bieniasz, P. D. Vpu binds directly to tetherin and displaces it from nascent virions. PLoS pathogens. 9, e1003299 (2013).
- Manel, N., et al. A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells. Nature. 467, 214-217 (2010).
- Yan, N., Regalado-Magdos, A. D., Stiggelbout, B., Lee-Kirsch, M. A., Lieberman, J. The cytosolic exonuclease TREX1 inhibits the innate immune response to human immunodeficiency virus type 1. Nature immunology. 11, 1005-1013 (2010).
- Fonteneau, J. F., et al. Human immunodeficiency virus type 1 activates plasmacytoid dendritic cells and concomitantly induces the bystander maturation of myeloid dendritic cells. Journal of virology. 78, 5223-5232 (2004).
- Ankel, H., Capobianchi, M. R., Frezza, F., Castilletti, C., Dianzani, F. Interferon induction by HIV-1-infected cells: a possible role of sulfatides or related glycolipids. Virology. 221, 113-119 (1996).
- Schmidt, B., Ashlock, B. M., Foster, H., Fujimura, S. H., Levy, J. A. HIV-infected cells are major inducers of plasmacytoid dendritic cell interferon production, maturation, and migration. Virology. 343, 256-266 (2005).
- Bego, M. G., Dube, M., Mercier, J., Cohen, E. A. Effect of calcium-modulating cyclophilin ligand on human immunodeficiency virus type 1 particle release and cell surface expression of tetherin. Journal of virology. 83, 13032-13036 (2009).
- Grouard, G., et al. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand. The Journal of experimental medicine. 185, 1101-1111 (1997).
- Fitzgerald-Bocarsly, P., Jacobs, E. S. Plasmacytoid dendritic cells in HIV infection: striking a delicate balance. Journal of leukocyte biology. 87, 609-620 (2010).
- Bego MG, ., Côté, &. #. 2. 0. 1. ;., Aschman, N., Mercier, J., Weissenhorn, W. Cohen ÉA. Exploits the Cross-Talk between BST2 and the ILT7 Receptor to Suppress Anti-HIV-1 Responses by Plasmacytoid Dendritic Cells. PLoS Pathog. 11 (7), e1005024 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados