Method Article
诱导星形胶质细胞受体的可塑性由神经元的放电频率操作
摘要
在这里,我们描述了用于诱导稳态可塑性神经元星形胶质细胞的G蛋白偶联受体的可塑性研究方案的适应。最近用于检查变化星形细胞组I型mGluRs在幼年小鼠中,该方法可以应用于测量各种星形细胞G蛋白偶联受体的比例,在从成年小鼠原位和体内组织,并更好地欣赏星形细胞受体的敏感性的变化的神经元活性。
摘要
近二十年研究已经证实, 原位和体内星形胶质细胞表达大量的G蛋白偶联受体(GPCR),可以通过neuronally发布的发射器被激发。然而,星形细胞受体表现出的响应变化的神经元活动的可塑性的能力很少受到关注。在这里,我们介绍了可用于全球范围内扩大或缩小规模星形细胞I组急性脑切片代谢型谷氨酸受体(mGluRs的)一个模型系统。当中包括如何准备矢状窦旁海马切片,构建适合长期切片孵化室,双向操纵神经元动作电位频率,负载星形胶质细胞和星形胶质细胞的过程与荧光Ca 2 +的指标,衡量变动情况记录星形细胞Gq蛋白G蛋白偶联受体活性的方法自发和诱发星形胶质细胞Ca 2 +的使用共聚焦显微镜的事件。在本质上,一个“钙Řoadmap“是为如何衡量星形细胞Gq蛋白G蛋白偶联受体的可塑性。该技术为星形胶质细胞的研究应用进行了讨论。具有星形细胞受体信号是如何变化所影响神经元活动的理解有两个正常的突触功能以及过程潜在的神经性疾病和神经退行性疾病具有重要意义。
引言
星形胶质细胞在几秒钟内响应的神经元或神经元轴突的刺激增加细胞质中的Ca 2 +引起的激活星形胶质细胞Gq蛋白G蛋白偶联受体几乎完全。例如,毒蕈碱型乙酰胆碱受体1,大麻素受体2,α1A肾上腺素能受体3,4,和组I型mGluRs(见下文)都是星形细胞Gq蛋白的GPCR亚型急性神经元的活动作出反应。星形细胞组I的mGluRs的活化已被证明最为广泛,下面的神经细胞的谷氨酸能传入原位刺激(如急性海马切片)5-7,以及在成年小鼠皮质体内以下的感官刺激8。星形胶质细胞的激活Gq蛋白G蛋白偶联受体的生物学和星形胶质细胞,神经元,星形胶质细胞或神经元相互作用的生理信令的结果一直是人们争论9-12的问题。这将是S神经元对胶质细胞受体信号传导的功能之前,青梅时间完全理解。
虽然很清楚,神经元可以使用的实验方案激活星形细胞受体,还有一些仍然知之甚少神经元对星形胶质细胞受体的通信的各个方面。首先,要激活星形胶质细胞Gq蛋白G蛋白偶联受体所需的神经元活动的实际金额不明确,二是星形细胞受体表现出使用依赖性的可塑性的能力很少受到关注。要开始解决这些问题,我们最近开发的协议,诱导星形胶质细胞组I型mGluRs在急性少年海马脑片双向缩放以响应神经元动作电位依赖的长期变化(AP)突触活动。类似于已经发现神经元离子型谷氨酸受体13,14,星形细胞组I型mGluRs扩大FO的双向稳态塑性神经元动作电位llowing封锁和缩减时神经细胞的动作电位频率增加15。在星形细胞受体这些代偿性改变可以通过记录自发进行测量和诱发星形胶质细胞的Ca 2 +瞬变,这些事件的属性进行比较,以从那些在控制条件下的星形胶质细胞。在这个手稿中,我们描述了完整的方法使用该协议的,包括编制急性海马脑片,培养条件诱导星形胶质细胞受体缩放,利用共聚焦显微镜星形胶质细胞的Ca 2 +指示剂负载,Ca 2 +的成像技术,及预期效果在星形胶质细胞Gq蛋白G蛋白偶联受体的活性。在星形胶质细胞可预见的影响的Ca 2 +信号的属性-它匹配在转Gq蛋白G蛋白偶联受体的不同表达水平培养细胞之前录制的-提供了一个“路线图”,可以在今后的研究中用于测定的变化为trocytic G蛋白偶联受体的表达。所带来的后果和潜在的应用中使用这种技术将有助于我们在健康和疾病脑星形胶质细胞的神经元相互作用的理解。
研究方案
下面的过程中已获得美国加州大学河滨分校的机构动物护理和使用委员会。
1。孵化室和切片持有人建设
- 构建孵化室:从材料,无毒构建孵化室。确保该室已控制的空气循环,保持ACSF足够量的供片架浮动,并且足够大,使得片夹持器可以在该腔室的一端浮动,而从氧系气体分散发生在另一端上。其气密盖( 图1A)吸管存储容器的抽屉部分正好符合这些标准。
- 约1¼在从顶部和¼在从侧面钻在容器的侧面上的小孔。通过该孔适合一块柔性管( 图1B)。小心钻足够低,使得当盖关闭时,管道将不会被压缩,但足够高,以便它是解决以上。
- 适用于有机硅接缝密封剂(“水族馆接缝密封剂”)来创建氧气线和所述腔室之间的水密封。
- 连接管连接到一个气体罐(95%氧气,5%二氧化碳)用注射器阳配件的“外部”结束。对于定制适合,削减到适合自然斜角200微升移液器吸头( 图1C)。
- 连接管连接到一到六线塑料歧管的“内部”结束。削减到适合6 20微升的Eppendorf微加载移液器吸头各歧管入口( 图1D)。该microloaders的细小开口非常适合生产小气泡源源不断。
- 要允许通风,钻在容器( 图1E)的盖两个微小的孔。
- 构建切片ħ旧的:切片座由浮动的气泡架( 图1F)制成。
- 卸下底部的“腿”泡沫机架,切顶约1¾英寸
- 粘上一块尼龙网状材料来使用氰基丙烯酸酯胶(如标准疯狂胶水)来创建一个八井片座( 图1G)的轮架的底部。每口井可以容纳一个单一的小鼠海马切片。
- 适合的片夹持在孵育室的一端,而在另一端的微加载歧管装置。让微加载提示休息室内地板( 图1H)。这种设置是为了确保足够的氧合作用,以同时在顶部和急性海马切片的底部,并避免气泡出来的片支架的正下方,以减少片搅拌,防止气泡与海马切片的直接接触。
- 冲洗孵化室的ð切片持有人彻底与双蒸2 O每次实验后,和净化用70%乙醇每周一次。在温育中的不同解决方案的切片的情况下,多个腔室/切片持有人将是必要的。
2。解决方案及药物
- 人工脑脊液(学联):准备4升在DDH 2 O标准学联使用以下(毫米):125氯化钠,氯化钾2.5,2.5 氯化钙 ,氯化镁1.3 2 1.25 磷酸二氢钠,碳酸氢钠26.0 3,15葡萄糖和0.1 Trolox的。 Measure using渗压计该solution的渗透压它应该前来〜310 mOsm时。对于实验条件ACSF组合物描述如下(参见方案3)。使用0.22微米瓶顶过滤器进入高压灭菌玻璃瓶过滤所有的解决方案。解决方案是稳定在4℃最多一个月。
- 切片缓冲液:125氯化钠,氯化钾2.5,3.8 MGC:使用含有改性ACSF(以mM)准备切片升2,1.25的NaH 2 PO 4,26.0的NaHCO 3,15葡萄糖,和1.3抗坏血酸。测量用渗透压计,溶液的渗透压,它应该来〜310毫渗透摩尔浓度。替换的CaCl 2含MgCl 2的切片缓冲提高切片的健康。
- 磺酰罗丹明101(SR-101,1μM)是用来识别在急性海马星形胶质细胞。使SR-101中的1 mM的库存通过稀释在100ml制备(以mM计)以下的改性低钙ACSF的60.67毫克,SR-101:125氯化钠,氯化钾2.5,0.5的CaCl 2,6的MgCl 2,1.25和NaH 2 PO 4,26.0的NaHCO 3,15葡萄糖,和1.3抗坏血酸。验证低钙学联的渗透压摩尔浓度为〜310毫渗量。稀释1毫米SR-101股票1,000次修改中低Ca 2 +的学联加载。存储最终的SR-101溶液在4℃下并避光,直到需要进行实验。
3。升操控翁期限神经元在急性海马脑片放电频率
使用的独立的实验2孵化协议之一来操纵长期神经元放电率:
- 抑制神经元放电:在孵育河豚毒素(TTX,1微米):小心:TTX小心,如果摄入足量也可以是致命的。手套和护目镜建议。 TTX完全废除AP驱动的神经元放电急性切片。孵育切片在3.5毫米的K +学联,加上在实验条件下1微米河豚毒素。在控制条件下,在孵育3.5毫米的K +学联片无TTX。这两个条件之间的比较揭示了在星形细胞Gq蛋白GPCR活性的向上尺度效应。 3.5 mM的钾离子ACSF作为控制条件(而不是说,2.5mM的K +),以最大限度地TTX治疗的效果。
- 或 -
- 增加上述神经元的放电基础利率:在孵育高钾:增加细胞外K +浓度的神经元去极化,提高自己的基础射速。孵化5.0毫米的K +学联相比,2.5毫米的K +学联15显著升高神经元动作电位的频率。孵育切片在5.0毫米的K +学联的实验条件,并为控制条件,孵育切片在标准的2.5毫米的K +学联。这两个条件之间的比较揭示了在星形细胞Gq蛋白GPCR活性的向下缩放效果。
4。急性海马脑片的制备
- 设立温馨恢复室:
- 温水浴至35℃,然后将里面的准备孵化室。用水多达内孵育室( 图1G)的ACSF的高度填充水浴中。
- 充氧实验组和对照学联与95%O 2,5%CO 2。在微加载歧管装置发出的泡沫要小而丰富,而且温柔;不应该有在室内学联的任何可见的运动。
- 设置冰冷的解剖腔:
- 就拿冰的两个水桶。放置一个瓶子约300毫升切片缓冲器入冰中的一个桶并保持它的含氧入95%O 2,5%CO 2的20分钟。淹没100毫米培养皿中放入其他冰桶,只是冰的表面之下。确保在培养皿的一侧与冰直接接触。倒一些切片缓冲到培养皿中,并保持其氧化为好。
- 浸没入在培养皿中的冰冷切片的缓冲时间超过1分钟的寒意单刃刀片的切削刃。
- Vibratome设置:
- 打开vibratome,并确保排水已关闭。
- 固定切割室中的振动希瑞和周围的切割室浮冰。它预冷至0-4℃。
- 除去从双缘剃刀刀片通过浸泡入70%乙醇进行5分钟,然后用双蒸水漂洗厂油脂。切成一半是小心地(不弯叶片)和挂载一半叶片上切割块。
- 取出鼠脑:
- 麻醉一个12至18天龄的C57BL/6J小鼠中的小室预装用0.5ml的异氟醚浸泡成的Kimwipe或棉球。轻轻捏动物的脚趾,以确保没有疼痛反射。
- 使用一对锋利的剪刀斩首鼠标,然后用小镊子取出头皮。用小骨剪刀从小脑切头骨嗅球沿纵向裂缝。删除使用小镊子颅瓣。轻轻地用刮勺取出大脑,并浸没入在培养皿中的冰冷的含氧切片缓冲区。
- Bisec吨小鼠脑与在培养皿冷冻刀片,以允许更多的表面积用于冷却和氧气。让平分半球坐在冰冷的切片缓冲2-3分钟。大脑应该成为完全冷却,并更加稳固。
- 在vibratome的平台上涂上一层薄薄的氰基丙烯酸酯胶。胶南北半球的平台切方式和侧面起来,朝前嗅球。确保在切割室的平台,然后填写切割室与冰冷,溶氧充足切片缓冲区。
- 持续充氧切割室,同时准备厚度为300μm的矢状切片使用vibratome。切割片在85赫兹的频率,在0.20毫米/秒,和1.40毫米的振幅的前进速度。注:我们发现,在准备健康的急性海马脑片的一个最重要的变量是vibratome的质量。我们的实验室使用了徕卡的VT 1200 S磁铁IC驱动vibratome与vibrocheck减少“z”的震动。
- 切片后,解剖海马和邻近的内嗅皮质出来用锋利的钳每个矢状切片。在vibratome的切割室的冰冷,以及含氧切片缓冲区执行此过程。钳子的锐度是与切片健康非常重要的,因为它最小化处理的切片。
- 通过掰玻璃巴斯德吸管的长尖和一流的损坏部件用吸管灯泡使移液管。这使得使用移液管转移的切片的较大端的。请务必订购移液器无棉塞在大端(见材料表)。作为切片制备非无菌条件下,它是没有必要进行高压灭菌,使用前的吸移管,虽然新的移液管应准备用于各实验。
- 每个海马脑片转移到孵化室在35℃水中浴,浸移液管进入学联切片持有人的每一孔和内吸片。在此过程中最小化的切片的运动。切片直接转移到温暖的孵化浴效果更好的质量比片“斜坡”的温度逐渐上升。
- 让海马脑片在温水浴中恢复,共45分钟,细分如下:在1微米SR-101稀释于低钙学联切片孵育20分钟,然后将它们传输到低钙学联(不SR-101)10分钟。随后,转移切片,以控制或实验学联的热烈孵化的剩余15分钟。
- 45分钟温恢复后,小心地从35℃水浴将孵化室的工作台上,然后让切片继续开始推注装载前在室温下孵育3小时,总孵化时间协议(见下文)。
5。星形胶质细胞与Ca 2 +的指示灯丸加载中
- 制备的Ca 2 +指示剂丸加载染料:
- 为染料(50微克)的每个小瓶中,添加3.87微升新鲜二甲亚砜(DMSO)和涡流彻底。二甲基亚砜的新鲜度是很好的装载重要的,因此,每次破解打开一个新的安瓿。
- 混在9微升20%聚醚酸和涡彻底。用100微升适当的实验或控制学联和涡井混合染料,作最后的染料10μM浓度。
- 用离心机过滤管过滤该溶液。此步骤防止装载吸管从染料的喷射过程中堵塞。
- 从拉至约1.3MΩ电阻时,充满了染料溶液硼硅玻璃毛细管准备吸管。
- 放置一个海马切片到记录室设计用于与显微镜使用并与它被培养在(1.5毫升/分钟)相同的组合物的氧化ACSF连续灌注。选择海马切片时,对照组和实验条件之间交替。
- 放弃不健康的期待海马。片的质量甚至会在给定的试验有所不同。有没有一套标准的量化切片的健康,因此,测定片健康是主观的,主要依据是经验。
- 一般来说,保持具有光滑的表面出现,健康的CA1区锥体细胞的比例很高( 图2A)切片。 CA1区锥体细胞特别敏感,容易受到中枢神经系统的侮辱,所以有健康的CA1区锥体细胞的一大比例(≥75%)可能是接受或拒绝一个片一个有用的标准。
- 丢弃含有约> 25%死亡的神经元片。死亡的神经元有一个煎鸡蛋一样的外观( 图2B)。注:我们公顷已经观察到,切割角度起着神经元是否出现健康与否的重要作用。如果神经元的树突向上突出(出片的),那么神经元将主要死亡。这大概是因为神经元体积的这样的大比例被包含在树突树内,即切断树突是致死的细胞。另一方面,如果枝晶突出平行或在从切片表面上的向下的角度,会有健康的神经元的比例很高。有时,因此,神经元将主要死在片的一侧和健康的另一侧。
- 定位基于大小,形态和位置使用微分干涉对比(DIC)的光学元件SR的星形胶质细胞的切片表面40-70微米以下的合适的字段。
- 加载玻璃吸管与染料溶液,并使用标准膜片钳微电极HOLDE降低它的切片的上面这个字段的表面河用吸管在片的表面上,施加背压,以移液管以开始喷射染料。染料的喷射都将DIC的光学和适当的激光器,如488线的绿色染料下是可见的。
- 慢慢放下吸管约40微米用显微操作片表面之下,并允许染料弹出约45-60秒。然后,放下吸管额外35微米(75微米以下片表面)和大约45-60秒弹出染料。慢慢地从片缩回枪头。较短的注射时间是可能导致染料装载不足,而较长的喷射趋于增加背景负荷,从而降低了记录的信号 - 噪声比。
- 为了确保大量的星形胶质细胞的占用染料,它通常是有帮助的注入第二种染料丸很短的距离。提高移液器回片的表面,确保移液管是否堵塞,然后莫已经移液器约80-100微米远离第一注射部位,沿辐射层。重复推注在这个网站。
- 前成像的星形胶质细胞占用染料和背景信号,以减少允许30-45分钟。离开切片在灌注腔在这段时间。请确保此孵化时间是内置在实验的总4小时的治疗。获得下一个切片,然后重复步骤5.2-5.8。
6。记录自发和Gq蛋白G蛋白偶联受体激动剂诱发星形胶质细胞的Ca 2 +活性的海马脑片
- 设立共聚焦显微镜成像:
- 极限片受到激光照射是最重要的,因为高暴露可导致染料漂白和/或光毒性。使用较高的光学放大或增大变焦设置可提高光线照射到成像领域。因此,为每个激光器的默认值到高光电倍增设置搜索克,1X增益和0.5%,激光输出功率。
- 应用1.5倍变焦,更好的可视化星形胶质细胞的过程。
- 将字段设置分辨率为512×512像素。
- 设置扫描速度,以最快的可能,这是〜每次扫描1.2秒使用单程扫描模式。
- 采用503-548纳米的488 nm激光,和624-724 nm波长的559 nm激光带通滤波器收集发射光谱。这些设置允许〜5-8星形胶质细胞的字段成像在较快速度足以观察星形胶质细胞胞体和主要流程的决议。理想情况下,在该领域的星形胶质细胞将是光明的,足以清楚地看到,但没有任何像素饱和。
- 确认电池装入的Ca 2 +的身份染料作为星形胶质细胞通过使用559 nm激光可视化的SR-101 colabeling。
- 记录星形胶质细胞的Ca 2 +活动:
- 使用图像采集软件在感兴趣区域(RO绘制框是),在细胞内,在这种情况下,以上的星形胶质细胞的细胞体。箱子不应该包括的背景象素,以达到最佳的信号 - 噪声比的可能。在背景绘制一个方框作为参考。
- 灌注切换到通过该实验的其余实验ACSF加上1μM的TTX(Abcam公司)。这消除了任何可能的神经元的AP驱动的星形胶质细胞钙反应。然后剩余的增加,星形胶质细胞Ca 2 +浓度也会因量子囊泡释放,构(基础)GPCR活性,或这两种机制的结合。
- 记录荧光从全投资回报时间。任何增加的荧光比基线增加表明细胞质中Ca 2 +浓度16,而在星形胶质细胞10,17,18,因此G蛋白偶联受体的活性。为了避免河豚毒素对星形细胞受体的任何可能的早期的尺度效应,在40 min内FR完整的实验OM的时候1微米河豚毒素灌流开始。
- 获得自发的Ca 2 +活性基线记录 的10分钟后,取利息(如DHPG)激动剂的浓度依次增大。留下最小的应用程序之间的5分钟,以减少可能的受体脱敏。
- 在录音结束后,申请激动剂其他星形细胞Gq蛋白G蛋白偶联受体的鸡尾酒作为阳性对照的完整星形细胞Gq蛋白G蛋白偶联受体信号转导通路。激动剂鸡尾酒的成分将取决于感兴趣的受体。 10每个Gq蛋白G蛋白偶联受体的激动剂微米组胺,氨甲酰胆碱和二钠,三磷酸腺苷刺激组胺H1受体[H1R],毒蕈碱型乙酰胆碱受体[mAchR的],和嘌呤受体[P2YR],分别是常用的激动剂鸡尾酒。
- 后的实验图像采集:
- 在完成Ca 2 +的记录,采取与488 nm和559 nm的激光器,F静止图像或星形胶质细胞的身份和ROI放置后确认。激光功率和HV设定可以自由地在这个点被改变以获得用于共定位最佳的图像,因为不再有关于激光强度影响数据( 图2A),一个关注的问题。
- 总共约8片和40星形胶质细胞/组重复步骤6.1-6.3。片应该从最低3个不同的小鼠。
7。的星形胶质细胞的Ca 2 +活性分析
- 定义的Ca 2 +海拔:标准化定义中的Ca 2 +瞬变还没有在科学界已深入人心。下面是一个典型的协议,同时限制检测的误报事件了基线噪音的最大化灵敏度。
- 还有一个实验室成员分配每个切片的数字代码,以一味对它们进行分析。在分析的结论,解码每个切片。
- 离线使用图像分析软件分析自发和诱发星形胶质细胞的Ca 2 +升高。重绘和/或调整大小,形状和ROI的随意的位置。
- 分数增加,荧光强度与基线相比的Ca 2 +的升高,如果峰值幅度大于2标准差(SD)以上30秒的平均基线荧光为至少两个连续的采样点的平均值。在特别嘈杂的录音(低信号对噪声),该标准可能需要被调整为3以上的SD平均基线荧光。每个定义的Ca 2 +升高的发生作为最后一个数据点的荧光强度超过上述平均值一个标准差之前。
- 多峰与连续的单峰事件之间的区别。分数的事件称为“多峰”时的荧光强度并没有恢复到基线(低于平均基线值+2 SD)为≤峰之间连续9个数据点(10.8秒)。因此,单峰事件将有10个或更多个连续的基准数据点在它们之间。
- 事件归类为“高原”型反应,当荧光强度保持峰值幅度(峰值±10%)至少3.6秒。
- 分析的振幅,频率,以及自发和激动剂诱发的钙瞬变动力学。
- 定义的Ca 2 +升高的峰值幅度为具有最高强度值的数据点(在“多峰”的反应情况下使用的第一个高峰, 见图2B)。
- 计算的上升时间作为反应发生和对应于所述峰值幅度的时刻之间的差值。注:0〜100%的上升时间可能需要以可用于具有数据点的足够数量,以获得时间值;扫描速度是这里的重要变量。
- 计算延迟的时间激动剂灌注到响应发病的起始之间。上升时间可能是一个更为有用的指标,在脑片,只要洗的时候创建的计算响应延迟一个变乱。
- 确定是否有统计学上使用学生独立样本t-检验的每个参数在两组间显著差异。使用星形胶质细胞的数量作为'N'。使用Pearson的卡方检验比较对照组和治疗组之间的Ca 2 +的活动模式。使用Fisher精确双尾检验比较控制组和治疗组之间的特定的Ca 2 +活动模式的百分比。表达差异,* P <0.05,** P <0.01和*** P <0.001。
结果
在图3中代表性的结果显示,在急性TTX小鼠海马切片培养4-6小时,在星形胶质细胞的SR Ca 2 +的活性的影响。数据包括自发的Ca 2 +瞬变和DHPG诱发I组代谢型谷氨酸受体的Ca 2 +的响应,从培养在控制学联与学联加TTX片。除基本特征形态特征,星状工艺装配和小胞体大小(〜10微米),星形胶质细胞是在由SR的Ca 2 +的指示剂OGB-1上午01点与星形胶质细胞的选择性标记SR-101 19,20(叠加鉴定图3A)。在星形胶质细胞胞体编号的箱子对应了图3B所示时间的痕迹编号的荧光。本组1代谢型谷氨酸受体激动剂(RS)-3.5-DHPG应用于确定第1组mGluRs的星形胶质细胞中特定的尺度效应。以物理之间的区别iology中的缩放效果第1组mGluRs的相对于其他Gq蛋白G蛋白偶联受体的特异性激动剂的鸡尾酒在每个实验结束时被应用。在这里,我们用各Gq蛋白G蛋白偶联受体10微米激动剂组胺,氨甲酰胆碱氯化物(卡巴)和腺苷5'-三磷酸腺苷二钠(NA-ATP)。激动剂鸡尾酒也可作为阳性对照,以确定可行的,星形胶质细胞的反应的情况下细胞不向DHPG响应,大概是因为这些特定的星形胶质细胞不表达足够量的受体引发针对DHPG的响应。
我们用不同浓度的DHPG,包括5微米和15微米( 图3B),以及30微米和50微米( 图4A),以有助于揭示变化,星形细胞组I型mGluRs。细胞内Ca 2 +的响应和Gq蛋白G蛋白偶联受体的表达水平之间的关系已经在体外 21-24先前检查。首先,将阈值来对特定的激动剂浓度响应取决于由每个细胞表达的受体的密度。在细胞群中,更多的细胞反应与Ca 2 +的升高至激动剂的一个给定的浓度时,细胞被转染的受体的密度更高。在TTX孵育切片后,星形胶质细胞在人口中的百分比响应固定浓度的激动剂增加( 图3B和3C)。我们已经发现5微米和15微米DHPG揭示了在控制和TTX处理的细胞之间响应的星形胶质细胞的百分比明显的差异,而30和50μMDHPG须在5.0 mM的钾离子处理与对照比较I组代谢型谷氨酸受体的反应细胞( 图4A)。
星形胶质细胞Ca 2 +的反应模式和激动剂浓度之间的关系也被审查原位 。增加激动剂集中转变,从单峰的Ca 2 +升高到多峰和高原的Ca 2 +升高25-27 Ca 2 +的响应星形胶质细胞中的格局。根据这些以前的研究结果,我们预测,如果有变化的受体表达水平的响应模式来激动剂的单一浓度将转移。因此,取决于在其上的两个缩放方法被利用(抑制神经元放电或增加的话),需要的激动剂的浓度,以产生特定的反应模式会增加或减少。例如,星形胶质细胞培养在TTX其DHPG诱发的Ca 2 +响应的模式转变为更高原型Ca 2 +升高和响应,以降低相比,控制的星形胶质细胞( 图3C)的激动剂的浓度。考虑到早先的研究中,这些观察表明,该组中的星形胶质细胞代谢型谷氨酸受体我受体表达水平有所增加。
上升了的Ca 2 +升高的时间和发病(等待时间)也被证明直接的关联,在培养细胞22-24变化Gq蛋白G蛋白偶联受体表达水平。更高的受体表达水平导致更短的响应延迟和更快的上升时间而降低受体密度产生相反的效果。为星形胶质细胞培养在TTX,Ca 2 +的瞬变由应用DHPG诱发有显著更快的上升时间相比,星形胶质细胞培养在控制ACSF( 图3D)。的激动剂诱发的Ca 2 +反应如前所述,振幅保持不变,而不管激动剂浓度或比例的模型15( 图3D)的。
除了 通过直接激活组中观察到的变化I型mGluRs与DHPG,自发的星形胶质细胞的Ca 2 +活性也显著受此操纵。我们观察达2.26倍,增加的自发活动的星形胶质细胞培养在TTX与对照的百分比。这是一个增长仅12.9%的控制权星形胶质细胞表现在躯体自发活动,以42.1%的TTX培养星形胶质细胞( 图3E)。因为它是已知的,在没有激动剂21,26,28,以及与增加受体表达水平这一内在活性水平的提高,这些数据表明G蛋白偶联受体表现出“内在”或组成的活动,星形细胞Gq蛋白G蛋白偶联受体的密度增加以下在神经元动作电位发放长期减少。类似激动剂诱发反应,自发的Ca 2 +升高的上升时间也增加( 图3E)。
使用第二个协议,孵化升高细胞外钾(5.0毫米)的代表性数据,在网络被描绘GURE 4。在细胞外K +从2.5-5.0毫米结果在基底CA3区神经元动作电位频率15显著增加增加。较高浓度的DHPG(30μM和50μM)是必要的,以便从培养于高酸钾( 图4A和4B)的星形胶质细胞唤起I组代谢型谷氨酸受体的Ca 2 +的响应。这与I组代谢型谷氨酸受体反应的星形胶质细胞中的下列长期增加神经细胞的动作电位降低的水平相一致。此外,诱发反应模式DHPG的固定浓度转变,从平台样的反应较弱的单峰的反应( 图4B)。检查的自发活性的星形胶质细胞中的2钾条件下的百分比显示,培养在高K +更少的星形胶质细胞的自发活性相对于对照条件( 图4C)。这种效果是在opposit的TTX的条件,其中的星形胶质细胞表现自发的Ca 2 +升高的比例增大E方向。最后,无论是诱发和自发的Ca 2 +的升高有较慢的上升时间在星形胶质细胞的培养在高K +与对照条件( 图4C和图4D)。总之,这些数据表明,星形细胞Gq蛋白G蛋白偶联受体表达水平磅秤双向取决于神经元动作电位的活性在一个延长的时间周期的水平。

图1。切片孵化室制作和设置。(一 )连同其气密盖的布林克曼吸管存储容器的抽屉部分被用来构建切片孵化室。 (B)D细沟在容器约1¼侧的孔中从顶部和¼在从侧。适合在一块柔性管材。 (C)的微加载歧管装置,连接到所述柔性管的内端。注削减到适合天然200微升移液器吸头(白色箭头)。 ( 四)截至20微升的Eppendorf microloaders被削减到适合一到六线歧管来创建一个微加载歧管设备。 ( 五)钻盖子上两个小孔。 (六 )一个浮动的气泡架制作切片持有人。 (七 )本底“腿”浮泡架被删除,这样一块尼龙网状材料可以粘在底部。 (H)填充孵育室与ACSF的足够量,以使片夹持器浮动。调整管的长度,因此microloaders的技巧可以在休息室内地板的一角。放置在孵化室时,水洗澡,在洗澡的水位应在同一水平在室内学联。 点击这里查看大图。
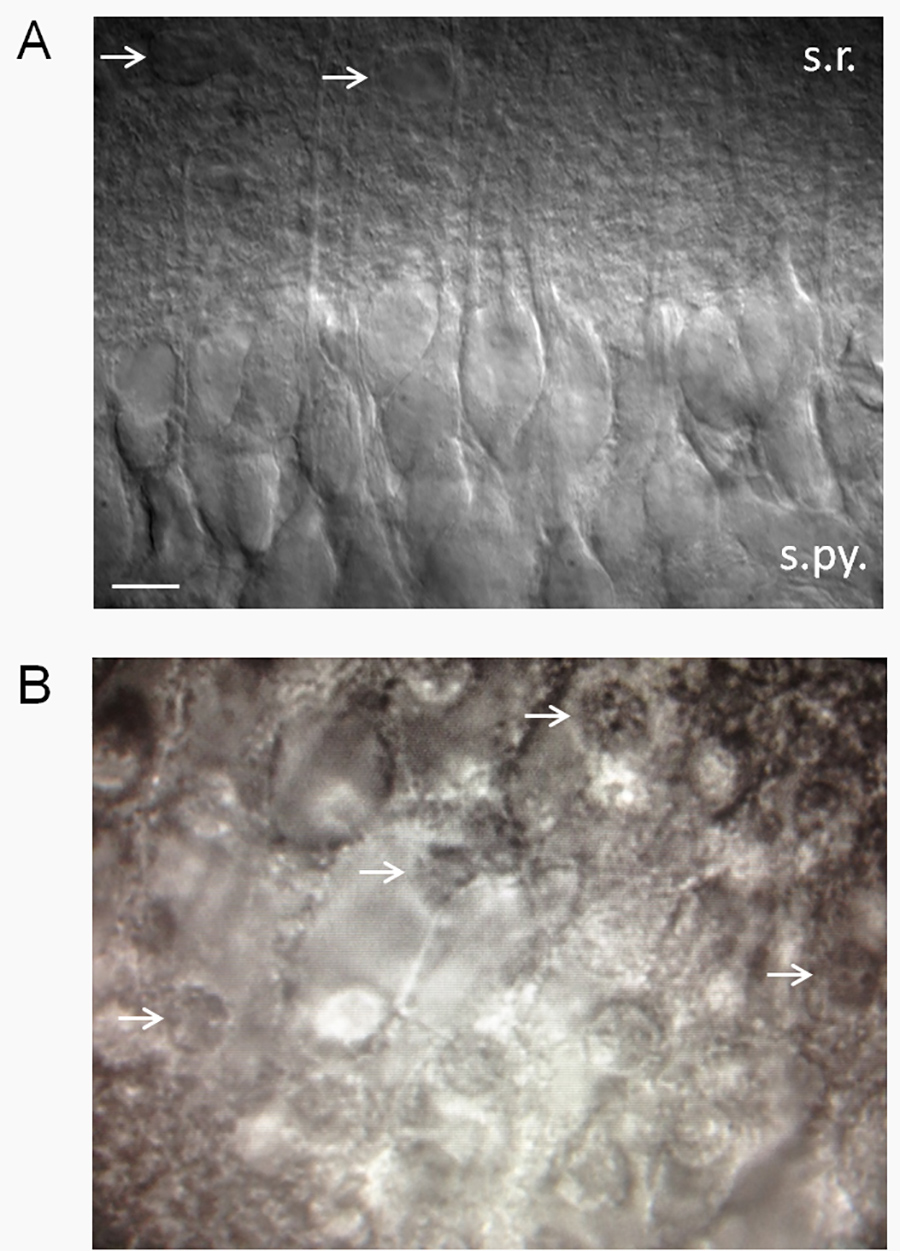
图2。切片健康评估(一 )使用微分干涉对比(DIC)的光学表面健康的海马切片。健康切片平稳,天鹅绒般的外观和健康的CA1锥体神经元的比例很高。请注意,顶树突伸入辐射层。膜片钳神经元,看起来像那些在这里显示的揭示了低静息膜电位(-61至-62毫伏)在标准的2.5毫米的K +学联很少自发动作电位。膜电位和放电频率会有所不同,前一个函数细胞外K +(Xie 等人 15)。箭头指向公认的星形胶质细胞。缩写:SR,辐射层; s.py.,地层锥体。比例尺,10微米。 ( 二)不健康的切片将有高比例的死亡CA1锥体神经元,其中有炒鸡蛋(白色箭头指向死亡的神经元的细胞核-煎鸡蛋的“蛋黄”)的外观。 点击这里查看大图。
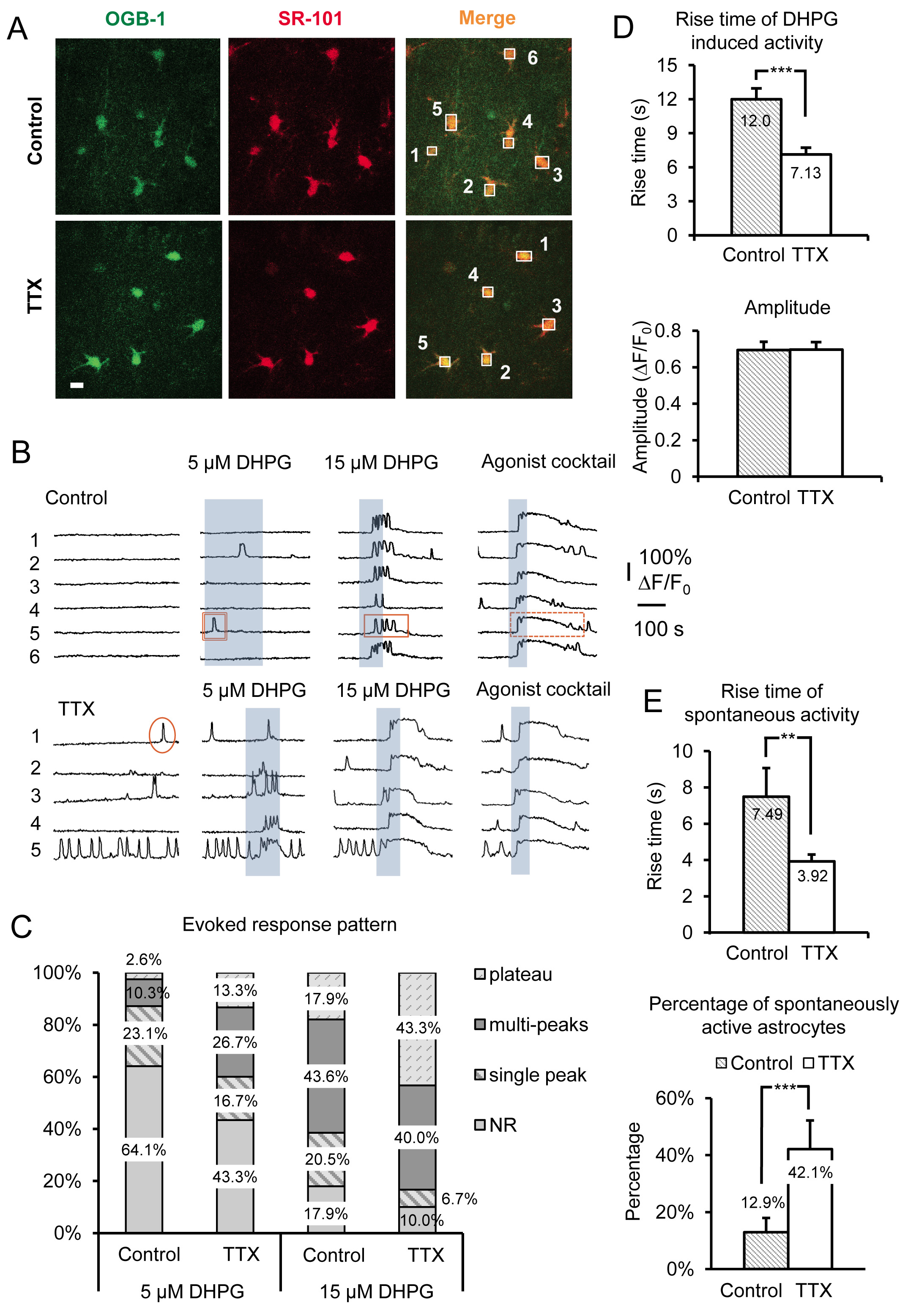
图3。录音放大Gq蛋白G蛋白偶联受体的活性和孵育在TTX长期抑制神经元AP的后诱发I组代谢型谷氨酸受体的Ca 2 +的响应。(一 )细胞在录制现场代表图像孵育在CONTROL已采取了俄勒冈绿BAPTA-1点的Ca 2 +指示剂染料(左图)和SR-101(中板)的条件下(上图),或在TTX(下图)。比例尺是10微米。两个信号的叠加(“合并”)表示的星形胶质细胞负载的Ca 2 +指示剂。框绘制在单独的星形胶质细胞胞体记录荧光强度随时间的绿色通道监测Ca 2 +的活性在星形胶质细胞。 ( 二)从录音盒中A样品的痕迹)的Ca 2 +的活性在星形胶质细胞。星形胶质细胞培养在TTX显示增加的自发活动和更强大的诱发I组代谢型谷氨酸受体的Ca 2 +的反应可见一斑变化响应的格局。单峰(圆),多峰(矩形),和高原(虚线矩形)的例子的Ca 2 +瞬变显示。 ( 三)在变化的反应模式是特别明显使用不同concent在I组mGluR激动剂DHPG的口粮。更多峰和高原反应孵育中TTX相比,在给定的激动剂浓度控制后是显而易见的。 (四)上升的DHPG诱发的Ca 2 +的响应时间更快的培养星形胶质细胞TTX比对照(上图),而振幅不会改变(下图),表示“全或无”反应振幅一次阈值响应已经达到。 (五 )上升自发星形胶质细胞的时代的Ca 2 +瞬变也是TTX更快的培养与控制星形胶质细胞培养(上图),而星形胶质细胞在人口中的比例呈现自发Gq蛋白G蛋白偶联受体的Ca 2 +的活性增加(下图)。 点击此处查看大图。
图4。录制减少星形胶质细胞Gq蛋白的GPCR活性,诱发I组代谢型谷氨酸受体的Ca 2 +的响应下长期增加神经元的AP孵育升高细胞外钾(A)星形胶质细胞的Ca 2 +从录音中孵育5.0毫米的K +学联片代表的痕迹去极化神经元,并增加较对照学联(2.5毫米的K +学联)的基础射速。星形胶质细胞孵育5.0毫米的K +学联展品较少的自发体细胞钙瞬变和弱DHPG诱发反应相比,星形胶质细胞培养中控制学联。 (二)经过长期增加神经元AP的诱发反应的模式,以多种浓度DHPG的比较揭示了较弱的响应类型。 (C)在星形胶质细胞中宝的百分比减少电泳操作呈现自发的Ca 2 +的活性升高Ķ长期孵育后观察到+相比,控制ACSF(上图),而自发活动的上升时间变得更慢(下图)。 (四)上升时间诱发星形胶质细胞的Ca 2 +的响应不同浓度DHPG的变慢以下5.0毫米的K +处理相比,星形胶质细胞在培养控制学联。 点击这里查看大图。
讨论
所描述的缩放模型代表实际的方法为研究星形胶质细胞I组mGluR的长期可塑性。成像自发和诱发的Ca 2 +的事件提供了一个敏感的检测测量变化的星形胶质细胞Gq蛋白G蛋白偶联受体的活性,作为确凿的证据已证实星形胶质细胞的Ca 2 +浓度升高的情况从Gq蛋白激活G蛋白偶联受体10的下游的IP 3的R-敏感的商店以下版本, 12,17,18。星形胶质细胞星形胶质细胞在人口中的比例响应I组mGluR激动剂和这样的Ca 2 +反应的报告模式转变组I型mGluRs。
用于加载与星形胶质细胞的Ca 2 +指示剂的具体方法是在实验设计中的一个重要的考虑因素,以寻找变化星形细胞Gq蛋白G蛋白偶联受体的活性。丸装或散装加载多个星形胶质细胞,或p个别的星形胶质细胞的ATCH钳装载可用于图像的Ca 2 +瞬变的星形胶质细胞。每种方法提供了一定的优点和缺点。直接填充星形胶质细胞的Ca 2 +通过膜片钳指示器,可明确辨识的细胞作为而不需要进行二次标记,如SR-101的星形胶质细胞。指示器的膜片钳分娩也使记录的Ca 2 +从小型星形细胞区室,包括毛精细的工序中,在细胞是健康的切片,并用与突触(取决于激光功率可用)更完整的相互作用可能更深的活性。然而,膜片钳装载从低吞吐量患有作为数据收集一格的时间。批量加载,相反,允许装入的Ca 2 +指示剂大量星形胶质细胞,并同时成像。然而,只有星形胶质细胞的表面附近(<20微米)切片的加载,与之相关联的关注是关于细胞的健康和完整的突触。
这里提出的反压丸加载协议提供了一个中间地带,具有相对较高的吞吐量和监控的Ca 2 +活性更深切片(40-75微米)范围内的能力。相比于批量加载中自发主动星形胶质细胞使用丸加载技术的比例显著增加观察,提示神经突触和星形胶质细胞过程间的连接都比较齐全15。具有良好的负荷,可以经常地监视Ca 2 +的活性,使用2 -光子显微镜的星形胶质细胞(数据未示出)或潜在的甚至更小室的主流程。不过,我们需要在分配较小的流程,以一个特定的星形胶质细胞行使,作为边界融入非特异性背景染色。一个额外的关注与使用批量加载或丸加载程序是需要一个二次三月KER星形胶质细胞的识别。虽然已经知道了许多年,星形胶质细胞优先占用AM酯的Ca 2 +的指标,次级标记SR-101通常被用来验证加载的细胞作为星形胶质细胞。 SR-101可以在本身改变神经元29的内在兴奋性。使用SR-101的证实需要执行在TTX所有星形胶质细胞的Ca 2 +测量值,以限制对神经元的兴奋性可能SR-101的效果。假设这两个控制组和实验组包括SR-101,在自身的标记不应该解释为以下长期操作的神经元的动作电位在星形胶质细胞的Ca 2 +信号中观察到的效果。 SR-101可以是一个更值得关注的在高K +的实验,但是,因为它可以减少2.5 mM的钾离子与之间的差5.0 mM的钾离子,如果基底的燃烧率是不按比例改变。
一个非常有前途的方法来提供的Ca 2 + 指示灯星形胶质细胞是近年来发现其使用的Ca 2 +染料提供了一个有吸引力的替代较传统的方法。显著的进步已在过去数年,有针对性的星形胶质细胞30-32基因编码的钙指标(GECIS)。 GECIS可以通过体内注射的腺相关病毒载体到感兴趣如海马脑区域被输送到星形胶质细胞。 GECIS的表达后大约两周下列病毒感染32实现的。还有由星形胶质细胞使用GECIS呈现诸多优势。首先,向量是针对使用星形细胞特异性启动子的星形胶质细胞的,所以标记的细胞是星形胶质细胞32。第二,信号-噪声现在看来这样的举动,可以使用染料的膜片钳分娩方式获得,但没有有过一个补丁吸管的小区32上的侵袭。三,指标可以是DELivered并表示在成人组织,使用批量加载交付方法是有问题的。此外,表达的是马赛克,提供多种星形胶质细胞中分化能力。因此,一些星形胶质细胞可能会被同时成像,同时也记录在体细胞和细小枝在同一时间。因此,有可能一个单一的技术可以被用于代替三个分开的技术(批量加载,丸剂加载和膜片钳负载)来记录的星形细胞Gq蛋白GPCR的缩放活性,大大提高了效率。
使用病毒介导的交付Ca 2 +的指标星形胶质细胞的一个潜在缺点是片上32健康可能造成的影响。用于递送GECIS的腺相关病毒载体已经预先证明可导致星形胶质细胞33的反应性神经胶质增生。一般脑片的制备可能引发病变的早期阶段,包括INF释放lammatory分子10。因此,结合诱导星形胶质细胞受体的比例所需的潜伏期长的时间,使用病毒载体的使用GECIS的交付将需要在这些类型的实验切片健康的情况下获得额外代价。
当使用这个协议,它的报名时间为激动剂产生一个响应会有所不同的受体可用性的功能是很重要的要记住。对于激动剂的一个给定的浓度,施用时间将要更长,如果受体已按比例缩小,和更短的,如果受体已按比例放大,为使药物在组织中激活受体足以产生的Ca 2 +达到足够的浓度响应。因此,药物的施用时间,并有可能它们的浓度,可以具有取决于缩放的预定方向进行调整。例如,激动剂浓度可能需要在c被降低TTX的酶,以避免饱和的反应,并培养在高K +切片甚至看到一个响应之后增加。具体地说,DHPG浓度从5-15μM移TTX治疗30-50微米5.0毫米的K +处理后,以研究Ca 2 +的响应模式,如5-15微米往往太低,以产生可靠的回应后扩展I组mGluR的下跌后,星形胶质细胞。
星形胶质细胞的Ca 2 +的活性的记录提供了受体的插入或内在化或从细胞膜的直接证据。然而,根据来自体外以往的研究,其中审查Gq蛋白G蛋白偶联受体的表达水平和自发的直接关系,并诱发的Ca 2 +瞬变21-24,变化最合乎逻辑的解释中Ca 2 +的数据的数据惊人的相似信令是,星形胶质细胞表面受体的表达水平有改变。一个互补的方法可能是一个重要的考虑因素,如果一个人想提供更多的证据有关的影响对Ca 2 +的活性位点。我们采用的策略是研究河豚毒素的潜伏期从星形胶质细胞MrgA1R小鼠海马脑片的效果。这些转基因小鼠表达外Gq蛋白G蛋白偶联受体(在MrgA1R)仅在星形胶质细胞。因为该受体是不是当地的大脑,没有内源性神经递质存在改变其活性水平。以前的工作表明,这种受体从事相同的细胞内信号分子作为内源性组I型mGluRs在同一星形胶质细胞34。从MrgA1R小鼠在TTX切片后长期培养后,在激动剂诱发MrgA1R反应没有差异相比于同窝对照孵育切片将提供的证据表明,在星形胶质细胞的影响Ca 2 +的活性是由于局部的表面受体变化,特别是如果I组代谢型谷氨酸受体的反应仍然显icantly增强在相同的星形胶质细胞。另一种选择,虽然也许更复杂的策略是从切片进行Western印迹分析分离的星形胶质细胞,只要一个膜部分可用于改变表面受体的表达水平进行分析。荧光激活细胞分选术(FACS)或流式细胞术可能会有所帮助这里。
这种技术对神经元的研究的可能的应用,星形胶质细胞和星形胶质细胞 - 神经元的相互作用是很多的。在我们的实验中,只DHPG诱发的I组mGluR星形细胞的Ca 2 +的反应进行了研究,在从幼年小鼠急性分离海马切片。该制剂不仅具有完好的传入(谢弗络),也认为它们(CA3锥体细胞)引起的神经元,使得可以操纵这些谷氨酸能神经元的放电率到突触后细胞(CA1区锥体细胞)和其进程ASSOCIAT在辐射层中的星形胶质细胞E而这些突触。急性海马脑片可能不适合操作其他类型的神经元的放电频率最好的准备,但是,由于许多传入神经从它们产生的神经元被切断。然而,它可能会在某些片制剂,观察其它星形细胞Gq蛋白G蛋白偶联受体亚型的可塑性。例如,切片可与基底前脑胆碱能神经元及其预测准备海马完好。这些切片中的TTX或升高的K +的孵化会影响胆碱能神经元的基底燃烧率,从而导致mAchRs的缩放在地层oriens的星形胶质细胞,其接收胆碱能输入1的显著部分。另一种研究大脑的特定区域之内的星形细胞受体缩放,与所有完整的连接而结垢发生时,可以使用一种体内模型,其中TTX的持续释放是通过PLAST植入实现尚未检验方法关注35以上的地区IC聚合物的Elvax 40W。这种方法已在神经元比例的研究以前使用,但也应适用于星形胶质细胞的比例。最后,用正确的读出,未来的研究可以探讨其他G蛋白偶联受体家族,包括改变G S或G 我 G蛋白偶联受体。也许有人会预测星形细胞的GABA B G我的GPCR受到影响下面的局部投影任何片内准备GABA的interneurons抑制射击。靶向其他信号分子,如第二信使cAMP的实时指标新指标的开发,将开辟的神经元到星形胶质细胞受体传播研究一个全新的领域。
星形细胞mGluR的通过操纵基底神经元放电频率的双向定标提供了星形胶质细胞的神经递质的AP-介导的释放灵敏度的测量。星形胶质细胞可以明显地感觉到自发的AP和glutamaTE发布在谢弗侧支-CA1锥体细胞突触甚至当细胞外K +是一种生理范围内。虽然河豚毒素急性应用程序不减少星形胶质细胞自发的频率Ca 2 +的活动18,36,37,在成为去相关的36人口的星形胶质细胞中的Ca 2 +的活性,提供的证据表明,星形胶质细胞受体的AP探测器。这表明,星形胶质细胞自发的感觉神经元的AP与他们的整体Ca 2 +的活性没有影响。它已被广泛接受的细胞内浓度的IP 3的需要达到一个阈值电平,以刺激IP 3卢比到足以导致可检测Ca 2 +的升高。可以自发的神经元的AP激活星形胶质细胞的G蛋白偶联受体,而不产生可衡量的Ca 2 +升高?未来的研究可以利用荧光共振能量转移(FRET)或类似的技术部历史神游(如BRET)研究G蛋白偶联的受体(受体激活的量度)和Ca 2 +的释放从内部存储之间的关系。 BRET已被广泛用于在体外检测G蛋白对GPCR耦合38,尽管它可能需要一些时间这项技术变得可用于在完整的组织制剂后使用。这可能是星形细胞Gq蛋白的GPCR被激活大大多于可以使用当前可用的Ca 2 +的成像工具被记录。除了 感知动作电位,星形细胞Gq蛋白G蛋白偶联受体也可能是能够检测神经递质的微型量子释放的报道在最近的研究39。这里描述的双向缩放方法可用于在将来的研究中,以提供给该星形细胞Gq蛋白GPCR的检测量子囊泡释放神经递质,通过包括巴弗洛霉素A1在孵化协议的程度的一种度量。
ntent“>到目前为止,缩放协议都只是从幼年小鼠(P12-P18)海马使用,因此它是目前未知的,如果星形细胞受体的比例也可以诱导成年小鼠的组织。一个引人注目的最近的一项研究表明,星形胶质细胞I组mGluR表达的年龄后的第一周大幅减弱,并继续下降,直到成年,在成年星形胶质细胞40受体的表达水平很低,因此这将是有趣的,以确定是否星状细胞的mGluRs扩大下长长期抑制成年小鼠海马脑片的水平接近的负责人在幼年小鼠星形胶质细胞神经元放电。这个发现表明,星形胶质细胞受体表达也不是一成不变的在给定的年龄,但可以迅速改变取决于神经元活动的水平。相反, I组在成年小鼠mGluR的表达降低,有证据表明肾上腺素能受体,包括&#945,1A,2Aα和β1亚型,主要是通过在成人大脑3,4星形胶质细胞表达。在α1A肾上腺素Gq蛋白G蛋白偶联受体可能是神经元对胶质细胞通信未来的研究,包括这些受体是否改变肾上腺素能神经元放电频率敏感的一个有吸引力的目标。披露声明
作者希望向公众披露,在这些研究中使用的河豚毒素是从Abcam公司购买。 Abcam公司曾在假设,设计或收集的数据不参与。发生的所有有关的工作由Abcam公司赞助的沟通后,同行评审过程已经完成。
致谢
作者要感谢加州大学河滨分校的中心胶质细胞神经元的相互作用的缩放协议和数据有价值的讨论。作者也想给一个真诚的感谢您对Abcam公司赞助其作品的出版。
材料
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
参考文献
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。