Method Article
신경 발사 환율의 조작에 의해 성상 세포 수용체의 가소성을 유도
요약
여기에서 우리는 성상 교세포 G 단백질 결합 수용체의 가소성 연구를위한 신경 세포의 항상성 가소성을 유도하기 위해 사용되는 프로토콜의 적응을 설명합니다. 최근 성상 세포 그룹 청소년 생쥐 내가 mGluRs의 변화를 검사하는 데 사용되는 방법은 현장에서 생체 성인 마우스의 조직에서, 다양한 성상 세포의 GPCR의 확장을 측정하고, 성상 세포 수용체의 감도의 더 나은 인식을 얻기 위해 적용 할 수있는 신경 활동의 변화에.
초록
연구 년에 가까운이 현장과 생체 내에서 성상 세포가 neuronally 출시 송신기에 의해 자극 될 수 많은 G 단백질 결합 수용체 (GPCR에)을 표현하는 설립했다. 그러나, 신경 활성의 변화에 응답하여 가소성을 나타내도록 성상 세포 수용체의 능력은 거의 주목을 받고있다. 여기에 우리가 전 세계적으로 확장 또는 성상 교세포 그룹 아래 내가 급성 뇌 조각에 글루타민산 염 수용체 (mGluRs을)의 대사에 사용할 수있는 모델 시스템을 설명합니다. 포함 양방향 형광 칼슘 2 + 지표와 신경 활동 전위 주파수, 부하 성상 세포와 성상 세포 프로세스를 조작, 장기 슬라이스 배양에 적합한 챔버를 구성, parasagittal 해마 조각을 준비하고, 녹음에 의한 성상 세포되어 Gq GPCR 활동의 변화를 측정하는 방법에 대한 방법은 다음과 같습니다 공 초점 현미경을 사용하여 자연과 유발 성상 세포 칼슘 2 + 이벤트. 본질적으로, "칼슘 Roadmap "성상되어 Gq의 GPCR에의 가소성을 측정하는 방법을 제공합니다. 성상 세포의 연구를위한 기술의 응용 프로그램에 대해 설명합니다. 성상 세포 수용체 신호가 신경 활동의 변화에 의해 어떻게 영향을 받는지에 대한 이해를 갖는 것은 두 정상 시냅스 기능뿐만 아니라 프로세스 기반 신경 장애 및 신경 퇴행성 질환에 대한 중요한 의미가 있습니다.
서문
성상 세포는 2 + 성상 세포되어 Gq의 GPCR에의 활성화에서 거의 독점적으로 인해 발생하는 세포 내 칼슘의 증가와 신경 세포 또는 신경 세포의 축색 돌기의 자극에 초 이내에 응답합니다. 예를 들어, 무스 카린 성 아세틸 콜린 수용체 1, 칸 나비 노이드 수용체 2, α의 1A 아드레날린 수용체 3, 4, 그룹 I mGluRs (아래 참조) 심하게 신경 세포의 활동에 응답 모든 성상되어 Gq GPCR의 하위 유형. 성상 세포 그룹 I mGluRs의 활성화는 (급성 해마 조각 등) 현장에있는 신경 세포의 글루타메이트의 구 심성 신경의 자극 5-7뿐만 아니라 생체 내에서 성인 마우스 피질의 감각 자극 8 다음 다음, 가장 광범위하게 증명되었다. 생물학 및 성상 세포, 신경 세포, 성상 세포 또는 신경 세포의 상호 작용의 생리에 신호 성상 교세포되어 Gq GPCR의 활성화의 결과는 논쟁 9-12의 문제이다. 이들 것입니다신경 세포 간 성상 세포 수용체 신호의 기능 전에 오메 시간은 충분히 높게 평가되고 있습니다.
이 신경 세포는 실험 프로토콜을 사용하여 성상 세포 수용체를 활성화 할 수있는 것은 분명하지만, 제대로 이해 남아있는 신경 세포 간 성상 세포 수용체 통신의 측면이 있습니다. 우선, 성상 교세포되어 Gq의 GPCR을 활성화하는 데 필요한 신경 활성의 실제 양이 잘 정의되지 않고, 둘째, 사용 의존 가소성을 나타내도록 성상 세포 수용체의 능력은 거의 주목을 받고있다. 이러한 문제를 해결하기 위해 시작하려면, 우리는 최근 신경 세포의 활동 전위의 장기 변화 (AP)에 의존하는 시냅스 활동에 대한 응답으로 성상 세포 그룹 급성 청소년 해마 슬라이스에있는 I mGluRs의 양방향 확장을 유도하는 프로토콜을 개발했다. I mGluRs이 fo를 확장 신경 세포의 이온 성 글루타메이트 수용체 (13, 14), 성상 교세포 그룹의 양방향 항상성 소성에 발견 된 것과 유사한llowing의 신경 세포의 활동 전위의 봉쇄와 신경 세포 활동 전위 주파수가 15 증가 할 때 아래로 확장 할 수 있습니다. 성상 세포 수용체에 이러한 보상 변화는 자연 기록하여 측정 및 성상 세포 칼슘 2 + 과도 상태를 유발하고 제어 조건에서 성상 세포에서 사람들에게 이러한 이벤트의 특성을 비교 할 수 있습니다. 이 논문에서, 우리는 성상 세포 수용체의 조절을 유발하는 급성 해마 슬라이스, 배양 조건의 준비를 포함하여,이 프로토콜의 사용을위한 완벽한 방법을 설명하는, 성상 세포 칼슘 2 + 지시 염료 로딩, 칼슘 2 + 영상 공 초점 현미경을 사용하여 기술 및 기대 효과 성상되어 Gq GPCR 활동에. 성상 세포에 대한 효과를 예측 칼슘 2 시그널링 속성 + -되어 Gq의 GPCR의 다른 발현 형질 배양 세포에 이전에 기록 된 것과 일치 -로 변경을 검정 미래 연구에 사용될 수있는 "로드맵"을 제공한다trocytic GPCR 식입니다. 이 기술의 사용에 대한 파급 효과와 잠재적 인 응용 프로그램은 건강하고 병에 걸린 뇌의 성상 세포 - 신경 세포의 상호 작용에 대한 우리의 이해에 기여할 것입니다.
프로토콜
다음 절차는 캘리포니아 리버 사이드 대학의 기관 애니멀 케어 및 사용위원회에 의해 승인되었습니다.
1. 보육 회의소 슬라이스 홀더 건설
- 배양 챔버를 구축 : 비 독성 물질로 배양 챔버를 구축합니다. 챔버는 공기 순환을 제어했다는 것을 확인, 떠 슬라이스 홀더 ACSF의 충분한 양을 유지하고, 산소 라인에서 가스 분산에서 발생하는 동안 슬라이스 홀더는 챔버의 일단에 뜰 수 있도록 충분히 크다 다른 쪽 끝. 그 밀폐 뚜껑 (그림 1A)와 피펫 저장 용기의 서랍 부분은 잘 이러한 기준에 적합합니다.
- 약 1 ¼ 위에서와 ¼의 측면에서 용기의 측면에 작은 구멍을 드릴. 구멍을 통해 유연한 튜브의 조각을 장착 (그림 1B). 뚜껑이 닫힐 때 튜브가 솔루션 위가되도록 충분히 높은 아직 압축되지 않도록 충분히 낮은 드릴주의하십시오.
- 산소 라인과 챔버 사이에 방수 씰을 만들기 위해 실리콘 심 밀봉 제 ( "수족관 심 봉인")를 적용합니다.
- 수컷 루어 피팅을 사용하여 연료 탱크 (95 % 산소, 5 % 이산화탄소)로 튜브의 "외측"단부를 연결한다. 관례 적합의 경우, 컷 - 맞는 자연 경 200 μL 피펫 팁 (그림 1C)를.
- 한 - 투 - 여섯 줄의 플라스틱 매니 폴드 튜브의 "내부"끝을 연결합니다. 자르에 맞는 각각의 매니 폴드 입구 (그림 1D)에 여섯 20 ㎕를 에펜 도르프 microloader 피펫 팁. microloaders의 미세 구멍은 작은 기포를 일정하게 생산에 이상적입니다.
- 통풍을 위해 본 용기 (그림 1E)의 뚜껑에 두 개의 작은 구멍을 드릴.
- 슬라이스 H 구축나이 : 슬라이스 홀더는 부동 거품 랙 (그림 1 층)에서 이루어집니다.
- 거품 랙의 바닥 "다리"를 제거하고 약 1 ¾ 인치로 가기 잘라
- 여덟 아니라 슬라이스 홀더 (그림 1G)을 만들 시아 노 아크릴 레이트 접착제 (예 : 표준 크레이지 접착제 등)를 사용하여 라운드 랙의 바닥에 나일론 메쉬 소재의 조각을 붙입니다. 각 웰은 하나의 마우스 해마 슬라이스에 맞게 할 수 있습니다.
- 하나의 배양 챔버의 끝과 다른 쪽 끝에서 microloader 매니 폴드 장치에서 슬라이스 홀더를 장착한다. microloader 팁 챔버 바닥 (그림 1H)에 휴식 할 수 있습니다. 이 설정은 상부 및 급성 해마 슬라이스의 아래쪽에 모두 충분한 산화를 보장하기 위해, 및 거품 슬라이스 교반을 최소화하고 해마 슬라이스 거품의 직접적인 접촉을 방지하기 위해 직접 슬라이스 홀더 아래에 나오는 피하기 위하여 디자인된다.
- 배양 챔버에게 린스각 실험 후 DDH 2 O와 철저하게 D 슬라이스 홀더, 그리고 매주 70 % EtOH로 오염을 제거. 다른 해법 슬라이스 배양의 경우, 다 챔버 / 슬라이스 주주 필요할 것이다.
2. 솔루션 및 마약
- 인공 뇌척수 (ACSF) : 125의 NaCl, 2.5 KCl을, 2.5 염화칼슘, 1.3 MgCl2를, 1.25의 NaH 2 PO 4, 26.0 탄산 수소 나트륨, 15 : (mm 단위) 다음을 사용하여 DDH 2 O 표준 ACSF 4 L를 준비 포도당, 0.1 트롤. osmometer를 사용하여 용액의 삼투압을 측정, 그것은 ~ 310 mOsm에 와서해야합니다. 실험 조건에 대한 ACSF 조성물 (프로토콜 3 참조) 아래에 설명되어 있습니다. 압력 가마로 소독 한 유리 병에 0.22 μm의 병 상단의 필터를 사용하여 모든 솔루션을 필터링합니다. 솔루션은 한 달에 최대 4 ℃에서 안정적이다.
- 슬라이스 버퍼 : 125의 NaCl, 2.5 KCl을, 3.8 MGC를 : (mm 단위)를 포함하는 수정 ACSF를 사용하여 조각을 준비한다L 2, 1.25의 NaH 2 PO 4, 26.0 탄산 수소 나트륨, 15 포도당, 1.3 아스 코르 빈산. osmometer를 사용하여 용액의 삼투압을 측정, 그것은 ~ 310 mOsm에 와서해야합니다. 슬라이싱 버퍼 MgCl2를 2 염화칼슘의 교체 슬라이스 건강을 향상시킵니다.
- Sulforhodamine (101) (SR-101, 1 μM)는 급성 해마 슬라이스의 성상을 식별하는 데 사용된다. 125의 NaCl, 2.5 KCl을, 0.5 염화칼슘, 6 MgCl2를, 1.25의 NaH 2 : (mm 단위)은 다음과 같이 준비 수정 낮은 칼슘 ACSF 100 ㎖에서 60.67 mg의 SR-101을 희석하여 SR-101의 1 ㎜의 재고를 확인 PO 4, 26.0 탄산 수소 나트륨, 15 포도당, 1.3 아스 코르 빈산. 낮은 칼슘 ACSF의 오 스몰 농도 ~ 310 mOsm 있는지 확인합니다. 로딩을위한 수정 낮은 칼슘 2 + ACSF에 1 ㎜ SR-101 주식 1,000 배 희석. 4 ° C에서 마지막 SR-101 솔루션을 저장하고 실험을 위해 필요할 때까지 빛으로부터 보호.
3. L의 조작급성 해마 조각의 환율을 발사 사연 기간의 연결
장기 신경 발사 속도를 조작하는 별도의 실험에서 두 배양 프로토콜 중 하나를 사용
- 신경 세포의 발화를 억제 : 테트로도톡신 (TTX, 1 μM)에 품어 :주의 : 충분한 양을 섭취하면 치명적일 수 있으므로주의 TTX를 처리합니다. 장갑과 고글을 권장합니다. TTX는 완전히 급성 조각에 AP 기반의 연결 발사를 폐지. 3.5 MM K + ACSF의 조각을 품어 플러스 실험 조건에서 1 μM의 TTX. 제어 상태에서, TTX없이 3.5 MM K + ACSF의 조각을 품어. 두 가지 조건 사이의 비교가되어 Gq 성상 세포 GPCR 활동의 업 스케일링 효과를 보여준다. TTX 치료의 효과를 극대화하기 위해 (2.5 mM의 K + 말 대조적으로) 3.5 mM의 K + ACSF는 제어 조건으로서 역할을한다.
- 또는 -
- 위의 연결을 발사 증가기초 가격 : 높은 칼륨에 품어 : 증가 세포 외 K + 농도는 뉴런을 탈분극과 그 기초 발사 속도를 증가시킨다. 5.0 mM의 K + ACSF의 부화는 크게 2.5 mM의 K + ACSF 15에 비해 신경 세포의 활동 전위 주파수를 올린다. 실험 조건에 대해 5.0 mM의 K + ACSF의 조각을 품어, 제어 조건, 표준 2.5 mM의 K + ACSF의 조각을 품어. 두 가지 조건 사이의 비교가되어 Gq 성상 세포 GPCR 활동의 다운 스케일링 효과를 보여준다.
4. 급성 해마 슬라이스 준비
- 따뜻한 복구 챔버를 설정 :
- 35 ° C에 물 목욕을 따뜻하게 한 다음 내부의 준비 배양 챔버를 놓습니다. 배양 챔버 (그림 1G) 내에서 ACSF의 높이까지 물과 물을 욕조를 채우십시오.
- 95 % O 2 5 % C와 실험 및 제어 ACSF 산소를O 2. microloader 매니 폴드 장치에서 방출 된 기포가 작고 풍부하지만 부드러운해야하며, 챔버 내에서 ACSF의 가시적 인 움직임이있을 수 없습니다.
- 얼음처럼 차가운 해부 챔버를 설정 :
- 얼음의 두 양동이를 가져 가라. 얼음의 한 양동이에 버퍼를 깔끔히 약 300 ㎖의 병을 배치하고는 95 % O 2, 20 분 동안 5 % CO 2와 산소를 유지합니다. 불과 얼음의 표면 아래에 다른 얼음 통에 100mm 페트리 접시를, 잠수함. 페트리 접시 측은 얼음 직접 접촉 지킨다. 페트리 접시에 몇 가지 슬라이스 버퍼를 붓고뿐만 아니라 산소 유지.
- 이상 1 분 동안 페트리 접시에 빙냉 슬라이싱 버퍼에 수몰하여 단일 에지 면도날의 절삭 날을 풀어.
- Vibratome 설정 :
- vibratome 켜고 배수가 닫혀 있는지 확인하십시오.
- 진동의 절단 실을 확보메 절단 실 주위에 팩 얼음. 0-4 ° C.에 Precool
- 공장은 5 분 동안 70 %의 EtOH에 몸을 담근 후 ddH2O로 세척하여 두 배 가장자리 면도날에서 그리스 제거합니다. (잎이 구부러지지 않는 것) 절단 블록에 반 블레이드를 장착 조심스럽게 반으로 잘라.
- 마우스의 뇌를 제거 :
- 킴 와이프 나 면봉에 적신 0.5 ㎖의 이소 플루 란과 함께 미리로드 작은 실에서 12-18 일 된 C57BL/6J 마우스를 마취. 부드럽게 고통 반사가 없는지 확인하기 위해 동물의 발가락을 꼬집어.
- 날카로운 가위를 사용하여 마우스를 목을 베다, 다음 작은 집게를 사용하여 두피를 제거합니다. 종 방향 균열을 따라 후각 전구에 소뇌에서 두개골을 잘라 작은 뼈 가위를 사용합니다. 작은 집게를 사용하여 두개골 뚜껑을 제거합니다. 부드럽게 주걱으로 두뇌를 제거하고 배양 접시에 얼음처럼 차가운 산소 슬라이스 버퍼에 잠수함.
- Bisec냉각 및 산소에 대한 더 많은 표면적을 허용하는 페트리 접시에서 냉장 면도날 마우스 뇌 t. 양분 반구 2 ~ 3 분 동안 얼음 차가운 슬라이싱 버퍼에 앉아 보자. 뇌는 완전히 시원하고 더 단단한 될 것이다.
- vibratome의 플랫폼에서 시아 노 아크릴 레이트 접착제의 얇은 레이어를 적용합니다. 앞으로 직면 후각 망울로, 플랫폼 컷 사이드 아래로 측면 업 양반을 붙입니다. 절단 실에서 플랫폼을 확보 한 다음, 얼음 추위에 잘 산소 슬라이싱 버퍼를 절단 챔버를 입력합니다.
- vibratome를 사용하여 300 μm의 두께 parasagittal 조각을 준비하는 동안 절단 실을 산소를 계속합니다. 85 Hz의 주파수에서 잘라 슬라이스, 0.20 / 초 mm, 및 1.40 mm의 진폭의 전진 속도. 참고 : 우리는 건강한 급성 해마 슬라이스를 준비하는 가장 중요한 변수가 vibratome의 질 것으로 나타났습니다. 우리 연구소는 라이카 VT 1200 S 자석을 사용하여IC는 "Z"진동을 줄이기 위해 vibrocheck vibratome로 구동한다.
- 슬라이스 한 후, 날카로운 집게를 사용하여 각 parasagittal 조각 중 해마와 인접한 entorhinal 피질을 해부하다. vibratome의 절단 실에서 얼음처럼 차가운, 잘 산소 슬라이싱 버퍼에이 절차를 수행합니다. 그것은 조각의 처리를 최소화로 집게의 선명도는 슬라이스의 건강에 매우 중요합니다.
- 유리 파스퇴르 피펫의 긴 끝을 깨고 피펫 전구 파손 된 부품을 토핑하여 전송 피펫을 확인합니다. 이 조각을 전송하는 피펫의 큰 끝의 사용을 가능하게한다. (자료 표 참조) 큰 끝의면 플러그없이 피펫을 주문해야합니다. 슬라이스가 비 멸균 조건에서 제조되기 때문에 새로운 피펫 준비 각 실험에 사용한다하더라도, 그것은 사용하기 전에 피펫 오토 클레이브 할 필요가 없다.
- 35 ° C의 물에서 배양 챔버 각 해마 슬라이스로 이동목욕, 슬라이스 홀더의 각 웰 내부의 ACSF로 전송 피펫을 담그고 조각을 흡입하여. 이 과정에서 조각의 움직임을 최소화합니다. 서서히 온도를 "램핑"보다 더 나은 품질의 조각에 따뜻한 배양 목욕 결과 조각의 직접 전송.
- 해마 조각은 다음과 같이 나누어 45 분의 총에 따뜻한 물을 욕조에 복구 할 수 있습니다 :없이 (저 칼슘 ACSF로 전송 한 후, 저 칼슘 ACSF에 희석 1 μM SR-101에 20 분 동안 조각을 품어 SR-101) 10 분. 그 후, 따뜻한 배양 나머지 15 분 동안 제어하는 조각 또는 실험 ACSF을 전송합니다.
- 45 분 따뜻한 복구 한 후, 조심스럽게 벤치 톱에 35 ° C의 물을 욕조에서 배양 챔버를 이동 한 다음 조각은 알약 로딩을 시작하기 전에 3 시간의 총 배양 시간 동안 실온에서 배양을 계속 할 수 있도록 프로토콜 (아래 참조).
5. 칼슘 2 + 표시와 성상의 알약 로딩
- 준비 칼슘 2 + 표시 알약 로딩 염료 :
- 염료 (50 μg)의 각각의 병에 대해, 신선한 디메틸 설폭 사이드 (DMSO) 철저하게 소용돌이의 3.87 μl를 추가합니다. DMSO의 선도가 좋은로드에 중요하기 때문에, 신선한 앰플 때마다 열려있는 균열.
- 철저하게 20 % 플루로 닉 산 소용돌이의 10 μl를 섞는다. 10 μM의 최종 염료 농도, 적절한 실험 또는 제어 ACSF 잘 와동 100 μL와 염료를 혼합.
- 원심 분리 여과 튜브를 이용하여 용액을 고를. 이 단계는 염료의 배출되어 막히는로드 피펫을 방지 할 수 있습니다.
- 염료 용액으로 가득 할 때 약 1.3 MΩ의 저항을 뽑아 붕규산 유리 모세관에서 피펫을 준비합니다.
- 현미경과 함께 사용하도록 설계된 기록 챔버로 해마 조각을 놓고연속적이 (1.5 ㎖ / 분)에서 인큐베이션 하였다 동일한 조성의 산소 ACSF와 perfuse. 제어 및 실험 조건 사이의 대체 해마 슬라이스를 선택.
- 건강에 해로운 찾고 해마 조각을 폐기하십시오. 슬라이스의 품질에도 주어진 실험 내에서 변할 것이다. 슬라이스 건강을 정량화에 대한 설정 기준이 없습니다, 따라서 슬라이스 건강의 결정은 주관적인 주로 경험에 근거한다.
- 일반적으로 매끄러운 나타나는 표면과 건강한 CA1 피라미드 세포의 높은 비율 (그림 2A)가 조각을 유지합니다. CA1 피라미드 세포 조각을 수락 또는 거부를위한 유용한 기준이 될 수 있으므로 건강한 CA1 피라미드 뉴런의 큰 비율 (≥ 75 % 할인)를 갖는, 특히 민감하고 CNS 모욕에 취약합니다.
- 약> 25 % 죽은 신경이 조각을 폐기하십시오. 죽은 신경 세포는 기름에 튀긴 된 계란 같은 모양 (그림 2B)가있다. 참고 : 우리는 하컷의 각도가 신경 세포의 건강 여부를 표시할지 여부에 중요한 역할을한다는 것을 관찰했습니다. 신경 세포의 수상 돌기가 (슬라이스)의 개 위쪽으로 돌출되는 경우, 뉴런은 대부분 죽은 것입니다. 신경 세포의 부피와 같은 큰 비율이 수지상 트리에 포함되어 있기 때문 수지상을 절단하는 것은 세포에 치명적인 것을 생각된다. 덴 드라이트가 슬라이스 표면으로부터 하향 각으로 또는 평행을 투영하는 경우 한편, 건강한 신경 세포의 높은 비율이있을 것이다. 경우에 따라서 신경 세포는 주로 조각의 한면에 죽은 다른 측면에서 찾고 건강한 것입니다.
- 미분 간섭 대비 (DIC) 광학 장치를 사용하여 크기, 형태 및 위치에 따라 40 ~ 70 μm의 슬라이스 표면 아래 SR 성상 세포의 적절한 필드를 찾습니다.
- 염료 용액을 유리 피펫을 넣고 표준 패치 클램프 holde 미세 전극을 이용하여 해당 필드 위에 슬라이스의 표면에 내려R. 조각의 표면에서 피펫, 배출 염료를 시작 피펫에 압력을 다시 적용합니다. 염료의 방출은 DIC 광학 등 녹색 염료의 488 라인으로 적절한 레이저 모두에서 볼 수 있습니다.
- 천천히 약 40 ㎛의 미세 조작기를 이용하여 조각의 표면 아래에 피펫을 낮추고 염료가 약 45 ~ 60 초 동안 배출 할 수 있습니다. 그런 다음, 피펫 추가로 35 μm의 (슬라이스 표면 아래 75 μm의)를 절감하고 약 45 ~ 60 초 동안 염료를 꺼냅니다. 천천히 조각에서 피펫 팁을 철회. 이상 분사 기록 신호 대 잡음비를 감소 배경 로딩을 증가시키는 경향이있는 반면 짧은 분사 시간이 불충분 염료 로딩을 초래할 가능성이있다.
- 성상 세포의 많은 수의 염료를 가지고 있는지 확인하기 위해, 가까운 거리에 두 번째 염료 알약을 주입하는 것이 도움이됩니다. 다시 조각의 표면에 피펫을 높이고, 피펫이 막혀 있지 않은지 확인 후, 미주리지층 radiatum 함께 약 80 ~ 100 ㎛의 거리에 첫 번째 주사 부위에서 피펫을했습니다. 이 사이트에서 일시 주사를 반복합니다.
- 염료를 채택하는 성상 세포에 이미징 전에 감소하는 배경 신호에 대해 30 ~ 45 분을 허용합니다. 이 시간 동안 재관류 챔버의 조각을 남겨주세요. 이 배양 시간이 실험의 총 4 시간의 치료에 내장되어 있는지 확인합니다. 다음 슬라이스를 반복 5.2-5.8 단계를 얻습니다.
6. 해마 슬라이스에 기록 자발적이고되어 Gq GPCR 작용제 - 유발 성상 세포 칼슘 2 + 활동
- 이미징을위한 공 초점 현미경을 설정 :
- 높은 노출 표백 및 / 또는 광독성을 염료로 이어질 수있는 레이저 광에 슬라이스 노출을 제한하는 것은 극히 중요하다. 높은 광학 배율 또는 증가 줌 설정을 사용하면 영상화 분야에 빛에 노출을 증가시킨다. 따라서, 높은 광전자 증을 맞춘다 각 레이저에 대한 기본값을 설정g, 1X 이득 및 0.5 %의 레이저 출력 파워.
- 성상 세포 프로세스의 더 나은 시각화를위한 1.5 배 줌을 적용합니다.
- 필드 해상도를 512 X 512 픽셀로 설정합니다.
- ~ 하나의 방법 스캔 모드를 사용하여 스캔 당 1.2 초이다, 가장 빠른 주사 속도를 설정합니다.
- 488 nm의 레이저 503-548 nm의 및 559 nm의 레이저 624-724 ㎚의 대역 통과 필터를 사용하여 발광 스펙트럼을 수집합니다. 이러한 설정은 성상 세포의 세포체 및 메인 프로세스를 관찰하기에 충분한 해상도에서 비교적 빠른 속도로 ~ 5-8 성상 세포의 필드의 이미징을 허용한다. 이상적으로, 현장에서 성상 세포는 분명하게 볼 수있을 정도로 밝은, 그러나 어떤 픽셀의 채도없이 될 것입니다.
- + 559 nm의 레이저를 사용하여 SR-101 colabeling를 시각화하여 성상 세포로 염색 칼슘로드 세포의 신원을 확인합니다.
- 기록 성상 세포 칼슘 2 + 활동 :
- 관심 영역을 통해 이미지 수집 소프트웨어 (RO를 사용하여 상자를 그립니다성상 세포의 세포체 이상이 경우에는, 세포 내에서)이다. 바꾸거나 최상의 신호 대 잡음비를 달성하기 위해, 배경 픽셀을 포함해서는 안된다. 참고로 배경에 하나의 상자를 그립니다.
- 실험의 나머지 부분을 통해 실험 ACSF 플러스 1 μM의 TTX (ABCAM)로 관류를 전환합니다. 이것은 가능한 모든 신경 AP 중심의 성상 세포의 칼슘 반응을 제거합니다. 성상 세포 칼슘 2 + 농도의 증가 나머지는 다음에 의한 계량 적 기공을 갖는 릴리스 제정 (기초) GPCR 활동, 또는 두 메커니즘의 조합 일 것이다.
- 모든 로아에서 시간이 지남에 기록 형광. 기준에 형광의 모든 증가는 세포 내 칼슘 이온 농도가 16의 증가를 표시하고 성상 10, 17, 18, 따라서 GPCR 활동. TTX에 의해 성상 세포 수용체에 대한 모든 가능한 초기 스케일링 효과를 방지하기 위해, 40 분 FR 내에서 완전한 실험톰 시간은 1 μM의 TTX 관류가 시작했을 때.
- 자연 칼슘 2 + 활동의 기준 기록 10 분을 얻은 후, 순차적으로 증가하는 농도 (예 : DHPG 등) 그 효능을 적용합니다. 가능한 수용체의 탈감작을 줄이기 위해 응용 프로그램 사이에 최소 5 분을 남겨주세요.
- 기록의 끝에서 그대로 성상되어 Gq GPCR이 신호 전달 경로에 대한 긍정적 인 제어로 다른 성상 세포되어 Gq의 GPCR에 대한 작용제의 칵테일을 적용합니다. 작용제 칵테일의 구성 요소는 관심의 수용체에 따라 달라집니다. 되어 Gq GPCR의 각 10 μM은 [H1R], 무스 카린 성 아세틸 콜린 수용체 [mAchR], 그리고 퓨린 수용체가 [P2YR], 각각 일반적으로 사용되는 효능 칵테일입니다 히스타민 H1 수용체를 자극하는 히스타민, 카바 콜, 그리고 2 NA-ATP를 주작 동근.
- 후 실험 영상 획득 :
- 칼슘 + 녹화 완료시, 488 ㎚, 559 nm의 레이저, F와 정지 영상을또는 성상 세포의 정체성과 ROI 배치 이후 확인. (도 2a)의 데이터에 영향을 미치는 레이저 광 강도에 대한 우려가 더 이상 존재하는 한 레이저 파워와 HV 설정, colocalization을위한 최적의 이미지를 획득하기 위해이 시점에서 자유롭게 변경 될 수 없다.
- 반복 약 8 조각 및 / 그룹 (40) 성상 세포의 총 6.1-6.3 단계를 반복합니다. 조각은 3 가지 마우스의 최소에서 와야한다.
7. 성상 칼슘 2 + 활동 분석
- 칼슘 2 + 고도 정의 : 2 + 과도 칼슘을 정의 표준화하는 것은 확실히 과학계 내에서 확립되어 있지 않다. 다음은베이스 라인 노이즈 중 가양 이벤트 감지를 제한하면서 감도를 극대화하는 일반적인 프로토콜입니다.
- 다른 랩 부재 맹목적들을 분석하기 위해 각각의 슬라이스에게 숫자 코드를 할당 하였다. 분석의 결론에서, 각 조각을 디코딩.
- 오프라인 이미지 분석 소프트웨어를 사용하여 자연과 유발 성상 세포 칼슘 2 + 고도를 분석합니다. 다시 그리고 / 또는 크기, 형상 및 원하는 ROI 영역의 위치를 조정한다.
- 칼슘 2 + 입면 등 기준선 위에 형광 강도의 점수가 증가 피크 진폭이 적어도 두 개의 연속 된 샘플 점 평균 기준선 형광의 30 초간의 평균값이 상기 표준 편차 (SD)보다 큰 경우. 특히 소음이 녹음에서 (신호 대 잡음 낮음),이 기준은 평균 기준 형광 위 3 SD로 조정해야 할 수도 있습니다. 형광 강도는 평균 이상 하나의 표준 편차를 초과하기 전에 마지막 데이터 점으로 각 CA 2 + 고도의 발병을 정의합니다.
- multipeak 대 연속 단일 피크 이벤트 사이의 차별화. 형광 강도 및 위해 (평균 기준 값 +2 SD 이하) 기준에 반환하지 않는 경우 "multipeak"로 이벤트를 점수# 8804; 피크 사이의 9 연속 데이터 포인트 (10.8 초). 따라서, 하나의 피크 이벤트의 사이에 그 10 개 이상의 연속 기준선 데이터 포인트가됩니다.
- 형광 강도는 적어도 3.6 sec 동안 피크 진폭 (피크 값의 ± 10 %)을 유지하면 "고원"형 응답으로 이벤트를 분류.
- 자연과 효능 - 유발 칼슘 과도 전류의 진폭, 주파수 및 반응 속도를 분석합니다.
- ( "multipeak"응답의 경우에 첫 번째 피크를 사용하여,도 2B 참조) 가장 높은 강도 값을 가진 데이터 요소로서 칼슘 2 + 상승의 피크 진폭을 정의한다.
- 피크 진폭에 대응하는 응답 발병과 시간의 차이로서 상승 시간을 계산한다. NOTE : 0-100% 상승 시간은 시간 값을 구하는 데이터 포인트의 수가 충분하기 위해 사용될 필요가있다; 속도 여기서 중요한 변수이다 스캔.
- 시간과 대기 시간을 계산응답 발병 작용제 관류의 개시 사이. 시간이 오래 세척 된 시간이 응답 대기 시간을 계산에 혼동을 생성, 뇌 조각에 더 유용하게 측정 될 수있다 상승.
- 학생의 독립적 인 t-검정을 사용하여 각 매개 변수에 대한 두 그룹 사이에 유의 한 차이는 통계적으로이 있는지 확인합니다. 'N'으로 성상 세포의 번호를 사용합니다. 제어 및 치료 그룹 사이에 칼슘 2 + 활동 패턴을 비교하는 피어슨의 카이 제곱 검정을 사용합니다. 제어 및 치료 그룹 사이에 특정 칼슘 2 + 활동 패턴의 비율을 비교하는 피셔의 정확한 2 꼬리 테스트를 사용합니다. *의 P <0.05, ** p <0.01의 차이를 표현하고, *** P <0.001.
결과
그림 3의 대표적인 결과는 SR 성상 세포 칼슘 2 + 활동에 4-6 시간 동안 TTX 급성 마우스 해마 슬라이스 배양의 효과를 발휘합니다. 데이터는 ACSF 플러스 TTX 대 제어 ACSF 배양 조각에서 자연 칼슘 2 + 과도 및 DHPG-유발 그룹 I mGluR 칼슘 2 + 반응을 모두 포함한다. 기본 특성을 형태 학적 특징, 별 모양의 프로세스 조립 및 작은 소마 크기 (~ 10 ㎛) 외, 성상 세포가 선택적 성상 세포 마커 SR-101 19, 20 (과 칼슘 2 + 표시 OGB-1 오전 오버레이하여 SR에 식별 도 3A). 성상 세포의 세포체 이상의 번호를 바꾸거나도 3b에 도시 된 시간 트레이스 위에 형광 번호에 대응한다. 그룹 1 mGluR 작용제 (RS)-3.5-DHPG은 성상 세포에서 1 군 mGluRs에 특정 스케일링 효과를 결정하기 위해 적용된다. 은 phys 구별하기다른되어 Gq의 GPCR에 비해 1 군 mGluRs로 스케일링 효과의 특이성에 iology, 작동 제의 칵테일은 각 실험의 끝에인가한다. 여기에서 우리는 히스타민, carbamylcholine 클로라이드 (카바 콜)과 아데노신 5'-ATP 나트륨 (NA-ATP)를 주작 동근 10 μM되어 Gq GPCR의 각을 사용했다. 작용제 칵테일은 그 특정 성상 세포는 DHPG에 대한 응답을 유도하는 수용체의 충분한 양을 표현하지 아마도 때문에, 세포가 DHPG에 반응하지 않는 경우에 가능한 응답 성 성상 세포를 식별 할 수있는 긍정적 인 제어 역할을합니다.
우리는 성상 세포 그룹 I mGluRs의 변화를 드러내는을 지원하기 위해 5 μM 및 15 μM (그림 3B)뿐만 아니라, 30 μM, 50 μM (그림 4A)를 포함 DHPG의 다른 농도를 사용했다. 세포 칼슘 2 + 반응과되어 Gq GPCR 발현 수준 사이의 관계는 시험 관내 21 ~ 24 이전에 조사되었다. 우선,특정 작용제의 농도에 대응하는 임계 값은 각각의 셀에 의해 표현 수용체의 밀도에 의존한다. 세포 집단에서보다 세포는 세포가 수용체의 높은 밀도로 형질 작용제의 농도에 관련 칼슘 2 + 상승으로 반응한다. TTX 슬라이스 잠복기 후에, 인구 성상 세포의 비율이 증가 작용제의 고정 농도 (도 3B 및 3C)에 응답. 우리는 30, 50 μM DHPG가 5.0 밀리미터 K + 조절 대 처리에 그룹 I mGluR의 응답을 비교하는 데 필요한 반면, 5 μM 및 15 μM DHPG는, 제어 및 TTX 처리 된 세포 사이의 반응 성상 세포의 비율 분명한 차이를 보여 것을 발견했다 세포 (그림 4A).
성상 세포 칼슘 2 + 반응 패턴 및 작용 물질 농도의 관계는 또한 동일 반응계에서 조사되었다. 효능을 증가농도는 단일 피크 칼슘 2 + 고도 2 + 고도 25 ~ 27 주 multipeak와 고원에서 성상 세포에서 칼슘 2 + 반응의 패턴을 이동합니다. 이러한 이전의 연구 결과에 기초하여, 우리는 수용체 발현 수준의 변화가 있는지 작용제의 단일 농도 응답 패턴이 교대 것이라고 예측 하였다. 따라서, 두 개의 스케일링 방법 중 어느 (신경원 발화를 억제 또는 증가) 활용되고에 따라 특정 응답 패턴을 생성하는데 필요한 작용제의 농도를 증가 또는 감소 할 것이다. 예를 들어, TTX 배양 성상 세포는 더 많은 고원 형 칼슘 2 + 고도에 자신의 DHPG-유발 칼슘 2 + 응답 패턴을 이동하고 성상 세포 (그림 3C)를 제어에 비해 효능 농도를 낮추기 위해 반응한다. 계정에 이전 연구를 복용, 이러한 관찰은 그룹 성상 세포에서 I mGluR 수용체의 발현이 증가하는 것이 좋습니다.
칼슘 2 + 고도의 시간과 발병 (지연) 상승은 직접 배양 세포 22 ~ 24에되어 Gq GPCR 발현 수준의 변화에 상관 관계를 보여왔다. 수용체 밀도 감소가 반대의 효과를 생성하는 동안 높은 수용체 발현 수준은 짧은 응답 대기 시간 및 더 빠른 상승 시간을 초래한다. TTX, 캘리포니아에있는 성상 세포 배양을 위해 DHPG의 응용 프로그램에 의해 유발 2 + 과도 제어 ACSF (그림 3D) 배양 성상 세포에 비해 훨씬 더 빠른 상승 시간이 있습니다. 효능 - 유발 칼슘 2 +의 답변으로 이전에 언급, 진폭에 관계없이 작용 물질 농도 또는 스케일링 모델 15 (그림 3D)의 변경되지 않습니다.
직접 그룹을 활성화하여 관찰 된 변화뿐만 아니라 내가 DHPG와 mGluRs, 자연 성상 세포 칼슘 2 + 활동도 크게이 조작에 의해 영향을받습니다. 우리는 관찰제어 대 TTX 배양 자발적으로 활동 성상 세포의 비율에 다 2.26 배 증가했다. 이 성상 세포 (그림 3E)를 배양 TTX에서 42.1 %로 소마의 자발적인 활동을 나타내는 제어 성상 세포의 단지 12.9 %의 증가이다. 그것이 공지되어 있으므로 그 작용제 (21), (26), (28)의 부재, 및 수용체 발현 정도가 증가함에 따라이 고유 활성 증가의 수준은, 이러한 데이터를 제시한다는 점에서 GPCR에 전시 "진성"또는 구성 적 활성 해당 성상되어 Gq GPCR에 증가 밀도 신경 활동 전위 소성 장기 환원을 다음. 효능 - 유발 반응과 유사하게, 자연 칼슘 2 + 고도의 상승 시간은 (그림 3E)을 증가합니다.
제 2 프로토콜, 상승 된 세포 외 칼륨 (5.0 ㎜)의 인큐베이션을 사용하여 대표 데이터는 인터넷에 도시되어gure 4. 세포 외 K +의 기초 CA3 신경 세포의 활동 전위의 주파수 (15)의 상당한 증가에 2.5-5.0 mM의 결과에서 증가했다. DHPG (30 μM 및 50 μM)의 높은 농도가 높은 칼륨 (그림 4a 및도 4b)에서 배양 성상 세포에서 그룹 I mGluR 칼슘 2 + 반응을 불러 일으킬하기 위해 필요합니다. 이것은 신경 활동 전위에서 장기간 상승 다음 교세포에서 그룹 I mGluR 반응성의 감소 수준과 일치한다. 또한, DHPG의 고정 농도 유발 반응 패턴은 약한 단일 피크 응답 (그림 4B)에 고원과 같은 반응에서 이동합니다. 이 칼륨 조건에서 자발적 활성 성상 세포의 비율을 조사하는 것은 높은 K + 배양 닫기 교세포는 제어 조건 (도 4C)에 비하여 자발적으로 활성임을 보여준다. 이 효과는 opposit에자발 칼슘 2 + 입면도를 나타내는 성상 세포의 백분율이 증가되는 TTX 조건의 E 방향. 마지막으로, 모두가 유발과 자발적인 칼슘 2 + 고도는 제어 조건 (그림 4C와 4D)에 비해 높은 K + 배양 성상 세포의 느린 상승 시간이 있습니다. 전반적으로 이러한 데이터는 성상 교세포되어 Gq GPCR 발현 수준이 양방향으로 확장 된 기간 동안 신경 세포의 활동 전위 활동의 수준에 따라 가늠자를하는 것이 좋습니다.

그림 1. 슬라이스 배양 챔버 제조 및 설정합니다. (A)의 밀폐 뚜껑과 함께 브 링크 피펫 저장 용기의 서랍 부분은 슬라이스 배양 챔버를 구성하는 데 사용됩니다. (B) D정상에서의 컨테이너 약 1 ¼의 측면에서 케이 구멍 ¼의 측면에서. 유연한 튜브의 조각에 맞게. (C)는 유연한 튜브의 안쪽 끝에 microloader 매니 폴드 장치를 연결합니다. 참고 컷에 맞는 천연 200 μL 피펫 팁 (흰색 화살표). (D) 식스 20 ㎕를 에펜 도르프 microloaders 자르에 맞는 한 - 투 - 여섯 줄의 매니 폴드에 microloader 매니 폴드 장치를 만들 수 있습니다. (E) 뚜껑에 두 개의 작은 구멍을 뚫습니다. (F) 슬라이스 홀더를 만들기위한 부동 거품 랙. (G) 나일론 메쉬 재료의 조각이 바닥에 접착 될 수 있도록 부동 버블 랙 바닥 "다리"가 제거된다. (H) ACSF의 충분한 양으로 배양 챔버를 채우기 슬라이스 홀더 떠오른다. microloaders의 끝이 실 바닥의 한 구석에서 휴식 할 수 있도록 튜브의 길이를 조정합니다. 에서 배양 챔버를 배치 할 때물 목욕은 욕조에 물 수준은 챔버의 ACSF 같은 수준에 있어야합니다. 더 큰 이미지를 보려면 여기를 클릭하십시오.
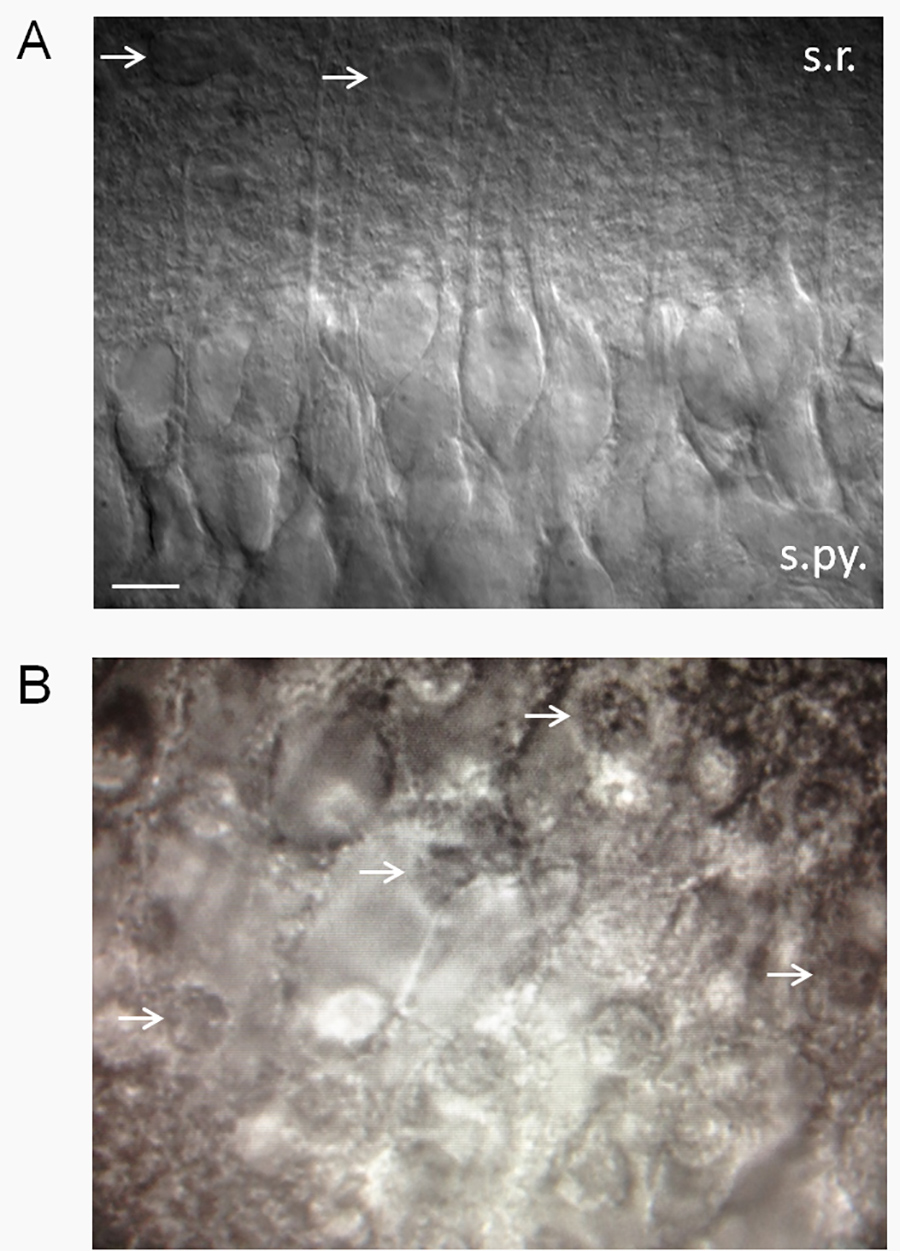
그림 2. 슬라이스 건강의 추정. (A) 미분 간섭 대비 (DIC) 광학 장치를 사용하여 건강 찾고 해마 조각. 건강한 조각 부드러운 벨벳 모양과 건강한 CA1 피라미드 뉴런의 높은 비율이있다. 지층 radiatum에 돌출 혀끝의 수상 돌기를합니다. 여기에 표시된 것과 같이 신경의 패치 클램프는 몇 자발적인 활동 전위 표준 2.5 mM의 K + ACSF의 낮은 휴식 막 잠재력 (-61 ~ -62 MV)를 알 수있다. 막 잠재력과 발사 속도는 EX의 함수로 변화 할 것이다tracellular K + (샤오 등. 15). 화살표는 추정 성상을 가리 킵니다. 요약 : SR, 지층 radiatum, s.py., 지층 pyramidale. 스케일 바, 10 μm의. (B) 건강에 해로운 슬라이스 기름에 튀긴 된 계란 (흰색 화살표가 죽은 신경 세포의 핵을 가리 - 기름에 튀긴 된 계란의 "노른자")의 모양이 죽은 CA1 피라미드 뉴런의 높은 비율을해야합니다. 더 큰 이미지를 보려면 여기를 클릭하십시오.
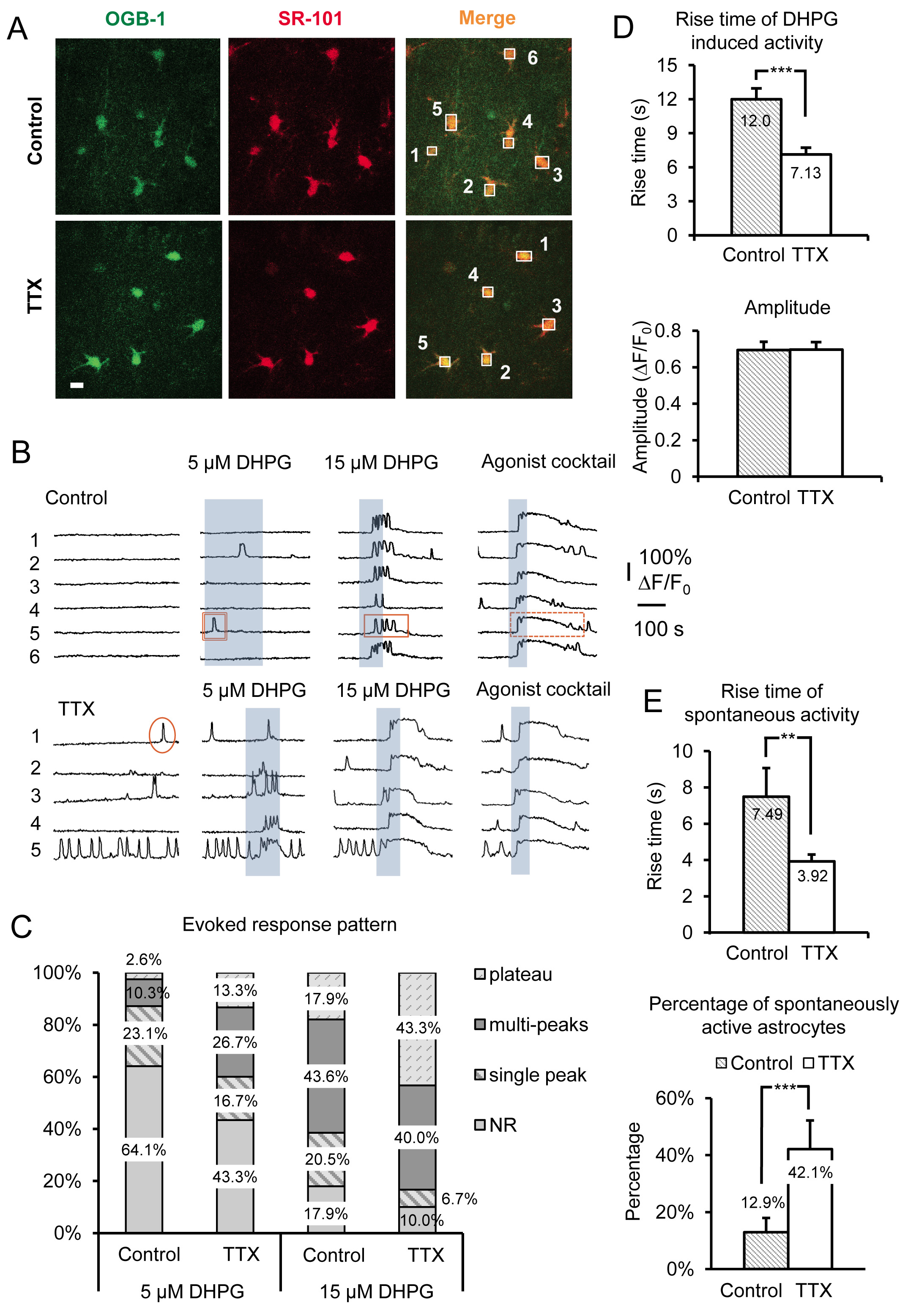
그림 3. 되어 Gq GPCR의 활동을 증폭 TTX의 배양 신경 세포의 AP의 장기 억제 후 유발 된 그룹 I mGluR 칼슘 2 + 응답 녹음. (A) 기록 필드에있는 세포의 대표 이미지는 C에서 배양ontrol 오레곤 그린 BAPTA - 오전 1시 칼슘 2 + 지시 염료 (왼쪽 패널) 및 SR-101 (중간 패널)를 촬영 한 조건 (상단 패널) 또는 TTX (아래 패널)에서. 스케일 바는 10 ㎛이다. 두 신호의 오버레이 ( "병합") 칼슘 2 + 표시와 그 성상로드를 나타냅니다. 박스는 성상 세포에서 칼슘 2 + 활동을 모니터링 녹색 채널에 시간이 지남에 따라 형광 강도를 기록하는 개별 성상 세포 소마에 그려집니다. 성상 세포에서 칼슘 2 + 활동의 기록 상자에서 (B) 샘플 트레이스). 응답의 패턴의 변화에 의해 입증 TTX 쇼에서 배양 성상 세포는 자발적인 활동을 증가시키고 더 강력한 유발 그룹 I mGluR 칼슘 2 + 반응. 단일 피크 (원), multipeak (사각형), 및 고원 (점선으로 된 사각형)의 예는 칼슘 2 + 과도가 표시됩니다. 응답 패턴 (C)의 변화는 다른 concent를 사용하여 특히 명백하다그룹 I mGluR 작용제 DHPG의 식량. 더 multipeak 및 고원 응답은 주어진 작용제의 농도 제어에 비해 TTX에서 배양 한 후 분명하다. 진폭 (아래 패널)를 변경하지 않지만 (D)는 "모든 - 또는 - 없음"응답 진폭을 나타내는, 제어 (상단 패널)에 비해 TTX 배양 성상 세포에 빠르게 DHPG-유발 칼슘 2 + 응답 시간을있다 상승 번 응답 임계 값에 도달했습니다. (E) 자연 성상 세포의 배 상승 칼슘 2 + 과도 인구의 성상 세포의 비율이 자발적되어 Gq GPCR 칼슘 2 + 활동 증가 (아래 패널)을 전시하면서, 성상 세포 (상단 패널) 배양도 빠른 TTX의 제어 대 배양 있습니다. 큰 이미지를 보려면 여기를 클릭하십시오.

그림 4. 높은 세포 외 칼륨 배양 신경 세포의 AP 장기 증가 다음 녹화 감소 성상되어 Gq GPCR 활동 및 유발 그룹 I mGluR 칼슘 2 + 반응. (A) 5.0 mM의 K + ACSF 배양 조각에서 성상 세포 칼슘 2 + 음반의 대표 흔적 뉴런을 탈분극과 ACSF (2.5 mM의 K + ACSF)를 제어에 비해 자신의 기초 발사 속도를 증가시킵니다. 5.0 mM의 K + ACSF 전시 적은 자연 체세포 칼슘 2 + 과도 약한 DHPG와 함께 배양 성상 세포는 제어 ACSF 배양 성상 세포에 비해 반응을 유발. (B) DHPG의 여러 농도 유발 반응의 패턴의 비교는 신경 세포의 AP 장기 상승 후 약한 반응 유형을 보여준다. PO에서 성상 세포의 비율 (C)의 감소자발적인 활동의 상승 시간이 느린 (아래 패널)가있는 동안 자연 칼슘 2 + 활성을 나타내는 pulation는 높은 K 장기 배양 후 관찰 + ACSF (상단 패널)를 제어하기 위해 비교된다. (D) DHPG의 서로 다른 농도로 유발 된 성상 세포의 배 칼슘 2 + 반응을 상승 제어 ACSF 배양 성상 세포에 비해 5.0 mM의 K +의 처리를 다음 느려질. 더 큰 이미지를 보려면 여기를 클릭하십시오.
토론
설명 확장 모델은 성상 교세포 그룹 I mGluRs의 장기 가소성 연구를위한 실제적인 방법을 나타냅니다. 이미징 자연과 유발 칼슘 2 + 이벤트, 회사 증거가 성상 세포 칼슘 2 + 고도가되어 Gq GPCR 활성화 (10)의 다운 스트림 IP 3 R-민감한 상점에서 릴리스를 다음 발생하는 설립 한 바와 같이, 성상 교세포되어 Gq GPCR 활동의 변화를 측정하는 중요한 분석을 제공합니다 12, 17, 18. 인구의 성상 세포의 비율은 그룹 I mGluR 작용제와 같은 칼슘 2 + 반응의 패턴에 응답은 성상 세포에 의해 그룹 I mGluRs의 변화를보고합니다.
칼슘 2 + 지표와 성상 세포를로드하는 데 사용되는 특정 기술은 성상 교세포되어 Gq GPCR 활동의 변화를 보는 실험의 설계에서 중요한 고려 사항이다. 알약 로딩 또는 대량로드 여러 성상 세포, 또는 p개인 성상 세포의 ATCH 클램프 로딩 성상 세포에서 이미지 칼슘 2 + 과도로 사용할 수 있습니다. 각각의 접근 방법은 어떤 장점과 단점이 있습니다. 직접 패치 클램프를 통해 칼슘 2 + 지표와 성상을 작성하는 등 SR-101 차 마커없이 성상 세포로 세포의 명백한 식별 할 수 있습니다. 표시의 패치 클램프 배달도 세포가 건강하게하는 조각과 시냅스 (사용 가능한 레이저 파워에 따라) 더 그대로 상호 작용 가능성이 깊은 덤불 미세 공정 등의 작은 성상 세포 구획에서 칼슘 2 + 활동을 기록 할 수 있습니다. 데이터는 한 번에 하나의 셀을 모아진다 그러나 패치 - 클램프로드 낮은 처리량에서 겪고있다. 벌크로드는 대조적으로, 성상 세포의 다수 칼슘 2 + 표시기로드 동시에 묘화 될 수있다. 단, 성상 세포 표면 근처의 슬라이스 (<20 μM)는 연관된 문제와,로드세포의 건강과 그대로 시냅스에 대한의.
여기에 제시된 배압 알약 로딩 프로토콜은 상대적으로 높은 처리량 및 조각 (40 ~ 75 μm의) 내 깊은 칼슘 2 + 활동을 모니터링 할 수있는 기능으로, 중간을 제공합니다. 알약 로딩 기술을 사용하여 자발적으로 활동 성상 세포의 비율이 크게 증가는 신경 세포의 시냅스와 성상 세포 프로세스 사이의 연결이 15보다 완벽한 것을 제안, 대량로드에 비해 관찰된다. 좋은 로딩 중 하나는 종종 2 광자 현미경을 이용하여 아스트로 사이트 (데이터 미도시) 또는 잠재적으로 더 작은 구획의 주요 공정에서 칼슘 2 + 활동을 모니터링 할 수있다. 그러나,주의를 경계 비특이적 배경 염색을 바꿀 같은 특정 성상 세포에 작은 프로세스를 할당에서 수행 될 필요가있을 것이다. 대량로드하거나 알약 로딩 절차의 사용과 추가 관심사는 보조 마르 필요하다성상 세포의 식별을위한 KER. 이 성상 세포가 우선적으로 칼슘 2 + 지표 AM 에스테르를 수행하는 것이 여러 해 동안 알려져되었지만, 보조 마커 SR-101는 종종 성상 세포로로드 세포를 확인하는 데 사용됩니다. SR-101은 자체 신경 (29)의 고유 흥분을 변경할 수 있습니다. SR-101의 사용은 신경 세포의 흥분에 가능한 SR-101의 효과를 제한하는 TTX의 모든 성상 세포 칼슘 2 + 측정을 수행 할 필요가 확증. 제어 및 실험 그룹이 모두 SR-101을 포함한다고 가정하면, 자체 마커는 신경 활동 전위의 장기 조작 다음 성상 세포 칼슘 2 + 신호에서 관찰 된 효과를 고려하지 않아야합니다. 그것이 2.5 mM의 K + 대비의 차이를 줄일 수 있으므로 SR-101은, 그러나, 높은 K + 실험 우려 이상일 수있다 5.0 mM의 K + 기초 발사 속도가 비례 적으로 변경되지 않은 경우.
칼슘 2 +를 전달하는 매우 유망한 방법 성상에 표시 칼슘 2 + 염료를 사용하여 전통적인 방법에 매력적인 대안을 제공하는 최근에 등장했습니다. 상당한 진보가 성상 세포 30-32을 대상으로 유전자 인코딩 칼슘 지표 (GECIs)와 함께 지난 몇 년 동안되었습니다. GECIs는 해마와 같은 관심의 뇌 영역에 아데노 - 관련 바이러스 벡터의 생체 내 미세 주입하여 성상 세포에 전달 될 수있다. GECIs의 표현은 바이러스 감염 32 다음 약 2 주 후에 달성된다. 성상 세포의 GECIs의 사용에 의해 제공 많은 장점이 있습니다. 첫째, 벡터는 성상 세포 - 특이 적 프로모터를 사용하여 성상 세포를 대상으로, 그래서 표지 세포 성상 세포 (32)에 근거합니다. 둘째, 신호 대 잡음 지금 만 셀 (32)에 패치 피펫을받은의 침입하지 않고, 염료의 패치 클램프 배달을 사용하여 얻을 수있는 것과 비슷한 것 같다. 셋째, 지표 델이 될 수 있습니다ivered 벌크 로딩 전달 방법을 사용하여 문제가 성인 조직, 표현. 또한, 발현은 여러 성상 구비 분화하는 능력을 제공하고, 모자이크이다. 또한 동시에, 소마 미세 branchlets 녹화하면서 따라서, 몇개의 성상 세포는 잠재적으로 동시에 이미지화 될 수있다. 따라서 잠재적으로 하나의 기술은 효율성을 크게 증가, 성상 교세포되어 Gq의 GPCR에의 확장 활동을 기록하기 위해 별도의 세 가지 기술 (벌크 로딩, 알약 로딩 및 패치 클램프로드) 대신에 사용될 수있다.
성상 세포에 칼슘 2 + 지표의 바이러스 매개 배달을 사용하여 하나의 잠재적 인 단점은 슬라이스 건강 (32)에 가능한 효과입니다. GECIs을 전달하는 데 사용되는 아데노 - 관련 바이러스 성 벡터는 성상 세포 (33)의 반응성 신경교 증의 원인이 이전에 표시되었습니다. 일반적으로 뇌 조각의 준비 가능성 INF의 방출 등의 병리의 초기 단계를 시작lammatory 10을 분자. 따라서 GECIs를 사용하는 바이러스 벡터를 사용하여 전달 성상 세포 수용체의 조절을 유도하기 위해 필요한 긴 배양 시간과 결합 이런 종류의 실험에서 슬라이스 건강의 컨텍스트에서 추가적인 고려를받을 필요가있는 것이다.
이 프로토콜을 사용하면 응답을 생성하는 효능에 대한 응용 프로그램 시간이 수용체의 가용성 기능으로 달라질 수 있다는 것을 기억하는 것이 중요하다. 작용제의 특정 농도의 경우,인가 시간은 수용체가 스케일 다운 및 짧은 경우 수용체는 칼슘 2 +을 생성하기 위하여 충분히 수용체를 활성화하는 조직에서 적절한 농도에 도달하는 약물에 대해, 최대 크기를 조정 한 경우에 이상되어야 할 것이다 응답. 따라서 약 응용 시간 및 잠재적으로 그들의 농도는, 스케일링의 의도 된 방향에 따라 조정되어야 할 수도있다. 예를 들어, 작용제 농도 C 저하 될 필요가있다TTX의 ASE는 반응을 포화 방지, 심지어 응답을 볼 높은 K의 + 슬라이스를 배양 후 증가합니다. 특히, DHPG 농도는 15 μM이 종종에서 신뢰할 수있는 응답을 생성하기에 너무 낮은 때, 칼슘 2 + 응답 패턴을 연구하기 위해 5.0 mM의 K +의 치료 후 30 ~ 50 μM에 TTX 처리 후 5 ~ 15 μM에서 이동했다 그룹 I mGluRs 다운 스케일링 후 성상 세포.
성상 세포 칼슘 2 + 활동의 기록은 세포막이나에서 수용체 삽입 또는 국제화의 직접적인 증거를 제공하지 않습니다. 그러나되어 Gq GPCR 발현 수준과 자연 사이의 직접적인 관계를 조사하고 칼슘 2 + 과도 21-24, 칼슘 2 +의 변화의 가장 논리적 인 해석을 유발 체외에서 이전 연구에서 데이터와 데이터의 놀라운 유사성에 근거 시그널링은 성상 세포 표면 수용체 발현 수준을 가지고있다변경. 하나는 칼슘 2 + 활동에 미치는 영향의 궤적에 대한 추가 증거를 제공하고자하는 경우 보완적인 접근 방식은 중요한 고려 사항이 될 수있다. 우리가 사용하는 전략은 성상 세포 MrgA1R 쥐의 해마 슬라이스 TTX 배양의 효과를 알아보고자 하였다. 이러한 형질 전환 마우스는 성상 세포의 외래되어 Gq GPCR (MrgA1R)을 표현한다. 이 수용체는 뇌에 네이티브 아니기 때문에, 그것의 활동 수준을 변경할 수있는 어떠한 내인성 신경 전달 물질이 없다. 이전 작업은이 수용체가 동일한 성상 세포 (34)에 내생 그룹 I mGluRs 같은 신호 분자 같은 세포 내 결합하는 것이 좋습니다. TTX에 MrgA1R 마우스에서 슬라이스 한 후 장기 배양은 littermate 제어에 비해 효능 - 유발 MrgA1R 응답의 차이는, 조각은 성상 세포에 미치는 영향은 칼슘 2 + 활동이 표면의 수용체에 지역화 변경 등에 따라 증거를 제공 할 것입니다 배양하지 특히 그룹 I mGluR의 반응은 여전히 상당히 더있는 경우icantly 같은 성상 세포에서 강화. 대안 아마도 더 복잡한 전략만큼 막 분획은 표면 수용체 발현 수준의 변화를 분석 할 수 있기 때문에, 웨스턴 블롯 분석을위한 슬라이스에서 성상 세포를 분리하는 것이지만. 형광 활성화 된 셀 정렬 (FACS) 또는 유동 세포 계측법은 여기에 도움이 될 수 있습니다.
신경 세포의 연구에이 기술의 응용 가능성은 성상 세포와 성상 세포 - 신경 세포의 상호 작용이 많다. 우리의 실험에서, 만 DHPG-유발 그룹 I은 성상 세포 칼슘 2 + 응답이 청소년 생쥐에서 분리 급성 해마 조각에서 공부했다 mGluR. 이 혼합물은, 본래의 심성 (샤퍼의 담보), 또한 그 (CA3 피라미드 세포)에 상승을주는 신경이 가능 시냅스 후 세포 (CA1 피라미드 세포)에있는 글루타메이트 신경 세포의 발사 속도를 조작 할 만들고뿐만 아니라 그 과정 associat 지층 radiatum의 성상이러한 시냅스와 전자. 급성 해마 조각이 신경 세포의 다른 유형의 발사 속도를 조작하기위한 최선의 준비를하지 않을 수 있습니다, 그러나, 많은 구 심성은 그들에게 야기 뉴런에서 절단됩니다. 그럼에도 불구하고, 다른 성상 세포되어 Gq GPCR의 하위 유형의 가소성을 준수하기 위해 특정 슬라이스 준비에서 할 수있다. 예를 들어, 조각은 그대로 해마 기저 전뇌의 콜린성 신경 세포와 그 돌기를 준비 할 수 있습니다. TTX 또는 높은 K +의 이러한 조각의 외피는 콜린성 입력 1의 상당 부분을받을 수 지층 oriens의 성상에 mAchRs의 확장으로 이어지는, 콜린성 뉴런의 기초 발사 속도에 영향을 미칠 것입니다. 대안 스케일링이 발생하면서, TTX의 서방이 플라 스트의 주입에 의해 달성되는 생체 모델을 사용하는 수 있습니다 그대로 모든 연결과 뇌의 특정 영역 내에서 성상 세포 수용체 조절을, 공부하는 아직 검증되지 않은 방법IC 폴리머로 명명 된 ELVAX 40W 관심 (35)의 영역 위. 이 방법은 신경 스케일링의 연구에서 이전에 사용 된뿐만 아니라, 성상 세포 확장에 적용 할 수 있어야합니다. 마지막으로, 적절한 판독으로, 미래의 연구는 G s 또는 G I의 GPCR의 변화를 포함하여 다른 GPCR의 가족을 조사 할 수 있습니다. 하나는 내가 GPCR에 로컬로 모든 슬라이스 준비에서 GABA의의 interneurons을 투사하는 발사의 억제 다음과 같은 영향을받을 성상 세포 GABA B 형 G를 예측할 수 있습니다. 이러한 두 번째 메신저 캠프의 실시간 표시와 같은 다른 신호 전달 분자를 표적으로하는 새로운 지표의 개발, 신경 세포 간 성상 세포 수용체 통신에 대한 연구의 새로운 영역을 열어 것입니다.
기초 신경 세포의 발사 속도의 조작에 의한 성상 세포 mGluRs의 양방향 스케일링은 신경 전달 물질의 AP-매개 릴리스 성상 세포의 감도를 나타내는 값을 제공합니다. 성상 세포는 분명히 자연 AP와 glutama를 감지 할 수세포 외 K +는 생리적 범위도 샤퍼 담보 CA1 피라미드 세포 시냅스에서 테 릴리스. TTX의 급성 응용 프로그램은 자연 성상 세포의 주파수 성상 세포 수용체가 AP 감지기하다는 증거를 제공하는 칼슘 2 + 활동 18, 36, 37,됩니다 (36) 역 상관 인구의 성상 세포 사이의 칼슘 2 +의 활동을 감소하지 않지만. 이 성상 세포가 더 전반적인 칼슘 2 + 활동에 미치는 영향과 자연의 연결 AP를 감지하는 것이 좋습니다. 그것은 널리 IP 3의 세포 내 농도가 검출 칼슘 2 + 상승으로 이어질 충분히 IP 3 R을 자극하는 임계 수준에 도달 할 필요가 허용됩니다. 자연의 연결 AP는 측정 칼슘 2 + 고도를 생산하지 않고 성상 세포의 GPCR을 활성화 할 수 있을까요? 미래 연구는 형광 공명 에너지 전달 (FRET) 또는 유사한 techn을을 활용할 수 수용체에 대한 G 단백질 커플 링 (수용체 활성화의 측정) 및 내부 저장소에서 칼슘 2 + 방출 사이의 관계를 검사 (예 BRET 등) 개새끼. 이 기술은 그대로 티슈 제제에 사용하기에 들어가 전에 시간이 될 수 있지만 BRET는 G 단백질에 커플 링 GPCR-38를 검출하기 위해 시험 관내에서 광범위하게 사용되어왔다. 이것은 성상되어 Gq의 GPCR에 훨씬 더 빈번중인 칼슘 2 + 이미징 도구를 사용하여 기록 될 수있는 것보다 활성화되는 것이 가능하다. 활동 전위를 감지뿐만 아니라, 성상 교세포되어 Gq의 GPCR에 또한 최근의 연구 (39)에보고 된 신경 전달 물질의 소형 계량 적 자료를 검색 할 수 있습니다. 여기에 설명 된 양방향 스케일링 방법은 성상 세포가 GPCR에 이용되어 Gq 배양 프로토콜에서 bafilomycin A1을 포함하여 신경 전달 물질의 계량 적 소포 동의서를 감지하는 정도의 척도를 제공하기 위해 미래의 연구에 사용될 수있다.
성상 세포 수용체 스케일링은 성인 쥐에서 얻은 조직에서 유도 될 수 있다면 ntent이 "> 지금까지 스케일링 프로토콜은 청소년 마우스 (P12-P18)에서 해마 조각에 사용되었습니다. 따라서 현재 알 수 없습니다. 강력한 최근 연구 성상 세포의 그룹 I mGluR의 표현이 시대의 첫 주 이후 상당히 감소와 성인 성상 세포 (40)의 수용체 발현의 매우 낮은 수준으로, 성인이 될 때까지 계속 감소 것을. 그것은 따라서 성상 세포 mGluRs은 다음과 같은 확장 여부를 확인하는 흥미로운 일이 될 것이다 제안 긴 청소년 마우스의 성상 세포에서 보인 그들에 접근하는 수준으로 성인 마우스 해마 슬라이스에있는 신경 세포의 발화의 장기 억제.이 발견은 성상 세포 수용체 발현은 주어진 나이에 정적이 아니라 신경 활동의 수준에 따라 신속하게 변경할 수 있습니다 제안했다. 대조적으로 성인 생쥐 그룹 I mGluRs의 감소 표현, 증거를 포함하여 & # 그 아드레날린 수용체를, 신흥945, 1A, α의 2A, 및 β 1 부속 유형은 주로 성인 뇌의 3, 4의 성상 세포에 의해 표현된다. α의 1A 아드레날린되어 Gq GPCR은이 수용체는 아드레날린 성 신경 세포의 발사 속도의 변화에 민감하게 반응하는지 여부를 포함하여 신경 세포 간 성상 세포 통신의 미래 연구를위한 매력적인 대상이 될 수 있습니다.공개
저자는이 연구에 사용 된 테트로도톡신이 ABCAM에서 구입 한 것을 공개하고 싶습니다. ABCAM는 가설, 디자인, 또는 데이터의 컬렉션에 참여했다. 피어 리뷰 프로세스가 완료된 후 ABCAM에 의해 작품의 후원에 관한 모든 통신이 발생했습니다.
감사의 말
저자는 스케일링 프로토콜과 데이터의 가치있는 토론을위한 아교 세포 - 신경 세포의 상호 작용을위한 UC 리버 사이드의 센터를 인정하고 싶습니다. 저자는 또한 자신의 작품의 출판을 후원에 ABCAM에 진심으로 감사 당신을주고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
참고문헌
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유