Method Article
La inducción de la plasticidad de astrocítico Receptores por manipulación de Neuronales cocción Precios
En este artículo
Resumen
Aquí se describe una adaptación de los protocolos utilizados para inducir la plasticidad homeostática en las neuronas para el estudio de la plasticidad de los receptores acoplados a proteínas G astrocíticos. Recientemente se utiliza para examinar los cambios en el grupo I mGluRs astrocítica en ratones jóvenes, el método se puede aplicar para medir la escala de varios GPCRs astrocitos, en el tejido de los ratones adultos in situ e in vivo, y para obtener una mejor apreciación de la sensibilidad de los receptores de los astrocitos a los cambios en la actividad neuronal.
Resumen
Cerca de dos décadas de investigación ha establecido que los astrocitos in situ e in vivo expresan numerosos receptores acoplados a proteínas G (GPCR) que pueden ser estimulados por el transmisor neuronal-lanzado. Sin embargo, la capacidad de los receptores de astrocíticos para exhibir plasticidad en respuesta a cambios en la actividad neuronal ha recibido poca atención. Aquí se describe un modelo de sistema que se puede utilizar a nivel mundial escalar hacia arriba o hacia abajo astrocítica grupo I metabotrópicos receptores de glutamato (mGluRs) en rodajas de cerebro agudas. Se incluyen métodos sobre cómo preparar cortes de hipocampo parasagitales, construir cámaras adecuados para la incubación rebanada de largo plazo, de manera bidireccional manipular acción neuronal de frecuencia potencial, astrocitos de carga y procesos de astrocitos con fluorescente Ca 2 + indicador y medir los cambios en la actividad astrocítica Gq GPCR mediante el registro astrocitos espontáneo y evocado Ca 2 + eventos mediante microscopía confocal. En esencia, un "r calciooadmap "es proporcionado por la forma de medir la plasticidad de los GPCRs Gq astrocíticos. Se discuten aplicaciones de la técnica para el estudio de los astrocitos. Tener una comprensión de la forma en la señalización del receptor astrocítica se ve afectada por cambios en la actividad neuronal tiene importantes implicaciones tanto para la función sináptica normal, así como los procesos de trastornos neurológicos subyacentes y las enfermedades neurodegenerativas.
Introducción
Los astrocitos responden dentro de segundos a la estimulación de las neuronas o axones neuronales con aumentos en citoplásmica de Ca 2 + resultantes casi exclusivamente a partir de la activación de GPCR Gq astrocíticos. Por ejemplo, los receptores de acetilcolina muscarínicos 1, 2 receptores cannabinoides, los receptores α-adrenérgicos 1A 3, 4, y el grupo I mGluRs (ver abajo) son todos los subtipos Gq GPCR astrocytic que responden de forma aguda con la actividad neuronal. La activación de los astrocitos grupo I mGluRs se ha demostrado más ampliamente, después de la estimulación de aferentes glutamatérgicas neuronales in situ (tales como cortes de hipocampo agudos) 5-7, así como en la corteza adulto de ratón in vivo después de la estimulación sensorial 8. El resultado de la activación de astrocítica Gq señalización de GPCR en la biología y la fisiología de los astrocitos, neuronas, o las interacciones neurona-astrocito ha sido un tema de debate 9-12. Será some hora antes de la función de señalización del receptor de la neurona-astrocito a se aprecia plenamente.
Aunque está claro que las neuronas pueden activar los receptores astrocytic utilizando protocolos experimentales, hay aspectos de la comunicación de las neuronas a los astrocitos receptor que siguen siendo poco conocidos. En primer lugar, no está bien definido el monto real de la actividad neuronal necesaria para activar astrocítica Gq GPCRs, y en segundo lugar, la capacidad de los receptores de los astrocitos a exhibir su uso dependen de la plasticidad ha recibido poca atención. Para comenzar a abordar estas preguntas, hemos desarrollado recientemente un protocolo para inducir escala bidireccional del grupo I mGluRs astrocítica en rodajas de hipocampo de menores agudas en respuesta a los cambios a largo plazo en el potencial de acción neuronal (AP) que dependen de la actividad sináptica. De manera similar a lo que se ha descubierto para la plasticidad homeostática bidireccional de los receptores ionotrópicos de glutamato neuronal 13, 14, grupo astrocítica I mGluRs Scale Up fobloqueo llowing de potenciales de acción neuronales y escalar hacia abajo cuando la acción neuronal potencial de la frecuencia se incrementa 15. Estos cambios compensatorios en receptores astrocíticos se pueden medir mediante el registro de espontáneas y provocadas de astrocitos Ca 2 + transitorios y la comparación de las propiedades de estos eventos a los que a partir de astrocitos en condiciones de control. En este manuscrito, se describe la metodología completa para el uso de este protocolo, incluyendo la preparación de cortes de hipocampo, condiciones de incubación agudos para inducir escalado receptor astrocito, astrocitos Ca 2 + indicador de carga de tintes, Ca 2 + técnicas de imagen mediante microscopía confocal, y efectos esperados en astrocitos actividad Gq GPCR. Efectos previsibles sobre los astrocitos Ca 2 + propiedades de señalización - que coinciden con los registrados previamente en células cultivadas transfectadas con diferentes niveles de expresión de GPCR Gq - proporcionar una "hoja de ruta" que se puede utilizar en futuros estudios para analizar los cambios en loexpresión GPCR trocytic. Las ramificaciones y aplicaciones potenciales para el uso de esta técnica contribuirá a nuestra comprensión de las interacciones entre astrocitos neuronal en el cerebro sano y enfermo.
Protocolo
Los siguientes procedimientos han sido aprobados por el Comité de la University of California, Riverside Animal Institucional de Uso y Cuidado.
1. Construcción de cámara de incubación y Slice Holder
- La construcción de la cámara de incubación: Construir la cámara de incubación a partir de material que es no tóxico. Asegúrese de que la cámara se haya controlado la circulación de aire, tiene una cantidad suficiente de ACSF para el titular de la rebanada de flotar, y es lo suficientemente grande para que el titular de la rebanada puede flotar en un extremo de la cámara, mientras que la dispersión de gas de las líneas de oxígeno se produce en el otro extremo. La parte de cajón de un recipiente de almacenamiento de la pipeta con su tapa estanca al aire (figura 1A) se ajusta a estos criterios muy bien.
- Perforar un pequeño agujero en el lado del recipiente de aproximadamente 1 ¼ desde la parte superior y ¼ desde el lado. Coloque un trozo de tubo flexible a través del orificio (Figura 1B). Tenga cuidado para perforar suficientemente baja para que el tubo no se comprimirá cuando la tapa está cerrada, pero lo suficientemente alta de modo que está por encima de la solución.
- Aplique sellador de la costura de silicona ("sellador de uniones acuario") para crear un sello hermético entre el tubo de oxígeno y la cámara.
- Conectar el extremo "fuera" de la tubería a un tanque de gas (95% de oxígeno, dióxido de carbono al 5%) usando un accesorio Luer macho. Para un ajuste perfecto, corte-a-caber un biselado de puntas de pipeta 200 l naturales (Figura 1C).
- Conecte el extremo "dentro" de la tubería a un colector de plástico de uno a seis líneas. Cut-to-fit seis 20 l Eppendorf puntas de pipeta microloader a cada colector de entrada (Figura 1D). La fina abertura de los microloaders es ideal para producir un flujo constante de pequeñas burbujas.
- Para permitir la ventilación, perforar dos orificios diminutos en la tapa del recipiente (Figura 1E).
- La construcción de la rebanada hmás: El titular de la rebanada se hace de un bastidor de la burbuja flotante (Figura 1F).
- Retire las "patas" parte inferior del bastidor de la burbuja, y cortar la parte superior de aproximadamente 1 ¾ pulg
- Pegue un pedazo de material de malla de nylon en la parte inferior de la cremallera redonda con pegamento de cianoacrilato (como norma Krazy Glue) para crear un soporte de rebanada de ocho pocillos (Figura 1G). Cada pozo puede encajar un solo hipocampo rebanada ratón.
- Montar el soporte de rebanada en un extremo de la cámara de incubación y el aparato-Microloader colector en el otro extremo. Permita que los consejos Microloader descansen en el suelo de la cámara (Figura 1H). Esta configuración se ha diseñado para asegurar suficiente oxigenación tanto a la parte superior y la parte inferior de los cortes de hipocampo agudos, y para evitar las burbujas que salen directamente debajo del soporte de la rebanada con el fin de reducir al mínimo la agitación rebanada y evitar el contacto directo de las burbujas con las rebanadas de hipocampo.
- Enjuague las cámaras de incubación de unatitulares d rebanada fondo con ddH2O después de cada experimento, y descontaminar con EtOH al 70% semanal. En el caso de la incubación de las rebanadas de diferentes soluciones, se necesitarán los titulares de múltiples cámaras / rebanada.
2. Soluciones y Drogas
- Líquido cefalorraquídeo artificial (ACSF): Preparar 4 l de ACSF estándar en ddH2O utilizando la siguiente (en mM): 125 NaCl, 2,5 KCl, 2,5 de CaCl 2, 1,3 MgCl2, 1,25 NaH 2 PO 4, 26.0 NaHCO3, 15 glucosa, 0,1 y Trolox. Mida la osmolaridad de la solución utilizando un osmómetro, sino que debe venir a ~ 310 mOsm. Composiciones ACSF para las condiciones experimentales se describen a continuación (véase el Protocolo 3). Filtrar todas las soluciones utilizando un filtro de botella-top 0,22 micras en frascos de vidrio esterilizados en autoclave. Las soluciones son estables en 4 ° C durante un máximo de un mes.
- Rebanar Tampón: Preparar rodajas usando un ACSF modificada que contiene (en mM): 125 NaCl, 2,5 KCl, 3,8 MgCll 2, 1,25 NaH 2 PO 4, 26.0 NaHCO3, 15 de glucosa y 1,3 ácido ascórbico. Mida la osmolaridad de la solución utilizando un osmómetro, sino que debe venir a ~ 310 mOsm. Sustitución de CaCl2 con MgCl 2 en el buffer de corte mejora la salud rebanada.
- Sulforodamina 101 (SR-101, 1 M) se utiliza para identificar astrocitos en cortes de hipocampo agudos. Hacer una madre 1 mM de SR-101 mediante la dilución de 60,67 mg de SR-101, en 100 ml de una ACSF bajo de calcio modificado preparado de la siguiente manera (en mM): 125 NaCl, 2,5 KCl, 0,5 de CaCl 2, 6 MgCl2, 1,25 NaH 2 PO 4, 26.0 NaHCO3, 15 de glucosa, y 1,3 de ácido ascórbico. Verifique que la osmolaridad de la ACSF bajos de calcio es de ~ 310 mOsm. Diluir el 1 mM SR-101 stock 1000 veces bajo Ca 2 + ACSF modificado para la carga. Guarde la solución final SR-101 en 4 ° C y protegido de la luz hasta que sea necesario para el experimento.
3. La manipulación de Long Neuronal Plazo Firing Cambio en el infarto agudo del hipocampo rebanadas
Utilice una de dos protocolos de incubación en experimentos separados para manipular las tasas de disparo neuronal a largo plazo:
- Inhibir la activación neuronal: Incubar en la tetrodotoxina (TTX, 1 M): ATENCION: Manejar TTX con cuidado, ya que puede ser fatal si se ingiere en cantidades suficientes. Se recomienda utilizar guantes y gafas protectoras. TTX suprime completamente la descarga neuronal impulsado por la AP en rodajas agudas. Incubar las rebanadas en 3,5 mM de K + ACSF, más 1 M de TTX en la condición experimental. En la condición de control, incubar las rebanadas en 3,5 mM K + ACSF sin TTX. La comparación entre las dos condiciones revela el efecto de aumento de escala en astrocítica actividad Gq GPCR. 3,5 mM de K + ACSF sirve como la condición de control (en lugar de decir, 2,5 mM de K +) con el fin de maximizar el efecto del tratamiento TTX.
- OR -
- Aumentar el disparo neuronal por encimatasas basales: Incubar en niveles altos de potasio: El aumento de la concentración extracelular de K + despolariza las neuronas y aumenta su tasa de disparo basal. La incubación en 5,0 mM de K + ACSF eleva significativamente la acción neuronal potencial de la frecuencia en comparación con 2,5 mM de K + ACSF 15. Incubar las rebanadas en 5,0 mM de K + ACSF para la condición experimental, y para la condición de control, se incuba en rodajas estándar 2,5 mM de K + ACSF. La comparación entre las dos condiciones revela el efecto de la reducción a escala en astrocítica actividad Gq GPCR.
4. Agudo Preparación de cortes de hipocampo
- Configuración de la cámara de recuperación tibia:
- Calentar el baño de agua a 35 ° C, a continuación, colocar las cámaras de incubación preparados en el interior. Llenar el baño de agua con agua hasta la altura de la ACSF dentro de las cámaras de incubación (Figura 1G).
- Oxigena la ACSF experimental y control, con un 95% de O 2, 5% CO 2. Las burbujas emitidas desde el aparato-microloader colector deben ser pequeñas y abundante, pero también suave, no debe haber ningún movimiento visible de ACSF dentro de la cámara.
- Configuración de la cámara de disección helada:
- Tome dos cubos de hielo. Coloque una botella de aproximadamente 300 ml rebanar búfer en un cubo de hielo y mantenerla oxigenada con un 95% de O 2, 5% de CO 2 durante 20 min. Sumerja un 100 mm placa de Petri en el otro cubo de hielo, justo debajo de la superficie del hielo. Asegúrese de que el lado de la placa de Petri está en contacto directo con el hielo. Vierta un poco de búfer rebanado en la placa de Petri y mantenerla oxigenada también.
- Enfríe el filo de la cuchilla de afeitar de un solo filo sumergiéndolo en el hielo búfer corte frío en la placa de Petri durante más de 1 min.
- Vibratome configuración:
- Encienda el vibratome y asegúrese de que el drenaje esté cerrada.
- Fije la cámara de corte en la vibracióntomo y el paquete de hielo alrededor de la cámara de corte. PreCool a 0-4 º C.
- Quitar fábrica grasas de la cuchilla de afeitar de doble filo por inmersión en 70% EtOH durante 5 min y después de enjuagar con ddH2O. Cortar en mitades con cuidado (no doble la hoja) y monte la mitad de la cuchilla sobre el bloque de corte.
- Extracción del cerebro del ratón:
- Anestesiar a un ratón C57BL/6J doce a dieciocho días de edad, en una pequeña cámara precargada con 0,5 ml de isoflurano empapado en una Kimwipe o bola de algodón. Pellizcar suavemente los dedos de los animales para asegurarse de que no hay un dolor reflejo.
- Decapita el ratón con un par de tijeras afiladas, a continuación, quitar el cuero cabelludo usando unas pequeñas pinzas. Utilice pequeñas tijeras para cortar los huesos del cráneo desde el cerebelo a los bulbos olfatorios lo largo de la fisura longitudinal. Retire las aletas craneales utilizando las pinzas pequeñas. Retire con cuidado el cerebro con una espátula, luego sumérjala en el búfer de corte oxigenada helado en la placa de Petri.
- Bisect el cerebro de ratón con la hoja de afeitar enfriada en la placa de Petri para permitir una mayor superficie para la refrigeración y la oxigenación. Deje que los hemisferios bisectados sientan en el búfer de corte frío hielo durante 2-3 min. El cerebro debe ser completamente fresco y más sólida.
- Aplique una capa fina de pegamento de cianoacrilato en la plataforma del vibratome. Pegue los dos hemisferios a la corte plataforma lateral abajo y los lados laterales más, con el bulbo olfatorio hacia el frente. Sujete la plataforma en la cámara de corte, y luego rellenar la cámara de corte de frío de hielo, tampón rebanar bien oxigenada.
- Continuar oxigenar la cámara de corte, mientras que la preparación de 300 micras de espesor rebanadas parasagitales utilizando el vibratome. Cortar las rebanadas a una frecuencia de 85 Hz, una velocidad de avance de 0,20 mm / seg, y una amplitud de 1,40 mm. NOTA: Se ha encontrado que la variable más importante en la preparación de cortes de hipocampo agudos sanos es la calidad de la vibrátomo. Nuestro laboratorio utiliza el S imán Leica VT 1200ic conducir vibratome con VibroCheck para reducir la vibración "z".
- Después de cortar, diseccionar el hipocampo y la corteza entorrinal adyacente de cada rebanada parasagital utilizando pinzas cortantes. Realice este procedimiento en el, tampón de corte en rodajas bien oxigenada enfriada con hielo en la cámara de corte de la vibrátomo. La nitidez de los fórceps es muy importante para la salud rebanada, ya que minimiza la manipulación de las rebanadas.
- Hacer una pipeta de transferencia rompiendo la larga punta de una pipeta Pasteur de vidrio y el liderato en la parte rota con un bulbo de la pipeta. Esto permite el uso de la gran final de la pipeta para transferir las rebanadas. Asegúrate de pedir pipetas sin el tapón de algodón en el extremo grande (véase la tabla de Materiales). Como las rebanadas se preparan en condiciones no estériles, no es necesario esterilizar en autoclave la pipeta antes de su uso, aunque una nueva pipeta debe ser preparado y utilizado para cada experimento.
- Transfiera cada rebanada del hipocampo de las cámaras de incubación en el agua de 35 ° Cbaño, por inmersión de la pipeta de transferencia en el ACSF dentro de cada pocillo de la titular de la rebanada y la aspiración de la rebanada. Minimizar el movimiento de la rebanada durante este proceso. La transferencia directa de los cortes a las cálidas resultados de baño de incubación en mejores cortes de calidad de "rampa" la temperatura poco a poco.
- Permita que los cortes de hipocampo se recuperen en el baño de agua caliente para un total de 45 minutos, repartidos de la siguiente manera: Incubar las rebanadas durante 20 minutos en 1 M SR-101 diluido en baja ACSF calcio, a continuación, transferirlas a la ACSF baja de calcio (sin SR-101) durante 10 min. Posteriormente, transferir las rebanadas para controlar o ACSF experimental de 15 minutos restantes de la incubación caliente.
- Después de los 45 minutos de calentamiento de recuperación, mueva con cuidado las cámaras de incubación del baño de agua de 35 ° C a la mesa de trabajo, y luego permitir que los cortes sigan incubar a temperatura ambiente durante un tiempo de incubación total de 3 horas antes de comenzar el bolo de carga protocolo (ver más abajo).
5. Bolo de carga de astrocitos con Ca 2 + indicador
- Preparación de Ca 2 + indicador de tinte bolo de carga:
- Para cada vial de colorante (50 g), añadir 3,87 l de dimetil sulfóxido fresco (DMSO) y mezclar bien. La frescura del DMSO es importante para una buena carga y, por lo tanto, abrir una grieta en una ampolla de nuevo cada vez.
- Mezclar en 9 l de 20% de ácido plurónico y mezclar bien. Mezclar el colorante con 100 l de la ACSF y agitar bien experimental o de control adecuado, para una concentración de colorante final de 10 mM.
- Filtrar la solución usando un tubo de filtro de centrífuga. Este paso evita que la pipeta de carga de la obstrucción durante la expulsión del colorante.
- Preparar una pipeta de un capilar de vidrio de borosilicato tirado a una resistencia de aproximadamente 1,3 MΩ cuando se llena con solución de colorante.
- Coloque una rebanada del hipocampo en una cámara de registro diseñado para su uso con el microscopioy perfundir continuamente con ACSF oxigenada de la misma composición que se incubó en (1.5 ml / min). Alterna entre el control y las condiciones experimentales al seleccionar una rebanada del hipocampo.
- Deseche poco saludables que buscan cortes de hipocampo. La calidad de las rebanadas puede variar incluso dentro de un experimento dado. No hay criterios establecidos para la cuantificación de la salud rebanada, por lo tanto, la determinación de la salud rebanada es subjetivo y basado sobre todo en la experiencia.
- Hablando en general, mantener las rebanadas que tienen una superficie que aparece suave y un alto porcentaje de células piramidales CA1 sanos (Figura 2A). Las células piramidales de CA1 son particularmente sensibles y vulnerables a las agresiones del SNC, así que tener un porcentaje grande (≥ 75%) de las neuronas piramidales CA1 saludables puede ser un criterio útil para aceptar o rechazar una rebanada.
- Deseche las rebanadas que tienen aproximadamente> 25% de neuronas muertas. Neuronas muertas tienen una forma de huevo frito apariencia (Figura 2B). NOTA: Nos hahan observado que el ángulo del corte juega un papel importante en si las neuronas parecen sanos o no. Si las dendritas neuronales están proyectando hacia arriba (de la rebanada), entonces las neuronas serán en su mayoría muertos. Esto es probablemente debido a una gran proporción del volumen de la neurona está contenida dentro del árbol dendrítico, que la ruptura de las dendritas es letal para las células. Por otro lado, si las dendritas están proyectando paralelo a o en un ángulo hacia abajo desde la superficie de la rebanada, habrá un alto porcentaje de las neuronas sanas. A veces, por lo tanto, las neuronas serán en su mayoría muertos en un lado de la rebanada y de aspecto saludable en el otro lado.
- Localice un campo adecuado de los astrocitos sr 40-70 micras por debajo de la superficie de corte en función del tamaño, la morfología y ubicación mediante contraste de interferencia diferencial (DIC) óptica.
- Cargar la pipeta de vidrio con solución de tinte y lo baja a la superficie de la porción por encima de este campo usando un microelectrodo holde de patch-clamp estándarr. Con la pipeta en la superficie de la rebanada, aplicar de nuevo la presión a la pipeta para comenzar colorante de expulsión. De eyección de tinte será visible bajo las dos DIC óptica y un láser apropiado, tal como una línea 488 para un tinte verde.
- Lentamente baje la pipeta a aproximadamente 40 m por debajo de la superficie de la rebanada utilizando un micromanipulador y permitir que el colorante para expulsar durante aproximadamente 45-60 segundos. Luego, baje la pipeta una 35 micras adicional (75 m debajo de la superficie rebanada) y expulsar colorante por aproximadamente 45 a 60 segundos. Poco a poco retraer la punta de la pipeta de la rebanada. Es probable que resulte insuficiente en colorante de carga más corto tiempo de inyección, mientras que la inyección ya tiende a aumentar el fondo de carga, lo que disminuye la relación señal-ruido de la grabación.
- Para asegurarse de que un gran número de astrocitos ocupan el medio de contraste, por lo general es útil para inyectar un segundo bolo de colorante a una corta distancia. Levante la pipeta de nuevo a la superficie de la loncha, asegúrese de que la pipeta no está obstruido, a continuación, move la pipeta aproximadamente 80-100 micras de distancia de la primera zona de la inyección, a lo largo del estrato radiado. Repetir la inyección en bolo en este sitio.
- Permitir 30-45 minutos antes de la proyección de imagen de los astrocitos a tomar el tinte y de la señal de fondo a disminuir. Deje la rebanada en la cámara de perfusión durante este tiempo. Asegúrese de que este tiempo de incubación está integrada en el tratamiento total de 4 horas del experimento. Obtener la rebanada siguiente y repita los pasos 5.2 a 5.8.
6. Grabación espontánea y Gq GPCR-evocó Agonist astrocítico Ca 2 + Actividad en Hippocampal Slices
- Configuración del microscopio confocal para la imagen:
- Limitar la exposición rebanada a la luz láser es de suma importancia, ya que la alta exposición puede conducir a teñir el blanqueo y / o fototoxicidad. El uso de un mayor aumento óptico o un mayor ajuste del zoom aumenta la exposición de la luz para el campo de imagen. Por lo tanto, establecer los valores predeterminados para cada láser a un alto settin fotomultiplicadorg, 1x ganancia y el 0,5% de la potencia de salida del láser.
- Aplique un zoom de 1.5x para una mejor visualización de los procesos de astrocitos.
- Ajuste la resolución de campo a 512 x 512 píxeles.
- Ajuste la velocidad del análisis y el más rápido posible, lo cual es de ~ 1,2 segundos por cada ciclo usando el modo de exploración de una manera.
- Recoger espectros de emisión usando filtros de paso de banda de 503 a 548 nm para el láser de 488 nm, y 624 a 724 nm para el láser de 559 nm. Estos ajustes permiten imágenes de un campo de ~ 5-8 astrocitos a una velocidad relativamente rápida con una resolución suficiente para observar los cuerpos celulares de astrocitos y los procesos principales. Lo ideal sería que los astrocitos en el campo será suficiente para ver claramente brillante, pero sin ningún tipo de saturación de píxel.
- Confirmar la identidad de las células cargadas con Ca 2 + teñir como astrocitos mediante la visualización de la SR-101 colabeling usando el láser 559 nm.
- Grabación astrocito Ca 2 + actividad:
- Dibuja cajas usando el software de adquisición de imágenes sobre las regiones de interés (ROIs) dentro de la célula, en este caso sobre cuerpos celulares de astrocitos. Las cajas no deben incluir los píxeles de fondo, para lograr la mejor relación posible de señal a ruido. Dibuja un rectángulo sobre el fondo como referencia.
- Cambie la perfusión ACSF experimental más 1 M TTX (Abcam) a través del resto del experimento. Esto elimina cualquier posible impulsadas por AP respuestas de calcio astrocito neuronales. Resto de incrementos en los astrocitos concentración de Ca2 + serán entonces debido a la liberación cuántica vesicular, constitutiva (basal) la actividad de GPCR, o alguna combinación de ambos mecanismos.
- Record de fluorescencia con el tiempo de todos los ROI. Cualquier aumento en la fluorescencia más de la línea de base indican los aumentos en citoplasmática concentración de Ca2 + 16, y por lo tanto la actividad de GPCR en astrocitos 10, 17, 18. Para evitar cualquier posible efecto de escala principios sobre los receptores astrocytic por TTX, experimentos completos dentro de 40 min from el momento en que comenzó la TTX perfusión 1 mM.
- Después de la obtención de 10 minutos de grabación de línea de base de la actividad espontánea Ca 2 +, aplicar un agonista de interés (tales como DHPG) a concentraciones secuencialmente crecientes. Deje un mínimo de 5 minutos entre las aplicaciones para reducir la posible desensibilización de los receptores.
- Al final de la grabación, aplicar un cóctel de agonistas para otros GPCRs Gq astrocíticos como un control positivo para los astrocitos intactos Gq GPCR vías de señalización. Componentes de la cóctel agonista dependerán del receptor de interés. 10 mM de cada uno de los Gq GPCR agonistas de histamina, carbacol, y 2Na-ATP para estimular los receptores H1 de histamina [H1R], los receptores de acetilcolina muscarínicos [mAchR], y los receptores purinérgicos [P2YR], respectivamente, es un cóctel agonista comúnmente utilizado.
- Adquisición de imágenes de post-experimento:
- A la finalización de la Ca 2 + grabación, tomar imágenes fijas con el 488 nm y 559 nm, los láseres fo posterior confirmación de la identidad de los astrocitos y la colocación ROI. Configuración de energía láser y AT pueden ser alterados libremente en este punto para obtener una imagen óptima para la colocalización, puesto que ya no es una preocupación por la intensidad de la luz láser que afecte a los datos (Figura 2A).
- Repita los pasos 6.1 hasta 6.3 para un total de aproximadamente 8 rebanadas y 40 astrocitos / grupo. Rebanadas deben provenir de un mínimo de 3 ratones diferentes.
7. Análisis de Astrocyte Ca 2 + Actividad
- Definición de una Ca 2 + elevación: Normalización en la definición de Ca 2 + transitorios no se ha establecido firmemente en la comunidad científica. Lo que sigue es un protocolo típico que maximiza la sensibilidad al tiempo que limita la detección de falsos eventos positivos de ruido de línea base.
- Haga que otro miembro del laboratorio de asignar a cada rebanada un código numérico con el fin de analizarlos a ciegas. A la conclusión del análisis, decodificar cada rebanada.
- Analizar astrocitos espontáneo y evocado Ca 2 + elevaciones fuera de línea con el software de análisis de imágenes. Volver a dibujar y / o ajustar el tamaño, la forma y la ubicación de las regiones de interés según se desee.
- Puntuación aumentos en la intensidad de fluorescencia más de línea de base como Ca 2 + elevación si la amplitud máxima es superior a dos desviaciones estándar (SD) por encima de la media de 30 segundos de promedio de fluorescencia de línea de base para al menos dos puntos de muestreo consecutivos. En grabaciones particularmente ruidosos (bajo señal-ruido), puede ser necesario ajustar a 3 DS por encima de la fluorescencia basal media de este criterio. Definir el inicio de cada Ca 2 + elevación que el último punto de datos antes de que la intensidad de la fluorescencia excede una desviación estándar por encima de la media.
- Diferenciar entre multipeak vs eventos de un solo pico sucesivas. Puntuación de un evento como "multipeak" cuando la intensidad de la fluorescencia no vuelve a la línea de base (por debajo del valor medio de referencia 2 SD) para y# 8804; 9 puntos de datos consecutivos (10,8 seg) entre picos. Por lo tanto, los eventos máximos individuales tendrán 10 o más puntos de datos de referencia consecutivos en entre ellos.
- Clasifique eventos como respuestas "plateau" de tipo, cuando la intensidad de fluorescencia mantiene amplitud máxima (± 10% del valor de pico) durante al menos 3,6 segundos.
- Analizar la amplitud, la frecuencia, y la cinética de espontáneas y agonistas-evocó los transitorios de calcio.
- Definir la amplitud pico de la Ca 2 + altura que el punto de datos con el valor más alto de intensidad (en los casos de respuestas "multipeak" utilizar el primer pico; ver Figura 2B).
- Calcular el tiempo de subida como la diferencia entre el inicio y el tiempo de respuesta correspondiente a la amplitud de pico. NOTA: puede necesitar 0 a 100% de tiempo de subida para ser utilizado con el fin de tener un número suficiente de puntos de datos para obtener un valor de tiempo; Velocidad de exploración es una variable importante aquí.
- Calcular la latencia como el tiempoentre el inicio de la perfusión agonista para el inicio de respuesta. Tiempo de subida puede ser una medida más útil en cortes de cerebro, siempre y lavado en épocas crean un factor de confusión en el cálculo de las latencias de respuesta.
- Determinar si existen diferencias estadísticamente significativas entre los dos grupos para cada parámetro utilizando la prueba t de Student independiente. Utilice el número de astrocitos como la 'n'. Use test de chi-cuadrado de Pearson para comparar los patrones de Ca 2 + de actividad entre los grupos de control y tratamiento. Use exacta prueba de 2 cola de Fisher para comparar los porcentajes de los patrones de Ca 2 + de actividad específicos entre grupos de control y tratamiento. Expresar las diferencias como * p <0.05, ** p <0,01, y *** p <0,001.
Resultados
Los resultados representativos en la Figura 3 muestran el efecto de la incubación de secciones de hipocampo de ratón agudos en TTX durante 4-6 h en astrocitos SR Ca 2 + actividad. Los datos incluyen tanto espontánea Ca 2 + transitorios y grupo-evocó DHPG I mGluR Ca 2 + respuestas, de las rebanadas se incubaron en control ACSF vs ACSF más TTX. Aparte de las características morfológicas características básicas, el montaje de proceso estrelladas y el pequeño tamaño del soma (~ 10 m), astrocitos se identifican en la SR por superposición de la Ca 2 + indicador de OGB-01 a.m. con el marcador de astrocitos selectiva SR-101 19, 20 ( Figura 3A). Las cajas numeradas más de los cuerpos celulares de astrocitos se corresponden con la fluorescencia de número superior a los rastros tiempo que se muestran en la Figura 3B. El grupo 1 agonista de mGluR (RS)-3.5-DHPG se aplica para determinar los efectos de escala específicas en grupo 1 mGluRs en astrocitos. Para discriminar entre Phys.iology en la especificidad del efecto de escala para los mGluRs del grupo 1 versus otros GPCRs Gq, un cóctel de los agonistas se aplica al final de cada experimento. Aquí hemos utilizado 10 M cada uno de los Gq GPCR agonistas de histamina, cloruro carbamilcolina (carbacol) y disódico de adenosina 5'-ATP (Na-ATP). El cóctel de agonista también sirve como un control positivo para identificar, astrocitos responden viables en los casos en que las células no responden a DHPG, supuestamente debido a que los astrocitos particulares no expresan cantidades suficientes del receptor para provocar una respuesta a DHPG.
Utilizamos diferentes concentraciones de DHPG, incluyendo 5 M y 15 M (Figura 3 B), así como 30 M y 50 M (Figura 4A) para ayudar en la revelación de los cambios en el grupo I mGluRs astrocítica. La relación entre celulares Ca 2 + respuestas y los niveles de expresión Gq GPCR que hubiera sido previamente in vitro 21-24. En primer lugar, laumbral para responder a una concentración de agonista en particular depende de la densidad de receptores expresados por cada célula. En una población de células, las células responden más con un Ca 2 + elevación a una concentración dada de agonista cuando las células son transfectadas con mayores densidades de receptores. Después de incubar las rebanadas en TTX, el porcentaje de astrocitos en la población que responde a una concentración fija de los aumentos de agonistas (Figuras 3B y 3C). Hemos encontrado que 5 M y 15 M DHPG revelan diferencias obvias en el porcentaje de astrocitos de respuesta entre el control y las células tratadas TTX, mientras que 30 y 50 M DHPG son necesarios para comparar las respuestas del grupo I mGluR en 5,0 mM de K + tratados frente a control células (Figura 4A).
La relación entre los patrones de Ca 2 + de respuesta astrocíticos y concentración de agonista también ha sido examinada in situ. El aumento de la agonistaconcentración cambia el patrón de la Ca 2 + respuesta en astrocitos de solo pico de Ca 2 + elevaciones a multipeak y meseta de Ca 2 + elevaciones 25-27. Basándose en estos hallazgos anteriores, predijimos que el patrón de respuesta a una única concentración de agonista se desplazará si hay cambios en el nivel de expresión del receptor. Por lo tanto, dependiendo de cuál de los dos métodos de escalado se está utilizando (la inhibición de la descarga neuronal o aumentarla), la concentración de agonista necesaria para producir un patrón de respuesta particular, aumentará o disminuirá. Por ejemplo, los astrocitos incubadas en TTX cambian su patrón de Ca 2 +-evocó DHPG respuesta a más Ca de tipo meseta 2 + elevaciones y responden a reducir las concentraciones de agonistas en comparación con el control de los astrocitos (Figura 3C). Teniendo en cuenta los estudios anteriores, estas observaciones sugieren que el grupo I de mGluR los niveles de expresión del receptor en los astrocitos se ha incrementado.
El tiempo de subida y el inicio (latencia) de la Ca 2 + elevaciones también han demostrado que se correlaciona directamente con los cambios en los niveles de expresión Gq GPCR en células cultivadas de 22-24. Los niveles de expresión del receptor de altos producen latencias de respuesta más cortos y tiempos de subida más rápidos mientras que la reducción en la densidad de receptores produce el efecto contrario. Para astrocitos incubadas en TTX, Ca 2 + transitorios provocados por la aplicación de DHPG tienen significativamente más rápido los tiempos de subida en comparación con los astrocitos incubadas en control ACSF (Figura 3D). Como se mencionó anteriormente, las amplitudes de Ca 2 + respuestas agonistas-evocó permanecen sin cambios, independientemente de la concentración de agonista o el modelo de escalamiento 15 (Figura 3D).
Además de los cambios observados por la activación directa de mGluRs del Grupo I con DHPG, los astrocitos espontánea Ca 2 + actividad también se ve afectada significativamente por esta manipulación. Observamosda aumento de 2,26 veces en el porcentaje de astrocitos espontáneamente activos se incubaron en TTX versus control. Este es un aumento de sólo el 12,9% de los astrocitos de control que exhiben actividad espontánea en el soma al 42,1% en el TTX incubado astrocitos (Figura 3E). Debido a que se sabe que la actividad GPCR exposición "intrínseca" o constitutiva en ausencia de agonista 21, 26, 28, y que el nivel de este intrínsecas aumenta la actividad con el aumento de los niveles de expresión del receptor, estos datos sugieren que la densidad de astrocíticos aumenta Gq GPCRs después de la reducción a largo plazo en la acción neuronal potencial de fuego. Al igual que en las respuestas agonistas evocados, los tiempos de subida de los espontáneos Ca 2 + elevaciones también se incrementaron (Figura 3E).
Los datos representativos que utilizan el segundo protocolo, la incubación en potasio extracelular elevado (5,0 mM), se representa en la Figura 4. Un aumento en K + extracelular de resultados 2,5-5,0 mM en un aumento significativo en la acción de las neuronas CA3 basal potencial de la frecuencia 15. Mayores concentraciones de DHPG (30 M y 50 M) son necesarios con el fin de evocar el grupo I mGluR Ca 2 + respuestas de los astrocitos incubadas en niveles altos de potasio (Figuras 4A y 4B). Esto es coherente con un nivel reducido de grupo de respuesta I mGluR en astrocitos después de un aumento a largo plazo en los potenciales de acción neuronales. Además, el patrón de respuesta evocada a una concentración fija de DHPG se desplaza de respuestas-meseta como a las respuestas de un solo pico más débiles (Figura 4B). Examinando el porcentaje de astrocitos espontáneamente activos en las dos condiciones de potasio revela que un menor número de astrocitos se incubaron en alta K + son espontáneamente activa en comparación con la condición de control (Figura 4C). Este efecto es en el opposite dirección de la condición de TTX en la que se incrementa el porcentaje de astrocitos que exhiben espontáneas Ca 2 + elevaciones. Por último, tanto evocada y espontánea Ca 2 + elevaciones tienen tiempos de subida más lento en los astrocitos incubadas en alto K + en comparación con el grupo de control (Figuras 4C y 4D). En general, estos datos sugieren que los niveles de expresión Gq GPCR astrocytic escala de cuotas de forma bidireccional, dependiendo del nivel de la acción neuronal potencial actividad durante un período de tiempo prolongado.

Figura 1. Fabricación cámara de incubación Slice y configurar. (A) La porción del cajón de un contenedor de almacenamiento pipeta Brinkmann junto con su tapa hermética se utiliza para construir la cámara de incubación rebanada. (B) Driachuelo de un agujero en el lado del recipiente de aproximadamente 1 ¼ desde la parte superior y ¼ desde el lado. Colocar en un trozo de tubo flexible. (C) Conecte el aparato microloader colector al extremo interior del tubo flexible. Nota de corte para el montaje de puntas de pipeta 200 l naturales (flecha blanca). (D) Seis 20 l microloaders Eppendorf se cortan-to-fit a un colector de la línea de uno a seis para crear un aparato de microloader múltiples. (E) Haga dos pequeños agujeros en la tapa. (F) Un Rack burbuja flotante para hacer que el titular de la rebanada. (G) Las "piernas" parte inferior del bastidor burbuja flotante se eliminan de manera que una pieza de material de malla de nylon se pueden pegar a la parte inferior. (H) Llenar la cámara de incubación con una cantidad suficiente de ACSF para que las carrozas titular rebanada. Ajuste la longitud de la tubería de modo que las puntas de las microloaders pueden descansar en un rincón del piso de la cámara. Al colocar la cámara de incubación enel baño de agua, el nivel del agua en el baño debe estar al mismo nivel que la ACSF en la cámara. Haga clic aquí para ver la imagen más grande.
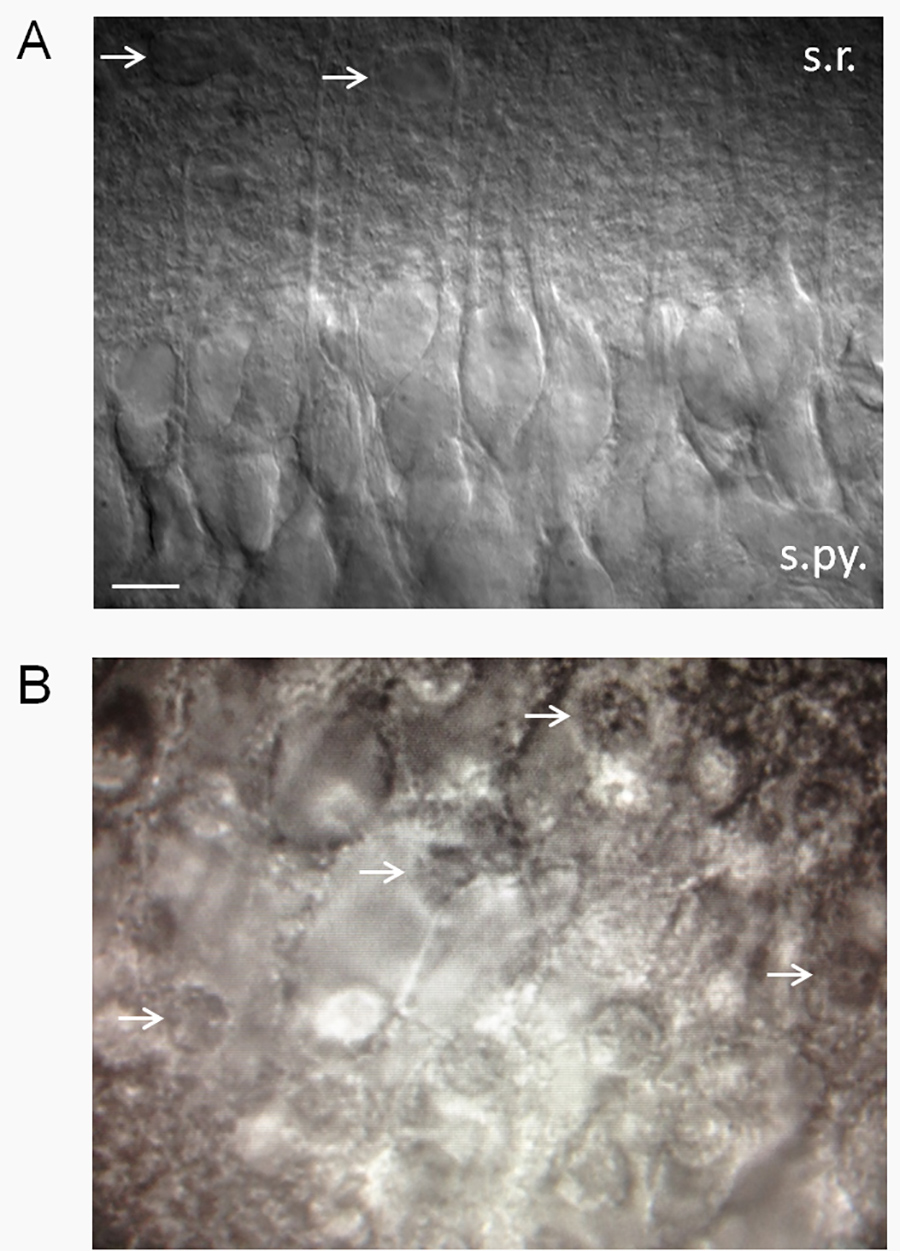
Figura 2. Estimación de la salud rebanada. (A) Una rebanada del hipocampo de aspecto saludable mediante contraste de interferencia diferencial (DIC) óptica. Rodajas sanos tienen una apariencia aterciopelada y un alto porcentaje de las neuronas piramidales CA1 saludables. Tenga en cuenta las dendritas apicales que se proyectan dentro estrato radiado. Patch-clamp de las neuronas que se parecen a los que se muestran aquí revelan un potencial de membrana de reposo baja (-61 a -62 mV) en la norma 2.5 mM K + ACSF con unos potenciales de acción espontáneos. Las tasas de potencial de membrana y de cocción variarán en función de la exextracelular de K + (Xie et al. 15). Las flechas apuntan a los astrocitos putativo. Abreviaturas: sr, estrato radiado; s.py., estrato piramidal. La barra de escala, 10 micras. (B) las rebanadas no saludables tienen un alto porcentaje de las neuronas piramidales CA1 muertos, que tienen el aspecto de huevos fritos (flechas blancas señalan núcleos de neuronas muertas - la "yema" del huevo frito). Haga clic aquí para ver la imagen más grande.
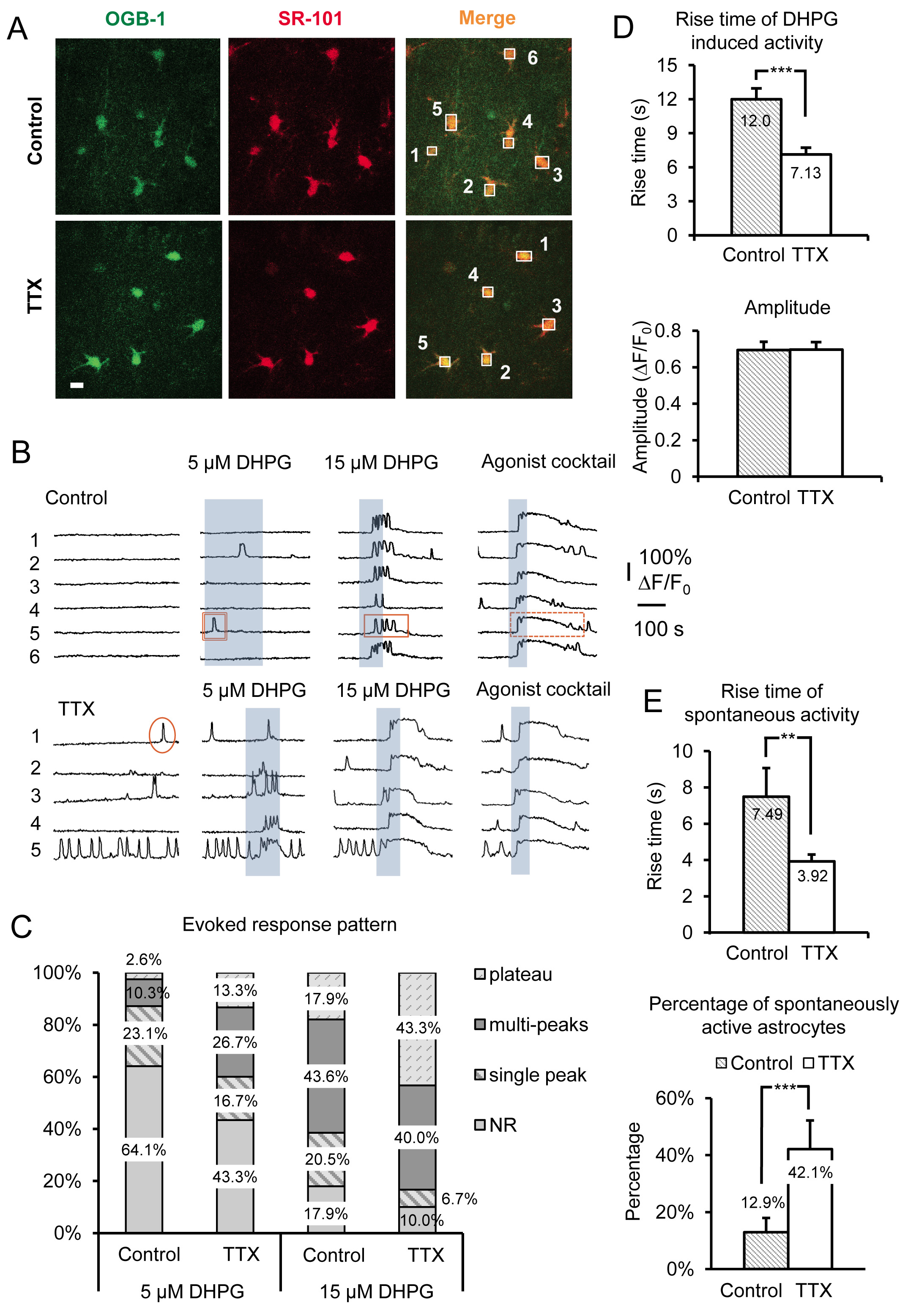
Figura 3. Grabación amplificada actividad de GPCR y Gq grupo I mGluR evocado Ca 2 + respuestas después de la inhibición a largo plazo de los puntos de acceso neuronales por incubación en TTX. (A) Imágenes representativas de células en el campo de la grabación incubaron en Control condiciones (paneles superiores) o en TTX (paneles inferiores) que han tomado Oregon Green BAPTA-01 a.m. Ca 2 + colorante indicador (paneles de la izquierda) y SR-101 (paneles centrales). La barra de escala es de 10 micras. Superposición de ambas señales ("merge") indica que los astrocitos de carga con Ca 2 + indicador. Las cajas son dibujadas sobre soma de astrocitos individuo para registrar la intensidad de fluorescencia con el tiempo en el canal verde para supervisar Ca 2 + actividad en astrocitos. (B) restos de muestra de las cajas registradoras en A) de Ca 2 + en la actividad de los astrocitos. Los astrocitos incubadas en TTX muestran mayor actividad espontánea y evocada grupo más sólido I mGluR Ca 2 + respuestas según lo evidenciado por los cambios en el patrón de respuesta. Ejemplos de pico simple (círculo), multipeak (rectángulo), y la meseta (rectángulo de puntos) se muestran Ca 2 + transitorios. (C) Los cambios en los patrones de respuesta son especialmente evidentes utilizando diferentes concentraciones del grupo I agonista mGluR DHPG. Más multipeak y meseta respuestas son evidentes después de la incubación en TTX comparación con el control a una concentración de agonista dada. (D) Rise tiempos de Ca 2 + respuestas evocadas por DHPG son más rápidos en los astrocitos incubadas en TTX en comparación con el control (panel superior), mientras que las amplitudes no cambian (panel inferior), indicativo de "todo o nada" amplitud de la respuesta, una vez se ha alcanzado el umbral para responder. (E) Aumento tiempos de astrocito espontánea Ca 2 + transitorios son también más rápido en TTX incubado frente a control incubada astrocitos (panel superior), mientras que el porcentaje de los astrocitos en la población exhibiendo espontáneas Gq GPCR Ca 2 + aumenta la actividad (panel inferior). Haga clic aquí para ver la imagen más grande.

Figura 4. Grabación astrocítica disminuida actividad Gq GPCR y de grupo I mGluR evocado Ca 2 + respuestas siguientes aumento a largo plazo en los puntos de acceso neuronales mediante incubación en potasio elevado extracelular. (A) trazas representativas de astrocitos Ca 2 + grabaciones de rebanadas incubadas en 5,0 mM K + ACSF para despolarizar las neuronas y aumentar su tasa de disparo basal en comparación con el control de ACSF (2,5 mM K + ACSF). Astrocitos incubadas con 5,0 mM de K + ACSF exhiben menos espontáneas somáticas Ca 2 + transitorios y más débiles DHPG respuestas evocadas en comparación con los astrocitos incubadas en ACSF control. (B) La comparación de los patrones de las respuestas evocadas a varias concentraciones de DHPG revela tipos de respuesta más débiles después de aumento a largo plazo en los puntos de acceso neuronales. (C) Una reducción en el porcentaje de los astrocitos en el POblación exhibiendo espontánea Ca 2 + actividad se observó después de la incubación a largo plazo en elevada K + en comparación con el control de ACSF (panel superior), mientras que los tiempos de subida de la actividad espontánea se vuelven más lentas (panel inferior). (D) Aumento tiempos de astrocito evocó Ca 2 + respuestas a diferentes concentraciones de DHPG ralentizarse tras 5,0 mM K + tratamiento en comparación con los astrocitos incubadas en ACSF control. Haga clic aquí para ver la imagen más grande.
Discusión
Los modelos de escala descritas representan métodos prácticos para la investigación de la plasticidad a largo plazo del grupo I mGluRs astrocítica. Imagen Ca 2 + eventos espontáneos y provocados proporciona un ensayo sensible para la medición de los cambios en la actividad astrocítica Gq GPCR, como evidencia firme se ha establecido que los astrocitos de Ca 2 + elevaciones se producen después de la liberación de 3 tiendas-R sensible IP aguas abajo de la activación Gq GPCR 10, 12, 17, 18. El porcentaje de los astrocitos en la población que responde al grupo agonista I mGluR y el patrón de tales Ca 2 + respuestas informan de cambios en el grupo I mGluRs por los astrocitos.
La técnica específica usada para cargar los astrocitos con Ca 2 + indicador es una consideración importante en el diseño de experimentos para buscar cambios en la actividad de los astrocitos Gq de GPCR. Bolo de carga o múltiples astrocitos carga masiva, o patch-abrazadera de carga de los astrocitos individuales se puede utilizar para imagen Ca 2 + transitorios en los astrocitos. Cada enfoque ofrece ciertas ventajas y desventajas. Llenar directamente los astrocitos con Ca 2 + indicador a través de patch clamp permite la identificación inequívoca de la célula como un astrocito sin necesidad de un marcador secundario tal como SR-101. Entrega Patch-clamp de indicador también permite la grabación de Ca 2 + actividad de pequeños compartimentos astrocytic incluyendo los procesos finas y tupidas, potencialmente más profundos en el segmento donde las células son más sanos y con interacciones más intactas con las sinapsis (dependiendo de la potencia del láser disponible). Sin embargo, de patch-clamp de carga sufre de bajo rendimiento como los datos se recogen una célula a la vez. Granel de carga, por el contrario, permite un gran número de astrocitos a ser cargado con Ca 2 + indicador y la imagen de forma simultánea. Sin embargo, sólo los astrocitos cerca de la superficie (<20 micras) de la rodaja se cargan, con preocupación asociadas acerca de la salud celular y sinapsis intactas.
El protocolo de bolo de carga contrapresión presentado aquí ofrece un punto medio, con rendimiento relativamente alto y la capacidad de supervisar Ca 2 + la actividad más profundo dentro de la porción (40-75 micras). Se observó un aumento significativo en el porcentaje de astrocitos espontáneamente activas usando la técnica de bolo de carga en comparación con la carga masiva, lo que sugiere que las conexiones entre las sinapsis neuronales y los procesos astrocíticos son más completa 15. Con buena carga, a menudo se puede controlar Ca 2 + actividad en los principales procesos de astrocitos (datos no mostrados) o, potencialmente, incluso compartimentos más pequeños utilizando microscopía de 2-fotón. Sin embargo, tendría que ser ejercido en la asignación de los procesos más pequeños a un astrocito en particular, ya que los límites se funden en la tinción de fondo inespecífica cuidado. Una preocupación adicional con el uso de los procedimientos de carga a granel o en bolo de carga es la necesidad de un mar secundariaKer para la identificación de astrocitos. Mientras que se ha sabido durante muchos años que los astrocitos preferentemente ocupan éster AM de Ca 2 + indicadores, el marcador secundario SR-101 se utiliza a menudo para verificar las células cargadas como astrocitos. SR-101 en sí mismo puede alterar la excitabilidad intrínseca de las neuronas 29. El uso de SR-101 corrobora la necesidad de realizar todas Ca 2 + mediciones de astrocitos en la TTX para limitar posibles SR-101 efectos en la excitabilidad neuronal. Suponiendo que los grupos control y experimentales incluyen SR-101, el marcador en sí mismo no debe tener en cuenta los efectos observados en los astrocitos Ca 2 + señalización siguientes manipulación a largo plazo de los potenciales de acción neuronales. SR-101 puede ser más de una preocupación en la escuela de K + experimentos, sin embargo, ya que puede reducir la diferencia entre mM K + 2.5 vs 5,0 mM de K +, si la velocidad de disparo basal no se altera de forma proporcional.
Un enfoque muy prometedor para entregar Ca 2 + Indicador de astrocitos ha surgido recientemente que ofrece una atractiva alternativa a los enfoques más tradicionales utilizando Ca 2 + tintes. Avances significativos se han hecho en los últimos años con los indicadores de calcio codificados genéticamente (Gecis) dirigidos a los astrocitos 30-32. Gecis puede ser entregado a los astrocitos por microinyección in vivo de vectores virales adeno-asociados en una región del cerebro de interés, tales como el hipocampo. Expresión de Gecis se alcanza después de aproximadamente dos semanas después de la infección viral 32. Hay numerosas ventajas presentadas por el uso de Gecis en astrocitos. En primer lugar, los vectores se dirigen a los astrocitos utilizando un promotor específico de astrocitos, por lo que las células marcadas son astrocitos 32. En segundo lugar, el ruido de la señal-a-ahora parece comparable a lo que puede ser obtenido usando la entrega de patch-clamp de tinte, pero sin la invasividad de haber tenido una pipeta de parche en la celda 32. En tercer lugar, los indicadores pueden ser delivered y se expresa en el tejido adulto, lo que es problemático el uso de métodos de entrega de la carga masiva. Por otra parte, la expresión es de mosaico, que ofrece la capacidad de diferenciar entre múltiples astrocitos. Por lo tanto, varios astrocitos potencialmente se pueden obtener imágenes de forma simultánea, a la vez que la grabación en el soma y ramillas finas al mismo tiempo. Por lo tanto, potencialmente, una sola técnica podría ser utilizada en lugar de tres técnicas separadas (la carga masiva, bolo de carga, y la carga de patch-clamp) para registrar la actividad de la ampliación de los GPCRs Gq astrocíticos, incrementando en gran medida la eficiencia.
Una desventaja potencial de usar la entrega mediada por virus de Ca 2 + indicadores de los astrocitos es el posible efecto sobre la salud de la rebanada 32. Los vectores virales adeno-asociados utilizados para entregar las Gecis se han demostrado previamente para causar gliosis reactiva de astrocitos 33. Preparación de cortes de cerebro en general probablemente inicia primeras etapas de la patología, incluida la liberación de inflammatory moléculas 10. Por lo tanto, junto con los tiempos de incubación largos requeridos para inducir la escala de los receptores de los astrocitos, el uso de Gecis entregado usando vectores virales tendrían que recibir una consideración adicional en el contexto de la salud rebanada en este tipo de experimentos.
Cuando se emplea este protocolo, es importante tener en cuenta que el tiempo de aplicación para el agonista para producir una respuesta variará en función de la disponibilidad del receptor. Para una concentración dada de agonista, el tiempo de aplicación tendrá que ser más largo si los receptores han reducido, y más corto si los receptores se han ampliado, para el fármaco para alcanzar una concentración adecuada en el tejido para activar los receptores suficientemente para producir un Ca 2 + respuesta. Por lo tanto, los tiempos de aplicación de la droga, y, potencialmente, sus concentraciones, pueden tener que ser ajustados dependiendo de la dirección prevista de la escala. Por ejemplo, es posible que la concentración de agonista que bajar en el case de TTX para evitar la saturación de las respuestas, y aumentó después de la incubación de las rebanadas de alto K + ver aún una respuesta. En concreto, la concentración DHPG fue desplazado 5-15 M después del tratamiento TTX 30-50 M después del tratamiento 5,0 mM de K + con el fin de estudiar Ca 2 + patrones de respuesta, como 5-15 M era con frecuencia demasiado baja para producir respuestas fiables en astrocitos después de escalar hacia abajo del grupo I mGluRs.
De grabación de astrocito Ca 2 + actividad no proporciona ninguna evidencia directa de la inserción del receptor o la internalización hacia o desde la membrana plasmática. Sin embargo, en base a la notable similitud de los datos con los datos de estudios previos in vitro que examinaron la relación directa entre los niveles de expresión de GPCR Gq y espontánea y evocó Ca 2 + transitorios 21-24, la interpretación más lógica de los cambios en el Ca 2 + de señalización es que la superficie de los niveles de expresión de los receptores de astrocitos tienencambiado. Un enfoque complementario puede ser una consideración importante si se quiere proporcionar evidencia adicional sobre el locus del efecto sobre el Ca 2 + actividad. Una estrategia que utilizamos fue examinar el efecto de la incubación TTX en rodajas de hipocampo de ratones astrocytic MrgA1R. Estos ratones transgénicos expresan un GPCR Gq extranjera (el MrgA1R) sólo en los astrocitos. Debido a que este receptor no es nativo al cerebro, no hay neurotransmisor endógeno presente para cambiar sus niveles de actividad. El trabajo previo sugiere que este receptor se acopla a la misma moléculas de señalización intracelular como grupo endógeno I mGluRs en los mismos astrocitos 34. Después de la incubación a largo plazo de las rebanadas de ratones MrgA1R en TTX, no hay diferencias en las respuestas MrgA1R agonistas-evocada en comparación con el control de la misma camada incubó rebanadas se proporcionan evidencia de que el efecto sobre los astrocitos Ca 2 + actividad es debido a los cambios localizados en el receptor de la superficie, especialmente si las respuestas del grupo I mGluR siguen siendo signifinificativamente mayor en los mismos astrocitos. Una alternativa, aunque estrategia tal vez más implicados sería para aislar los astrocitos de las rodajas para el análisis de Western blot, siempre y cuando una fracción de membrana se podría analizar los cambios en los niveles de expresión de los receptores de superficie. La fluorescencia de células activadas clasificación (FACS) o citometría de flujo pueden ser útiles aquí.
Las posibles aplicaciones de esta técnica para el estudio de las neuronas, astrocitos y las interacciones de astrocitos neuronal son muchos. En nuestros experimentos, único grupo-evocó DHPG I mGluR se estudiaron astrocytic Ca 2 + respuestas, en rodajas de hipocampo aisladas agudas de ratones jóvenes. Esta preparación no sólo tiene los aferentes intactas (colaterales de Schaffer), sino también las neuronas que dan lugar a ellas (las células piramidales CA3), por lo que es posible manipular las tasas de disparo de estas neuronas glutamatérgicas en las células postsinápticas (células piramidales CA1) y los astrocitos en estrato radiado cuyos procesos asoE con estas sinapsis. La rebanada del hipocampo aguda puede no ser la mejor preparación para la manipulación de las tasas de disparo de otros tipos de neuronas, sin embargo, el mayor número de fibras aferentes se separan de las neuronas que dan lugar a los mismos. Sin embargo, puede ser posible en ciertas preparaciones rebanada para observar la plasticidad de otros subtipos Gq GPCR astrocíticos. Por ejemplo, las rebanadas se podrían preparar con las neuronas colinérgicas del cerebro anterior basal y sus proyecciones al hipocampo intacto. La incubación de estas rebanadas en TTX o elevada de K + podría afectar las tasas de disparo de las neuronas colinérgicas basales, que conduce a la escala de mAChRs en astrocitos de estrato oriens, que reciben una parte significativa de la entrada colinérgica 1. Una alternativa todavía no probado enfoque para estudiar la escala del receptor de los astrocitos dentro de un área específica del cerebro, con todas las conexiones intactas mientras se realiza un escalado, podría ser el uso de un modelo in vivo donde una liberación sostenida de TTX se consigue mediante la implantación de un Plastpolímero IC Elvax 40W por encima de la región de interés 35. Este enfoque ha sido utilizado previamente en un estudio de escalado neuronal, sino también debe ser aplicable a la escala de los astrocitos. Finalmente, con la lectura correcta, futuros estudios podrían examinar otras familias de GPCR, incluyendo cambios en T o s T i GPCRs. Uno podría predecir astrocítica GABA B G i GPCRs verse afectados tras la inhibición del disparo en la proyección a nivel local interneuronas GABA dentro de cualquier rebanada preparación. Desarrollo de nuevos indicadores destinados a otras moléculas de señalización, como un indicador de tiempo real del segundo mensajero AMPc, se abriría un nuevo campo de investigación sobre la comunicación del receptor de la neurona-astrocito a.
Escalamiento bidireccional de los mGluRs astrocíticos por la manipulación de las tasas de disparo de las neuronas basales proporciona una medida de la sensibilidad de los astrocitos a la liberación mediada por AP de neurotransmisor. Los astrocitos aparentemente pueden detectar puntos de acceso espontáneas y glutamaliberación TE en las sinapsis de células piramidales CA1 colateral de Schaffer incluso cuando K + extracelular está dentro de un rango fisiológico. Si bien la aplicación aguda de TTX no reduce la frecuencia de los astrocitos espontánea Ca 2 + actividad 18, 36, 37, el Ca 2 + actividad entre los astrocitos en la población se convierte en decorrelacionada 36, proporcionando evidencia de que los receptores de los astrocitos son detectores de AP. Esto sugiere que los astrocitos sienten APs neuronales espontáneas con ningún efecto en su actividad general Ca 2 +. Es ampliamente aceptado que las concentraciones intracelulares de IP 3 necesitan para alcanzar un nivel de umbral para estimular IP 3 Rs lo suficiente como para dar lugar a una detectable Ca 2 + elevación. Podrían APs neuronales espontáneas activar GPCRs astrocytic sin producir mensurables Ca 2 + elevaciones? Los estudios futuros podrían utilizar energía de resonancia fluorescente Transfer (FRET) o una tecn similares ique (como BRET) para examinar la relación entre G acoplamiento proteína al receptor (una medida de la activación del receptor) y Ca 2 + liberación de las reservas internas. BRET se ha utilizado ampliamente in vitro para detectar g Acoplamiento de proteína a GPCR 38, aunque puede ser algún tiempo antes de que esta tecnología esté disponible para su uso en preparaciones de tejidos intactos. Es posible que los GPCRs Gq astrocitos se activan con mayor frecuencia que se puede grabar utilizando las herramientas de Ca 2 + de imágenes disponibles en la actualidad. Además de detectar potenciales de acción, los GPCR Gq astrocíticos también pueden ser capaces de detectar la liberación cuántica en miniatura de neurotransmisor como se informa en un estudio reciente 39. El método de escalado bidireccional aquí descrito se puede usar en futuros estudios para proporcionar una medida de la medida en que los GPCR astrocítico Gq detectar la liberación vesicular cuántica de neurotransmisor, incluyendo bafilomicina A1 en el protocolo de incubación.
ntent "> Hasta el momento, los protocolos de escala sólo se han usado en cortes de hipocampo de ratones jóvenes (P12-P18). Por lo tanto, actualmente se desconoce si la escala del receptor de los astrocitos también podría ser inducido en el tejido obtenido a partir de ratones adultos. Un estudio reciente convincente sugiere que la expresión grupo I mGluR en astrocitos disminuye considerablemente después de la primera semana de edad y sigue disminuyendo hasta la edad adulta, con muy bajos niveles de expresión del receptor en los astrocitos adultos 40. Por tanto, sería interesante determinar si mGluRs astrocytic escala a raíz de largo inhibición término de la descarga neuronal en adultos rodajas de hipocampo de ratón a niveles cercanos a los observados en los astrocitos de ratones jóvenes. Este hallazgo sugiere que la expresión del receptor astrocítica no es estática a una edad determinada, pero puede cambiar rápidamente dependiendo de los niveles de actividad neuronal. A diferencia de reducción de la expresión del grupo I mGluRs en ratones adultos, la evidencia está emergiendo que los receptores adrenérgicos, incluyendo & #945; 1A, 2A α, β y 1 subtipos, se expresan predominantemente por los astrocitos en el cerebro adulto 3, 4. El adrenérgicos α 1A Gq GPCR puede ser un blanco atractivo para los futuros estudios de la comunicación de las neuronas a los astrocitos, indicar si estos receptores son sensibles a los cambios en las tasas de disparo de las neuronas adrenérgicas.Divulgaciones
Los autores desean dar a conocer que la tetrodotoxina usada en estos estudios fue adquirido de Abcam. Abcam no tuvo ninguna participación en las hipótesis, el diseño, o la recogida de datos. Toda la comunicación sobre el patrocinio de la obra por Abcam se produjo después de que el proceso de revisión por pares fue completa.
Agradecimientos
Los autores desean agradecer el Centro de UC Riverside para glial-neuronal Interacciones valioso para el debate de los protocolos de escala y los datos. Los autores también quisiera dar un agradecimiento sincero a Abcam por patrocinar la publicación de su trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Chamber Supplies | |||
| Brinkmann pipette storage container | Fisher Scientific | 03-491 | Use the drawer portion as the incubation chamber |
| Electrical drill | |||
| Flexible tubing | Tygon | R-3603 | |
| Silicone seam sealant | Also called aquarium seam sealer | ||
| Gas tank | 95% oxygen, 5% carbon dioxide | ||
| Natural beveled pipette tip | USA Scientific | 1111-1000 | Cut-to-fit to connect oxygenate lines |
| One-to-six lines manifold | Warner Instruments | 64-0210 (MP-6) | For the microloader-manifold apparatus |
| Microloader | Eppendorf | 5242 956.003 | For the microloader-manifold apparatus, cut-to-fit |
| Floating Bubble Rack | Bel Art Scienceware | F18875-0400 | For slice holder |
| 600 µm Sefar Nitex Nylon mesh | ELKO Filtering Co. | 06-600/51 | For slice holder |
| Krazy Glue | For slice holder | ||
| Reagents | |||
| Isoflurane | Baxter | 1001936060 | |
| NaCl | Fisher | S271-3 | |
| KCl | Fisher | P333-500 | |
| CaCl2 | Fisher | C79-500 | |
| MgCl2 | Fisher | M33-500 | |
| NaH2PO4 | Fisher | S369-500 | |
| NaHCO3 | Fisher | S233-500 | |
| Glucose | Fisher | Fisher | |
| (±)-6-Hydroxy-2,5,7,8- tetramethylchromane-2-carboxylic acid (Trolox) | Acros Organics | 53188-07-1 | |
| Ascorbic acid | Acros Organics | 401471000 | |
| Tetrodotoxin citrate (TTX) | Abcam | ab120055 | |
| Sulforhodamine 101 (SR-101) | Sigma-Aldrich | 284912 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D128-500 | |
| Pluronic Acid F-127 | Invitrogen, Molecular Probes | P6867 | |
| Oregon Green 488 BAPTA-1 AM *cell permeant (special packaging) | Invitrogen, Molecular Probes | O6807 | |
| (RS)-3,5-DHPG | Abcam | ab120020 | |
| Histamine | Sigma-Aldrich | H7125 | |
| Carbamoylcholine chloride (Carbachol) | Sigma-Aldrich | C4382 | |
| Adenosine 5’-ATP disodium (Na-ATP) | Sigma-Aldrich | A7699 | |
| Dissection Tools | |||
| Single-edge razor blade | GEM | 62-0161 | For bisection |
| Double edge razor blade | TED PELLA, INC. | 121-6 | For cutting slices |
| Mayo Scissors, supercut | WPI | 14010-15 | For decapitation |
| Fine iris scissors, straight | Fine Science Tools | 14094-11 | For cutting the skull |
| Iris forceps, curved | WPI | 15915 | To remove the skin and skull |
| Small spatula | To remove/transfer the brain | ||
| Dumostar Dumont #5 Biologie Tip forceps | Fine Science Tools | 11295-10 | For hippocampus dissection |
| Glass Pasteur pipette | Fisher | 13-678-20B | For transferring brain slices |
| Pasteur pipette rubber bulb | Fisher | 03-448-22 | For transferring brain slices |
| Polystyrene 100 mm tissue culture dishes | Corning | 25020 | |
| Vibratome | Leica | VT 1200S | |
| Water bath | Fisher | ISOTEMP 210 | For warm incubation |
| Micropipette puller | Narishige | PC-10 | For bolus-loading pipette |
| Confocal microscope | Olympus | Olympus Fluoview 1000 | |
| Low Profile Open Diamond Bath Imaging Chamber with PM-1 platform | Warner Instruments | RC-26GLP | diamond bath with low profile |
| Borosilicate glass pipette | World Precision Instruments | TW150F-4 | For bolus-loading pipette |
| Micromanipulator | Sutter Instrument | ROE-200 | For bolus-loading pipette |
| Spin-X centrifuge tube filter with 0.22 µm cellulose acetate | Costar | 8161 |
Referencias
- Araque, A., Martin, E. D., Perea, G., Arellano, J. I., Buno, W. Synaptically released acetylcholine evokes Ca2+ elevations in astrocytes in hippocampal slices. J. Neurosci. 22, 2443-2450 (2002).
- Navarrete, M., Araque, A. Endocannabinoids mediate neuron-astrocyte communication. Neuron. 57, 883-893 (2008).
- Bekar, L. K., He, W., Nedergaard, M. Locus coeruleus alpha-adrenergic-mediated activation of cortical astrocytes in vivo. Cereb. Cortex. 18, 2789-2795 (2008).
- Hertz, L., Lovatt, D., Goldman, S. A., Nedergaard, M. Adrenoceptors in brain: cellular gene expression and effects on astrocytic metabolism and Ca2. Neurochem. Int. 57, 411-420 (2010).
- Porter, J. T., McCarthy, K. D. Hippocampal astrocytes in situ respond to glutamate released from synaptic terminals. J. Neurosci. 16, 5073-5081 (1996).
- Bernardinelli, Y., et al. Astrocytes display complex and localized calcium responses to single-neuron stimulation in the hippocampus. J. Neurosci. 31, 8905-8919 (2011).
- Panatier, A., et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell. 146, 785-798 (2011).
- Wang, X., et al. Astrocytic Ca2+ signaling evoked by sensory stimulation in vivo. Nat. Neurosci. 9, 816-823 (2006).
- Fiacco, T. A., Agulhon, C., McCarthy, K. D. Sorting out astrocyte physiology from pharmacology. Annu. Rev. Pharmacol. Toxicol. 49, 151-174 (2009).
- Agulhon, C., et al. Calcium Signaling and Gliotransmission in Normal vs Reactive Astrocytes. Front. Pharmacol. 3, 139 (2012).
- Nedergaard, M., Verkhratsky, A. Artifact versus reality--how astrocytes contribute to synaptic events. Glia. 60, 1013-1023 (2012).
- Nizar, K., et al. In vivo stimulus-induced vasodilation occurs without IP3 receptor activation and may precede astrocytic calcium increase. J. Neurosci. 33, 8411-8422 (2013).
- Sutton, M. A., et al. Miniature neurotransmission stabilizes synaptic function via tonic suppression of local dendritic protein synthesis. Cell. 125, 785-799 (2006).
- Ibata, K., Sun, Q., Turrigiano, G. G. Rapid synaptic scaling induced by changes in postsynaptic firing. Neuron. 57, 819-826 (2008).
- Xie, A. X., et al. Bidirectional scaling of astrocytic metabotropic glutamate receptor signaling following long-term changes in neuronal firing rates. PLoS ONE. 7, (2012).
- Takahashi, A., Camacho, P., Lechleiter, J. D., Herman, B. Measurement of intracellular calcium. Physiol. Rev. 79, 1089-1125 (1999).
- Petravicz, J., Fiacco, T. A., McCarthy, K. D. Loss of IP3 receptor-dependent Ca2+ increases in hippocampal astrocytes does not affect baseline CA1 pyramidal neuron synaptic activity. J. Neurosci. 28, 4967-4973 (2008).
- Nett, W. J., Oloff, S. H., McCarthy, K. D. Hippocampal astrocytes in situ exhibit calcium oscillations that occur independent of neuronal activity. J. Neurophysiol. 87, 528-537 (2002).
- Garaschuk, O., Milos, R. I., Konnerth, A. Targeted bulk-loading of fluorescent indicators for two-photon brain imaging in vivo. Nat Protoc. 1, 380-386 (2006).
- Nimmerjahn, A., Kirchhoff, F., Kerr, J. N., Helmchen, F. Sulforhodamine 101 as a specific marker of astroglia in the neocortex in vivo. Nat. Methods. 1, 31-37 (2004).
- Prezeau, L., et al. Changes in the carboxyl-terminal domain of metabotropic glutamate receptor 1 by alternative splicing generate receptors with differing agonist-independent activity. Mol. Pharmacol. 49, 422-429 (1996).
- Shao, Y., McCarthy, K. D. Quantitative relationship between alpha 1-adrenergic receptor density and the receptor-mediated calcium response in individual astroglial cells. Mol. Pharmacol. 44, 247-254 (1993).
- Wang, S. S., Thompson, S. H. Measurement of changes in functional muscarinic acetylcholine receptor density in single neuroblastoma cells using calcium release kinetics. Cell Calcium. 15, 483-496 (1994).
- Ostasov, P., Krusek, J., Durchankova, D., Svoboda, P., Novotny, J. Ca2+ responses to thyrotropin-releasing hormone and angiotensin II: the role of plasma membrane integrity and effect of G11alpha protein overexpression on homologous and heterologous desensitization. Cell Biochem. Funct. 26, 264-274 (2008).
- Shelton, M. K., McCarthy, K. D. Hippocampal astrocytes exhibit Ca2+-elevating muscarinic cholinergic and histaminergic receptors in situ. J. Neurochem. 74, 555-563 (2000).
- Hermans, E., Challiss, R. A. Structural signalling and regulatory properties of the group I metabotropic glutamate receptors: prototypic family C G-protein-coupled receptors. Biochem. J. 359, 465-484 (2001).
- Zur Nieden, R., Deitmer, J. W. The Role of Metabotropic Glutamate Receptors for the Generation of Calcium Oscillations in Rat Hippocampal Astrocytes In Situ. Cortex. 16 (5), 676-687 (2005).
- de Ligt, R. A., Kourounakis, A. P., AP, I. J. Inverse agonism at G protein-coupled receptors: (patho)physiological relevance and implications for drug discovery. Br. J. Pharmacol. 130, 1-12 (2000).
- Kang, J., et al. Sulforhodamine 101 induces long-term potentiation of intrinsic excitability and synaptic efficacy in hippocampal CA1 pyramidal neurons. Neuroscience. 169, 1601-1609 (2010).
- Tong, X., Shigetomi, E., Looger, L. L., Khakh, B. S. Genetically encoded calcium indicators and astrocyte calcium microdomains. Neuroscientist. 19, 274-291 (2013).
- Akerboom, J., et al. Optimization of a GCaMP Calcium Indicator for Neural Activity Imaging. J. Neurosci. 32, 13819-13840 (2012).
- Shigetomi, E., et al. Imaging calcium microdomains within entire astrocyte territories and endfeet with GCaMPs expressed using adeno-associated viruses. J. Gen. Physiol. 141, 633-647 (2013).
- Ortinski, P. I., et al. Selective induction of astrocytic gliosis generates deficits in neuronal inhibition. Nat. Neurosci. 13, 584-591 (2010).
- Fiacco, T. A., et al. Selective stimulation of astrocyte calcium in situ does not affect neuronal excitatory synaptic activity. Neuron. 54, 611-626 (2007).
- Echegoyen, J., Neu, A., Graber, K. D., Soltesz, I. Homeostatic plasticity studied using in vivo hippocampal activity-blockade: synaptic scaling, intrinsic plasticity and age-dependence. PLoS One. 2, (2007).
- Aguado, F., Espinosa-Parrilla, J. F., Carmona, M. A., Soriano, E. Neuronal activity regulates correlated network properties of spontaneous calcium transients in astrocytes in situ. J. Neurosci. 22, 9430-9444 (2002).
- Takata, N., Hirase, H. Cortical layer 1 and layer 2/3 astrocytes exhibit distinct calcium dynamics in vivo. PLoS ONE. 3, e2525 (2008).
- Salahpour, A., et al. BRET biosensors to study GPCR biology, pharmacology, and signal transduction. Front. Endocrinol. 3 (105), (2012).
- Di Castro, M. A., et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 14, 1276-1284 (2011).
- Sun, W., et al. Glutamate-dependent neuroglial calcium signaling differs between young and adult. Science. 339, 197-200 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados