Method Article
肾单位的组成与功能的成年斑马鱼肾脏分析
摘要
斑马鱼成人肾脏是一个很好的系统,肾功能恢复及疾病的研究。这种研究的一个重要方面是肾结构和功能的评估。这个协议描述了可被实现来评估肾小管组成,并评估肾重吸收的数种方法。
摘要
斑马鱼模型已成为一个相关制度,研究肾脏发育,再生和疾病。两个胚胎和成年斑马鱼的肾脏组成的被称为肾功能单元,它是高度保守的和其他脊椎动物,包括哺乳动物。研究斑马鱼最近表明,两种截然不同的现象蒸腾成年后产生肾损害:第一,政府现时有肾,取代被破坏的肾小管上皮细胞内强大的再生;第二,全新的肾单位是肾脏祖细胞被称为neonephrogenesis的方法生产。相比之下,人类和其他哺乳动物似乎有只对肾上皮再生的能力有限。迄今,负责这些肾脏再生现象的机制仍然知之甚少。由于成年斑马鱼的肾脏进行肾两者上皮再生和neonephrogenesis,他们提供了一个出色的实验段digm研究这些事件。此外,还存在多种可用于描绘调节肾再生的细胞和分子机制的斑马鱼模型可用的遗传学和药理学工具。这种研究的一个重要方面是肾单位结构和功能的评价。这个协议描述了一组可被用来测量肾功能的组合物和测试肾功能在成年斑马鱼肾标记技术。因此,这些方法广泛适用于成年斑马鱼肾损伤的范例,其包括但不限于,nephrotoxicant接触途径或靶向的细胞死亡的基因的方法,例如硝基还原酶介导的细胞消融技术未来的表型特征。此外,这些方法可用于研究基因的扰动在成年肾的形成,并且也可应用在慢性疾病模型,以评估肾状态。
引言
肾是一个复杂的器官,满足多种生理功能,在体外。肾脏最重要的功能是代谢废物的排泄,这个任务是与流体稳态的维持交织在一起。肾经过滤血液和尿液中形成,同时伴随调节血压,电解质水平和酸碱平衡执行这些作业。高度专门化的上皮细管称为肾作为肾1,2的基本功能单位。在成年脊椎动物,肾通常在组织周围的集中排水系统紧密盘绕的安排,从而使许多小管包装成相当小的器官。例如,每个人的肾脏可以含有超过100万个肾3。其它哺乳动物如小鼠具有的每肾4 8-10千肾单位的数量级。肾的复杂程度这些哺乳动物和其他VERT之间是不同的ebrates由于变化的总肾单位数量和它们的肾脏内建筑布局。脊椎动物物种形成发展过程中多达三个连续的肾脏结构和每个表单显示增加的复杂性有关肾禀赋和安排:前肾,中肾和后肾。最后的肾脏结构被保留作为成人的肾脏器官通常是中肾或后肾2。每个肾的形式,但是,有一个肾为主组成2。
肾单位是肾脏的主力,是沿着与代谢产物的分泌和再吸收负责血液过滤。肾单位是由上皮细胞的简单的管状结构,并有一个节段的组织,其中分化的上皮细胞的分离,高度专业化的域执行特定任务。在滤液流经肾单位的顺序,通常有三个主要部件,comprise每种单位:(1)肾小体,(2)近端,中间,和远段的小管,以及(3)集合管1。近端小管是负责的有机溶质,最主要的是葡萄糖和氨基酸1的重吸收。中间小管(或亨勒的循环)是盐和水调节1的主要场所。最后,微调的盐和其它离子发生在远曲小管和收集管,并通过内分泌系统1被高度调控。从那里,将滤液穿过输尿管和膀胱,最终离开身体作为废产物1。
肾功能的丧失可能源于多种原因,以防止正常肾单位的活动。发生这些原因肾脏发育, 如先天性缺陷,导致肾5,或导致对不同类型的损伤畸形(从遗传和environme过程中所产生NTAL的起源)。后天的伤害,大致分为急性肾损伤(AKI)或慢性肾损伤(CKD)。 AKI涉及的急剧丧失的肾功能,经常是局部缺血或毒素暴露6,7得到的。在哺乳动物中,肾上皮修复可能这种伤害8后,不少人AKI后表现出全面恢复肾功能。 70%的发病率范围6,7 -然而,AKI也与高发病率和死亡率已报道在宽30相关联。 CKD,与此相反,与肾功能而导致的年长期损害,通常具有纤维化8,9相关联的逐渐丧失有关。进一步,一个相互作用的AKI和CKD之间存在,作为其中之一可以易患个体的其他10-12。例如,那些谁从AKI遭受更易患慢性肾病,甚至死亡13。肾脏疾病的发病率,无论是在美国和世界各地,已经达到epide麦克风的比例和预计将上升,因为老年人口膨胀,因此有越来越多的需要确定再生医学干预肾14,15。
尽管AKI患者可以恢复的知识,它一直被认为肾为先天无再生能力的器官。这种传统的观点已经被大幅修订,近年来16。已经试验研究了肾损伤小鼠和大鼠急性肾损伤后表明,肾小管上皮细胞能够增殖和重建功能性肾单位17-20。虽然哺乳动物具有再生肾这个适应能力,也有明显的局限性和不适应性响应可以触发而导致肾脏纤维化和CKD 21。例如,最近的研究表明,在小鼠肾重复上皮细胞消融用减少的再生和肾纤维化,表明肾甲肝关联EA限制再生的阈值22。没有任何证据表明,成年哺乳动物的肾脏形成新的肾单位,以代替丢失或损坏的人,因此他们的破坏会导致永久性的肾赤字8,9。有趣的是,一些脊椎动物都用再生肾上皮细胞,并同时产生新的肾单位应对AKI,这个过程被称为neonephrogenesis或肾新生23。 Neonephrogenesis发生在毒素暴露或部分切除后的鱼,以及损伤模型历来包括金鱼24,25,罗非鱼26,滑板27,鳉28,以及最近的斑马鱼29,30。其中,斑马鱼提供了一个可行的遗传研究模型,发现负责肾脏再生的细胞和分子途径。
在这个视频中,我们演示了如何在成年斑马鱼标签肾段。知识肾解剖,分子特征的,和功能特点是使用斑马鱼成功的未来肾功能的研究是必不可少的。成年斑马鱼的肾脏是中肾的结构和本质上是不太复杂的肾单位数目及组织比成年哺乳动物,鸟类,爬行类31发现后肾结构上。然而,斑马鱼肾段组织类似于哺乳动物,以及在胚胎肾基于基因表达研究(31-35)被首次记载。斑马鱼胚胎肾含有线性小管,其中包括近曲小管(PCT),近端直细管(PST),远端早期(DE)和远侧末(DL)31-35( 图1)。斑马鱼成年肾具有相似的管状段30,31,36,37( 图1)。在PCT也可以识别由功能表型:上皮细胞中的百分比将结合荧光标记的葡聚糖化合物(10-70 kDa的大小),存在于该循环,这已在两个胚胎和成年斑马鱼的肾脏被用于由这些近端小管细胞38-41( 图1),以评估细胞内吞摄取。在斑马鱼和哺乳动物之间肾段的一个区别是,斑马鱼缺少一个中间细管,或汉勒30-37的环;因为在哺乳动物中这部分功能,以节约用水,和斑马鱼是一种淡水物种没有紧迫感,集中他们的尿液,这并不奇怪,斑马鱼缺乏这部分32,33。因此,整个肾单位组合物在很大程度上斑马鱼和哺乳动物肾32,33之间保守的。这些相似性已启用斑马鱼是一种有效的研究工具中的发育nephrogenesis 32-35,42调查肾脏表达的基因的功能和模拟多种肾脏疾病43,44,从而增加了对人的条件,可以大幅度列表使用调查斑马鱼45,46。
如今,成年斑马鱼的肾脏是一个有吸引力的模型肾脏再生的比较研究,由于其遗传可追踪性和技术资源可用来查询功能基因和信号通路在这一品种的扩大口感。几项研究已经使用了斑马鱼中肾调查再生的AKI 29,30,37后的机制。对于使用成年斑马鱼的肾脏持续AKI的研究,它必须有精致的方法来标记不同的肾单位区域和方法来调查肾功能。有几种方法,成人肾脏的分析已经改编自胚胎肾协议。腹膜内注射在成年斑马鱼荧光标记的葡聚糖的标签在中肾肾PCT的上皮经由内吞作用30,如在斑马鱼胚胎38-41( 图1)。此方法已被用于visualiz当近端小管重拾再吸收特性如下AKI,这使得对恢复生理功能30( 图1)1评估É。在肾近端小管的另一个特征是,上皮细胞在这个段具备刷状缘37,其示出了高浓度的内源性碱性磷酸酶活性。因此,近端上皮可以在视觉上,在成年斑马鱼肾使用被称为ELF-(酶标记的荧光),基于荧光的技术-97 47本地化。
在这里,我们描述了如何在成年斑马鱼的肾脏进行荧光葡聚糖的摄取测定法30,48,以便获得近端小管的功能评估,并映射该小管部分的尺寸和轮廓。接着,我们描述的技术来与荧光标记的碱性磷酸酶标记的成年肾近端小管区。第三,我们显示了第一次的RHOD胺标记的外源凝集素扁豆biflorus凝集素(DBA),它已被用作集合管在哺乳动物肾脏49一般标志,标志着成年斑马鱼肾远端小管。作为DBA的是互斥的碱性磷酸酶染色,这些标签提供了一种方法来区分广义泛近端与成年斑马鱼肾泛远端延伸。纵观两个整装和低温恒温组织切片这些荧光染料的实施,我们与相关的溶质转运蛋白基因,它唯一标识每个肾单位分段表达域这些标签。因此,该协议还包含了修改后的组织处理成人组织整体原位杂交(WISH)分析,根据我们的胚胎愿望协议50程序的指南。这些程序可以在各种组合使用( 图2)来记录形态和功能属性ö˚F成年斑马鱼肾肾。因此,这些协议可以应用于再生研究的其他肾疾病模型的表型特征,甚至用于学习形成的成年肾中。
研究方案
该程序在本协议中所述的斑马鱼工作在Notre Dame大学被批准的机构动物照顾与使用委员会。注:在斑马鱼肾脏和肾解剖的指南提供( 图1)。在这个协议中所描述的方法的概述被提供为流程图( 图2)来说明标记如何将多个程序可以在相同的肾样品进行。有关WISH准备成人的肾脏研究第7部分,这里提供的步骤说明如何修改斑马鱼胚胎的处理,如最近公布的50,提供的肾脏器官的成功愿望的分析技术指南。
1,成年斑马鱼腹腔注射兴趣的葡聚糖
- 通过在集中在蒸馏水中溶解葡聚糖粉末制备所需的荧光标记的右旋糖酐股票(S)50毫克/毫升,然后将其存储在离心管分装于-20℃在黑暗中。注意:各种荧光标记的葡聚糖是市售的。选择葡聚糖的基础上,所需要的其他标签结合使用,并确保适当的荧光过滤器可与将要使用的显微镜。赖氨酸-定影葡聚糖显示荧光而不活样品中的任何进一步的标记步骤,从安乐死的标本未固定的组织样品,并固定标本。
- 解冻所需的右旋糖酐股市和冰储存在黑暗中进行,而几步之1.3-1.5。包住微量离心管中的铝箔,以保护其不受光而处理。
- 2分钟 - 通过将鱼放入含有两种0.02%三卡因或0.001%2苯氧基乙醇约1碟麻醉5-7月龄之间的成年斑马鱼。注意:在优选使用的这个年龄范围的成年斑马鱼因为年轻的鱼可具有平均LL肾脏,很难解剖,并从旧鱼肾样品可以包含群众瘢痕组织不能被分析。当适当麻醉的成年斑马鱼不会表现出响应于触摸的刺激,这可通过使用勺子或钝探针轻轻触摸鱼的尾鳍进行测试。
- 用塑料勺,从盘中拿起鱼,倒出溶液小心地将动物放在潮湿的海绵模具,腹面朝上。
- 用一个31 G 1.0毫升的胰岛素注射器,注入20微升的解冻葡聚糖原液进入腹腔空间。使插入发生在腹部的腹中线的浅角度定位针。为了避免穿刺的器官,插入针头,然后稍微提高它,以解除体壁的鱼和创建一个用于注射右旋糖酐液48的空间。注意:可替换地,葡聚糖股票可以被稀释, 例如,以1:1的比为1:2或2:1(葡聚糖:DIS耕种水),以减少背景荧光的样品中。
- 轻轻鱼返回到油箱,以允许从麻醉中恢复。注意:摄取葡聚糖通过近端小管段内发生8 - 12小时,并且可以为至少3天注射后(dpi)的检测。分析3 DPI提供了在肾间质人群低背景荧光较强的小管信号。继续执行第2部分整装检查右旋糖酐摄取独自一人,如果额外的标签是不希望的。对于组合的标签,则继续第3部分以制备组织为整体安装检查葡聚糖的摄取,则第4部分,以双标签用碱性磷酸酶和/或第5部分,以执行DBA双链或三标记。对于使用组织切片研究,继续执行第6部分,了解有关如何使用低温恒温器,使肾脏的微细部分,以及如何与不同的标签和/或免疫组织化学原发性和继发性antib弄脏这些说明odies。
2,解剖及不固定动物样品的成年斑马鱼肾平山准备形象化近曲小管的荧光标记葡聚糖
- 5分钟 - 通过将它变成一盘菜用0.2%三卡因pH值为7.0的4安乐死的右旋糖酐注射成年斑马鱼。注意:请确保鱼已经被安乐死,然后再继续,通过仔细监测鳃是否已经停止运动和心脏已经停止跳动36。
- 用塑料勺,从三卡因溶液提起鱼,倒出溶液,然后将动物的组织或纸巾。
- 用锋利的解剖剪刀,使鳃鳃盖后面的切割,取下头上。
- 立即通过使从头部长腹侧切开尾鳍的基部打开与解剖剪鱼的身体。
- 取出鱼用一双细镊子的内脏。
- 使用超细解剖针到针打开的本体壁,以便允许的肾脏器官,它是附着在动物的背壁的可视化。
- 用细镊子取下从背墙的肾脏。
- 轻轻地放在肾成含有1X PBS中5毫升玻璃小瓶中,并洗涤3次,用3 - 5毫升新鲜的1X PBS,每次5分钟。注意:使用在玻璃小瓶中进行处理的成年肾样品利于组织的可视化,并允许为大约3与大容量的洗涤液(相对于组织的质量) - 5毫升备选地,在12孔细胞培养皿中都可以使用。而可以使用的塑料离心管中,在标准尺寸的管(1.5毫升)可能会限制在洗涤。
- 取出用移液管和地点肾上1-2滴PBS洗涤的干净的载玻片上。
- 用细镊子压平的肾脏在幻灯片上,确保没有任何组织有卷曲或以其他方式推翻在本身。注意:可替换地,钨丝工具可以用来制作在结缔组织的小切口,以促进肾的平面定位。
- 将小块橡皮泥在一个18×18毫米的玻璃盖玻片的每个角落,慢慢地设置盖玻片到肾脏。注意:微角放置在盖玻片,以减少捕获气泡在溶液50。造型粘土草皮是约2毫米的直径( 图2A)。替代地,真空润滑脂凹洞可被取代以代替橡皮泥。加入1×PBS的附加压降,如果需要填满盖玻片与载玻片之间的空间。
- 通过将载玻片进入视场的立体显微镜或化合物显微镜用合适的过滤器观察和/或图像的肾脏。注:参见图2A此玻片制备的宏观外观。
3的FIXa化,夹层,通透和去除成年斑马鱼肾脏的色素沉着
- 准备4%多聚甲醛(PFA)/ 1×PBS / 0.1%DMSO的新鲜固定液或解冻的4%PFA / 1×PBS冷冻等分,加入0.1%的DMSO。注意:煤灰是有毒的和PFA的解决方案应在化学罩处理,而穿着合适的个人防护装备,包括手套,实验室外套。此外,煤灰粉应谨慎使原液时处理。
- 填写解剖盘有足够的固定液淹没了整个动物。
- 安乐死和安装在固定溶液选定斑马鱼(参看步骤2.2-2.6)。注:所选择的鱼可能是一个未经处理的斑马鱼的肾脏标本,或从先前接受腹膜内注射右旋糖酐(第1部分)斑马鱼孤立肾。
- 固定样本的O / N(12 - 16小时),在4℃。
- 第二天,用细镊子小心完全分离从背体壁的肾将器官变成用移液管的玻璃小瓶。注意:可替换地,12孔或24孔培养皿中都可以使用。而可以使用的塑料离心管中,在标准尺寸的管(1.5毫升)可能会限制在洗涤。
- 5毫升1X PBS中含0.05%Tween,每次5分钟 - 与3洗解剖肾3次。
- 取出的1X PBS含0.05%Tween和冲洗肾脏用3毫升的5%蔗糖溶液(1X PBS)中30分钟。
- ( - 16小时12)在4℃。用3毫升30%的蔗糖溶液(1X PBS)和存储O 2 / N替换注意:蔗糖溶液透化细胞膜,随后使反应物特异性标记,因为它们穿透组织。
- 次日,除去30%的蔗糖溶液,并用5毫升的1X PBS中含0.05%Tween洗肾2次,每次5分钟。
- 取代的1X PBS含0.05%Tween与3 -将5ml的漂白溶液以除去黑素细胞的色素存在于肾脏的器官。
- 将玻璃瓶上肩,看着精心为色素沉着消失。注:通常色素脱失当蔗糖处理后进行大约需要20分钟,但偶尔也需要长达60分钟。如果漂白溶液留在肾脏的时间过长,将器官的崩解可能发生;它建议以监测样品每隔10-15分钟,以检查组织的完整性。
- 5毫升1X PBS中含0.05%Tween - 当色斑已经从肾脏取出,用3洗涤两次。
- 取代的1X PBS含0.05%Tween用3 - 5毫升4%PFA溶液1小时,在室温下。
- 取下4%PFA溶液并用3洗肾3倍 - 5毫升1X PBS中含0.05%Tween,每次5分钟。注意:一旦固定完成后,将肾脏也可被安装在载玻片上,并评价葡聚糖摄取SAN的黑素白色素entation,通过执行步骤2.8-2.12。
- 取出的1X PBS含0.05%Tween,并替换为3 - 5毫升封闭溶液,然后孵育的肾在室温在2小时的块。
- 当阻塞完成后,直接进入所选的染色方案。注意:肾脏,现在可以通过一个或多个其他程序,以进行标记研究用不同的试剂进行处理。对于近曲小管,只有碱性磷酸酶整装标签,进入第4节仅适用于远端肾小管的整装标签进入第5另外,第4和第5,可以在直线陆续在整装进行双检测。
4,标注的成人肾脏近端小管与碱性磷酸酶检测
- 删除块和洗肾3次,用3 - 5毫升的1X的PBS中含0.05%Tween,每次5分钟,然后用0.05%吐温3取代的1X PBS - 5毫升的1X PBS。让肾浸泡至少10分钟。注意:在此期间,肾转移到12孔或24孔培养皿中,如果组织被保存在玻璃小瓶中的先前处理步骤。
- 取代的1X PBS与足够的工作碱性磷酸酶底物溶液(参见位于材料的表中所示的检测试剂盒),以覆盖样品,然后将样品在旋转器上在室温30分钟。保持避光的样品。
- 停止反应,洗涤中碱性磷酸酶的洗涤缓冲液的肾脏。
- 冲洗的洗涤缓冲液在10 3改变肾脏 - 15分钟。注意:这一步后,直接进入第5步5.1(因此暂时省略步骤4.5-4.6),如果具有DBA标签还期望。可选步骤:要标记和可视化细胞的细胞核中的器官,泡在碘化丙啶溶液中的肾。通过在concentra溶解粉末准备碘化丙啶股票化的1毫克/毫升(1.5毫摩尔)在蒸馏水中。稀释该股票至500nM在2×SSC和孵化的肾脏在该溶液中30分钟。冲洗用1×PBS和继续执行步骤4.5。
- 除去洗涤缓冲液并装入肾脏到一个干净的载玻片上于包含在标记试剂盒磷酸封固剂(参看步骤2.9-2.12)。注意:安装介质已经从步骤2.9替换了1X PBS中。
- 可视化的碱性磷酸酶使用立体显微镜或复式显微镜与赫斯特/ DAPI过滤器集染色肾。注:可选步骤:用四甲基若丹明(TRITC)或德州红色滤光片可视化的碘化丙啶。
5,划定成人肾远曲小管段罗丹明DBA
- 准备稀释的DBA(2毫克/毫升)1 200 mL工作的DBA解决方案:100在1X PBS。
- 更换1X PBS与200微升的DBA液0.05%吐温的解决方案。
- 放在旋转器1小时,在室温。
- 删除DBA溶液并用3洗肾3倍 - 5毫升1X PBS中,每次5分钟。注:可选步骤:要标记和可视化细胞的细胞核中的器官以及与DBA标签,浸泡肾DAPI的解决方案来检测与赫斯特/ DAPI过滤器(罗丹明DBA污渍可以用TRITC或得克萨斯红色滤光片进行检测)。通过在5毫克/毫升(14.3毫米)的浓度溶解粉末准备DAPI的股票。稀释该股票至300nm的2×SSC和孵化的肾脏在该溶液中20分钟。冲洗用1×PBS并继续执行步骤5.5。如果第4部分的处理已经执行,保持在该DAPI和碱性磷酸酶都用Hoechst公司/ DAPI过滤器检测出心。
- 取出的1X PBS和安装肾脏在干净的玻片上(参见步骤2.9-2.12)。
- 可视化的肾脏使用标准TRITC或德州红色滤镜上的荧光体视显微镜或复式显微镜设置DBA染色远段。注:可选的STEP:可视化使用赫斯特/ DAPI过滤器的DAPI染色。
6,嵌入,Cryosectioning和染色成年斑马鱼肾组织(活体染料及免疫组化标记)
- 分析选择鱼类,然后安乐死,修复和通透的描述(步骤3.2-3.8)。注:1乙醇:在9固定成鱼代替4%多聚甲醛的甲醛/ 0.1%DMSO / PBS洗涤/ 0.1%DMSO的冷冻切片过程产生的部分为葡聚糖,碱性磷酸酶,和DBA的可视化。但是,请记住,多聚甲醛为基础的注视可以对一些免疫组化的程序兼容。此外,不需要进行冷冻切片分析成人肾漂白,因为黑色素细胞是表面的,不影响肾细胞组成的肾脏器官的"内部"的可视化。
- 次日,除去30%的蔗糖溶液,并替换为1:1的组织冷冻介质:30%sucrosË4小时在室温。
- 取下1:1的解决方案,并嵌入肾脏样本100%的组织在冷冻介质cryomolds,地点在-80℃下至少1小时。
- 横向切割连续切片,约12μm厚,在整个成年肾。
- 安装冷冻冰冻切片上粘着显微镜载玻片,让空气干燥1小时,在50℃。
- 商店幻灯片在-80℃下备用。
- 当冰冻切片准备被标记,删除-80℃,发生在显微镜载玻片上的幻灯片,在50℃保温45分钟。
- 使用液体阻断笔,画周围的冰冻切片了一圈,让干燥的幻灯片15分钟,50 摄氏度温暖
- 从幻灯片中删除温暖的幻灯片,并放置在平坦的湿度室室温。
- 通过添加1X PBS中含0.05%Tween的幻灯片的环绕部分20分钟,再水化的冷冻切片。注:约200 - 300#956,L是需要覆盖在幻灯片上的每个环绕部分。
- 取代的1X PBS与用新鲜的1X PBS中0.05%吐温溶液并孵育10分钟。
- 删除1X PBS孵育冰冻切片在2小时封闭液。注意:对于10ml的封闭溶液,结合8毫升1X PBS中含0.05%Tween,将2ml胎牛血清和150微升的DMSO。到封闭步骤之后执行免疫组织化学,孵育在新鲜O座稀释/ N所需的初级抗体的滑动,在4℃下 ,用洗一次1X PBS中含0.05%Tween,孵育2小时,在室温下用稀释的二级抗体溶液1X PBS中含0.05%Tween,用1X PBS中含0.05%Tween洗涤一次,并装入一个盖玻片上有安装介质的幻灯片。所需的抗体稀释液会有所不同,试验应进行,以选择最佳的稀释液。抗原修复还可以促进免疫标记,并阻断之前被执行。幻灯片解冻50℃后,立即(步骤6.8),培养在95℃下,100℃的冰冻切片进行预热10 mM柠檬酸钠缓冲液40分钟。酷幻灯片30分钟,然后用1X PBS洗涤两次,0.05%吐温,并继续执行步骤6.11。
- 除去封闭液和洗涤冷冻切片3次,用PBS洗涤,每次5分钟。
- 取代的1X PBS具有DBA染色溶液孵育1小时。注:稀释1微升的DBA在99μL1X PBS中,使100微升染色液。
- 删除DBA染色溶液和洗涤冷冻切片3次,用PBS洗涤,每次5分钟。
- 申请碱性磷酸酶标记,孵育在冷冻切片10分钟。
- 用一系列的洗涤缓冲液洗涤3次,每次10分钟洗碱性磷酸酶关闭冷冻切片。注:对于洗涤液100 ml的溶液,结合加入5ml 0.5M的EDTA和120毫克的左旋咪唑进入95毫升1X PBS中。要标记细胞核,孵化用碘化丙啶或DAPI的部分在二决方案前面所指出(步骤4.4,5.4,分别)为30分钟,在RT。选择核染色与已经选择了其他的荧光染料的结合兼容。
- 从冰冻切片取出所有的液体,并把2滴于载玻片上的安装介质。
- 小心地将微玻璃盖到显微镜载玻片。冰冻切片现在就可以像使用适当的过滤器(S)。
7 WISH处理成年斑马鱼肾脏样本
- 选择所需的斑马鱼标本(S),安乐死,修复和描述(步骤3.1-3.5)解剖肾脏。注:必须使用4%多聚甲醛(PFA)的固定液/ 1X PBS为0.1%DMSO通透的肾脏。将肾脏到玻璃小瓶易于可视化在后续的加工步骤。
- 除去固定液,并用5毫升1X PBST洗肾脏两次。
- 取出的1X PBS和洗肾两次的Wi次100%的甲醇,然后孵育肾脏在-20℃下至少20分钟,以透化。注:解剖的肾脏可以无限期保存-20℃。
- 加入5ml 50%甲醇/ 1X PBST,30%甲醇/ 1X PBST,并两次用1X PBST - 通过用3进行一系列的5分钟洗涤水化肾病。
- 漂白肾脏去除色素沉着的描述(步骤3.10-3.14)。
- 治疗与10微克/毫升蛋白酶K / 1X PBST肾脏用0.1%DMSO的20分钟,然后用1X PBST和定位后冲洗两次在4%PFA / 1X PBST 20分钟,O 2 / N。注:请务必通过结合50微升刚解冻的蛋白酶K的股票(10毫克/毫升)50毫升1X PBST和50微升的DMSO准备蛋白酶K立即消解前的工作方案。
- 过程中,肾脏单人或双人愿在步骤核糖核酸探针的合成,预杂交,杂交,抗洋地黄毒苷/抗荧光素抗体孵化和DETEC化最近描述49。注:整装应在执行染色反应几天进行肾污渍成像。肾污渍容易褪色非常快,尤其是红色底的标签。对于肾摄影,平面安装使用立体或复合式显微镜在步骤2.10上述2.12肾脏样本,和形象。微分干涉相衬滤波器可以被用来更好地观察肾的细胞的轮廓,以促进样品分析。
结果
每个协议是在野生型斑马鱼进行的。的数据,例如可以得到文件的健康成年斑马鱼的肾脏内的正常结构组合物和肾单位的属性。成年斑马鱼拥有中肾,或第二肾的形式,位于背侧体壁( 图1A)。成人的肾脏是比较平坦的,并包含一个所谓的头,躯干和尾区与遍布这些地区( 图1A)表浅黑色素细胞。肾组织中含有支链的连接区和漏入中央集合管( 图1A)的肾单位的阵列。每个肾单位沿其长度偏振光,用血液过滤器(或肾小体)在一端处,后面是一系列小管段,最后终止于导管,用于收集将要排出的溶液( 图1A)。每一成人肾曲小管中含有近端和远端segmen细胞的TS,划定由特定溶质转运30,31,36,37的表达,这是保守与胚胎肾(31-35)( 图1B)显示出弓形图案。例如,cubilin转录标记近端小管39(PCT和PST)和clcnk转录标记的远端小管32(DE和DL)( 图1B)。另外,对PCT段由slc20a1a的表达区分,将PST是杰出的由SLC13A1的表达,对DE是由SLC12A1的表达区分,和DL是由SLC12A3 32的表达区分 ( 图1B)。相比胚胎那些成年肾小管之间的区别是,远侧段的成人,这是从直链,这些区域的非支解剖学的EMBR鲜明的显示波形圈(DE,DL)和DL段分支广泛哟30,31,36,37( 图1A)。在成年30和胚胎38-41肾小管,对PCT上皮可适当加以区别,以它的内吞属性,并且可以可视化和评估的基础上,以摄取荧光葡聚糖偶联物( 图1B)的能力reabsorptive功能。另外,作为表现出在随后的附图中,成人近端小管(PCT和PST,或泛近侧区)是通过碱性磷酸酶标记,而远端小管(DE和DL,或泛远端区域)由DBA标记( 图1B)。使用葡聚糖的摄取,碱性磷酸酶,DBA,免疫组织化学或希望本文中所使用到的标签成年斑马鱼肾区段的方法可以以各种组合来进行,在整个安装或肾组织( 图2)的组织切片。这允许很大的灵活性和多样性时肾组合物进行评估(图2)。
成人肾脏可安装平板上进行分析载玻片,用橡皮泥的凹洞(或可替代地,真空润滑脂)用于悬浮在盖玻片上的组织( 图3A)。作为典型的肾脏长度约为5-7毫米,它的尺寸有利于成像上的立体声或化合物显微镜( 图3A)。下明场照明,黑素以黑色色素沉着的浅表群体可以关联于肾脏组织,与脉管的可视化,如在主动脉中可以看出,因为在循环的红细胞具有红色色调( 图3B)。以下腹腔注射右旋糖酐-FITC,位于整个中肾厘领域仍然标示3天后,并使用FITC滤光片的荧光显微镜( 图3C)成像。而黑素细胞部分掩盖个别肾小管的可视化(Figu重新3C'),黑素细胞不阻止肾单位数或小管的直径和长度进行评价的定量。以下腹腔注射右旋糖酐氟红宝石,固定样品的漂白消除了黑素细胞的色素沉着,以及PCT段,观察单独的明场照明( 图3D)。从腹部体腔脂滴,有时在与整个肾脏器官制剂( 图3A).Individual厘段关联可见显示圈,线圈( 图3D'),但也可以其特征在于相对线性伸展( 图3D")。
不同的葡聚糖结合物在近曲小管标签提供不同层次的整体清晰度。特别是,葡聚糖-FITC或葡聚糖氟红宝石导致脆最小的背景( 图3C-D")肾标签。无论是右旋糖酐级联蓝光e和荧光黄偶联物显示出近曲小管吸收在成人肾( 图4A,4B)。有趣的是,暴露于葡聚糖级联蓝肾脏显示相对特定的PCT荧光一些背景( 图4A,4A'),而暴露于葡聚糖荧光黄肾脏已经遍布在标厘段,但表现出显着的背景信号,与非特异性荧光染色本肾间质中,或在肾单位( 图4B,4B')之间的空间。最后,利用葡聚糖氟旁注提供优越近端小管贴标签,以最小的或没有背景在各种不同的放大倍数( 图4C,4C')的观察时也是如此。在所有情况下,葡聚糖偶联物的摄取的独特管状图案相关与转录编码slc20a1a,既定的PCT特异性标记30-32( 图4D)的WISH表达。 Nephr上沾有slc20a1a反义核糖核酸探针的PCT段显示的S形厘线圈,以及较少急剧盘绕厘段( 图4D'),在标记的葡聚糖偶联物测定法( 图3D所观察到的",3D")。
其他肾制剂,如检测近端小管的碱性磷酸酶活性( 图5A,5B,5C)的除去黑素色素的后同样地进行。这使得在近曲小管肾成像和分析,没有任何阻碍。在肾源性碱性磷酸酶活性是近曲小管1,47的一个主要标志。碱性磷酸酶染色是高度特异性的近端肾单位的区域相比,该基因的cubilin 39( 图5D,5D')泛基WISH表达模式。碱性磷酸酶的反应是最激烈的杉对应于PCT( 图5B),类似于cubilin表达模式( 图5D,5D'),其也有在PCT的最高相对转录水平的近端小管的ST段。在PCT由其稍宽直径,所述转录因子mafba( 图5E,5E')的具体表达,并且溶质转运蛋白基因slc20a1a( 图4D,4D的特定表达式')不同。碱性磷酸酶活性也贴上一片近曲小管与对应的PST段( 图5B)的基础上比较溶质转运蛋白基因SLC13A1( 图5F,5F")的段特定的转录表达更薄的直径。 PCT的标记slc20a1a和PST标志SLC13A1的意愿表达域是相互排斥的( 图5G ),以及单一肾的仔细检查表明,这些各个结构域邻接,很少,如果它们之间的任何间隙,并且它们一起概括cubilin的表达结构域(黑色箭头。 图5G',5G",5G"' )。
为了进一步证实碱性磷酸酶活性与近端肾小管身份的关系,整个安装碱性磷酸酶染色上接受腹膜内注射右旋糖酐氟红宝石前3天( 图6A-C),从斑马鱼的肾脏进行合作的标识。葡聚糖氟红宝石显示重叠在对应于PCT( 图6D-Ⅰ的例子)的近端小管结构域只是直径较宽部碱性磷酸酶。葡聚糖正域突然停在工地里近曲小管的直径变薄, 即,其中PCT和PST满足,(白箭头在图6中),并且仅碱性磷酸酶活性头观察到在随后的PST段图6D-Ⅰ(实施例)。从碱性磷酸酶反应的背景荧光也依稀概述的对平行主收集导管的轨道在成年肾中找到29,30 -ducts它们由具有任何肾相关的管的最宽直径(星号在图6A,6D区分, 6E,6G,6H)。接着,肾小管与碱性磷酸酶和右旋糖酐摄取的共同标签中观察到冰冻切片分析( 图6J,小管周长概述与白点)。在横截面中,所述碱性磷酸酯酶反应所指出的厚带在所述管状上皮,用刷状缘超微结构一致的顶端表面,而相应的肾小管细胞胞质空间表明葡聚糖氟红宝石反应性( 图6J)。值得注意的是,staineð肾小管要么双阳性碱性磷酸酶和葡聚糖,导致其识别为厘段,或碱性磷酸酶单独阳性( 图6J,小管周长的黄点画出的),导致一个标识为PST段(注:其他本细管为阴性两种污渍,数据未显示)( 图6J)。此外,碱性磷酸酶染色( 图6K)成功结合了核标签,碘化丙啶( 图6L),促进细胞计数(覆盖图6M)。
成年斑马鱼肾单位远端小管被标以罗丹明标记的DBA( 图7)。整个安装双标具有DBA和碱性磷酸酶从野生型斑马鱼( 图7A-C)的肾脏进行。 DBA和碱性磷酸酶活性表现在肾小管无重叠( 图7D-H)。 DBA染色肾小管呈明显更薄的直径相比,碱性磷酸酶阳性肾小管和肾小管的DBA经常支(白色箭头, 图7G,7H,7J),而在分支与染色碱性磷酸酶小管从未被观察到。 (:ENPEP:Tg的EGFP)肾冷冻切片从野生型斑马鱼携带的转基因,其中ENPEP启动子驱动的eGFP收集,如绿色荧光蛋白标签近端和远端肾小管51( 图7I)。免疫组织化学方法检测的GFP,以便标记所有肾小管(绿色, 图7I)中,接着用碱性磷酸酶和DBA(绿松石和红色,分别地, 图7I)荧光标记。肾小管部分分析表明,肾小管都是标签( 图7I)或正碱性磷酸酶或DBA,但不是。只有罕见的浴缸ULES呈反应性的既不碱性磷酸酶也不DBA污点,这可能是由于细管部分的角度(白色箭头, 图7I)。此外,DBA染色成功地结合在整个安装肾染色核的DAPI标记( 图7J),再次强调远端小管的特性分支性质(白色箭头, 图7J)。
接着,为了进一步进行比较的葡聚糖-FITC的摄取,碱性磷酸酶,和DBA的图案,三重标记进行了检查,腹腔内注射成年斑马鱼与葡聚糖-FITC,接着肾隔离3天后接着cryosectioning和染色碱性磷酸酶和DBA ( 图8A-E提供了实例)。肾小管呈三大类标签的组合:即是对碱性磷酸酶和右旋糖酐表示厘段(白色虚线),tubul双阳性肾小管ES正碱性磷酸酶单独表示PST段(黄色虚线),和远端小管是由刚刚DBA标记(红色虚线轮廓图8A-E)。进一步,只DBA阳性细管表现出的分支点( 图8E)。按征求分析,远端的这种独特的分枝格局,DBA正相关性小管与溶质转运成绩单是特定远端小管( 图8F-Ⅰ)基因表达模式。成绩单编码clcnk,这标志着整个远曲小管(DE和DL)显瘦的直径,集中于肾,包含分支点(黑箭头图8F,8F')。相比之下,小管的显示SLC12A1或SLC12A3,这是对DE和DL的标记物的表达,分别为以下丰富肾脏样本中整体相比clcnk表达(比较图8中 G和8F,8H)。此外,所表达SLC12A1小管是很少,如果有的话,支( 图8G,8G'),而所表达SLC12A3肾小管地区经常被支在性能风车般的安排( 图8H,8H',8H"8H""黑色箭头)。最后,双愿对PCT标志slc20a1a和远端标志clcnk表明,这些污渍是不重叠( 图8I)。值得注意的是,没有附slc20a1a -expressing厘段延伸至clcnk -expressing小管,这是意料之中的,因为PST的位于这些区域( 图8I)之间。两者合计,标签肾小管葡聚糖的摄取,碱性磷酸酶活性,数据库管理员,并希望针对特定基因转录的检测,使近端与远端段的法眼。
T"FO:保together.within页="总是">
图1:肾解剖在成年斑马鱼的肾脏。上述(A)的成年斑马鱼的肾脏和(B)由成人和胚胎斑马鱼表现出肾段的分子特征的对比图的示意图。(A)(左上),成人的肾脏是一个平面的器官位于背侧体壁。 (右上图),从腹侧角度看,肾脏具有鲜明的曲线形态,由头部,躯干和尾部区域,也有相关的黑素细胞表面的人口。放大(左下)显示了典型的肾树中的成年斑马鱼肾,其中每个单个肾单位拥有一个血液过滤器(肾小球)的一端,接着是近端小管,远端小管和导管的示意图。彩色示意图(BOTTOM右)展示了一名成人肾树的线性图,以与胚胎肾(B)的比较段的特点。斑马鱼胚胎肾包含小管,包括近曲小管(PCT),近端小管直(PST),远端早期(DE)和远侧末(DL),用下面列出的各个基因表达的结构域。在成年斑马鱼肾也有类似的节段组成,并根据基因编码溶质转运体的表达域类似的分子信号,但一个显着的区别相比,胚胎是那几个肾可以通过支DL段团结一致。 请点击这里查看本图的放大版本。

图2流程图的地图指示在这个协议中所描述的方法之间的关系,表明如何的方法可以单独使用,或在各色的组合进行的。以下腹腔注射标记的赖氨酸可固定葡聚糖进入成年斑马鱼的肾脏可以以可视化整体安装的准备,无论是单独使用或与碱性磷酸酶和/或DBA污渍组合。或者,选择斑马鱼的肾脏后,可以组织病理切片与冷冻切片机进行检查。该部分可以被染色以标记属性的多种组合,使用免疫组织化学,核染色,DBA染色,和/或碱性磷酸酶活性。此外,肾部分可直接用于赖氨酸定影葡聚糖的摄取在PCT片段的存在可视化。最后,选定的肾脏可以加工用于基因表达的使用WISH的时空表达。括号内的数字指的是corresponding协议部分。 请点击这里查看该图的放大版本。
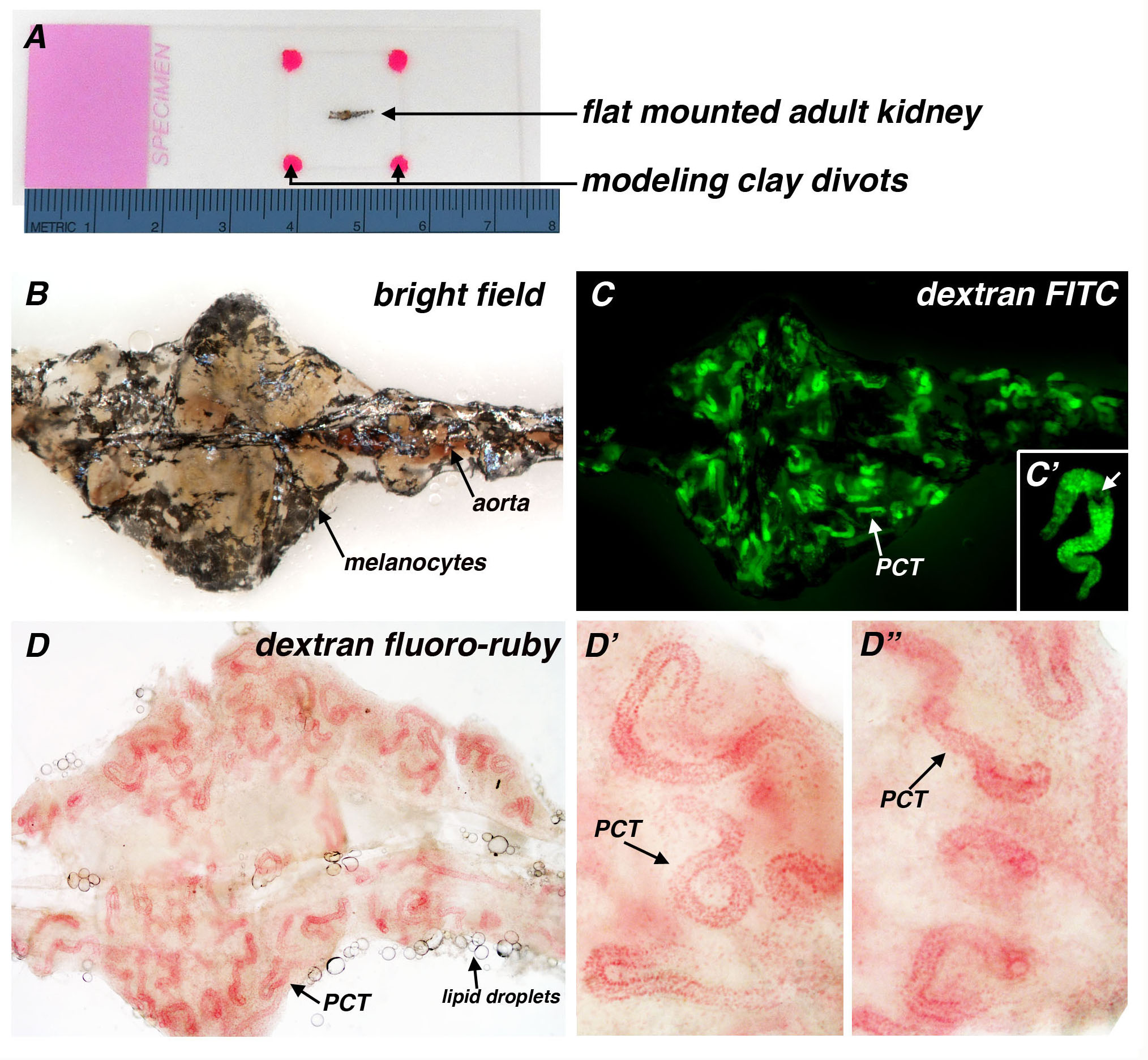
图3。成年斑马鱼的肾脏平板支架的制备和应用的可视化结合的葡聚糖摄取的肾脏肾单位的厘段。一个肾脏标本平板安装的准备,其中机关被置于平放在载玻片,盖玻片放置在被搁在四个草皮橡皮泥(热粉红色)的组织的顶部(一)明图像。在这里,肾编制成像旁边米尺提供了缩放比较。典型的成年肾脏是从头部到尾部约5-7毫米(mm),(B)一种原色的明场图像肾脏。黑色色素对应于与肾脏协会发现黑素细胞的散射人口和主动脉沿肾脏的中线运行。肾厘段(C)的可视化后3天腹膜内注射40 kDa的葡聚糖-荧光素(FITC)无成人肾脏的漂白。厘段看到整个肾脏,但由于被部分遮蔽的黑素细胞(C')单肾的数码变焦,拥有黑素细胞(白色箭头)。成人肾(四)图像3天后腹腔注射10 kDa的右旋糖酐氟红宝石,肾脏和漂白固定。黑素细胞的色素去除和PCT区域此处进行可视化基于葡聚糖的下明场照明的内吞摄取。从腹部脂肪滴(箭头)有时可见到在肾组织样本关联(D',D")Repre表性的图像描绘厘段之间的微小的形态变化。虽然许多肾单位多氯三联苯紧紧盘绕(D'),其他肾包含有最小的卷取(D")厘的地区。 请点击这里查看该图的放大版本。
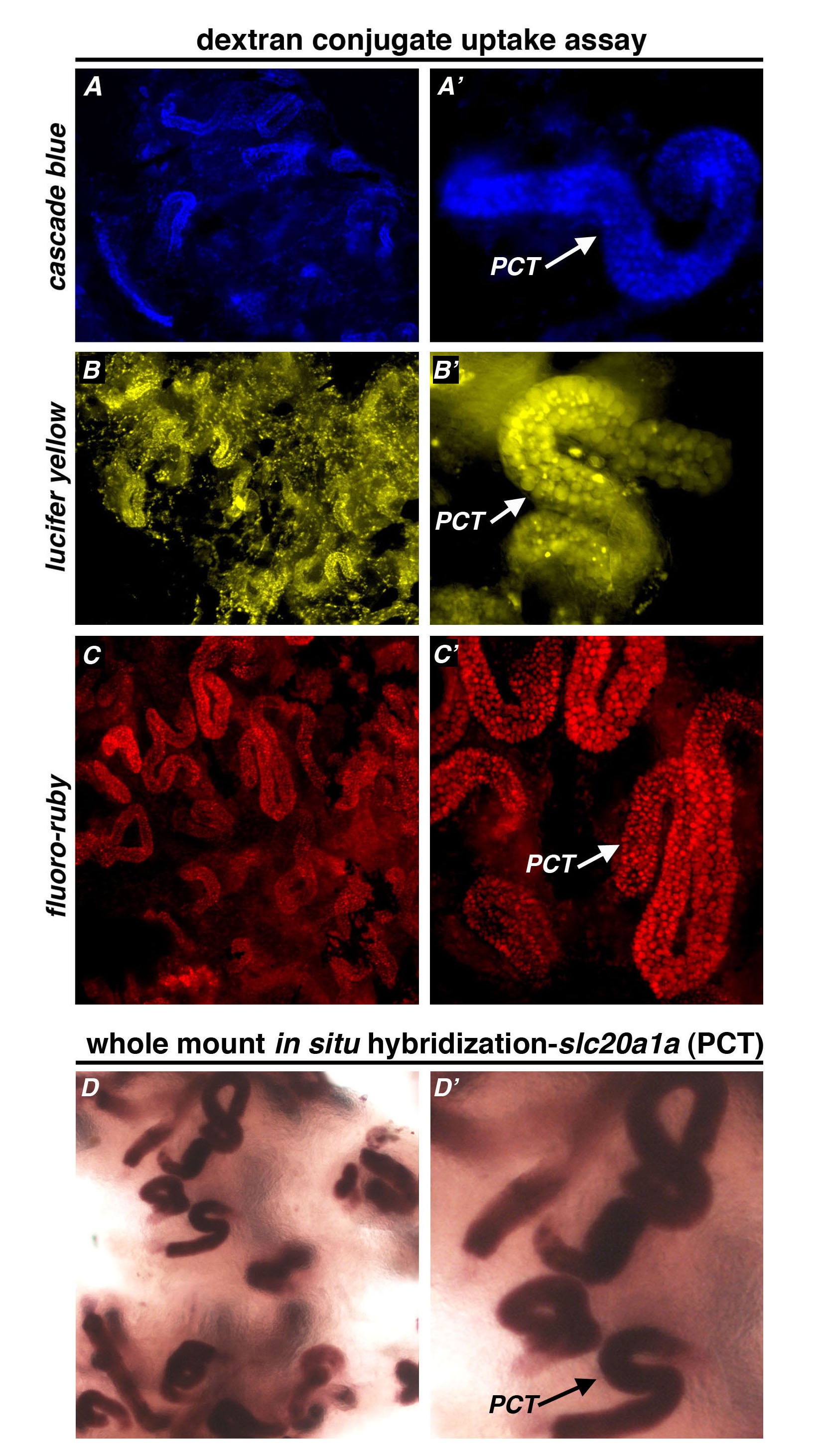
图4成人肾脏肾单位厘细管段标记野生型斑马鱼腹腔注射一种荧光葡聚糖偶联物;那么他们的肾脏检查了注射厘可视化后3天(A,A')葡聚糖级联蓝色,10 kDa的(B,B')右旋糖酐萤光黄,10 kDa及(C,C')右旋糖酐˚F luoro红宝石,10 kDa的所有标签优先肾肾PCT的片段。既葡聚糖级联蓝和荧光黄显示位于肾之间,具有高得多的背景荧光黄治疗肾脏观察到间质细胞群的一些非特异性标记。相比之下,葡聚糖氟红宝石呈激烈厘标签急剧减少的背景。(D,D')的成人肾经愿望染色检测成绩单编码slc20a1a,PCT的转运细胞类型的特定标记的位置。 slc20a1a表达域相匹配的肾观察右旋糖酐摄取的特征模式,与各紧紧缠绕/循环厘域的分布,以及,显示一致的宽直径更拉长厘延伸。 请点击这里查看大图这个数字。
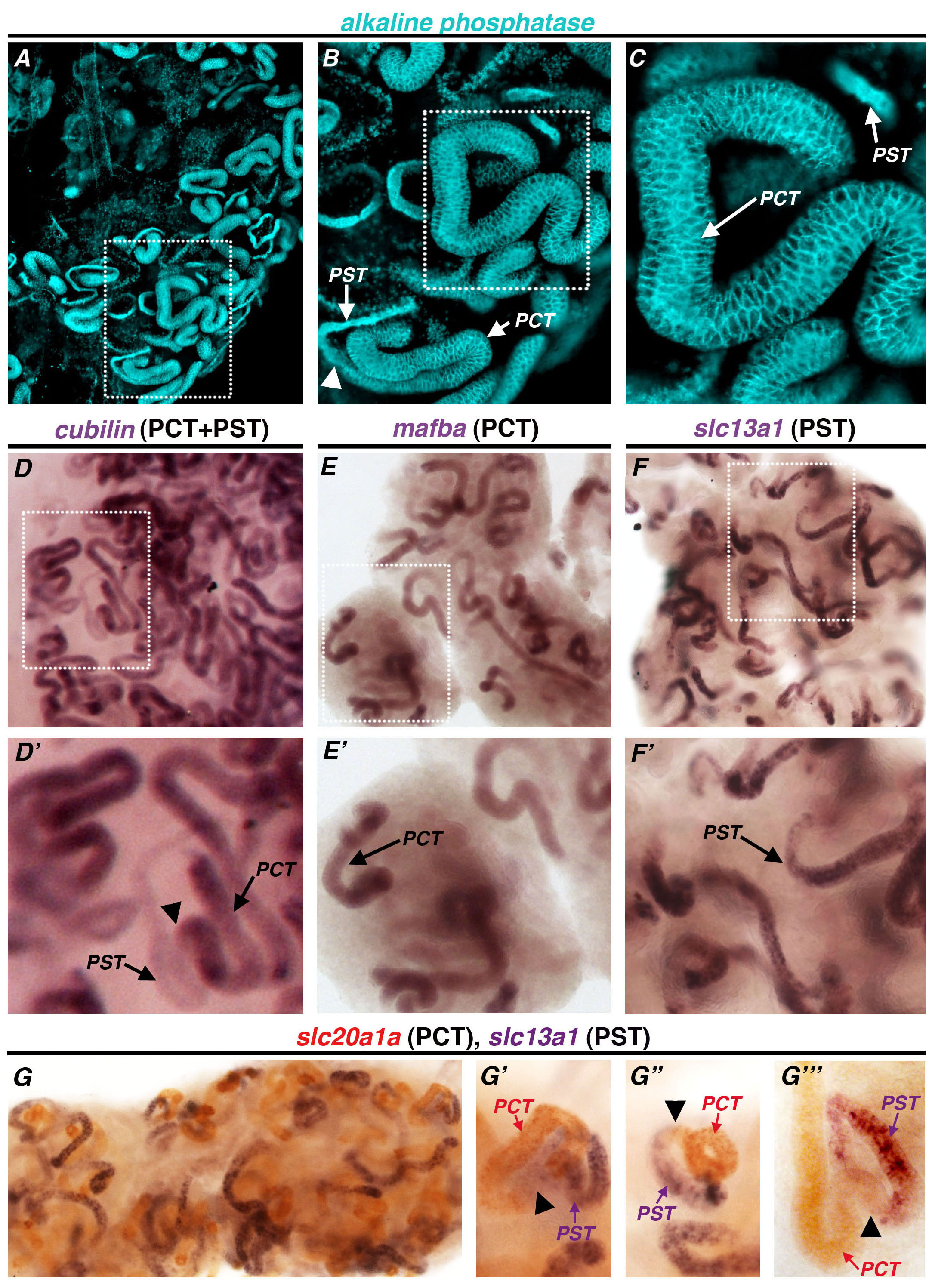
图染色碱性磷酸酶代表性的结果,泛近曲小管的标记,在成年斑马鱼的肾脏相比其他评估与愿望近端肾小管标志物。 (交流),碱性磷酸酶染色(绿宝石)照亮肾近曲小管,既突出了PCT和PST(DF')单心愿上市的基因(每个紫色染色),(D,D')cubilin的表达模式,泛近端(PCT-PST)的标记,与相 关碱性磷酸酶(D,D')。相比之下,祝愿mafba标志着厘(E,E')和SLC13A1标志着PST(F,F')。在(GG"")双愿在PCT标志slc20a1a </ em>的(红色)和PST标记SLC13A1(紫色)显示标记的这些标志物的链段不重叠,并比较它们的表达结构域占据的相邻位置时,单个肾单位被仔细检查(G'-G'")。黑色箭头指示厘和PST段之间的连接,通常在小管直径小的变化,从大的关联,分别请点击这里查看该图的放大版本。
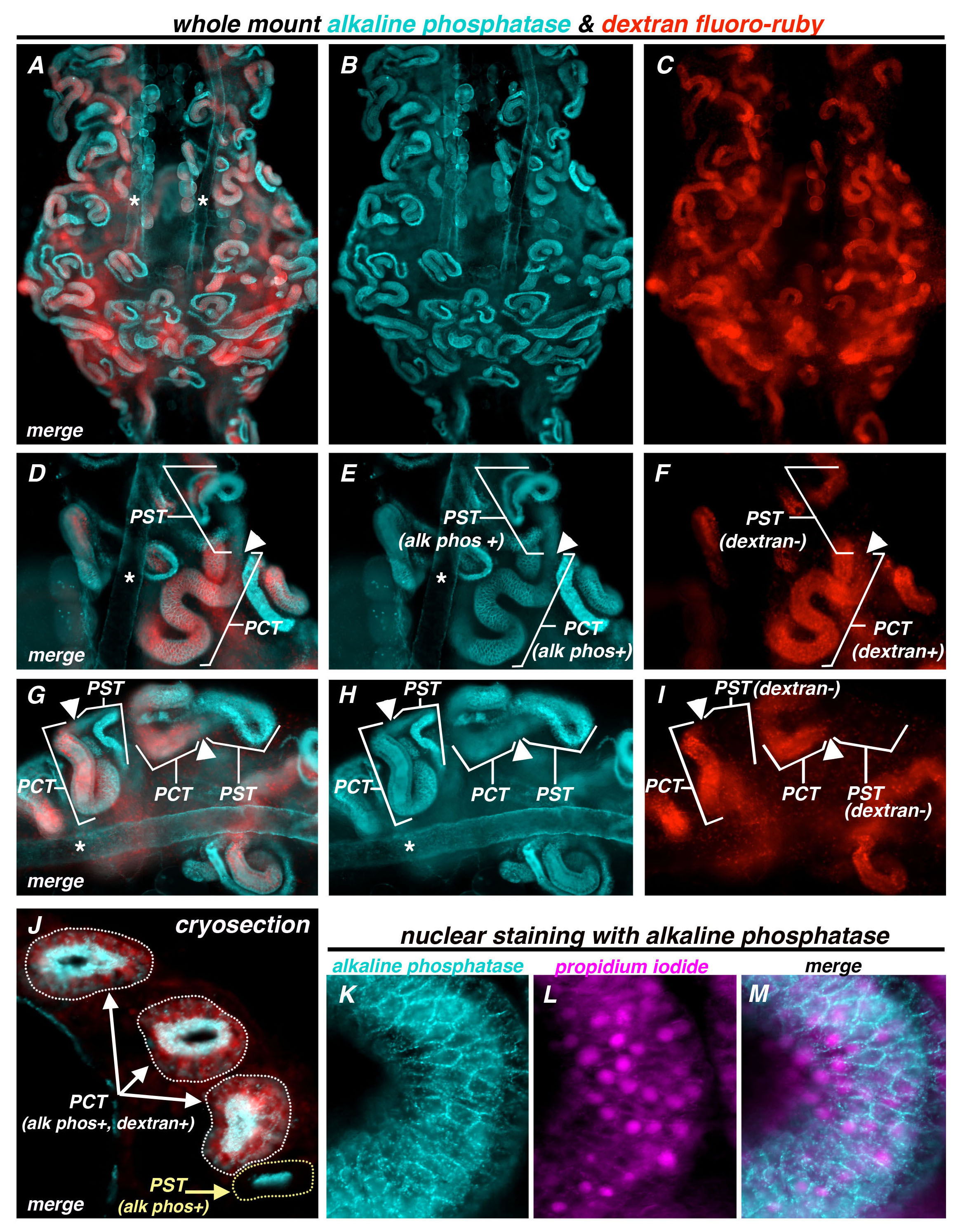
图6碱性磷酸酶和成人肾脏肾PCT的段中的葡聚糖摄取显示重叠,和碱性磷酸酶染色是用核共标记用碘化丙啶兼容。 (AI) 整装从那个曾接受过腹腔注射右旋糖酐氟红宝石斑马鱼成年人的肾脏进行碱性磷酸酶染色准备。碱性磷酸酶(绿松石)和在PCT葡聚糖氟红宝石(红色)显示重叠,但没有在PST,这是唯一的正面为碱性磷酸酶。碱性磷酸酶的背景水平照亮对主要集合管中的每个肾(星号,*),它是独特的,由于其宽直径(AC)合并图像和单个肾的鞍区的独立的图像。(DF)及(GI),两组合并后的图像和肾的例子单独的图像。(一)冷冻切片分析证实碱性磷酸酶和右旋糖酐氟红宝石在PCT段(白点所述)共同标签,而碱性磷酸酶单独标签的PST段(黄色点所述)。(公里)肾脏标记(K)碱性磷酸酶(绿松石)和(L)碘化丙啶(紫色),使(M)合并肾小管上皮细胞和它们的核,可视化分别请点击这里查看该图的放大版本。
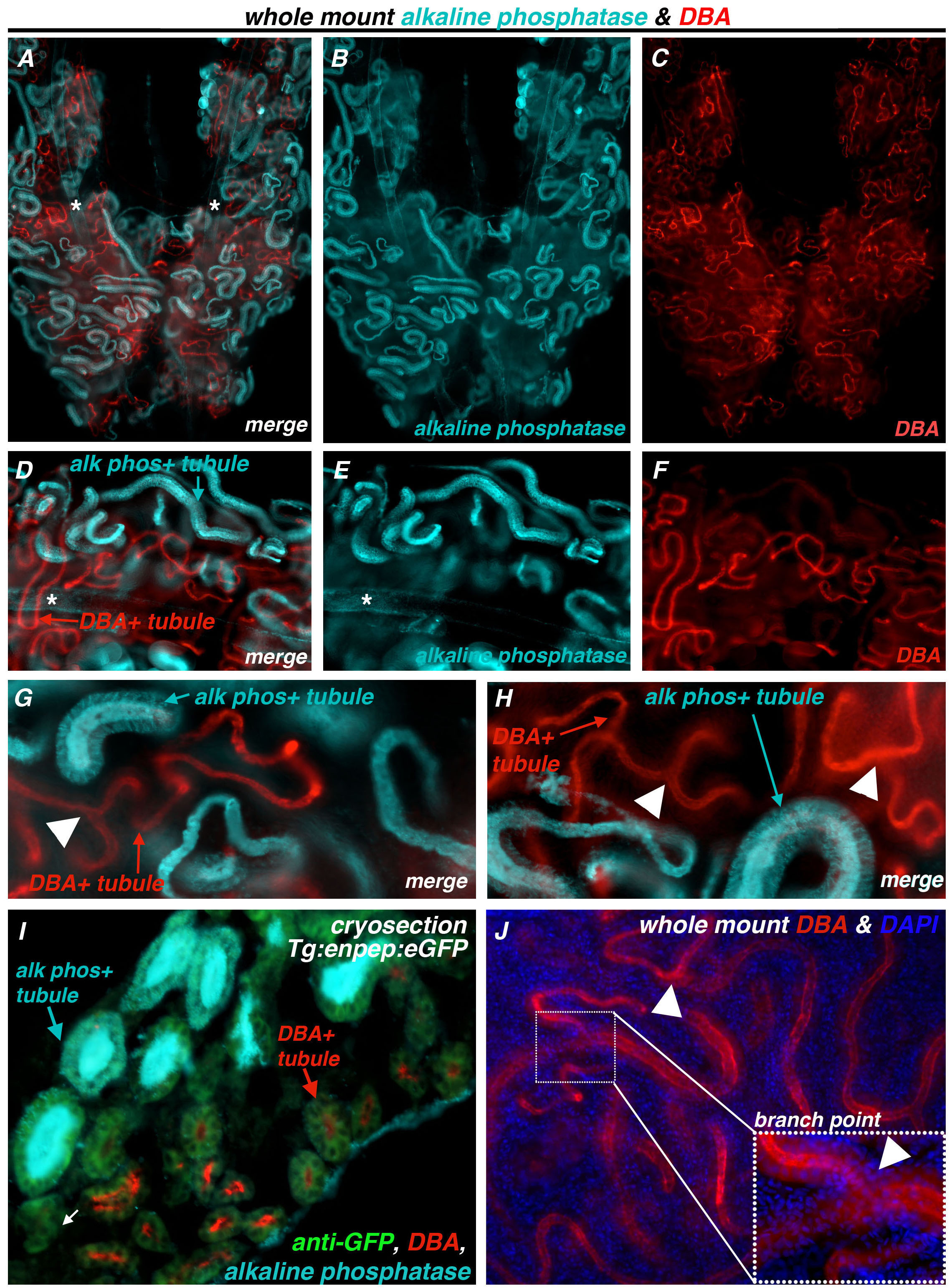
图7碱性磷酸酶和DBA是相互排斥的部分标签,它们分别标志着泛近端和泛远的地区,存在于成年斑马鱼肾肾。 (AH)斑马鱼肾沾上碱性磷酸酶和罗丹明DBA的整装准备。碱性磷酸酶(绿松石)和DBA(红色)不显示在肾脏重叠。碱性磷的背景水平特拉维夫照亮对主要集合管中的每一个肾(星号,*),它是独特的,由于其宽的直径。 DBA的正面小管的直径细,由分支点(白色箭头)存在经常特点。(交流)合并后的图像和一个肾脏的鞍区独立的图像。(DF)的一组图像合并和单独的图像例如肾(G,H)的其它例子,有支小管的DBA一起碱性磷酸酶阳性小管,合并后的图像。(一)冷冻切片分析证实,碱性磷酸酶和DBA的标签不同的小管的部分,只有罕见肾小管显示没有标签(白色箭头),可能是由于部分的该细管的角度。为了便于分析,野生型转基因鱼,TG:ENPEP:绿色荧光蛋白 ,用于所有的肾小管这个肾脏被免疫标记与第一抗体检测绿色荧光蛋白(J)。 整装肾染色的DBA(红色)和DAPI(蓝色)(合并后的图像),再次显示了成人肾(白箭头)的分支远端小管。 请点击这里查看该图的放大版本。
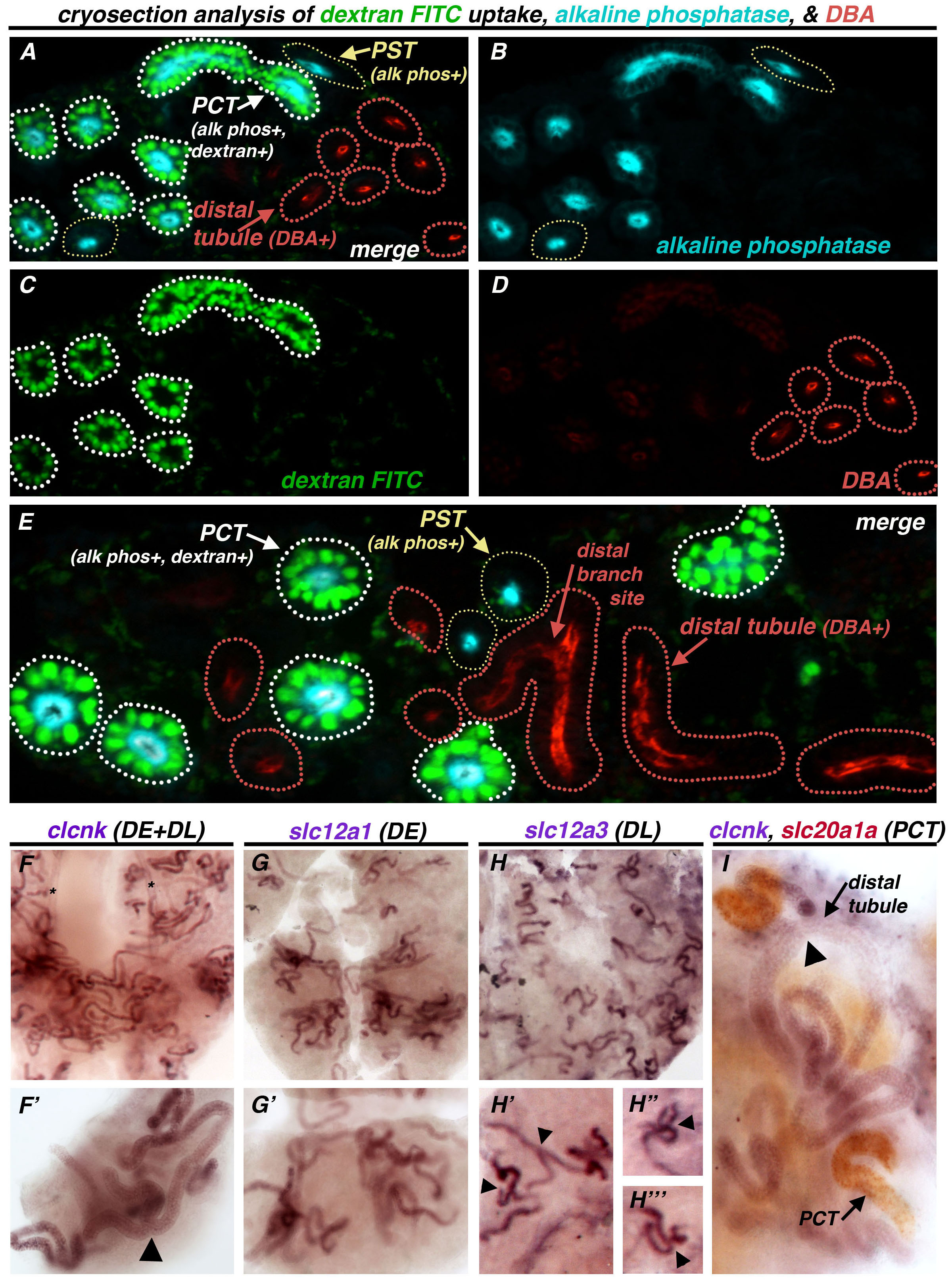
的成年肾冷冻切片与葡聚糖的摄取,碱性磷酸酶,和DBA图8三重标记相比远端段WISH分析。 (AE)成人肾脏腹腔注射葡聚糖-FITC(绿色),和肾收集3天后用于嵌入和cryosectioning。用碱性磷酸酯酶(青绿色)和DBA(红色)染色显示三个群体小管:PCT段是呈阳性的碱性磷酸酶活性和DEXT跑了(白点所述),太平洋标准时间段呈阳性仅供碱性磷酸酶活性(黄色点所述),和远端小管是呈阳性的DBA,只在(红点所述)也表现出特征的远端分支点。(另一个例子节,AD)合并后的图像和一个示例部分独立的图像。(五)合并后的图像。(FI),单(FH的远曲小管的基因表达模式的比较"")和双(I)的心愿。在(FH')单心愿上市的基因(每个紫色染色),(F,F')clcnk的表达模式,泛远(DE-DL)的标记,在薄小管包含分支点检测(黑箭头)。(G,G')相比较而言,求之不得SLC12A1标志着德与未检测到分支点,和(HH'")<EM> SLC12A3标志着DL,其特点是众多的分支点在整个肾脏器官(黑色箭头)段,(一)双愿在PCT标志slc20a1a(红色)和泛远clcnk(紫色)。标记这些标记物的链段不重叠,而相反的表达结构域占据非相邻位置上,使得个体PCT线圈(右下)不邻接远端小管,而后者占据的离散位置,并具有标志的分支点(黑箭头)。 请点击这里查看该图的放大版本。
讨论
这里,我们已经描述了方法,使肾段组件在成年斑马鱼的可视化。的荧光葡聚糖偶联物的注射使因这些近端小管细胞30,38的内吞属性优先厘标签。该方法能以极大的灵活性来执行,由于葡聚糖,可以用不同的荧光偶联物的一群得到的存在。此外,利用赖氨酸定影葡聚糖是一种特别方便的方法来标记的PCT段,作为二次标记的程序不是必需的。这使得能够相对直接的信号检测,并与许多其它的荧光标记,免疫标记,并且使用转基因报告线兼容。碱性磷酸酶标记也标志着近曲小管,与PCT的强反应性和稍弱的反应在PST。最后,DBA染色使远曲小管段,其中显示一个通道的标签aracteristic支形态。各种植物血凝素分子,其是非免疫来源的糖结合蛋白质,已被广泛使用,以区分哺乳动物肾段47。有趣的是,DBA在斑马鱼相关与远端小管段,因为它是用于在哺乳动物肾脏47马克集合管。
两者合计,这些方法可用于以不同的组合来记录的肾组成和功能。因为所有这些方法都可以在整个肾脏制剂中使用时,它们提供的工具来评估肾的结构和功能在整个器官而不完全依赖于使用的更费时,繁琐的方法, 例如,冰冻切片工作和免疫标记。但是,这种方法的文章中描述的污点是可行的冷冻切片。冷冻切片分析,产生的样本(相对于整个安装)是更适合进行免疫组化检测特定pepti宫,虽然当然这种类型的分析,需要适当的一级抗体的可用性。不幸的是在斑马鱼的动物模型工作的一个主要限制仍然是抗体的可用性较差。因而WISH仍然是最广泛使用的,也就是说 ,"去到"程序用于基因表达的分析。 WISH用BCIP,NBT,和/或INT基板反应,以产生紫色或红色的沉淀物是不与冷冻切片的荧光染色兼容。一个办法是调用使用荧光WISH检测,而进行了优化的斑马鱼胚胎样本,可以针对与成人肾脏的使用程序。这个视频文章中的方法的描述应允许进一步的实验与像荧光愿望,结合转基因斑马鱼线,让市民段标记报告,如绿色荧光蛋白或mCherry技术。可选地,所述方法在此描述可以变成与其他重要的染料, 如其他凝集素结合ð进行测试。因此,进一步的适应和扩张的这里所描述的方法可以被调用,以满足研究者的需求整装肾制剂和分析。
正因为如此,这些方法具有广泛的潜在实施与正在进行的再生研究斑马鱼模型以及在遗传性疾病模型。有创新的研究和治疗肾苦难的迫切需要。数以百万计的人患有某种形式的肾脏疾病,每年导致先天性,急性和/或慢性的原因受到影响。此外,肾脏病的患病率在全球不断攀升,使得这些疾病的全球公共健康问题[14,15]。在治疗如血液透析,由此可外接透析机的作用是排除代谢废物病人的血液,如果他们的肾脏不能发挥这种作用。不幸的是,这种干预有其局限性,因为持续的治疗是必要的生存。此外,患者最终需要肾移植,这可能需要数年领取一次,一个病人被放在等候名单。即使获得了肾移植,许多患者遭受不利影响的过程的结果,必须对付这些影响他们的生活休息。这些困难表现出严重的需要对新的治疗方法的发展,既有助于预防肾脏疾病,或可能增加组织再生8,16,52,53。给出了使用在生物医学实验室人类测试受试者的明显的伦理局限性,动物模型对于人类疾病的发病机理的研究,并为新的治疗药物的试验是必不可少的。作为它的解剖相似度和进化接近的结果,小鼠已经成为人类疾病45的最广泛使用的模型。然而,存在与该动物的某些限制,包括原理荷兰国际集团无法想象体内并完成大规模遗传筛选的实用性器官的发育。斑马鱼是一种相关的,有用的模式生物器官发育人类疾病45,46和建模的研究。在关于人类疾病,功能同系物的斑马鱼近70%的人类基因54,55存在。
最近的工作强调了斑马鱼的实用程序,用于肾脏研究31,37,56许多领域。再生和修复斑马鱼急性肾损伤后的研究表明,肾小管上皮再生和neonephrogenesis是出现和整个再生时间过程30,37重叠的两个过程。使用氨基糖苷类抗生素称为庆大霉素已用作通过该学习AKI的结果在成年斑马鱼29,30,37受伤的范例。过了大约两个星期的期限庆大霉素损伤后,近端tubulES再生,同时新的肾单位在整个器官29,30,37形成。在一般情况下,调节上皮再生的机制存在很大的争议。在维修过程中的一个提议的机制,有初始急性损伤事件后,通过脱落的死细胞进入管腔。接着,是一系列去分化,增殖和迁移的事件,在这之后的新细胞分化,再植受伤基底膜和恢复功能的损伤部位。可替代地,其它的研究表明,置换细胞源自驻留肾小管内的干细胞/祖细胞。至于neonephrogenesis的过程中,斑马鱼,细胞聚集物已经观察下面的AKI庆大霉素注射29,30。这些聚集体成熟后成下探到已经存在的小管29,30新的肾单位。 ,团结肾上皮再生和neonephr的共同点ogenesis是其庞大的神秘面纱因素:目前有关于这些再生的壮举是如何发生的比可用的见解指数更多的问题。
迄今为止,然而,一些证据励磁线支持的概念,即使用斑马鱼肾再生研究的确可以提供相关的比较分析上市人类AKI也可以具有直接平移潜在56-58。化学筛选,以确定小分子,增加在斑马鱼胚胎最近导致了组蛋白脱乙酰基酶抑制剂的甲基- (苯硫基) -丁酸(m4PTB)56,57的识别肾脏祖细胞的增殖。这种化合物对斑马鱼幼虫用庆大霉素致急性肾损伤的政府透露,幼虫成活率增加,肾小管细胞增殖增强56,58。当小鼠中度缺血诱导的急性肾损伤是与m4PTB治疗,其恢复的副教授加快iation与增殖肾小管细胞58两个肾小管萎缩和细胞周期阻滞的减少。这些结果表明,负责正常斑马鱼肾发展和/或AKI的再生反应的途径将与哺乳动物56是保守的。
因此,尽管还需要进一步研究,以梳理出的再生,即机制,以确定所涉及的信号通路,并了解它们之间的相互作用,斑马鱼提供了一个可行的途径去追求,在肾脏病领域的这一重要目标。工具,如在该协议中描述的肾细胞标记代表一个组可以被用来评估在AKI模型肾组合物和功能测定法。此外,它们可应用于表征肾脏疾病的转基因模型,并且可以提供方法来鉴定能够肾坝后促进恢复肾结构的化学疗法年龄。
披露声明
作者什么都没有透露。
致谢
这项工作是由下列资金,支持RAW:美国国立卫生研究院授予K01 DK083512,DP2 OD008470和R01 DK100237;出生缺陷基金会罗勒奥康纳入门学者补助金#5 FY12-75的;开始从科学与生物科学系的圣母院书院的大学资金;和丰盛的礼物,巴黎圣母院大学的伊丽莎白和迈克尔·加拉格尔代表加拉格尔家庭,以促进干细胞研究。该资助者在研究设计,数据收集和分析,发布的决定,或准备的稿子没有任何作用。我们感谢生物科学部的工作人员的鼎力支持,以及中心的斑马鱼研究在巴黎圣母院为他们在我们的斑马鱼群体的照顾和福利的杰出贡献。最后,我们要感谢我们的研究实验室的成员对这项工作的意见,进行讨论和见解。
材料
| Name | Company | Catalog Number | Comments |
| 1X PBS | Made by diluting 10 X PBS in distilled water. | ||
| 1X PBST | 0.1% Tween-20 detergent in 1 X PBS. | ||
| 1X PBS with 0.05 % Tween | 0.05% Tween-20 detergent in 1 X PBS. | ||
| Tween 20 | American Bioanalytical | AB02038 | |
| 4% PFA/1X PBS | Dissolve 4% PFA (w/v) (Electron Microscopy Sciences, Cat # 19210) in 1 X PBS, bring to boil on a hot plate in a fume hood. Cool and freeze the aliquots for storage in the freezer at -20°C. Thaw just before use and do not refreeze stocks. | ||
| Fine Forceps | Roboz | RS-1050 | Dumont Tweezers Pattern #55 |
| Glass slide | Thermo-Fisher | 4445 | White Frost |
| Glass coverslip | Thermo-Fisher | 12-540A | 18 x 18 mm |
| Modeling clay | Hasbro | Playdoh | Other modeling clays can be substituted and work similarly |
| Slide holder | Thermo-Fisher | 12-587 | Optional: cardboard tray to store slides flat |
| Bleaching solution | Bleach mix formula (for a 20 ml solution): 1.6 ml of 10% Potassium hydroxide solution 0.6 ml of 30% Hydrogen peroxide solution 100 μl of 20% Tween Fill to 20 ml with distilled water | ||
| Potassium hydroxide | Sigma | 221473 | |
| Hydrogen peroxide | Sigma | H1009 | |
| Blocking solution | Blocking Solution (for a 10 ml solution): 8 ml of 1X PBS with 0.05% Tween 2 ml of fetal calf serum 150 μl of DMSO | ||
| Alkaline phosphatase activity detection | Invitrogen | E6601 | We utilize the ELF 97 Endogenous Phosphatase Detection Kit. To prepare the working substrate solution, dilute the substrate 20-fold in the detection buffer, according to the manufacturer's instructions. |
| Alkaline phosphatase wash solution | Recipe for Wash Buffer Solution (for a 100 ml solution): 5 ml of 0.5 M EDTA 120 mg of Levamisole 95 ml of 1X PBS | ||
| Dextran, fluorescein, 40,000 MW | Invitrogen | D1844 | Dilute with distilled water to make a 50 mg/ml stock solution, and store aliquots in the freezer at -20°C. |
| Dextran, cascade blue, 10,000 MW | Invitrogen | D1976 | Dilute with distilled water to make a 50 mg/ml stock solution, and store aliquots in the freezer at -20°C. |
| Dextran, lucifer yellow, 10,000 MW | Invitrogen | D1825 | Dilute with distilled water to make a 50 mg/ml stock solution, and store aliquots in the freezer at -20°C. |
| Dextran, tetramethylrhodamine (fluoro-ruby), 10,000 MW | Invitrogen | D1817 | Dilute with distilled water to make a 50 mg/ml stock solution, and store aliquots in the freezer at -20°C. |
| Dolichos biflorus agglutinin (DBA)-rhodamine | Vector laboratories | RL-10-32 | DBA Staining Solution (for a 100 μl solution): 1 μl of DBA 99 μl of 1X PBS |
| Propidium iodide | Invitrogen | E6601 | |
| DAPI | Invitrogen | P1304MP | |
| Vectashield hard set mounting medium | Vector laboratories | H-1400 | |
| Micro cover glass | VWR | 48393081 | |
| Dimethyl sulfoxide, DMSO | American Bioanalytical | 67-68-5 | |
| Sucrose | Sigma | S0289 | |
| EDTA, 0.5 M solution, pH 8.0 | American Bioanalytical | AB00502 | |
| Levamisole | Sigma | L-9756 | |
| Tissue freezing medium | Triangle Biomedical Sciences, Inc. | TFM-C | |
| Tissue-Tek Cryomold Biopsy, 10 x 10x 5 mm | Sakura Finetek | 4565 | |
| TruBond 380 adhesive microscope slides | Tru Scientific | 0380W | |
| Liquid blocker – super PAP pen | Electron Microscopy Sciences | 71312 | |
| Immuno stain moisture chamber | Evergreen Scientific | 240-9020-Z10 | |
| Cryostat | Therm | Microm™ HM 525 Cryostat | |
| Stereomicroscope | Nikon | SMZ645; SMZ1000; 83455 P-Blue GFP/DAPI; 83457 P-Endow GFP/FITC; 83457 P-TRITC | Filter set used was as follows: Hoechst/DAPI filter was used for DAPI, propidium iodide, dextran-cascade blue and alkaline phosphatase detection. GFP/FITC filter was used for dextran-FITC, dextran lucifer yellow, and anti-GFP detection. The TRITC filter was used for dextran-fluoro-ruby, PI, and DBA detection. |
| Compound microscope | Nikon | 96310 C-FL UV-2E/C DAPI; 96311 C-FL B-2E/C FITC; 96313 C-FL Y-2E/C Texas Red | Filter set used was as follows: Hoechst/DAPI filter was used for DAPI, propidium iodide, dextran-cascade blue and alkaline phosphatase detection. GFP/FITC filter was used for dextran-FITC, dextran lucifer yellow, and anti-GFP detection. The Texas Red filter was used for dextran-fluoro-ruby, PI, and DBA detection. |
参考文献
- Reilly, R. F., Bulger, R. E., Kriz, W., RW, S. c. h. r. i. e. r. Structural-functional relationships in the kidney. Diseases of the Kidney and Urinary Tract. , 2-53 (2007).
- Dressler, G. R. The cellular basis of kidney development. Annu Rev Cell Dev Biol. 22, 509-529 (2006).
- Nyengaard, J. R., Bendtsen, T. F. Glomerular number and size in relation to age, kidney weight, and body surface in normal man. Anat Rec. 232, 194-201 (1992).
- Cebrian, C., Borodo, K., Charles, N., Herzlinger, D. A. Morphometric index of the developing murine kidney. Dev Dyn. 231, 601-608 (2004).
- Schedl, A. Renal abnormalities and their developmental origin. Nat Rev Genet. 8, 791-802 (2007).
- Ricci, Z., Cruz, D. N., Ronco, C. Classification and staging of acute kidney injury: beyond the RIFLE and AKIN criteria. Nat Rev Nephrol. 7, 201-208 (2011).
- Faubel, S., et al. Ongoing clinical trials in AKI. Clin J Am Soc Nephrol. 7, 861-873 (2012).
- Li, Y., Wingert, R. A. Regenerative medicine for the kidney: stem cell prospects and challenges. Clin Transl Med. 2, 11 (2013).
- Liu, Y. Cellular and molecular mechanisms of renal fibrosis. Nat Rev Nephrol. 7, 684-696 (2011).
- Murugan, R., Kellum, J. A. Acute kidney injury: what’s the prognosis. Nat Rev Nephrol. 7, 209-217 (2011).
- Palevsky, P. M. Chronic-on-acute kidney injury. Kidney Int. 81, 430-431 (2012).
- Chawla, L. S., Kimmel, P. L. Acute kidney injury and chronic kidney disease: an integrated clinical syndrome. Kidney Int. 82, 516-524 (2012).
- Bucaloiu, I. D., Kirchner, H. L., Norfolk, E. R., Hartle, J. E., Perkins, R. M. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury. Kidney Int. 81, 477-485 (2012).
- Collins, A. J., et al. USRDS 2012 Annual Data Report: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States (2012). Lancet. 365, 331-340 (2012).
- El Nahas, M. e. g. u. i. d., Bello, A., K, A. Chronic kidney disease: the global challenge. Lancet. 365, 331-340 (2005).
- McCampbell, K. K., Wingert, R. A. Renal stem cells: fact or science fiction. Biochem J. 444, 153-168 (2012).
- Toback, F. G. Regeneration after acute tubular necrosis. Kidney Int. 41, 226-246 (1992).
- Thadhani, R., Pascual, M., Bonventre, J. V. Acute renal failure. N Engl J Med. 334, 1448-1460 (1996).
- Bonventre, J. V. Dedifferentiation and proliferation of surviving epithelial cells in acute renal failure. J Am Soc Nephrol. 14, S55-S61 (2003).
- Romagnani, P., Kalluri, R. Possible mechanisms of kidney repair. Fibrogenesis Tissue Repair. 2, 3 (2009).
- Bonventre, J. V., Yang, L. Cellular pathophysiology of ischemic acute kidney injury. J Clin Invest. 121, 4210-4221 (2011).
- Grgic, I., et al. Targeted proximal tubule injury triggers interstitial fibrosis and glomerulosclerosis. Kidney Int. 82, 172-183 (2012).
- Reimschuessel, R. A fish model of renal regeneration and development. ILAR J. 42, 285-291 (2001).
- Reimschuessel, R., Williams, D. Development of new nephrons in adult kidneys following gentamicin-induced nephrotoxicity. Ren Fail. 17, 101-106 (1995).
- Salice, C. J., Rokous, J. S., Kane, A. S., Reimschuessel, R. New nephron development in goldfish (Carassius auratus) kidneys following repeated gentamicin-induced nephrotoxicosis. Comp Med. 51, 56-59 (2001).
- Augusto, J., Smith, B., Smith, S., Robertson, J., Reimschuessel, R. Gentamicin-induced nephrotoxicity and nephroneogenesis in Oreochromis nilotica, a tilapian fish. Dis Aquatic Org. 26, 49-58 (1996).
- Elger, M., et al. Nephrogenesis is induced by partial nephrectomy in the elasmobranch Leucoraja erinacea. J Am Soc Nephrol. 14, 1506-1518 (2003).
- Watanabe, N., et al. Kidney regeneration through nephron neogenesis in medaka. Develop Growth Differ. 51, 135-143 (2009).
- Zhou, W., Boucher, R. C., Bollig, F., Englert, C., Hildebrandt, F. Characterization of mesonephric development and regeneration using transgenic zebrafish. Am J Physiol Renal Physiol. 299, F1040-F1047 (2010).
- Diep, C. Q., et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature. 470, 95-101 (2011).
- Gerlach, G. F., Wingert, R. A. Kidney organogenesis in the zebrafish: insights into vertebrate nephrogenesis and regeneration. Wiley Interdiscip Rev Dev Biol. 2, 559-585 (2013).
- Wingert, R. A., et al. The cdx genes and retinoic acid control the positioning and segmentation of the zebrafish pronephros. PLoS Genet. 3, e189 (2007).
- Wingert, R. A., Davidson, A. J. The zebrafish pronephros: a model to study nephron segmentation. Kidney Int. 73, 1120-1127 (2008).
- Wingert, R. A., Davidson, A. J. Zebrafish nephrogenesis involves dynamic spatiotemporal expression changes in renal progenitors and essential signals from retinoic acid and irx3b. Dev Dyn. 240, 2011-2027 (2011).
- Li, Y., Cheng, C. N., Verdun, V. A., Wingert, R. A. Zebrafish nephrogenesis is regulated by interactions between retinoic acid, mecom, and Notch signaling. Dev Biol. 386, 111-122 (2014).
- Gerlach, G. F., Schrader, L. N., Wingert, R. A. Dissection of the adult zebrafish kidney. J Vis Exp. 54, (2011).
- McCampbell, K. K., Wingert, R. A. New tides: using zebrafish to study renal regeneration. Transl Res. 163, 109-122 (2014).
- Drummond, I. A., et al. Early development of the zebrafish pronephros and analysis of mutations affecting pronephric function. Development. 125, 4655-4667 (1998).
- Anzenberger, U., et al. Elucidation of megalin/LRP2-dependent endocytic transport processes in the zebrafish pronephros. J Cell Sci. 15, 2127-2137 (2006).
- Majumdar, A., Drummond, I. A. The zebrafish floating head mutant demonstrates podocytes play an important role in directing glomerular differentiation. Dev Biol. 222, 147-157 (2000).
- Kramer-Zucker, A. G., Wiessner, S., Jensen, A. M., Drummond, I. A. Organization of the pronephric filtration apparatus in zebrafish requires Nephrin, Podocin, and the FERM domain protein Mosaic eyes. Dev Biol. 285, 316-329 (2005).
- Brien, L. L., Grimaldi, M., Kostun, Z., Wingert, R. A., Selleck, R., Davidson, A. J. Wt1a, Foxc1a, and the Notch mediator Rbpj physically interact and regulate the formation of podocytes in zebrafish. Dev Biol. 358, 318-330 (2011).
- Ebarasi, L., Oddsson, A., Hultenby, K., Betsholtz, C., Tryggvason, K. Zebrafish: a model system for the study of vertebrate renal development, function, and pathophysiology. Curr Opin Nephrol Hypertens. 20, 416-424 (2011).
- Swanhart, L. M., Cosentino, C. C., Diep, C. Q., Davidson, A. J., de Caestecker, M., Hukriede, N. A. Zebrafish kidney development: basic science to translational research. Birth Defects Res C Embryo Today. 93, 141-156 (2011).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nat Rev Genet. 8, 353-367 (2007).
- Santoriello, C., Zon, L. I. Hooked! Modeling human disease in zebrafish. J Clin Invest. 122, 2337-2343 (2012).
- Cox, W. G., Singer, V. L. A high-resolution, fluorescence-based method for localization of endogenous alkaline phosphatase activity. J Histochem Cytochem. 47, 1443-1456 (1999).
- Drummond, I. A., Davidson, A. J. Zebrafish kidney development. Methods Cell Biol. 100, 233-260 (2010).
- Watson, L., Vassallo, J., Cantor, G., Lehman-McKeeman, L. Lectin histochemistry: an alternative to immunohistochemistry for identify specific structures in rat papillary necrosis. HistoLogic. 41, 28-31 (2008).
- Cheng, C. N., Li, Y., Marra, A. N., Verdun, V., Wingert, R. A. Flat mount preparation for observation and analysis of zebrafish embryo specimens stained by whole mount in situ hybridization. J Vis Exp. , e51604 (2014).
- Seiler, C., Pack, M. Transgenic labeling of the zebrafish pronephric duct and tubules using a promoter from the enpep gene. Gene Expr Patterns. 11, 118-121 (2011).
- Little, M. H. Regrow or repair: potential regenerative therapies for the kidney. J Am Soc Nephrol. 17, 2390-2401 (2006).
- Romagnani, P., Lasagni, L., Remuzzi, G. Renal progenitors: an evolutionary conserved strategy for kidney regeneration. Nat Rev Nephrol. 9, 137-146 (2013).
- Goldsmith, J. R., Jobin, C. Think small: zebrafish as a model system of human pathology. J Biomed Biotechnol. 2012, 817341 (2012).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496, 498-503 (2013).
- Poureetezadi, S. J., Wingert, R. A. Congenital and acute kidney disease: translational research insights from zebrafish chemical genetics. General Med. 1 (3), (2013).
- Groh, E. D., et al. Inhibition of histone deacetylase expands the renal progenitor population. J Am Soc Nephrol. 21, 794-802 (2010).
- Cosentino, C. C., et al. Histone deacetylase inhibitor enhances recovery after AKI. J Am Soc Nephrol. 24, 943-953 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。