需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
对于血液处理快速的方法,以提高血浆肽水平的人血产量
摘要
快速血液处理方法,可以在人类中使用,并产生更高的肽水平以及允许对正确分子形式的评估。因此,这种方法将在肽研究的宝贵工具。
摘要
研究食物摄入管制领域越来越重要。这通常包括肽调节食物摄入量的测量。为正确的测定的肽的浓度的,它应该是血处理过程中是稳定的。然而,这不是对几种肽它们很快被内源性肽酶降解的情况。最近,我们开发了一种血液处理方法采用ř得出的温度,A cidification,P rotease抑制, 我 sotopic外源控制和D ilution(RAPID)对大鼠使用。这里,我们已经建立了这种技术的使用在人类和调查恢复,分子形式和食物摄取调节激素的循环浓度。的快速方法显著改善了125 I标记的生长抑素-28(+ 39%),高血糖素样肽-1(+ 35%)的回收,酰基生长素释放肽和胰高血糖素(+ 32%),胰岛素和亲吻促动素(+ 29% ),注射nesfatin-1(+ 28%),瘦素(+ 21%)相比,标准处理(冰血EDTA,P <0.001),肽YY 3-36(+ 19%)。高效液相色谱表明内源性酰基生长素释放肽的洗脱在快速处理后的预期位置,而标准处理后的酰基生长素释放肽的62%被降解导致较早峰值可能表示desacyl生长素释放肽。快速加工后在正常体重受试者的血液酰基/ desacyl生长素释放比例为1:3相比1:23以下标准处理(p值= 0.03)。同时内生亲吻促动素水平的标准相比,处理后快速走高(+ 99%,P = 0.02)。快速血液处理方法,可以在人类中使用,产生较高的肽水平并且允许进行正确分子形式的评估。
引言
在肥胖1,2世界范围内日益流行的光,研究食物的摄入监管领域越来越重要。而迄今为止,只有一种肽,已知是外周产生并作用于中枢的刺激食物摄入,即生长素释放肽3,在过去的几十年中,范围广泛的肽已发现减少食物摄取, 例如 。瘦素,肽YY(PYY)和也胰高血糖素样肽-1(GLP-1)和胰岛素4,因此,在研究调查饥饿和饱满感肽水平的调节机制经常评估,并在同一时间,假设所研究的肽是稳定的,并在过程中等离子体形成高产量恢复。可是,很多时候不是这种情况下,由于内源性迅速击穿如之前如 。生长素释放肽是从酰基降解为desacyl生长素释放肽5。因此,我们最近描述了血液PROCES的快速方法唱采用ř得出的温度,A cidification老鼠,P rotease抑制, 我 sotopic外源控制和D ilution 6。这种方法改善了11 12的肽测试,并允许正确的循环分子形式的测定标准相比,血液处理(EDTA血冰)6复苏。这种方法已在几个随后的研究7-12被用于检测循环的生长素释放肽以及促肾上腺皮质激素释放因子13的。因此,该方法已被证明为在啮齿类动物的肽的研究是有用的。然而,由于啮齿类动物的研究并不总是平移到另一个物种,该方法应被用于在人血液中的用途确定为好。
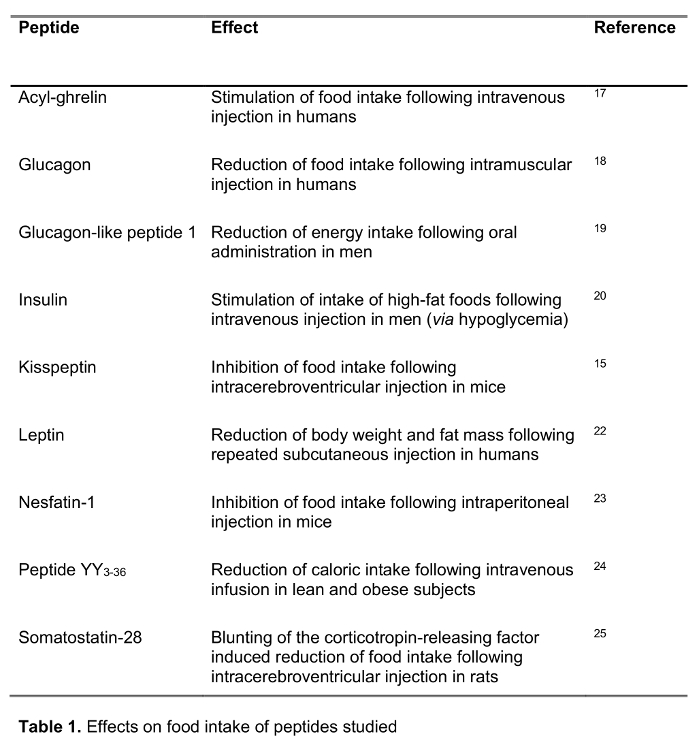
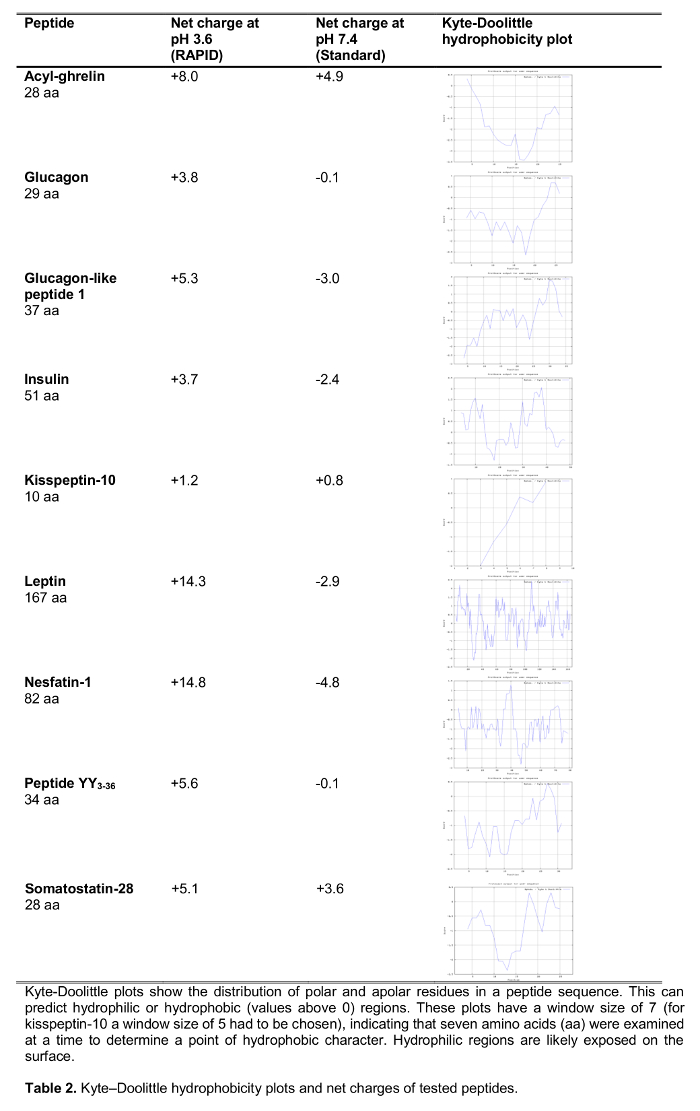
本研究的目的是测试在人类中用于血液处理的快速方法相比标准血液处理中,在冰上EDTA采血管,这是广泛推荐14和频繁ūsed的临床和研究环境。我们测试的选择125参与食物摄入,包括设立的肽,以及新的候选的规则I标记的肽的回收最近建议发挥摄食调节作用(对食物摄入的影响在表1中示出)以下的处理用这两种方法。还选择激素来代表不同的长度和电荷( 表2)的肽。此外,生长素我们调查的分子形式(S)按照标准和快速的方法。最后,我们评估内源性生长激素释放肽(酰基和desacyl生长素释放肽),以及亲吻促动素水平,肽也最近建议发挥食物摄入15,16的下面的快速或标准加工的调节作用。此外,我们还调查了受试者群体,这些肽水平具有广泛的身体质量指数(从10.2-67.6公斤/米2)研究possib的涉及到长期改变体重乐的差异。
诊断,评估和计划:
研究参与者
所有的研究参与者新住院患者(包含了内入院两天)心身医学科在查理特-Universitätsmedizin柏林,并签署知情同意书。为了避免唯一的女患者被纳入性别产生任何影响。总共有42科目参加了这项研究,并随机分为3组:正常体重(BMI 18.5-25公斤/米2,N = 12),神经性厌食症(BMI <17.5公斤/米2,N = 15)和肥胖(BMI"30公斤/米2,N = 15)。厌食症和肥胖患者根据疾病-10的国际分类诊断和住院体重增加(神经性厌食),或体重减少(肥胖),分别。所有正常体重的患者因躯体症状无相关的躯体疾病住院独占。有胃肠道症状,躯体或胃肠道手术史患者被排除在外。排除标准也包含了<18岁,目前在怀孕和未治疗精神性疾病。以增加或减少体重,分别接收饮食治疗前入院后第2天或3进行采血。人体测量参数进行了评估在同一天。
Access restricted. Please log in or start a trial to view this content.
研究方案
(/十分之一百十四协议号EA1)的方案经当地伦理委员会对人类的研究。
1.血液处理
- 根据标准程序或快速的方法,从前臂静脉和流程收集07:00至上午08时00分之间的静脉血后,隔夜快。指示受试者抽血前不能行使或烟雾。
- 对于标准处理,收集冷冻含有EDTA的试管血,离心10 min内的3000 XG在4℃下10分钟。收集上清,并保持在-80°C,直到进一步的处理用放射免疫法。
- 为快速处理,立即稀释血液1:10冰冷缓冲液(pH 3.6)含有0.1M乙酸铵,0.5M氯化钠和酶抑制剂(采血后1分钟之内)(diprotin A,E-64-D,抗蛋白酶,亮肽素,抑糜素,1微克/毫升)。然后,在10分钟内离心以3000 xg离心10分钟,4℃,并收集上清我们ING在大鼠前6详见聚丙烯管吸管。
- 电荷层析柱(360毫克,55-105微米)用100%乙腈(速率为10毫升/分钟),达到平衡用0.1%三氟乙酸(TFA,速率10ml /分钟)和负载与上清液以1ml恒定速率/分钟使用注射泵。
- 此后,洗涤用3ml 0.1%TFA的墨盒(速率10ml /分钟),并用含0.1%TFA(2毫升/分钟)2毫升70%乙腈缓慢洗脱。
- 采用真空离心并储存在-80°C,直到用放射免疫法进一步处理干燥洗脱的样品。
注:操守聚丙烯(快速处理)和硼硅(放射免疫法)表现出显著下表面结合特性,从 而最大限度地减少对大多数26日前研究肽的肽损失管的所有步骤。
2.测量
注:本节步骤应在实验室中进行认证的放射性物质的工作。标准预防措施125我应采取的工作。
- 放射性标记肽的恢复
- 获得125 I放射性标记的人的肽( 如酰基生长素释放肽,GLP-1,胰高血糖素,胰岛素,亲吻促动素,瘦素,注射nesfatin-1,PYY 3-36和生长抑素-28)。
- 保持粉末形式的肽,直至实验,然后在0.1%的新鲜稀乙酸(〜每毫升100000的cpm)。
- 为标准的血液处理,之后直接采血到含有管,传送1毫升血液成用50μl含有3,000-6,000的cpm放射性标记的管冷冻EDTA(直接计数的实验开始前)。
- 对于快速处理,含血液进入含9毫升快速缓冲管EDTA转移取血1ml(对于组成见1.3),并含有30,000-60,000 CPM 500微升放射性标记。 radiolabe更高由于1:10稀释使用10倍体积l对于快速处理。
- 此后,过程的样品与步骤1.2到1.3.2说明。
- 对于回收实验,通过真空离心不干燥的样品和在-80℃不存储。相反,评估放射性标记的肽直接事后用γ计数器的恢复。
- 衡量标准样品在整个上清液,而在快速样品分析总体积的1/10到获得的放射性标记的使用量的可比性。为了进行测量,转移上清液在管配合到γ计数器和评估的每分钟计数
- 作为一个100%的标准,用两个样品用50μl不进行处理125 I放射性标记肽。在测量中2.1.7所述的相同时间与其他样品。
- 执行实验的五至六倍的每个肽。
- 放射性标记的生长素释放肽高效液相色谱法
- 抽回血在C含管和1ml转移到含含15,000-20,000 CPM(实验开始前直接计入)200微升放射性酰基生长素管hilled EDTA。
- 对于快速处理,传输取血1ml到含有9毫升快速缓冲管(用于组成见1.3),并含有15,000-20,000 CPM 200微升放射性酰基生长素。
- 此后,过程的样品与步骤1.2到1.3.2说明。
- 通过反相HPLC进一步分析,直接加载样品到在水中的17%乙腈平衡过的稳定的键C18柱(2.1毫米×50毫米,1.8微米)(均补充有0.1%TFA)纯化。
- 5分钟的平衡后,使用梯度从17-40%乙腈洗脱的样品在40分钟(流速为1毫升/分钟速率)。
- 收集的每分钟1ml馏分,用γ计数器分析放射性。
- 在一个单独的实验中,负载200微升放射性酰基生长素释放肽含有15,000-20,000CPM直接上柱和步骤2.2.4 2.2.6描述执行HPLC。
- 放射免疫分析
- 对于放射免疫分析法,解冻上清(标准处理),并在室温下真空冻干粉(快速法)。
- 紧接放射免疫分析法,双蒸馏水2 O根据血浆(500微升)的原体积重悬浮干燥快速的样品。
- 作为根据制造商的协议使用商业放射免疫测定12,27之前描述评估亲吻促动素和总(包括desacyl和酰基生长素释放肽),以及酰基的生长素释放肽。使用硼硅管,使颗粒稳定形成。
- 在第一天,孵育在由生产的一段24小时所提供的稀释测定缓冲液和一抗( 例如抗生长素释放肽)的样品。
- 在第二天,添加125 I示踪剂( 如 125 I-生长素),VORTEX和孵化为期24小时。
- 第三天,添加沉淀剂,涡旋并孵育如制造商推荐的。然后,离心管在3000×g离心在4℃下20分钟。除去上清液并用γ计数器计数在颗粒放射性
- 计算desacyl生长素释放肽作为总减去酰基生长素释放肽的差异。通过desacyl生长素释放肽为每个单独的样本除以酰基评估酰基/ desacyl生长素释放比率。
- 处理所有样品 - 如果可能的话 - 在一个批次,避免批间差异。在本实验中的批内变异是亲吻促动素<8%,<总量的7%和酰基生长素释放肽<9%。
3.统计分析
- 确定使用Kolmogorov-Smirnov检验数据的分布。快速数据平均值(SEM)平均值±标准差。
- 评估两者之间的差异经t检验组。评估所有成对多重比较程序(图基事后检验)或双向ANOVA随后的Holm-Sidak方法的多个组之间的差异。
- 考虑P <0.05显著并执行使用统计程序分析。
Access restricted. Please log in or start a trial to view this content.
结果
快速血液处理增加在人体血液中的125 I放射性标记的肽的标准相比,血液处理的产率。
标准血液处理(在冰上的EDTA血)后,放射性标记的肽的回收在9/9肽( - K范围从48-68%, 图1A)为〜60%。快速处理提高了产率在所有125 I标记的肽,即在促生长素抑制素-28(+ 39%, 图1A),胰高血糖素样肽-1(+ 35%, 图1B?...
Access restricted. Please log in or start a trial to view this content.
讨论
我们之前报道,对于血液处理的快速方法,改善了11/12肽复苏相比,大鼠6个标准的血液处理。在本研究中,我们已经表明,这种方法也适合于在人体中使用。以下快速处理,测试了9 9 125 I标记的肽的回收率相比标准血液处理(在冰上EDTA采血管)的改善。所观察到的改善,从19-39%,这可能是相关的,特别是当该肽的产率是低,这可能被掩蔽时只有细微的差别预期的条件下不等。
Access restricted. Please log in or start a trial to view this content.
披露声明
作者什么都没有透露。
致谢
这项工作是由德国研究基金会STE 1765 / 3-1(AS)和德国联邦教育与研究03IPT614A(CG)的支持。我们感谢莱因哈德隆梅尔和佩特拉布斯的出色的技术支持,以及卡琳·约翰逊和克里斯蒂娜Hentzschel与组织和人体测量的执行帮助
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Diprotin A | Peptides International, Louisville, KY, USA | IDP-4132 | |
| E-64-d | Peptides International, Louisville, KY, USA | IED-4321-v | |
| Antipain | Peptides International, Louisville, KY, USA | IAP-4062 | |
| Leupeptin | Peptides International, Louisville, KY, USA | ILP-4041 | |
| Chymostatin | Peptides International, Louisville, KY, USA | ICY-4063 | |
| Sep-Pak C18 cartridges | Waters Corporation, Milford, MA, USA | WAT051910 | 360 mg, 55-105 µm |
| Acyl-ghrelin | Millipore, Billerica, MA, USA | 9088-HK | Radioactive |
| GLP-1 | Millipore, Billerica, MA, USA | 9035-HK | Radioactive |
| Glucagon | Millipore, Billerica, MA, USA | 9030 | Radioactive |
| Insulin | Millipore, Billerica, MA, USA | 9011S | Radioactive |
| Leptin | Millipore, Billerica, MA, USA | 9081-HK | Radioactive |
| Kisspeptin-10 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-048-56 | Radioactive |
| Nesfatin-1 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-003-26 | Radioactive |
| PYY3-36 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-059-02 | Radioactive |
| Somatostatin-28 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-060-16 | Radioactive |
| ZORBAX Rapid Resolution HT SB-C18 column | Agilent Technologies, Santa Clara, CA, USA | 822700-902 | 2.1 mm x 50 mm, 1.8 µm |
| Agilent 1200 LC | Agilent Technologies, Santa Clara, CA, USA | HPLC, several components, therefore no single catalog number | |
| Kisspeptin RIA | Phoenix Pharmaceuticals, Burlingame, CA, USA | # RK-048-56 | Radioactive |
| Total ghrelin RIA | Millipore, Billerica, MA, USA | # GHRT-89HK | Radioactive |
| Active ghrelin RIA | Millipore, Billerica, MA, USA | # GHRA-88HK | Radioactive |
| SigmaStat 3.1 | Systat Software, San Jose, CA, USA | online download |
参考文献
- Finucane, M. M., et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 377 (9765), 557-567 (2011).
- James, W. P. The epidemiology of obesity: the size of the problem. J Intern Med. 263 (4), 336-352 (2008).
- Stengel, A., Taché, Y. Gastric peptides and their regulation of hunger and satiety. Curr Gastroenterol Rep. 14 (6), 480-488 (2012).
- Hussain, S. S., Bloom, S. R. The regulation of food intake by the gut-brain axis: implications for obesity. Int J Obes (Lond). 37 (5), 625-633 (2013).
- Hosoda, H., et al. Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples). Clin Chem. 50 (6), 1077-1080 (2004).
- Stengel, A., et al. The RAPID method for blood processing yields new insight in plasma concentrations and molecular forms of circulating gut peptides. Endocrinology. 150 (11), 5113-5118 (2009).
- Stengel, A., et al. Lipopolysaccharide differentially decreases plasma acyl and desacyl ghrelin levels in rats: Potential role of the circulating ghrelin-acylating enzyme GOAT. Peptides. 31 (9), 1689-1696 (2010).
- Stengel, A., et al. Cold ambient temperature reverses abdominal surgery-induced delayed gastric emptying and decreased plasma ghrelin levels in rats. Peptides. 31, 2229-2235 (2010).
- Stengel, A., et al. Central administration of pan-somatostatin agonist ODT8-SST prevents abdominal surgery-induced inhibition of circulating ghrelin, food intake and gastric emptying in rats. Neurogastroenterol Motil. 23 (7), e294-e308 (2011).
- Stengel, A., et al. Abdominal surgery inhibits circulating acyl ghrelin and ghrelin-O-acyltransferase levels in rats: role of the somatostatin receptor subtype 2. Am J Physiol Gastrointest Liver Physiol. 301, G239-G248 (2011).
- Wang, L., et al. Intravenous injection of urocortin 1 induces a CRF2 mediated increase in circulating ghrelin and glucose levels through distinct mechanisms in rats. Peptides. 39, 164-170 (2013).
- Goebel-Stengel, M., Stengel, A., Wang, L., Taché, Y. Orexigenic response to tail pinch: role of brain NPY(1) and corticotropin releasing factor receptors. Am J Physiol Regul Integr Comp Physiol. 306 (3), R164-R174 (2014).
- Goebel, M., Stengel, A., Wang, L., Reeve, J., Taché, Y. Lipopolysaccharide increases plasma levels of corticotropin-releasing hormone in rats. Neuroendocrinology. 93 (3), 165-173 (2011).
- Banfi, G., Salvagno, G. L., Lippi, G. The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med. 45 (5), 565-576 (2007).
- Stengel, A., Wang, L., Goebel-Stengel, M., Taché, Y. Centrally injected kisspeptin reduces food intake by increasing meal intervals in mice. Neuroreport. 22 (5), 253-257 (2011).
- De Bond, J. A., Smith, J. T. Kisspeptin and energy balance in reproduction. Reproduction. 147 (3), R53-R63 (2014).
- Wren, A. M., et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 86 (12), 5992(2001).
- Schulman, J. L., Carleton, J. L., Whitney, G., Whitehorn, J. C. Effect of glucagon on food intake and body weight in man. J Appl Physiol. 11 (3), 419-421 (1957).
- Steinert, R. E., Poller, B., Castelli, M. C., Drewe, J., Beglinger, C. Oral administration of glucagon-like peptide 1 or peptide YY 3-36 affects food intake in healthy male subjects. Am J Clin Nutr. 92 (4), 810-817 (2010).
- Dewan, S., et al. Effects of insulin-induced hypoglycaemia on energy intake and food choice at a subsequent test meal. Diabetes Metab Res Rev. 20 (5), 405-410 (2004).
- Schlogl, M., et al. Increased 24-hour ad libitum food intake is associated with lower plasma irisin concentrations the following morning in adult humans. Appetite. 90, 154-159 (2015).
- Heymsfield, S. B., et al. Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial. JAMA. 282 (16), 1568-1575 (1999).
- Shimizu, H., et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 150, 662-671 (2009).
- Batterham, R. L., et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med. 349 (10), 941-948 (2003).
- Shibasaki, T., et al. Antagonistic effect of somatostatin on corticotropin-releasing factor-induced anorexia in the rat. Life Sci. 42 (3), 329-334 (1988).
- Goebel-Stengel, M., Stengel, A., Taché, Y., Reeve, J. R. Jr The importance of using the optimal plasticware and glassware in studies involving peptides. Anal Biochem. 414 (1), 38-46 (2011).
- Smets, E. M., et al. Decreased plasma levels of metastin in early pregnancy are associated with small for gestational age neonates. Prenat Diagn. 28 (4), 299-303 (2008).
- Kojima, M., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 402 (6762), 656-660 (1999).
- Stengel, A., Yin Taché, Y., Yang, the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake. J Neurogastroenterol Motil. 18 (2), 138-149 (2012).
- Inhoff, T., et al. Desacyl ghrelin inhibits the orexigenic effect of peripherally injected ghrelin in rats. Peptides. 29, 2159-2168 (2008).
- Hirayama, H., et al. Contrasting effects of ghrelin and des-acyl ghrelin on the lumbo-sacral defecation center and regulation of colorectal motility in rats. Neurogastroenterol Motil. 22 (10), 1124-1131 (2011).
- Horikoshi, Y., et al. Dramatic elevation of plasma metastin concentrations in human pregnancy: metastin as a novel placenta-derived hormone in humans. J Clin Endocrinol Metab. 88 (2), 914-919 (2003).
- Yang, Y. U., Xiong, X. Y., Yang, L. I., Xie, L., Huang, H. Testing of kisspeptin levels in girls with idiopathic central precocious puberty and its significance. Exp Ther Med. 9 (6), 2369-2373 (2015).
- Hosoda, H., Kojima, M., Matsuo, H., Kangawa, K. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun. 279 (3), 909-913 (2000).
- Raff, H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 21 (2), 159-161 (2003).
- Evans, M. J., Livesey, J. H., Ellis, M. J., Yandle, T. G. Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones. Clin Biochem. 34 (2), 107-112 (2001).
- Nabuchi, Y., Fujiwara, E., Kuboniwa, H., Asoh, Y., Ushio, H. The stability and degradation pathway of recombinant human parathyroid hormone: deamidation of asparaginyl residue and peptide bond cleavage at aspartyl and asparaginyl residues. Pharm Res. 14 (12), 1685-1690 (1997).
- White, A., Handler, P., Smith, E. L. Principles of Biochemistry. , 5th ed, McGraw-Hill Book Co. New York. (1973).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。