Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode rapide pour le traitement du sang pour augmenter le rendement des niveaux peptidiques plasma dans le sang humain
Dans cet article
Résumé
La méthode de traitement du sang RAPID peut être utilisé chez l'homme et donne des niveaux de peptides plus élevés ainsi que permet l'évaluation de la forme moléculaire correct. Par conséquent, cette méthode sera un outil précieux dans la recherche de peptide.
Résumé
La recherche dans le domaine de la régulation de la prise alimentaire gagne en importance. Cela comprend souvent la mesure des peptides de régulation de la prise alimentaire. Pour la détermination correcte de la concentration d'un peptide, il doit être stable au cours du traitement du sang. Cependant, ceci est pas le cas de plusieurs peptides qui sont rapidement dégradés par les peptidases endogènes. Récemment, nous avons développé une méthode de traitement du sang en utilisant des températures de R, A cidification éduqué, P rotease inhibition, je sotopic contrôles exogènes et ilution D (RAPID) pour l'utilisation chez les rats. Ici, nous avons établi cette technique pour l'utilisation chez l'homme et étudié la récupération, la forme moléculaire et concentration circulante d'hormones de régulation de la prise alimentaire. La méthode RAPID a considérablement amélioré la récupération pour 125 I-marqué somatostatine-28 (+ 39%), le glucagon-like peptide-1 (+ 35%), acyl ghréline et de glucagon (+ 32%), l' insuline et kisspeptin (+ 29% ) nesfatine-1 (+ 28%), la leptine(+ 21%) et le peptide YY 3-36 (+ 19%) par rapport à un traitement standard (EDTA de sang sur la glace, p <0,001). chromatographie en phase liquide à haute performance a montré l'élution endogène acyl ghréline à la position attendue après le traitement RAPID, alors qu'après traitement standard 62% des acyl ghréline ont été dégradés résultant en un pic plus tôt représentant probablement désacyl ghréline. Après le traitement RAPID le rapport de la ghréline acyl / désacyl dans le sang des sujets de poids normal est de 1: 3 par rapport à 1h23 suivant le traitement standard (p = 0,03). Aussi les niveaux kisspeptin endogènes étaient plus élevés après RAPID par rapport à un traitement standard (+ 99%, p = 0,02). Le procédé de traitement rapide de sang peut être utilisé chez les humains, on obtient des niveaux élevés de peptides et permet d'évaluer la forme moléculaire correcte.
Introduction
Compte tenu de la prévalence croissante de l' obésité dans le monde 1,2, la recherche dans le domaine de la régulation de la prise alimentaire gagne en importance. Alors que jusqu'à présent un seul peptide est connu qui est produit et périphériquement à action centrale pour stimuler la prise alimentaire, à savoir la ghréline 3, dans les dernières décennies, un large éventail de peptides a été identifié réduire l' apport alimentaire, par exemple. la leptine, le peptide YY (PYY) et aussi glucagon-like peptide-1 (GLP-1) et de l' insuline 4, donc, dans les études portant sur les mécanismes de régulation des niveaux de la faim et de satiété peptidiques sont souvent évaluées et en même temps, il est supposé que le peptide étudié est stable et récupéré à des rendements élevés pendant la formation de plasma. Cependant, très souvent , ce n'est pas le cas en raison de pannes endogène rapide comme indiqué précédemment pour par exemple. ghréline qui est dégradé parmi les groupes acyle à 5 DÉSACYL ghréline. Par conséquent, nous avons décrit récemment la méthode RAPID pour procesus de sangchanter dans des rats employant des températures de R, A cidification éduqué, P rotease inhibition, je sotopic contrôles exogènes et D ilution 6. Cette méthode a amélioré la récupération pour 11 des 12 peptides testés et autorisés pour la détermination de la forme moléculaire de circulation correcte par rapport au traitement du sang standard (sang EDTA sur la glace) 6. Cette méthode a été utilisée dans plusieurs études ultérieures 7-12 pour la détection de la ghréline en circulation, ainsi que le facteur de libération de corticotrophine 13. Par conséquent, le procédé se sont révélées utiles pour la recherche de peptides chez les rongeurs. Cependant, étant donné que les études sur les rongeurs ne sont pas toujours traduisible à une autre espèce, le procédé doit être mis en place pour l'utilisation dans le sang humain.
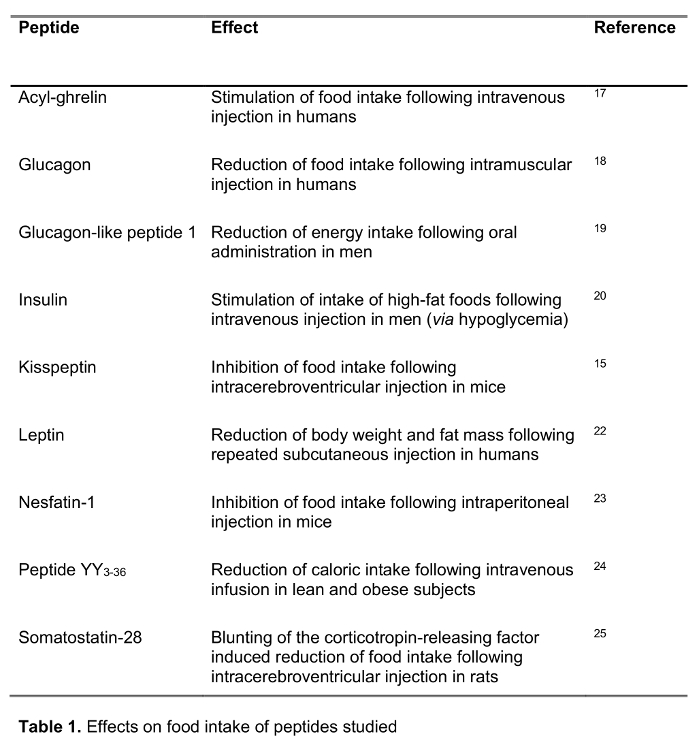
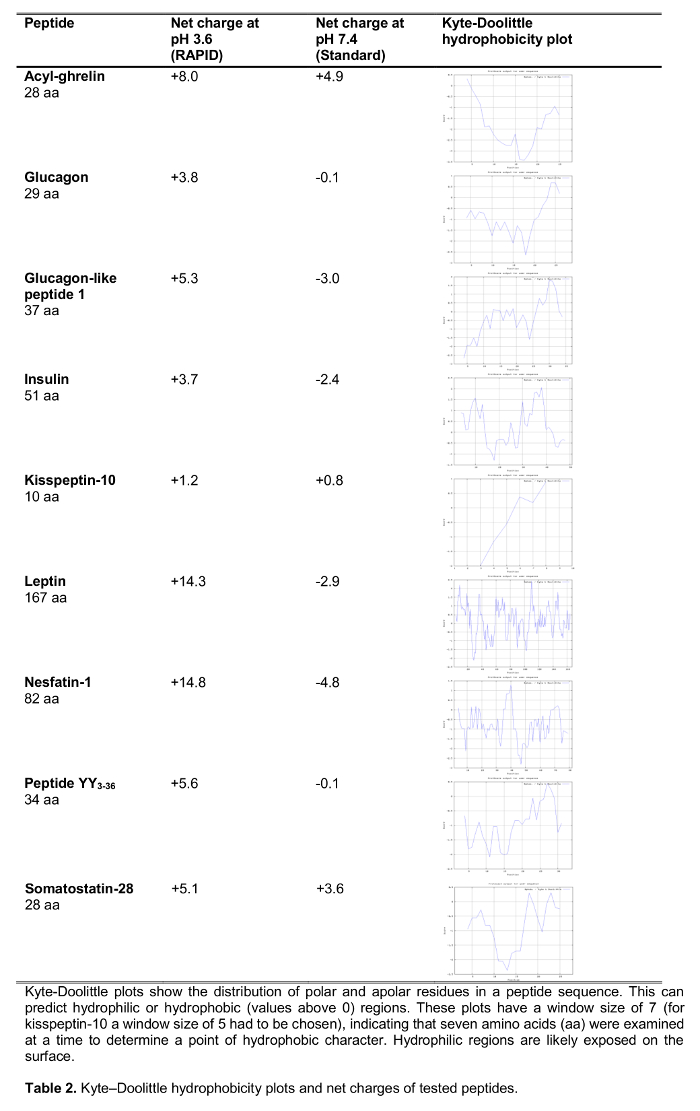
Le but de la présente étude était de tester la méthode RAPID pour le traitement du sang chez l' homme par rapport au traitement du sang standard, le sang EDTA sur la glace, qui est largement recommandé 14 et fréquemment used dans le cadre ainsi que de la recherche clinique. Nous avons testé la reprise d'une sélection de 125 peptides I marqués impliqués dans la régulation de la prise alimentaire , y compris des peptides établis ainsi que de nouveaux candidats ont récemment suggéré de jouer un rôle dans l' alimentation régulation (effets sur la consommation alimentaire sont présentés dans le tableau 1) traitement suivant avec les deux méthodes. Hormones ont également été choisis pour représenter les peptides de longueur et de charge (tableau 2) différent. En outre, pour la ghréline, nous avons étudié la forme moléculaire (s) suivant la méthode standard et RAPID. Enfin, nous avons évalué la ghréline endogène (acyl et désacyl ghréline), ainsi que les niveaux de kisspeptin, un peptide aussi récemment proposé de jouer un rôle dans la régulation de la prise alimentaire 15,16 après traitement rapide ou standard. En outre, nous avons également étudié ces niveaux de peptides dans une population de sujets avec un large éventail de l' indice de masse corporelle (allant de 10,2 à 67,6 kg à partir de / m 2) pour étudier possibLe différences liées au poids corporel chroniquement modifié.
Diagnostic, évaluation et plan:
participants à l'étude
Tous les participants à l'étude ont été nouvellement patients hospitalisés (inclusion était dans les deux jours suivant l'admission à l'hôpital) de la Division de médecine psychosomatique à Charité-Universitätsmedizin Berlin et ont donné leur consentement éclairé écrit. Afin d'éviter tout impact du genre que les patientes ont été incluses. Un total de 42 sujets ont participé à cette étude et ont été divisés en trois groupes: un poids normal (IMC de 18,5 à 25 kg / m 2, n = 12), l' anorexie mentale (IMC <17,5 kg / m 2, n = 15) et de l' obésité (BMI> 30 kg / m 2, n = 15). Anorexic et les patients obèses étaientdiagnostiquée selon la Classification internationale des maladies-10 et hospitalisés pour un gain de poids (anorexie mentale) ou la réduction du poids (obésité), respectivement. Tous les patients de poids normal ont été hospitalisés exclusivement en raison de symptômes somatoformes sans troubles somatiques pertinents. Les patients présentant des symptômes somatoformes gastro-intestinaux ou des antécédents de chirurgie gastro-intestinale ont été exclus. Les critères d'exclusion également inclus un âge <18 ans, la grossesse actuelle et les maladies psychotiques non traitées. La collecte de sang a été effectuée sur 2 ou 3 jours après l'admission à l'hôpital avant de recevoir un traitement diététique afin d'augmenter ou de réduire le poids corporel, respectivement. paramètres anthropométriques ont été évalués sur le même jour.
Protocole
Le protocole a été approuvé par le comité d'éthique local pour la recherche humaine (numéro de protocole EA1 / 114/10).
Traitement 1. Blood
- Recueillir le sang veineux 7:00-08h00 après une nuit dans une veine et le processus avant-bras selon la procédure standard ou la méthode RAPID. Instruire les sujets à ne pas exercer ou de fumée avant le retrait de sang.
- Pour le traitement standard, recueillir le sang dans des tubes contenant de l'EDTA réfrigérés et centrifuger à moins de 10 min à 3000 xg pendant 10 min à 4 ° C. Recueillir le surnageant et conserver à -80 ° C jusqu'à ce que le traitement ultérieur par radioimmunoessai.
- Pour le traitement rapide, on dilue immédiatement le sang (à moins de 1 min après le retrait du sang) 1:10 dans un tampon glacé (pH 3,6) contenant 0,1 M d'acétate d'ammonium, 0,5 M de NaCl et des inhibiteurs d'enzymes (diprotine A, E-64-d, antipaïne , la leupeptine, la chymostatine, 1 pg / ml). Ensuite, centrifuger à moins de 10 min à 3000 x g pendant 10 min à 4 ° C et on recueille le surnageant noustion d' une pipette dans des tubes en polypropylène comme détaillé avant chez les rats 6.
- cartouches de chromatographie de charge (360 mg, 55-105 pm) avec 100% d'acétonitrile (taux de 10 ml / min), équilibrent avec 0,1% de trifluoroacétate (TFA, débit 10 ml / min) et la charge avec le surnageant à un débit constant de 1 ml / min en utilisant une pompe à seringue.
- Par la suite, les cartouches de lavage avec 3 ml de TFA 0,1% (débit 10 ml / min) et éluer lentement avec 2 ml d'acétonitrile à 70% contenant 0,1% de TFA (2 ml / min).
- Des échantillons secs éluées à l'aide de centrifugation sous vide et conserver à -80 ° C jusqu'à un traitement ultérieur par radioimmunoessai.
REMARQUE: Effectuer toutes les étapes en polypropylène (traitement RAPID) et borosilicate (radioimmunoessai) tubes qui présentent surface nettement inférieure des propriétés de liaison et donc de minimiser la perte de peptide pour la plupart des peptides étudiés avant le 26.
2. mesures
REMARQUE: Les étapes de cette section doit être effectuée dans un laboratoirecertifié pour le travail avec des matières radioactives. Les précautions standard pour le travail avec 125 I doivent être prises.
- Récupération de radiomarqué Peptides
- Obtenir 125 I-peptides humains radiomarqués (par ex. Acyl-ghréline, le GLP-1, le glucagon, l' insuline, kisspeptide, la leptine, nesfatine-1, PYY3.36 et la somatostatine-28).
- Gardez peptides sous forme de poudre jusqu'à ce que l'expérience, puis fraîchement dilué dans 0,1% d'acide acétique (~ 100.000 cpm par ml).
- Pour le traitement du sang standard, directement après le retrait du sang dans EDTA réfrigérés contenant des tubes, transfert 1 ml de sang dans un tube avec 50 ul de radiomarqueur contenant 3,000-6,000 cpm (compté directement avant l'expérience commence).
- Pour un traitement rapide, le transfert 1 ml de sang d'EDTA contenant du sang dans un tube contenant 9 ml de tampon RAPID (pour la composition voir 1.3) et 500 ul radiomarqueur contenant 30,000-60,000 cpm. volume due à l'utilisation de 1:10 dilution 10 fois plus élevé de radiolabel pour le traitement RAPID.
- Ensuite, les échantillons de procédés tels que décrits dans les étapes 1.2 à 1.3.2.
- Pour les expériences de récupération, faire des échantillons non secs par centrifugation sous vide et ne pas stocker à -80 ° C. Au lieu de cela, d'évaluer la récupération des peptides marqués radioactivement directement par la suite à l'aide d'un compteur gamma.
- Mesurer l'ensemble du surnageant dans des échantillons standards, tandis que les échantillons à analyser dans RAPID 1/10 du volume total afin d'obtenir la comparabilité de la quantité de marqueur radioactif utilisé. Pour la mesure, transférer le surnageant dans des tubes ajustés dans le compteur gamma et évaluer les comptes par minute
- En tant que standard de 100%, utiliser deux échantillons avec 50 ul de 125 I-radiomarqué peptide qui ne subissent le traitement. Mesurer simultanément avec d'autres échantillons comme décrit dans 2.1.7.
- Effectuer l'expérience de cinq à six fois pour chaque peptide.
- Chromatographie liquide haute performance de radiomarqué ghréline
- Prélever le sang dans cEDTA hilled contenant des tubes et de transfert de 1 ml dans des tubes contenant 200 ul ghréline radiomarqué-acyl contenant 15.000-20.000 cpm (comptabilisés directement avant l'expérience commence).
- Pour le traitement RAPID, transférer 1 ml de sang dans un tube contenant 9 ml de tampon RAPID (pour la composition voir 1.3) et 200 ul acyl radiomarqué ghréline contenant 15.000-20.000 cpm.
- Ensuite, les échantillons de procédés tels que décrits dans les étapes 1.2 à 1.3.2.
- Pour une analyse supplémentaire par HPLC en phase inverse, charger directement des échantillons sur une colonne stable liaison C18 (2,1 mm x 50 mm, 1,8 um) équilibrée dans 17% d'acétonitrile dans de l'eau (à la fois complémenté avec 0,1% de TFA).
- Après 5 min équilibration, utilisez un gradient 17-40% d'acétonitrile pour éluer l'échantillon dans 40 min (débit de 1 ml / min débit).
- Recueillir des fractions de 1 ml par minute et à analyser la radioactivité en utilisant un compteur gamma.
- Dans une expérience séparée, la charge de 200 ul contenant un groupe acyle radiomarqué ghréline 15.000-20.000cpm sur la colonne directement et effectuer HPLC comme décrit dans les étapes 2.2.4 à 2.2.6.
- radioimmunologique
- Pour radioimmunoessai, dégeler surnageants congelés (traitement standard) et aspirer la poudre sèche (méthode RAPID) à la température ambiante.
- Immédiatement avant radioimmunoessai, remettre en suspension des échantillons RAPID secs dans le double H 2 O distillée selon le volume initial de plasma (500 pi).
- Évaluer kisspeptin et totale (y compris les désacyl et acyl ghréline), ainsi que acyl ghréline comme décrit précédemment en utilisant 12,27 radioimmunoessais commerciaux selon les protocoles du fabricant. Utiliser des tubes de borosilicate qui permettent la formation de granulés stables.
- Le premier jour, incuber les échantillons avec du tampon d'essai et l' anticorps primaire (par exemple. L' anti-ghréline) dans la dilution fourni par le fabricant pendant une période de 24 heures.
- Le deuxième jour, ajouter le traceur 125I (par exemple , 125 I-ghréline), VORTEX et laisser incuber pendant une période de 24 heures.
- Le troisième jour, ajouter le réactif de précipitation, vortex et incuber comme recommandé par le fabricant. Ensuite, des tubes de centrifugation à 3000 xg pendant 20 min à 4 ° C. Enlever le surnageant et compter la radioactivité dans les pastilles à l'aide d'un compteur gamma
- Calculer désacyl ghréline comme la différence du nombre total ghréline moins acyle. Évaluer le rapport de la ghréline acyl / désacyl en divisant acyl par désacyl ghréline pour chaque échantillon individuel.
- Traiter tous les échantillons - si possible - en un seul lot pour éviter la variabilité inter-essai. La variabilité intra-essai dans la présente expérience était <8% pour kisspeptin, <7% pour le total et <9% pour les acyl ghréline.
3. Analyse statistique
- Déterminer la répartition des données en utilisant le test de Kolmogorov-Smirnov. Exprimez données comme moyenne ± erreur type de la moyenne (SEM).
- Évaluer les différences entre les deuxgroupes par le test t. Évaluer les différences entre plusieurs groupes par tous les multiples procédures de paires de comparaison (test Tukey post hoc) ou ANOVA à deux voies suivies par la méthode Holm-Sidak.
- Considérons p <0,05 significative et effectuer des analyses en utilisant un programme de statistiques.
Résultats
Le traitement du sang rapide augmente le rendement de 125 peptides I radiomarqués dans le sang humain par rapport au traitement du sang standard.
Après le traitement du sang standard (EDTA sang sur de la glace), la récupération des peptides radiomarqués était d' environ 60% en peptides (9/9 allant 48-68%, la Figure 1A - K). Le traitement rapide a amélioré le rendement dans tous les 125 peptides I marqués, à savo...
Discussion
Nous avons signalé avant que la méthode RAPID pour le traitement du sang a amélioré la récupération des 11/12 peptides par rapport à un traitement sanguin standard chez le rat 6. Dans la présente étude, nous avons montré que cette méthode est également approprié pour l'utilisation chez l'homme. Après un traitement rapide, la reprise pour 9 de 9 125 peptides I marqués testé a été améliorée par rapport à un traitement de sang standard (EDTA de sang sur la glace). L'am...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par la Fondation allemande pour la recherche STE 1765 / 3-1 (AS) et le ministère allemand de l'éducation et de la recherche 03IPT614A (CG). Nous remercions Reinhard Lommel et Petra Buße pour leur excellent support technique, ainsi que Karin Johansson et Christina Hentzschel de l'aide à l'organisation et l'exécution des mesures anthropométriques
matériels
| Name | Company | Catalog Number | Comments |
| Diprotin A | Peptides International, Louisville, KY, USA | IDP-4132 | |
| E-64-d | Peptides International, Louisville, KY, USA | IED-4321-v | |
| Antipain | Peptides International, Louisville, KY, USA | IAP-4062 | |
| Leupeptin | Peptides International, Louisville, KY, USA | ILP-4041 | |
| Chymostatin | Peptides International, Louisville, KY, USA | ICY-4063 | |
| Sep-Pak C18 cartridges | Waters Corporation, Milford, MA, USA | WAT051910 | 360 mg, 55-105 µm |
| Acyl-ghrelin | Millipore, Billerica, MA, USA | 9088-HK | Radioactive |
| GLP-1 | Millipore, Billerica, MA, USA | 9035-HK | Radioactive |
| Glucagon | Millipore, Billerica, MA, USA | 9030 | Radioactive |
| Insulin | Millipore, Billerica, MA, USA | 9011S | Radioactive |
| Leptin | Millipore, Billerica, MA, USA | 9081-HK | Radioactive |
| Kisspeptin-10 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-048-56 | Radioactive |
| Nesfatin-1 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-003-26 | Radioactive |
| PYY3-36 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-059-02 | Radioactive |
| Somatostatin-28 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-060-16 | Radioactive |
| ZORBAX Rapid Resolution HT SB-C18 column | Agilent Technologies, Santa Clara, CA, USA | 822700-902 | 2.1 mm x 50 mm, 1.8 µm |
| Agilent 1200 LC | Agilent Technologies, Santa Clara, CA, USA | HPLC, several components, therefore no single catalog number | |
| Kisspeptin RIA | Phoenix Pharmaceuticals, Burlingame, CA, USA | # RK-048-56 | Radioactive |
| Total ghrelin RIA | Millipore, Billerica, MA, USA | # GHRT-89HK | Radioactive |
| Active ghrelin RIA | Millipore, Billerica, MA, USA | # GHRA-88HK | Radioactive |
| SigmaStat 3.1 | Systat Software, San Jose, CA, USA | online download |
Références
- Finucane, M. M., et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 377 (9765), 557-567 (2011).
- James, W. P. The epidemiology of obesity: the size of the problem. J Intern Med. 263 (4), 336-352 (2008).
- Stengel, A., Taché, Y. Gastric peptides and their regulation of hunger and satiety. Curr Gastroenterol Rep. 14 (6), 480-488 (2012).
- Hussain, S. S., Bloom, S. R. The regulation of food intake by the gut-brain axis: implications for obesity. Int J Obes (Lond). 37 (5), 625-633 (2013).
- Hosoda, H., et al. Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples). Clin Chem. 50 (6), 1077-1080 (2004).
- Stengel, A., et al. The RAPID method for blood processing yields new insight in plasma concentrations and molecular forms of circulating gut peptides. Endocrinology. 150 (11), 5113-5118 (2009).
- Stengel, A., et al. Lipopolysaccharide differentially decreases plasma acyl and desacyl ghrelin levels in rats: Potential role of the circulating ghrelin-acylating enzyme GOAT. Peptides. 31 (9), 1689-1696 (2010).
- Stengel, A., et al. Cold ambient temperature reverses abdominal surgery-induced delayed gastric emptying and decreased plasma ghrelin levels in rats. Peptides. 31, 2229-2235 (2010).
- Stengel, A., et al. Central administration of pan-somatostatin agonist ODT8-SST prevents abdominal surgery-induced inhibition of circulating ghrelin, food intake and gastric emptying in rats. Neurogastroenterol Motil. 23 (7), e294-e308 (2011).
- Stengel, A., et al. Abdominal surgery inhibits circulating acyl ghrelin and ghrelin-O-acyltransferase levels in rats: role of the somatostatin receptor subtype 2. Am J Physiol Gastrointest Liver Physiol. 301, G239-G248 (2011).
- Wang, L., et al. Intravenous injection of urocortin 1 induces a CRF2 mediated increase in circulating ghrelin and glucose levels through distinct mechanisms in rats. Peptides. 39, 164-170 (2013).
- Goebel-Stengel, M., Stengel, A., Wang, L., Taché, Y. Orexigenic response to tail pinch: role of brain NPY(1) and corticotropin releasing factor receptors. Am J Physiol Regul Integr Comp Physiol. 306 (3), R164-R174 (2014).
- Goebel, M., Stengel, A., Wang, L., Reeve, J., Taché, Y. Lipopolysaccharide increases plasma levels of corticotropin-releasing hormone in rats. Neuroendocrinology. 93 (3), 165-173 (2011).
- Banfi, G., Salvagno, G. L., Lippi, G. The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med. 45 (5), 565-576 (2007).
- Stengel, A., Wang, L., Goebel-Stengel, M., Taché, Y. Centrally injected kisspeptin reduces food intake by increasing meal intervals in mice. Neuroreport. 22 (5), 253-257 (2011).
- De Bond, J. A., Smith, J. T. Kisspeptin and energy balance in reproduction. Reproduction. 147 (3), R53-R63 (2014).
- Wren, A. M., et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 86 (12), 5992 (2001).
- Schulman, J. L., Carleton, J. L., Whitney, G., Whitehorn, J. C. Effect of glucagon on food intake and body weight in man. J Appl Physiol. 11 (3), 419-421 (1957).
- Steinert, R. E., Poller, B., Castelli, M. C., Drewe, J., Beglinger, C. Oral administration of glucagon-like peptide 1 or peptide YY 3-36 affects food intake in healthy male subjects. Am J Clin Nutr. 92 (4), 810-817 (2010).
- Dewan, S., et al. Effects of insulin-induced hypoglycaemia on energy intake and food choice at a subsequent test meal. Diabetes Metab Res Rev. 20 (5), 405-410 (2004).
- Schlogl, M., et al. Increased 24-hour ad libitum food intake is associated with lower plasma irisin concentrations the following morning in adult humans. Appetite. 90, 154-159 (2015).
- Heymsfield, S. B., et al. Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial. JAMA. 282 (16), 1568-1575 (1999).
- Shimizu, H., et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 150, 662-671 (2009).
- Batterham, R. L., et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med. 349 (10), 941-948 (2003).
- Shibasaki, T., et al. Antagonistic effect of somatostatin on corticotropin-releasing factor-induced anorexia in the rat. Life Sci. 42 (3), 329-334 (1988).
- Goebel-Stengel, M., Stengel, A., Taché, Y., Reeve, J. R. The importance of using the optimal plasticware and glassware in studies involving peptides. Anal Biochem. 414 (1), 38-46 (2011).
- Smets, E. M., et al. Decreased plasma levels of metastin in early pregnancy are associated with small for gestational age neonates. Prenat Diagn. 28 (4), 299-303 (2008).
- Kojima, M., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 402 (6762), 656-660 (1999).
- Stengel, A., Yin Taché, Y., Yang, the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake. J Neurogastroenterol Motil. 18 (2), 138-149 (2012).
- Inhoff, T., et al. Desacyl ghrelin inhibits the orexigenic effect of peripherally injected ghrelin in rats. Peptides. 29, 2159-2168 (2008).
- Hirayama, H., et al. Contrasting effects of ghrelin and des-acyl ghrelin on the lumbo-sacral defecation center and regulation of colorectal motility in rats. Neurogastroenterol Motil. 22 (10), 1124-1131 (2011).
- Horikoshi, Y., et al. Dramatic elevation of plasma metastin concentrations in human pregnancy: metastin as a novel placenta-derived hormone in humans. J Clin Endocrinol Metab. 88 (2), 914-919 (2003).
- Yang, Y. U., Xiong, X. Y., Yang, L. I., Xie, L., Huang, H. Testing of kisspeptin levels in girls with idiopathic central precocious puberty and its significance. Exp Ther Med. 9 (6), 2369-2373 (2015).
- Hosoda, H., Kojima, M., Matsuo, H., Kangawa, K. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun. 279 (3), 909-913 (2000).
- Raff, H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 21 (2), 159-161 (2003).
- Evans, M. J., Livesey, J. H., Ellis, M. J., Yandle, T. G. Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones. Clin Biochem. 34 (2), 107-112 (2001).
- Nabuchi, Y., Fujiwara, E., Kuboniwa, H., Asoh, Y., Ushio, H. The stability and degradation pathway of recombinant human parathyroid hormone: deamidation of asparaginyl residue and peptide bond cleavage at aspartyl and asparaginyl residues. Pharm Res. 14 (12), 1685-1690 (1997).
- White, A., Handler, P., Smith, E. L. . Principles of Biochemistry. , (1973).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon