Method Article
心肌细胞DNA的合成和倍性的同时评价:一个方法来帮助心肌细胞再生和营业额的量化
摘要
Quantification of cardiomyocyte turnover is challenging. The protocol described here makes an important contribution to this challenge by enabling accurate and sensitive quantification of neo-cardiomyocyte nuclei generation and nuclei ploidy.
摘要
虽然公认的事实是心脏有潜力有限再生正常老化过程中损伤后心肌细胞和心肌细胞的营业额水平低发生,这些事件的定量仍然具有挑战性。这部分是由于该方法的稀有和事实,即多个蜂窝源向心肌维修。此外,心肌细胞内的DNA复制往往导致多倍体心肌和很少导致通过细胞分裂新的心肌细胞。为了准确地量化这些过程之间的心肌细胞周转歧视是必不可少的。这里描述的协议采用长期核苷的标签,以标示它已出现的利用核隔离和随后的PCM1免疫标记识别DNA复制和心肌细胞核的结果全部核。一起这允许C的核苷标签的准确和灵敏的识别ardiomyocyte核人口。此外,4',6-二脒基-2-苯基标签和细胞核倍性的分析,使新的心肌细胞核的从中多倍体中已掺入的核苷细胞核的鉴别。虽然这种方法不能用于心肌binucleation控制,它允许新的心肌细胞核的快速和强大的量化而占多倍体。这种方法具有许多下游应用包括评估潜在的治疗剂,以提高心肌再生或调查心脏疾病的心肌周转和倍性的影响。该技术也与附加的下游免疫组织学技术,允许核苷掺入定量在所有的心脏细胞类型相容。
引言
近年来出现了质疑的证据的假设,心脏是终末分化,有丝分裂后的器官1,2的积累。然而,心肌营业额和再生的量化仍然具有挑战性。
在使用标准的免疫组化技术精确识别罕见的心肌产生的困难以及报告3。此外,心肌细胞产生的细胞来源仍然不明朗与由心肌细胞增殖以及由干细胞分化4-6作出贡献的证据。因此,使用其中所需要的心肌祖细胞表型的知识谱系追踪模式是不可能的,并在一个单一的人口,包括心肌细胞增殖的定量,是不合适的。此外心肌细胞具有无有丝分裂为endoreplication的电位(导致多倍体车diomyocyte)或在没有胞质(导致双核心肌)7,8的有丝分裂。心肌营业额的准确定量依赖于这些事件和真正的新的心肌细胞生成之间分辨能力。这产生独特的并发症,因为DNA复制和细胞周期蛋白依赖性激酶的表达在心肌细胞不完全证明真正细胞分裂9,10。
为了协助新心肌生成的量化,如由贝格曼等 7,11与长期的新颖方法中所述,我们已经联合建立核隔离技术,和pericentriolar材料1(PCM1),用于心肌细胞核识别的免疫标记DNA标记和倍体分析。 PCM-1是积聚在分化的,非循环细胞的核表面上的中心体蛋白质。以前的研究已经表明,对抗体PCM-1特异性标记心肌细胞核7,11,因此PCM1已被用于由多个独立组来识别心肌1,12,13。此外,我们已经表明,PCM1表达映射到肌钙蛋白-CRE转基因小鼠模型14( 补充图1)遗传标记的心肌细胞核。
这里所描述的协议使得不论该细胞起源( 图1A和B),而同时排除核苷标签由于从分析( 图1C和D)多倍体新心肌细胞核产生的在小鼠心脏的精确和灵敏的识别。虽然这种方法不能用于心肌binucleation控制,它允许这是需要的心肌细胞周转的精确定量新心肌细胞核的快速和强大的定量。此外,它提供了一个快速筛选工具,以评估在心肌细胞产生的动态电位变化。
而DNA标记通常涉及将5-溴-2'-脱氧尿苷(BrdU)标记作为胸苷类似物,这里所描述的协议使用,因为它需要一个更迅速更少的处理步骤的5-乙炔基-2'-脱氧尿苷(EDU)基于测定通过量和不需要的DNA进行免疫检测的变性,使它与其他免疫染色的协议,从而增加了该方法的潜在的下游应用相兼容。
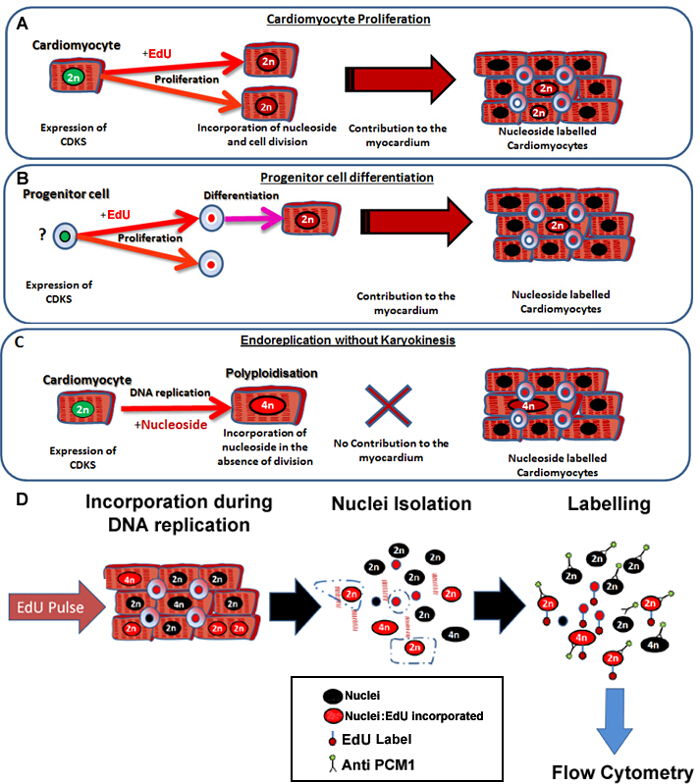
图1: 连续脉冲用EdU标签新的心肌细胞,不论其祖细胞 。 (A)的EdU掺入心肌细胞分裂过程中DNA的。增殖心肌人口将resul吨心肌的增加,或更换,因此是生产性的DNA合成(有助于组织维持和修复)。 (B)中的EdU被掺入心脏祖细胞的细胞分裂过程中的DNA。这将在细胞分化为心肌细胞谱系期间被保留。这种干细胞分化也将导致增加心肌细胞的数目,因此,有助于组织维护和修理。 (C)的心肌细胞均经过导致增加的心肌细胞的倍性,这是与心肌细胞肥大和心肌重塑相关的"非生产"DNA复制的潜能,但不替换丢失的心肌细胞。多倍体的方法,从binucleation不同,因为它导致心肌细胞与含有四个或更多组两条同源染色体(> 2N)的单核。 (D)继连续细胞核pulse,该协议描述了PCM1表达心肌细胞核的核分离和鉴定,使双方心肌套数和掺入的EdU量化。 PCM1表达,用流式细胞仪检测的EdU掺入。 请点击此处查看该图的放大版本。
研究方案
动物工作授权和纽卡斯尔大学伦理委员会的批准。所有动物的程序进行,符合从2010年指令欧洲议会/ 63 / EU的指导原则上用于科学目的的动物的保护。
1.管理的EdU
- 在无菌盐水中的溶液溶解的EdU(0.9%重量/体积)以12.5毫克/毫升的最终浓度。
- 加热该溶液至40℃,并涡旋以完全溶解。储存足够的教育/盐水在4℃注入所有小鼠在研究允许每天注射6。
注意:通常在6只小鼠都需要每个实验组。然而,功率计算应独立研究完成。
- 加热该溶液至40℃,并涡旋以完全溶解。储存足够的教育/盐水在4℃注入所有小鼠在研究允许每天注射6。
- 称量单个小鼠。计算所需的体积施用100微克/克的学科/生理盐水溶液,以每只小鼠(8微升每克库存的EdU溶液)。
- 得出相应的volum教育/生理盐水电子与将25g针头注射器胰岛素。
- 在处理使用经批准的家庭办公室技术小鼠腹腔内执行(ip)注射。
- 放置在笼盖鼠标。轻轻地向后拉动尾部的基础上,并颈背紧紧抓住鼠标。
- 通过按住鼠标用食指和拇指头的根部附近和向后倾翻动物的头朝向地板暴露于注射腹部。
- 擦拭用70%酒精溶液腹部。找到动物的中线和右下象限。注入学科/盐溶液到动物到右下象限。
- 注射小鼠用EdU /生理盐水溶液,并记录每天的时间。
- 在一天的同一时间重复步骤1.2至1.4,连续6天。
注意:作为一个的EdU阴性对照是设置为流式细胞仪分析的门控需要,注入额外的年龄,性别和实验匹配编小鼠用生理盐水等体积的无的EdU。这将提供所需的控制(没有的EdU控制)。这种控制应包括为每个研究,以便在试剂批次变化和流式细胞仪成立。
2.心收获
- 在第 6 次的EdU注射后24小时,用牺牲颈椎脱位(或替代附表1民政厅批准的方法)小鼠。
- 将牺牲动物仰卧位,并从中期腹部手术剪隔膜使皮肤切口。
- 切割膜片,和从体腔保持胸骨远,切断双侧暴露心脏。
- 轻轻抬起心脏并切断流出道的大血管解剖的心脏出了胸腔。
- 立即将每个心脏中含有10ml个体15ml离心管的PBS冷却至4℃。
- 传输心中SEP独的10cm陪替皿,用手术刀切成各两个心脏在矢状方向和用一对镊子轻轻挤压洗心脏。然后更换PBS除去尽可能多的血越好。重复此步骤两次。
- 将每个心脏的两个部分为同一个人的1.5 ml离心管。
- 继续到步骤3或备选存储标本-80℃如在步骤2.9和2.10详述。
- 使用地下25针,使离心管盖了一个小洞,以防止开盖因气体膨胀时,被处理的心脏。
- 标记每个微量离心管中并发生在液氮的容器冻结。
3.核解离和心肌细胞核标签
注:此细胞核分离和心肌细胞核标记是从贝格曼等人的改编11注射所有样品执行此过程。用EdU和生理盐水(无控制的EdU)阴性对照。 表1为执行这些步骤所需的解决方案的良方。
- 对于要分析的每个心脏,放置36毫升的1%BSA / PBS溶液到超速离心管,温育30分钟,弃去溶液,然后风干。
注意:此管在步骤3.6中使用。 - 将个人心中冻结在上用手术刀让心中在切碎过程中解冻的冰切末10毫米盘。
- 放置剁碎心入15 ml的细胞裂解缓冲液在50毫升离心管中,并在室温下以25,000rpm下与探针均化器均化15秒。
- 添加另外15 mL细胞裂解缓冲液的离心管,并转移到取40ml DOUNCE具有大间隙杵。用杵执行10笔,并通过100微米,然后40微米的细胞滤网过滤到50ml离心管中。
- 离心10分钟T对于4℃700 XG,去除上清。
- 重悬在25毫升蔗糖梯度溶液的核颗粒和层中包含的10毫升在3.1编写超速离心管的新鲜蔗糖梯度液上层溶液细胞核。
- 离心机13,000 XG 1小时在4℃使用摆动出管转子。
- 以下离心,弃去上清,重悬在1300微升细胞核存储缓冲器的细胞核沉淀在1.5ml微量离心管中,并标记PCM1。
- 除去300微升该悬浮液到一个新的离心管中,并加入到700微升新鲜晶核存储缓冲液中。标签此管作为ISO控制。
- 添加抗PCM1在8微克/毫升到标PCM1离心管的终浓度,并在8微克/毫升到标ISO控制离心管的浓度添加兔IgG同种型对照抗体。
- 在4℃孵育过夜。继incub通货膨胀,离心机在700×g离心10分钟,弃去上清液,用1ml新鲜细胞核存储缓冲器,悬浮和离心的再次在700×g下10分钟更换。弃去上清液并用1ml新鲜细胞核存储缓冲器的替换。
- 加入1μl的F(ab')山羊抗兔IgG(H + L)抗体(FITC或等效绿色荧光色素)的2片段来实现的2微克/毫升的最终浓度。
注意:使用的F(ab')2片段抗体减小为免疫细胞,包括巨噬细胞和B细胞的非特异性标记的潜力。 - 在铝箔包裹管,以从光保护和孵育在4℃下1小时。
4.掺入的EdU检测
- 稀的10倍浓缩的EdU反应缓冲液1:10与去离子水。
- 离心机在PCM-1,并在700×g离心10分钟,ISO控制标记的细胞核的悬浮液,弃去上清,重悬所述细胞核沉淀在1ml的1%BSA / PBS溶液。洗细胞核沉淀两次。
- 最后一次洗涤后,弃去上清,用100μl的EdU固定液替换。
- 包裹管中铝箔从光以保护并在室温下孵育15分钟。
- 在700 xg离心用1ml的1%BSA / PBS溶液,离心机的洗涤样品两次,并在室温下用1×基于皂苷透化溶液进行15分钟孵育。
- 制备1×的EdU标记混合物( 表2)。 2反应至少将需要包括没有的EdU的控制。
- 加入500μl1X的EdU标记鸡尾酒直接向已经含有在100μl1×基于皂苷透化溶液的细胞核各样品并在室温下保护光30分钟孵育。
- 离心机在700 xg离心,重悬在1ml的1%BSA / PBS中,并重复此步骤两次。
- 离心机在700 XG,弃去上清液,用4取代00微升DNA染色溶液(见材料表 )。
| 试剂的命名 |
| 1.细胞裂解液 |
| 0.32M蔗糖 |
| 的10mM的Tris-HCl(pH值= 8) |
| 5毫米氯化钙2 |
| 5毫米醋酸镁 |
| 2.0毫摩尔EDTA |
| 0.5毫米EGTA |
| 1毫摩尔DTT |
| 2.Sucrose梯度解决方案 |
| 2.1蔗糖 |
| 的10mM的Tris-HCl(pH值= 8) |
| 5毫米醋酸镁 |
| 1毫摩尔DTT |
| 3.核存储缓冲区(NSB) |
| 0.44蔗糖 |
| 的10mM的Tris-HCl(pH值= 7.2) |
| 70毫米氯化钾 |
| 10毫米氯化镁2 |
| 1.5毫米精胺 |
表1: 核分离缓冲液成分配方在协议第3条(核解离和心肌细胞核标签)中使用的所有缓冲区。
5.流式细胞仪分析
注意:如前面所述-7,11,15-孤立核流式细胞仪进行流量。
- 首先,创建一个描述前向散射(FSC)和侧向散射(SSC),允许核碎片( 图2A)的歧视情节。
- 创建情节通过绘制4以鉴别从聚集体( 图2B)单核',6-二脒基-2-苯基)吲哚(DAPI)区域(3-405 / 450/50 A)与高度(33-405 / 450 / 50-H)。确保塔T中的3-405 / 450/50的信号收集的线性度,让正确判断DNA含量。
- 创建VS SSC描述535分之488/ 30-A中的曲线图(PCM-1)和,以评估在单线人口的PCM-1的表达显示在5.2创建的单峰门唯一的事件。
- 为了建立一个PCM-1正栅极( 图2C)运行同种型对照样品。运行PCM1少量标记的样品,以验证PCM1表达人口和门控位置。
- 创建描述SSC-A对四百五分之四百○五/ 50- A(检测DAPI)的阴谋。在这个情节,只显示单线PCM1表达核,使用5.3创建的大门。此图来创建一个只包含2N的细胞核( 图2D)的额外层次大门。
- 创建描述535分之488/ 30-A对1-633 / 660/20-A到允许表达心肌细胞群的PCM1的标签的EdU的鉴定曲线。只显示这是单线,P核 CM1 +和2N使用上述门控。
- 从没有控制的EdU心脏运行样品来设置这些EDU正栅极( 图2E)。创建的EdU +细胞适当的大门。
- 记录和量化单峰,已掺入的EdU PCM-1表达,2N的细胞核。
- 计算这个人口占总单峰,PCM1 +核的百分比。这将提供新心肌细胞核产生的速率,在7天的EdU脉冲期间,由于总心肌细胞核的百分比。
注意:作为DAPI与DNA结合是化学计量的荧光强度正比于DNA的量。确定倍性基于所述四百五十零分之四百零五/ 50-的信号的强度,如前面7所述。 - 为了评估总心肌细胞群内的套数用成立于5.5的情节和基于DNA浓度7门控策略。
/files/ftp_upload/53979/53979fig2.jpg"/>
图2:门控策略,量化心肌掺入的EdU和套数 (A)原子核是由碎片基于前向散射(FSC)和侧向散射(SSC)歧视。 (B)中,创建一个线性栅极和单核人口是基于DAPI标记和405/450/50高度VS区域信号识别。 (C)的荧光门控使心肌细胞核(PCM-1阳性)和非心肌细胞(PCM-1阴性)晶核从心脏组织的分离。 (D)的DAPI信号的强度被用来确定DNA浓度和PCM1 +心肌细胞群的从而细胞核倍性。在小鼠>心肌细胞核的80%是二倍体(2N)。 (E)荧光门使2N的分离,这从2N纳入埃杜(PCM + / EDU + = 0.9%),心肌细胞核,这些都没有纳入心肌的EdU(PCM +埃杜)。所有步骤在协议5.0中详述。从MDX显示示例-在C57 / BL10背景/ Y小鼠请点击此处查看该图的放大版本。
结果
这种方法允许增加的EdU掺入的量化由于心肌细胞核分裂,同时控制增加多倍体化。使用基于BrdU的测定中,我们以前表明,在哺乳动物心脏响应慢性心肌损失,在杜兴氏肌营养不良的mdx小鼠模型中,用新的心肌细胞再生。我们用在这里描述的进一步验证我们公布调查结果,并证明该协议的效用的方法。按照描述的协议;成人(12周龄) 的mdx和控制BL10小鼠致敏以每天注射1的EdU的7天,先前报道以允许实验组5,13之间静态分析。脉冲心中的免疫组化分析表明PCM1的表达已纳入埃杜( 图3A)心肌细胞的存在。然而,所获得的数据全光照免疫组化摹方法可以被误解,因为它已纳入的EdU其他细胞类型可以被误判为心肌细胞。这样的一个例子是表现在补充图1A和B。此外免疫组化方法不区分核分裂多倍体化。流式细胞术在这个协议详细的分析流程能够在MDX和对照组小鼠心肌细胞核分裂的快速定量,同时排除其已将的EdU因多倍体细胞。类似于先前公布的数据13,分析结果显示在mdx小鼠心脏增加新心肌细胞核代的比率相比,年龄匹配的对照组(1.2%和0.17%; 图3B和C)。
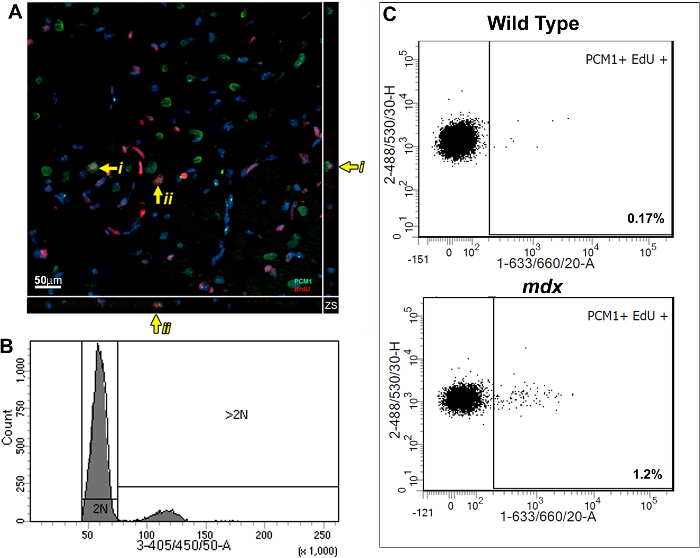
图3: 埃杜量化标记的野生型和 MDX 心 心肌细胞 。(A)为40微米MDX心厚的部分采取Z堆叠投影图像。 PCM-1表达心肌细胞核已纳入埃杜(红色)(绿色)。黄色箭头指示的EdU标记的心肌细胞。 I和II表示个人的EdU标记在Z平面显示心肌细胞。细胞核标记用DAPI(蓝色)(B和C)流式细胞术分离的核表示从12-13周龄的野生型(C57 / BL10)和mdx小鼠代表性的图(MDX -对C57 / BL10背景/年 )。 (B)直方图显示2N和> 2N核之间DAPI强度和歧视。 (C)地块分析显示,当在本协议详细介绍了2N心肌细胞核人口的EdU结合。对于所有小鼠埃杜在1周给药12周的年龄。 请点击此处查看该图的放大版本。
补充图1:PCM-1是用于心肌细胞核的特异性标记物使用协议描述细胞核从通过杂交TNT-CRE小鼠14与ROSA NT / NG CRE敏感报告线16产生的双转基因小鼠中分离。在肌钙蛋白T(TNT)启动子的控制下,将得到的鼠标CRE活化导致与定位于细胞核的GFP不可逆转表达。核标有同型的控制(ISO)显示,以确定GFP表达心肌细胞核人口(530分之488/ 30-A)的能力。具有抗PCM1核标签(由检测二抗633-660 / 20-A)显示PCM1表达与GFP表达cardiomyocy的相关性TE核人口。在这个例子中98.8心肌细胞核所标识的TNT启动子活性,由PCM1抗体标记的%。 请点击此处下载补充如图1所示。
补充图 2: 挑战通过免疫组织化学技术定量心肌细胞更新 (A)的二维图像显示这似乎也标示埃杜(红)二PCM-1表达心肌细胞核(绿色)。黄色箭头表示这似乎是已注册成立的EdU心肌细胞。这是由于PCM1表达,并使用2维成像可视化时的EdU标记的表观共定位。 ( 二 )该图像的三维投影识别这些EDU标记细胞不是心肌,但非心肌细胞覆盖PCM1表达心肌细胞核。在12周的用于实验的年龄C57 / BL10小鼠。 请点击此处下载补充图2A。 请点击此处下载补充图2B。
| 反应组分 | 反应数 | |
| 2 | 五 | |
| PBS | 875微升 | 2.19毫升 |
| 铜保护剂 | 20微升 | 50微升 |
| 荧光染料吡啶甲基叠氮化 | 5微升 | 12.5微升 |
| 稀释后的反应在4.1缓冲液 | 100微升 | 250微升 |
| 总反应体积 | 1毫升 | 2.5毫升 |
表2: 鸡尾酒的EdU成分 。食谱的EdU标记鸡尾酒协议第4版(EDU掺入的检测)必需的。
讨论
要准确量化心肌营业额和再生试验必须真正心肌细胞的产生和非生产性的DNA分裂区分。许多研究继续简单地忽略这些非生产性活动,量化心肌细胞增殖仅通过周期室壁运动及细胞周期标记物的表达。迄今为止一个方法,使心肌营业额的准确定量,同时控制这些非生产性活动仍然引经据典。尤其是,它仍然很难占到心肌多倍体这有助于达到〜心肌DNA复制13的65%。因此,以协助在心肌细胞产生的精确量化,我们已经开发出一种协议,它允许新心肌细胞核的速率的健壮量化,同时排除了导致增加的倍性DNA的复制。虽然这个协议可以新的心肌细胞属间不是歧视灰和心肌细胞的双核,它可以快速地使用,并且准确地计算上限心肌代的(占倍)。因此该协议提供了一种筛选工具,以评估在疾病模型中的心肌细胞的产生和多倍体的速率潜在变化或评估治疗剂的潜在效率。一旦新心肌细胞核产生的速率的变化使用该协议确定了随后的研究可用于确定是否此由于在心肌细胞产生心肌细胞的成核数量的变化,如先前2,13,17,18所述。这些包括在脉冲期间的使用组织学定量心肌核动力学的或从的EdU脉冲动物得到在在单个核和多核心肌群体比较的EdU掺入组织切片的分析。
由于心肌成交额的低水平协议采用埃杜多次注射超过7天。这也使心肌细胞的生成所有潜在的细胞来源"追",并允许累计心肌细胞核代量化超过这个时间段。根据研究的基础上,在此时间范围可被调整以适应心肌生成的预测水平。对的EdU掺入在心肌细胞核的准确定量,必须有与用于检测的PCM-1反应性的二级抗体的核的没有非特异性标记。因此这将是谨慎,以优化该协议的这个方面,尤其是当比其他的第二抗体建议在这个协议是用来承接附加二级抗体滴定实验。这里所描述的协议使用PCM-1的表达来识别心肌细胞核。虽然这是一个既定的心肌细胞的标记,替代标记可用于验证数据;这些包括特异性针对已被确认为心肌细胞的细胞核1部分局部心肌肌钙蛋白T抗体。同样,替代核局部蛋白可用于在比上述心肌细胞的其他核种群确定和量化的EdU掺入。重要的是,所有的心肌细胞核正在积极进行有丝分裂被排除在分析,该DNA合成的命运是未知的,并且可能导致在任一细胞分裂或增加的倍性。 PCM1是在细胞周期因此心肌经历有丝分裂不会被PCM1表达式确定的M期拆卸。此外,在细胞周期的S期的所有核应排除随后的分析。这可以通过用2N人口包括与2N和4N种群之间的DAPI强度高于DAPI强度选通所有的细胞核来实现。
虽然它是日益接受的是,心脏具有正常老化和急性损伤过程中替换心肌细胞的能力,这种潜在的源和程度仍存在争议。此外,心肌周转率不同的报道1,7,20-22。这可能部分由于在精确地确定和量化新的心肌细胞的产生19的困难。迄今为止,大多数研究仅在使用组织学分析的,并通过胞质蛋白质,包括肌节的蛋白,心肌周转和更新2,4,23,24的量化的表达心肌细胞的识别依赖。使用这些方法来检测增殖标记物的表达,或者作为这里证明的,胸苷类似物的掺入极易造成其它心脏细胞类型为心肌细胞的误认。虽然使用3D共焦成像可以帮助缓解这些问题日ESE方法是昂贵且耗时的。有趣的是,这里描述的方案展示了新的心肌细胞的核生成发生在每周0.17%的速度。这是与其它流式细胞术为基础的研究表明高达0.13%5周成交率一致。虽然这是很有诱惑力根据这些数据来推断全年周转率,因为在以往的研究2,5,25,26,作为周转率在动物13的续航时间动态,这是不合适的。
这种方法具有许多潜在的应用包括评估潜在的治疗剂,以提高心肌再生或调查心脏疾病的心肌周转和影响心肌多倍体的速率。
披露声明
The authors have nothing to disclose.
致谢
This work was supported by the British Heart Foundation, project grant PG/13/69/30454.
材料
| Name | Company | Catalog Number | Comments |
| 0.32 M sucrose | Sigma | 84100 | |
| 10 mM Tris-HCl (pH = 8) | Sigma | T3253 | |
| 5 mM CaCl2 | Sigma | c5086 | |
| 5 mM magnesium acetate | sigma | M-5661 | |
| 2.0 mM EDTA | Sigma | E5134 | |
| 0.5 mM EGTA | Sigma | 63779 | |
| 1 mM DTT | Sigma | D0632 | |
| 70 mM KCl | Sigma | P9541 | |
| 10 mM MgCl2 | Sigma | M8266 | |
| 1.5 mM spermine | Sigma | 85590 | |
| Isotype rabbit IgG- ChIP Grade | abcam | abc7415 | |
| Rabbit anti-PCM-1 antibody | Sigma | HPA023374 | |
| Alexa Fluor 488 F(ab')2 Fragment of Goat Anti-Rabbit IgG (H+L) Antibody | Life technologies | A-11070 | |
| cell strainers 70 μm and 100 μm | Fisher scientific | 11597522, 11517532 | |
| Glass dounce (40 ml) and pestle large clearance | Sigma | D9188-1SET | |
| EdU (5-ethynyl-2’-deoxyuridine) | Life technologies | A10044 | |
| Click-iT Plus EdU Alexa Fluor 647 Flow Cytometry Assay Kit | Life technologies | C10634 | This kit inlcudes reagents required for section, EdU reaction buffer, EdU fixative, saponin-based permeabilization solution and the reagents required for the EdU labelling cocktail. |
| CyStain DNA 2 step kit, | Sysmex Partec | 05 5005 | This kit inlcudes reagents required for DAPI labelling (DNA staining solution) |
| Probe homogeniser, e.g., TissueRuptor | Qiagen | 9001273 | |
| TissueRuptor Disposable Probes | Qiagen | 990890 | |
| ultracentrifuge | Sorvall | ||
| Facscanto II | BD Biosciences | ||
| Ultracentrifuge Tube, Thinwall, Polypropylene. 38.5 ml, 25 x 89 mm | Beckman Coulter | 326823 | |
| Bovine serum albumin | Sigma | A2153 |
参考文献
- Bergmann, O., et al. Evidence for cardiomyocyte renewal in humans. Science. 324, 98-102 (2009).
- Senyo, S. E., et al. Mammalian heart renewal by pre-existing cardiomyocytes. Nature. 493, 433-436 (2013).
- Soonpaa, M. H., Rubart, M., Field, L. J. Challenges measuring cardiomyocyte renewal. Biochim Biophys Acta. 1833, 799-803 (2013).
- Loffredo, F. S., Steinhauser, M. L., Gannon, J., Lee, R. T. Bone marrow-derived cell therapy stimulates endogenous cardiomyocyte progenitors and promotes cardiac repair. Cell Stem Cell. 8, 389-398 (2011).
- Malliaras, K., et al. Cardiomyocyte proliferation and progenitor cell recruitment underlie therapeutic regeneration after myocardial infarction in the adult mouse heart. EMBO Mol Med. 5, 191-209 (2013).
- Hsieh, P. C., et al. Evidence from a genetic fate-mapping study that stem cells refresh adult mammalian cardiomyocytes after injury. Nat Med. 13, 970-974 (2007).
- Bergmann, O., et al. Identification of cardiomyocyte nuclei and assessment of ploidy for the analysis of cell turnover. Exp Cell Res. 317, 188-194 (2011).
- Herget, G. W., Neuburger, M., Plagwitz, R., Adler, C. P. DNA content, ploidy level and number of nuclei in the human heart after myocardial infarction. Cardiovasc Res. 36, 45-51 (1997).
- Scholzen, T., Gerdes, J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 182, 311-322 (2000).
- Carmena, M., Earnshaw, W. C. The cellular geography of aurora kinases. Nat Rev Mol Cell Biol. 4, 842-854 (2003).
- Bergmann, O., Jovinge, S. Isolation of Cardiomyocyte Nuclei from Post-mortem Tissue. J. Vis. Exp. , e4205 (2012).
- Gilsbach, R., et al. Dynamic DNA methylation orchestrates cardiomyocyte development, maturation and disease. Nat Commun. 5, 5288 (2014).
- Richardson, G., Laval, S., Owens, W. A. Cardiomyocyte regeneration in the mdx mouse model of non-ischemic cardiomyopathy. Stem Cells Dev. , (2015).
- Jiao, K., et al. An essential role of Bmp4 in the atrioventricular septation of the mouse heart. Genes Dev. 17, 2362-2367 (2003).
- Bergmann, O., et al. Cardiomyocyte renewal in humans. Circ Res. 110, e17-e18 (2012).
- Prigge, J. R., et al. Nuclear double-fluorescent reporter for in vivo and ex vivo analyses of biological transitions in mouse nuclei. Mamm Genome. , (2013).
- Naqvi, N., et al. A proliferative burst during preadolescence establishes the final cardiomyocyte number. Cell. 157, 795-807 (2014).
- Liu, Z., Yue, S., Chen, X., Kubin, T., Braun, T. Regulation of cardiomyocyte polyploidy and multinucleation by CyclinG1. Circ Res. 106, 1498-1506 (2010).
- Ang, K. L., et al. Limitations of conventional approaches to identify myocyte nuclei in histologic sections of the heart. Am J Physiol Cell Physiol. 298, C1603-C1609 (2010).
- Kajstura, J., et al. Myocyte turnover in the aging human heart. Circ Res. 107, 1374-1386 (2010).
- Kajstura, J., et al. Cardiomyogenesis in the adult human heart. Circ Res. 107, 305-315 (2010).
- Walsh, S., Ponten, A., Fleischmann, B. K., Jovinge, S. Cardiomyocyte cell cycle control and growth estimation in vivo--an analysis based on cardiomyocyte nuclei. Cardiovasc Res. 86, 365-373 (2010).
- Anversa, P., Leri, A., Kajstura, J. Cardiac regeneration. J Am Coll Cardiol. 47, 1769-1776 (2006).
- Gonzalez-Valdes, I., et al. Bmi1 limits dilated cardiomyopathy and heart failure by inhibiting cardiac senescence. Nat Commun. 6, 6473 (2015).
- Kimura, W., et al. Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart. Nature. 523, 226-230 (2015).
- Soonpaa, M. H., Field, L. J. Assessment of cardiomyocyte DNA synthesis in normal and injured adult mouse hearts. Am J Physiol. 272, H220-H226 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。