需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
协议隔离威利斯的鼠标圈
摘要
We describe here a reproducible protocol for isolating the mouse circle of Willis.
摘要
脑底动脉环(circulus动脉脑瘤)或威利斯(COW)的圆是围绕着视交叉和下丘脑的血液供应到大脑和周围结构的循环吻合。它已牵涉几种脑血管疾病,包括脑淀粉样血管病(CAA)相关血管病变,颅内动脉粥样硬化和颅内动脉瘤。这些疾病的基本为新颖的药物靶标对他们的预防识别的分子机制的研究需要的动物模型。其中一些模型可以是转基因,而其他将涉及脑血管的隔离,包括这里所描述的CoW.The方法适合于在任何小鼠谱系牛隔离,并具有相当大的潜力用于筛选(基因,蛋白质生产的表达,翻译后蛋白修饰,分泌组分析等 )上的大血管鼠标cerebro-研究血管。它也可以用于体外研究,通过调整对分离的小鼠嗅动脉开发的器官浴系统。
引言
脑底动脉环(circulus动脉脑瘤),也被称为威利斯(COW),Willisor威利斯多边形的环圈)最早是由托马斯·威利斯在1664描述的是周围设视交叉和下丘脑,可以循环系统吻合被看作是一个中心毂供给血液到脑和周围结构。血经颈内动脉和椎动脉进入这个结构,它通过内部中,后脑动脉流出圈。每个这些动脉的具有左右分支圆上的任一侧。基底,后连通,并且前交通动脉完全的圆( 图1和图2)。血流受损的任何流出动脉的风险由血液进入从颈和脑动脉的圆,从而保证有足够的血液供给到b中的合并减少雨。这种结构也可作为在颈内动脉的严重闭塞性疾病侧支血流的主要途径。
几种类型的脑血管疾病有他们的牛奶原产地。最常见的是脑淀粉样血管病(CAA)相关血管病变,颅内动脉粥样硬化和颅内动脉瘤。1,2,3,这些疾病可能导致灌注不足是由于血管扩张,和脑和/或蛛网膜下腔出血最终转化为缺血性或出血性中风或充其量短暂性缺血发作。在诊断过程,包括神经影像学,可能与血管造影术相结合的最新进展,已使人们有可能在临床诊断这些主要脑血管疾病,而不需要一个脑活检。然而,有效和特定的治疗(药理学或血管内),目前缺乏,因此,有必要定义新分子靶点。
的新颖的药物靶标用于预防这些疾病在人类中鉴定需要的动物模型并分离脑脉管系统包括牛的方法。这些模型应提供的证据和线索的具体变化,包括炎性改变,在颅内动脉瘤,CAA或颅内动脉粥样硬化的动物模型的大血管壁发生。4,5,6
我们已经建立了小鼠牛隔离的方法,以促进在阿尔茨海默氏病(AD)和相关疾病容器炎症研究,例如CAA。该隔离鼠标牛方法,为脑血管炎症基因表达的疾病进展过程中的评估开发。再加上检测软脑膜及脑膜动脉壁内的β淀粉样蛋白的沉积,这种方法可以更容易地阻止矿山在脑血管壁的炎症基因表达和Aβ肽的积累之间的可能关系。大脑,包括蛛网膜下腔的柔脑膜和软脑膜的血管网,是大动脉形成Willis环的扩展。此处所描述的方法可以用于任何小鼠谱系的牛隔离和可用于在大型船只的小鼠脑脉管系统的所有类型的筛选( 例如 ,基因表达,蛋白质产生和翻译后蛋白修饰)的。
研究方案
所有的程序均按照照顾和使用实验动物的欧盟标准进行,与当地的伦理委员会进行动物实验(巴黎大区 - 巴黎委员会,授权4270)的批准。
1.麻醉
- (最多至1mg / 10g体重)腹膜内(27号针和1毫升注射器)到成年小鼠手术前注入戊巴比妥的致死剂量。
2.血管灌注
注:没有必要血管灌注过程中兽医药膏敷眼睛。这个过程是快速(5-10分钟),并在动物死亡结束。确认缺乏应对与脚趾捏的。
- 使用虹膜剪,使一个切口,约4厘米长,入腹壁和腹膜,只是肋条笼之下。
- 做一个小切口(几毫米长)的膜片,然后continuË沿肋骨的整个长度隔膜的切口以暴露胸膜腔。
- 提起胸骨路程,钳止血胸骨尖;把脖子上的止血钳。精心修剪的脂肪组织连接胸骨心脏。
- 穿过左心室15号针头灌注到心脏的顶点。
- 最后,用剪刀剪下肝叶之一来创建一个出口。
注:另一种插座可以通过使用虹膜剪创建到右心房切口创建。 - 灌注动物用一个泵以2.5毫升/分钟的速率操作25至50ml的磷酸盐缓冲盐水(PBS)的。肝脏应作为灼血被替换为PBS。
- 约五分钟后,一旦从肝脏中的流体是完全清楚,停止灌注。
- 如果免疫染色或常规染色计划,灌注所述动物用50ml的多聚甲醛(PFA;在PBS中的4%),15分钟。
注意:小心,PFA烟雾是有毒的。用PFA动物灌注应在通风橱中进行。
3.脑的分离和Willis环
- 脑的隔离
- 用一双手术剪取下头上。
- 请与虹膜剪正中切口,沿颈部到鼻子皮肤。
- 切去皮肤暴露的头骨和清除残留的肌肉和脂肪组织与虹膜剪。
- 虹膜剪的锋利端放入枕大孔一侧,并沿头骨到外耳道(也称为耳道)的内表面上小心地将它们。
- 重现对侧在3.1.4中描述的切口,使沿顶叶间骨的内表面切成矢状缝的开始的中线。
- 工厂虹膜剪刀额骨,右两眼之间,在矢状缝,然后打开它们一分为二头骨。
- 提起出大脑,抢夺嗅球,并使用虹膜剪刀剪下其腹面的神经连接。
- 取出大脑,并放置在含有冰冷的PBS为牛隔离60毫米的培养皿。完全沉浸在PBS的大脑。如果大脑固定用4%PFA(用于随后的切片和免疫染色或定期染色),保持它在4%PFA的浴中于4℃24小时。
- Willis环的分离
注:解剖显微镜需要奶牛隔离。大脑应该在整个过程保持在4℃。- 把脑倒挂( 即在其背水面),以可视化的奶牛。
- 用小镊子在嗅叶的基部抢前脑动脉(ACA)( 一个,图1)和施加压力,以从容器中连续分离它们。使用相同的步骤,以切割在b中的大脑中动脉(MCA)( 图1)。
- 使用镊子锋利的两端提起并取下主要干道形成了从皮质牛。
- 抬起后交通动脉(PCA)的开始从大脑断开它们,通过抓握大脑中动脉(MCA)与钳子。拿起前动脉(ACA和MCA),轻轻地拉他们在多前 - 背方向视交叉。为了防止牛中断,中断处理与其他血管的过程。
- 重复步骤3.2.2和3.2.3上级和后小脑动脉(SCA)/(PCA)( 三,图1)和用于基底动脉(BA)(D,图1),在一个dorsal-拉动它们前方向。停在过程中的描述我的结束ñ3.2.4。
- 通过使用镊子轻轻拉动取下整个牛。将牛在60毫米培养皿中充满了冰冷的PBS并用两个镊子取出任何剩余的连接脑组织,拿着牛的地方小针。
- 保持收获的母牛在-80℃下用于RNA纯化后续处理(RNA提取产量大量的RNA - 约500纳克)或蛋白质提取。
注意:牛可维持离体 24小时,通过调整对分离的小鼠嗅动脉开发的器官浴系统7。

图1:对小鼠脑突出的牛 ,牛是从两个内部颈动脉(MCA),这是从两个大脑前动脉(ACA)派生形成的腹面示意图。基底动脉(BA)分支成后(PCA)和优异的(SCA)的脑动脉和两个椎动脉(VA)。
结果
在PBS-灌注小鼠被杀害,并且在协议中的第3.2节所述的奶牛被隔离。当正确地进行清扫,奶牛应该出来在一块和应稍透明由于在脉管没有残留血液。
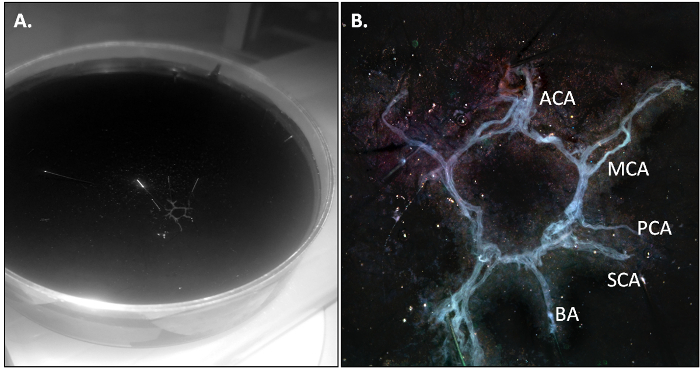
图2: 隔离后的母牛鼠标。在一个10厘米的培养皿中的牛(一)概述(二)...
讨论
我们在这里描述为Willis环的隔离可再现协议。涉及牛最常见的脑血管疾病是CAA相关血管病变,颅内动脉粥样硬化和颅内动脉瘤,所有这些都影响动脉血管的壁。的危险因素是众所周知的,但这些脑疾病的分子发病机制仍然知之甚少和用于预测它们发生特定的生物标记物所缺乏的。目前的方法相当大的兴趣了隔离转基因小鼠的牛的肉眼观察结果与分子变化联系起来。例如,通过在其特定的基因被敲?...
披露声明
The authors have nothing to disclose.
致谢
这项工作是由巴黎第六大学和皮埃尔·法布尔创新基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
参考文献
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。