Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Protokoll für die Maus Kreis von Willis Trenn
In diesem Artikel
Zusammenfassung
We describe here a reproducible protocol for isolating the mouse circle of Willis.
Zusammenfassung
Der zerebrale arterielle Kreis (Circulus arteriosus cerebri) oder Kreis von Willis (CoW) ist ein Kreislauf-Anastomose umgibt die Sehnervenkreuzung und dem Hypothalamus, die Blut zum Gehirn und der umgebenden Strukturen liefert. Es wurde in mehreren zerebrovaskulären Störungen, einschließlich zerebraler Amyloidangiopathie (CAA) -assoziierten Vaskulopathien, intracranial Atherosklerose und intrakranielle Aneurysmen gebracht. Studien der molekularen Mechanismen dieser Krankheiten für die Identifizierung neuer Arzneimitteltargets für deren Prävention zugrunde liegenden erfordern Tiermodellen. Einige dieser Modelle kann transgen sein, während andere Isolierung der cerebro-Vaskulatur einbeziehen, einschließlich der CoW.The hier beschriebene Verfahren eignet sich zur Isolation CoW in jeder Maus lineage und erhebliches Potenzial für das Screening (Expression von Genen, die Proteinproduktion, posttranslationalen Proteinmodifikationen, Sekretom Analyse, etc.) Studien zu den großen Gefäßen der Maus zerebro-Gefäße. Es kann auch für die Ex - vivo - Studien verwendet werden, indem das Organbad System für isolierten Maus Riech Arterien entwickelt anzupassen.
Einleitung
Der zerebrale arterielle Kreis (Circulus arteriosus cerebri), die auch als Kreis von Willis (Kuh), Schleife von Polygon Willisor Willis bekannt) wurde zum ersten Mal in 1664 von Thomas Willis beschrieben Es ist ein Kreislauf-Anastomose um die Sehnervenkreuzung und Hypothalamus das kann betrachtet werden als zentrale Drehscheibe Blut zum Gehirn versorgenden und der umgebenden Strukturen. Blut tritt diese Struktur über die A. carotis interna und Arteria vertebralis, und es strömt aus dem Kreis über das Innere mittleren und hinteren Hirnarterien. Jede dieser Arterien hat linke und rechte Zweige auf jeder Seite des Kreises. Die basilar, Post kommunizieren und vorderen Arterien vollständig den Kreis (Abbildung 1 und Abbildung 2) in Verbindung steht. Das Risiko einer Beeinträchtigung des Blutflusses in einem der Abflußadern wird durch die Zusammenführung von Blut Eingabe der Kreis von der Carotis und Hirnarterien minimiert, wodurch gewährleistet, dass ausreichend Blut zum b zugeführt wird,Regen. Diese Struktur dient auch als Hauptroute für Sicherheiten Blutfluss in schweren Verschlusskrankheiten der A. carotis interna.
Mehrere Arten von zerebrovaskulären Erkrankungen haben ihren Ursprung in der Kuh. Die häufigsten sind die zerebrale Amyloid - Angiopathie (CAA) -assoziierten Gefäßerkrankungen, intrakranielle Atherosklerose und intrakraniellen Aneurysmen. 1, 2, 3 Diese Störungen aufgrund Vasodilatation hypoperfusion führen können, und intrazerebrale und / oder Subarachnoidalblutungen letztlich Übersetzung in ischämischen oder hämorrhagischen Schlaganfällen oder allenfalls eine transitorische ischämische Attacke. Jüngste Fortschritte in Diagnoseverfahren, bildgebenden Verfahren, einschließlich, möglicherweise mit Angiographie kombiniert, haben es möglich gemacht, diese großen zerebrovaskuläre Erkrankungen klinisch, ohne die Notwendigkeit für ein Gehirn-Biopsie zu diagnostizieren. Dennoch wirksame und spezifische Behandlungen (pharmakologische oder endovaskuläre) fehlen derzeit und es besteht daher ein Bedarf neu zu definierenmolekulare Ziele.
Die Identifizierung neuer Arzneimitteltargets für die Prävention dieser Krankheiten beim Menschen werden Tiermodelle und Möglichkeiten erfordern die Cerebro-Gefäße einschließlich der Kuh zu isolieren. Solche Modelle sollten Beweise und Hinweise auf die spezifischen Veränderungen liefern, entzündliche Veränderungen , einschließlich, in den Wänden der großen Gefäße in Tiermodellen von intrakraniellen Aneurysma Arterie, CAA oder intrakranielle Atherosklerose auftreten. 4, 5, 6
Wir haben ein Verfahren zur Isolierung Maus CoW etablierten Studien der Gefäßentzündung bei Alzheimer-Krankheit (AD) und verwandter Krankheiten, wie CAA zu erleichtern. Dieses Verfahren zur Isolierung des Maus CoW wurde für die Beurteilung der Entzündungs zerebrovaskulären Genexpression während Fortschreiten der Krankheit entwickelt. Zusammen mit dem Nachweis von Amyloid-beta-Ablagerung innerhalb der Wände der trigeminale und pial Arterien, könnte dieses Verfahren erleichtern abzuschreckenMine die mögliche Beziehung zwischen inflammatorischen Genexpression in der Cerebro-Gefäßwand und Aß-Peptid-Akkumulation. Das vaskuläre Netzwerk des Gehirns, einschließlich der trigeminale und pial in den Subarachnoidalraum, ist eine Erweiterung der großen Arterien, den Kreis der Willis bilden. Das hier beschriebene Verfahren kann verwendet werden , um die Kuh jeder Mauslinie zu isolieren und könnte für alle Arten von Screening (zB Genexpression, Proteinproduktion und posttranslationale Modifikationen) an den großen Gefäßen der Maus Cerebro- Vaskulatur verwendet werden.
Protokoll
Alle Verfahren wurden in Übereinstimmung mit dem europäischen Gemeinschaftsstandards für die Pflege und Verwendung von Labortieren, mit Zustimmung der lokalen Ethikkommission für Tierversuche (Ile de France-Paris-Komitee, Zulassung 4270) durchgeführt.
1. Anesthesia
- eine letale Dosis von Pentobarbital (bis zu 1 mg / 10 g Körpergewicht) intraperitoneal (27-Gauge-Nadel und 1-ml Spritze) in erwachsenen Mäusen vor der Operation infundieren.
2. Behälter Perfusions
HINWEIS: Es gibt keine Notwendigkeit, die Augen während der Gefäß Perfusion anwenden Tierarzt Salbe ist. Dieses Verfahren ist schnell (5-10 Minuten) und endet mit dem Tod des Tieres. Bestätigen Sie die fehlende Reaktion mit einer Zehe Prise.
- Mit Iris Schere, einen Schnitt zu machen, etwa 4 cm lang, in die Bauchdecke und Peritoneum, direkt unterhalb des Brustkorbs.
- Machen Sie einen kleinen Schnitt (wenige Millimeter lang) in der Membran und dann continue der Schnitt der Membran entlang der gesamten Länge des Brustkorbs der Pleurahöhle zu belichten.
- Heben Sie das Brustbein weg und klemmen Sie die Spitze des Brustbeins mit dem hemostat; Stellen Sie den hemostat auf den Hals. Sorgfältig schneiden Sie das Fettgewebe des Brustbeins zum Herzen zu verbinden.
- Übergeben Sie die 15-Gauge-Perfusions-Nadel durch den linken Ventrikel in die Spitze des Herzens.
- Schließlich verwenden Schere eine der Leberlappen zu schneiden einen Ausgang zu schaffen.
HINWEIS: Eine alternative Ausgang kann mit Iris Schere erstellt werden, um einen Einschnitt in den rechten Vorhof zu schaffen. - Perfundieren das Tier mit 25 bis 50 ml Phosphat-gepufferter Salzlösung (PBS) mit einer Pumpe mit einer Geschwindigkeit von 2,5 ml / min betrieben wird. Die Leber sollte blanch wie das Blut wird mit PBS ersetzt.
- Nach ungefähr fünf Minuten, nachdem die Flüssigkeit aus der Leber vollständig klar ist, die Perfusion zu stoppen.
- Wenn Immunofärbung oder regelmäßige Färbung ist geplant, perfundieren das Tier mit 50 ml Paraformaldehyd(PFA; 4% in PBS) für 15 min.
HINWEIS: Vorsicht, sind PFA Dämpfe giftig. Perfusion des Tieres mit PFA sollte in einem gut belüfteten Laborabzug durchgeführt werden.
3. Isolierung des Gehirns und der Kreis von Willis
- Isolation des Gehirns
- Entfernen Sie den Kopf mit einem Paar von chirurgische Scheren.
- Machen Sie einen Mittelschnitt mit Iris Schere, entlang der Haut vom Hals bis zur Nase.
- Schneiden Sie die Haut, den Schädel zu entlarven und entfernen Sie alle Rest Muskeln und Fettgewebe mit Iris Schere.
- Platzieren das scharfe Ende der Iris Schere in das Foramen Magnum auf der einen Seite und vorsichtig gleiten entlang der inneren Oberfläche des Schädels auf den äußeren Gehörgang (auch als Ohrkanal bekannt).
- Reproduzieren des Einschnitts in 3.1.4 auf der kontralateralen Seite beschrieben und eine Mittellinie entlang der Innenfläche des Zwischenscheitelbein zu Beginn der Sutura sagittalis Schnitt.
- Pflanzen Sie die IrisSchere im Stirnbein, genau zwischen die Augen in der Pfeilnaht und sie dann öffnen, um den Schädel in zwei Teile gespalten.
- Heben Sie das Gehirn aus, die Riechkolben greifen und mit Hilfe der Iris Schere, um die Nervenverbindungen auf ihrer Bauchseite abzuschneiden.
- Entfernen Sie das Gehirn und legen Sie sie in einem 60-mm-Petrischale eiskaltem PBS für CoW Isolierung enthält. Völlig tauchen das Gehirn in der PBS. Wenn das Gehirn mit 4% PFA (für nachfolgende Schnitte und Immunfärbung oder regelmäßigen Färbung) fixiert wurde, halten Sie es in einem Bad von 4% PFA bei 4 ° C für 24 Stunden.
- Die Isolierung des Kreises von Willis
HINWEIS: Ein Binokular für CoW Isolierung erforderlich ist. Das Gehirn sollte während des gesamten Verfahrens bei 4 ° C aufbewahrt werden.- Setzen Sie das Gehirn auf den Kopf nach unten (dh auf seiner Rückenfläche) , die Kuh zu visualisieren.
- Verwenden Sie eine kleine Zange die vorderen Hirnarterien (ACA) auf der Basis der Riechlappen greifen ( a, 1) und Druck ausüben , sie aus dem Behälter Kontinuum zu distanzieren. Verwenden Sie das gleiche Verfahren , um die mittleren Hirnarterien (MCA) in b (Abbildung 1) zu schneiden.
- Verwenden Sie die spitzen Enden der Zange zu heben und entfernen Sie die Hauptarterien, die Kuh aus der Rinde bilden.
- Heben Sie den Start der hinteren kommuniziere Arterien (PCA), um sie vom Gehirn zu trennen, indem Sie die mittlere Hirnarterien Greif (MCA) mit der Zange. Pick-up die vorderen Arterien (ACA und MCA) und ziehen Sie sie sanft über die Chiasma in einer anterior-dorsalen Richtung. Um zu verhindern, Störung des Rindes, unterbrechen die das Verfahren für den Umgang mit den anderen Arterien.
- Wiederholen Sie die Schritte 3.2.2 und 3.2.3 für die oberen und hinteren Kleinhirnarterien (SCA) / (PCA) (c, Abbildung 1) und für die Basilaris (BA) (d, 1), so dass sie in einer dorsal ziehen anterior. Stoppen Sie am Ende des Verfahrens beschrieben in 3.2.4.
- Entfernen Sie die gesamte Kuh sanft mit der Zange herausziehen. Legen Sie die Kuh in einem 60-mm-Petrischale gefüllt mit eiskaltem PBS und entfernen Sie alle verbleibenden angebracht Hirngewebe mit zwei Zangen, die Kuh an Ort und Stelle mit kleinen Stiften zu halten.
- Halten Sie das geerntete CoW bei -80 ° C für die nachfolgende Verarbeitung für RNA-Reinigung (RNA Extraktionsausbeuten große Mengen an RNA - ca. 500 ng) oder Proteinextraktion.
Hinweis: Die Kuh beibehalten werden kann ex vivo 24 h, durch das Organbad System Anpassung für isolierten Maus Riech Arterie 7 entwickelt.

Abbildung 1: Schematische Darstellung eines ventrale Ansicht des Mäusegehirns Unter Hinweis auf die Kuh Die Kuh aus den beiden Arteria carotis interna (MCA) gebildet wird, die sich von den beiden vorderen Hirnarterien (ACA) abgeleitet sind;. die basilarArterie (BA) verzweigt sich in die hintere (PCA) und superior (SCA) Hirnarterien und zwei Wirbelarterien (VA).
Ergebnisse
Die PBS-perfundierten Maus getötet und die Kuh ist in Abschnitt 3.2 des Protokolls wie beschrieben isoliert. Wenn die Präparation korrekt durchgeführt wird, sollte die Kuh kommen in einem Stück aus und sollte aufgrund leicht transparent sein, um das Fehlen von Restblut in den Gefäßen.
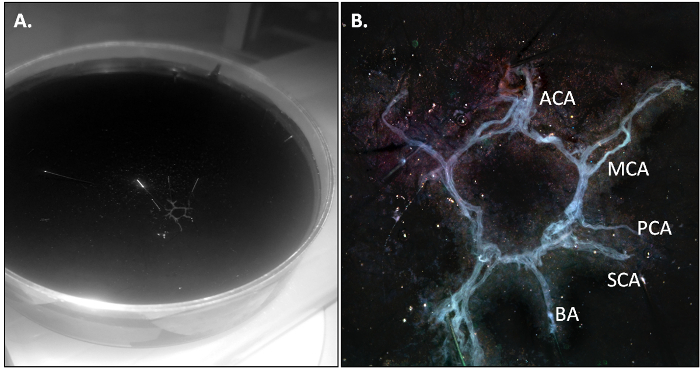
Abbildung 2: Die Maus CoW nach Isola...
Diskussion
Wir beschreiben hier ein reproduzierbares Protokoll für die Isolierung des Kreises von Willis. Die häufigsten zerebrovaskulären Störungen, die Kuh zu ergreifen sind, CAA-assoziierten Gefäßerkrankungen, intrakranielle Atherosklerose und Aneurysmen, von denen alle die Wände der arteriellen Gefäße auswirken. Die Risikofaktoren sind bekannt, aber die molekularen Pathogenese dieser Erkrankungen zerebraler bleibt schlecht verstanden und die spezifische biologische Marker für ihr Auftreten vorherzusagen fehlen. Es gi...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Arbeit wurde von Paris VI University und einen Pierre Fabre Innovation Zuschuss unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
Referenzen
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten