JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
윌리스의 마우스 원을 분리하는 프로토콜
요약
We describe here a reproducible protocol for isolating the mouse circle of Willis.
초록
윌리스 (COW)의 대뇌 동맥 원 (circulus 동맥 뇌종양) 또는 원은 뇌와 주변 구조에 혈액을 공급하는 광학 chiasma 및 시상 하부를 둘러싸는 순환 문합이다. 이는 대뇌 아밀로이드 혈관 병증 (CAA) -associated vasculopathies, 두개 내 죽상 경화증 및 두개 뇌 동맥류 등 여러 질병에 관여하고있다. 자신의 예방을위한 새로운 약물 표적의 식별을 위해 이러한 질병의 기초가되는 분자 메커니즘의 연구는 동물 모델을 필요로한다. 다른 사람들이 여기에 설명 된 CoW.The 방법 임의의 마우스 계통의 소 분리에 적합하며 (유전자, 단백질 생산의 발현을 선별하기위한 상당한 잠재력을 가지고 포함하는 뇌 - 혈관의 분리를 포함하는 반면 이러한 모델 중 일부는, 형질 전환 될 수있다 번역 후 단백질 수정 등 secretome 분석) 마우스 cerebro-의 대형 선박에 대한 연구혈관. 또한 절연 마우스 후각 동맥 위해 개발 기관 욕 시스템을 적용하여, 생체 외 연구에 사용될 수있다.
서문
또한 윌리스 (소), Willisor 윌리스 다각형의 루프의 원형으로 알려진 대뇌 동맥 원 (circulus 동맥 뇌종양은)) 먼저 그것은 시신경 chiasma 수 있습니다 시상 하부의 주위에있는 순환 문합 인 1664 년 토마스 윌리스에 의해 설명되었다 뇌와 주변 구조에 혈액을 공급하는 중앙 허브로 간주 될 수있다. 혈액 경동맥 및 척추 동맥을 통해 이러한 구성에 진입하며 내부 중간 및 후방 뇌동맥 통해 원 밖으로 흐른다. 이러한 동맥의 각각은 원호의 양측에 지점을 좌우되었다. 완전한 원을 동맥을 통신하는 기저, 포스트 소통하고, 전방 (그림 1과 그림 2). 유출 동맥 중 어느 하나에 장애가 혈류 위험함으로써 충분한 혈액이 (B)에 공급되도록 보장 경동맥 및 뇌동맥으로부터 원 입력 피 병합하여 최소화비. 이 구조는 내부 경동맥 폐색 심각한 질병에 부수적 혈류의 주요 경로로서 기능한다.
뇌 혈관 질환의 여러 유형의 소에서 자신의 기원을 가지고있다. 가장 일반적으로는 1, 2, 3이 질환으로 인한 혈관 확장에 관류 저하로 이어질 수있다. 대뇌 아밀로이드 혈관 병증 (CAA) -associated vasculopathies, 두개 내 죽상 경화증 및 두개 내 동맥류하고, 뇌내 및 / 또는 지주막 하 출혈 궁극적 허혈성 또는 출혈성 뇌졸중 또는로 변환 기껏해야 일시적 허혈성 발작. 아마도 조영술 결합 뇌 영상을 포함한 진단 절차에서의 최근 발전은 뇌 생검 없이도 가능 임상 이러한 주요 뇌 혈관 질환을 진단 만들었다. 그럼에도 불구하고, 효과적이고 특이 치료 (약물 또는 혈관)이 현재 부족과 새로운 정의 필요하다분자 표적.
인간에서 이들 질환의 예방을위한 신규 약물 표적의 식별은 동물 모델 및 소를 포함하는 뇌 - 혈관을 분리하는 방법이 필요하다. 이러한 모델은 두개 내 동맥 동맥류, CAA 또는 두개 내 동맥 경화증의 동물 모델에서 큰 혈관의 벽에 발생하는 염증을 포함하는 특정 변경에의 증거와 단서를 제공해야한다. 4, 5, 6
우리는 CAA와 같은 알츠하이머 질환에서 혈관 염증의 연구 (AD) 및 관련 질병을 촉진하기 위해 마우스 암소 분리하는 방법을 설립했다. 마우스 암소를 분리하는이 방법은 질병 진행 동안 뇌 염증 유전자 발현의 평가를 위해 개발되었다. 함께 leptomeningeal 및 pial 동맥의 벽 내에서 아밀로이드 베타 침착의 검출과,이 방법은 쉽게 저지 할 만들 수내 염증성 뇌 - 혈관 벽에 유전자 발현 및 Aβ 펩타이드의 축적 사이의 가능한 관계. 지주막 하 공간에 leptomeningeal 및 pial을 포함하는 뇌의 혈관 네트워크는 윌리스의 원을 형성하는 큰 동맥의 확장입니다. 여기서 설명한 방법은 임의의 마우스 계통의 암소를 분리하는 데 사용될 수 있고, 마우스 뇌 - 혈관의 대형 선박의 스크리닝 (예를 들어, 유전자 발현, 단백질 생산 및 번역 후 단백질 변형)의 모든 유형에 이용 될 수있다.
프로토콜
모든 절차가 동물 실험에 대한 로컬 윤리위원회 (일드 프랑스 - 파리 -위원회 승인 4270)의 승인, 관리 및 실험 동물의 사용을위한 유럽 공동체 표준에 따라 수행 하였다.
1. 마취
- 펜토 바르 비탈을 치사량을 주입 성인 마우스에 복강 내 (27 게이지 바늘 및 주사기를 1ml) (1 밀리그램 / 10g 체중까지) 수술 전.
2. 선박 관류
참고 : 혈관 재관류 동안 눈에 수의사 연고를 적용 할 필요가 없습니다. 이 절차는 (5-10 분) 신속하고 동물의 죽음에 끝납니다. 발가락 핀치와 응답의 부족을 확인합니다.
- 홍채 가위를 사용하여, 바로 흉곽 아래, 복벽과 복막에 약 4cm 길이 절개를합니다.
- 연속 주 후 진동판에 작은 절개 (밀리미터 길이)를 확인하고전자 흉곽의 전체 길이를 따라 진동판의 절개은 흉강을 노출.
- 멀리 흉골을 들어 올리고 지혈과 흉골의 끝 부분을 고정; 목에 지혈을 배치합니다. 조심스럽게 심장으로 흉골을 연결하는 지방 조직을 잘라.
- 마음의 꼭대기에 좌심실을 통해 15 게이지 관류 바늘을 전달합니다.
- 마지막으로, 출구를 만들기 위해 간 로브 중 하나를 잘라 가위를 사용합니다.
참고 : 또 다른 출구는 우심방에 절개를 만들 홍채 가위를 사용하여 만들 수 있습니다. - 2.5 ㎖ / 분의 속도로 작동하는 펌프를 인산 완충 용액 (PBS) 25 내지 50 ㎖로 동물을 관류. 간은 혈액으로 희게은 PBS로 교체해야합니다.
- 간에서 유체가 완전히 명확하면 약 5 분 후, 재관류를 중지합니다.
- 면역 염색 또는 일반 계획되는 경우, 파라 포름 알데히드의 50 mL로 동물 관류(PFA 4 PBS의 %) 15 분.
참고 :주의, PFA 연기는 독성. PFA와 동물의 재관류는 통풍이 흄 후드에서 수행되어야한다.
3. 뇌의 분리 및 윌리스의 원
- 뇌의 분리
- 수술 가위로 머리를 제거합니다.
- 코에 목으로부터 피부를 따라, 홍채 가위와 정중선 절개를합니다.
- 두개골을 노출하고 홍채 가위로 남아있는 근육과 지방 조직을 제거하는 피부를 낸다.
- 한쪽 난원 매그넘에 홍채 가위의 날카로운 끝을 놓고 신중하게 (또한 외이도로 알려진) 외부 청각 (外耳道)에 두개골의 내부 표면을 따라 그들을 밀어 넣습니다.
- 반대편 측면에 3.1.4에 설명 된 절개를 재현하고 시상 봉합의 시작에 간 정수리 뼈의 내부 표면을 따라 잘라 중간 선을합니다.
- 조리개를 심고정면 뼈의 위, 오른쪽 눈 사이, 시상 봉합에서 다음 두 두개골을 분할을 엽니 다.
- 후각 전구를 잡아와 복부 표면의 신경 연결을 차단하기 위해 홍채 가위를 사용하여 뇌를 들어 올립니다.
- 뇌를 제거하고 소 분리를 위해 얼음처럼 차가운 PBS를 포함하는 60 mm 페트리 접시에 넣습니다. 완전히 PBS의 뇌를 체험. 뇌가 4 % PFA로 고정 된 경우 (이후 절편 및 면역 염색 또는 일반 염색 용), 24 시간 동안 4 ° C에서 4 % PFA의 목욕에 보관합니다.
- 윌리스의 원의 분리
참고 : 해부 현미경이 암소 격리 필요합니다. 뇌는 전체 과정에 걸쳐 4 ° C에서 보관해야합니다.- 소를 시각화하기 위해 거꾸로 (즉, 그것의 등쪽 표면에) 뇌를 넣습니다.
- (후각 엽의 기지에서 전방 대뇌 동맥 (ACA)을 잡기 위해 작은 집게를 사용하여 을, 그림 1)과 발휘 압력 용기의 연속체에서 그들을 해리합니다. B의 중간 대뇌 동맥 (MCA) (그림 1) 잘라 동일한 절차를 사용합니다.
- 피질에서 소를 형성하는 주요 동맥을 들어 올려 제거 포셉의 날카로운 끝을 사용합니다.
- 포셉과 중간 대뇌 동맥 (MCA)을 파지하여, 뇌에서 분리하는 사후 통신 동맥 (PCA)의 시작을 올립니다. 전방 동맥 (ACA 및 MCA)를 선택하고 전방-등의 방향으로 광학 chiasm에 걸쳐 부드럽게 잡아 당깁니다. 암소의 중단을 방지하기 위해, 다른 혈관을 처리하는 절차를 중단.
- 반복은 dorsal-에서 그들을 당기는 / (PCA) (C, 그림 1)과 기저 동맥 (BA) (D, 그림 1)에 대한 3.2.2와 우수한 후방 소뇌 동맥 (SCA) 3.2.3 단계 전방 방향. 기재된 절차 I의 끝에서 중지n은 3.2.4.
- 포셉 부드럽게 당겨 전체 소를 제거합니다. 얼음처럼 차가운 PBS로 가득 찬 60 mm 페트리 접시에 소를 넣고 작은 핀 곳에서 소를 잡고, 두 집게로 남아있는 부착 된 뇌 조직을 제거합니다.
- 또는 단백질 추출 - 다음 RNA 정화 처리 (약 500 ng의 RNA 추출 수율 RNA 많은 양의)에 대한 -80 ° C에서 수확 암소 보관하십시오.
참고 : 소는 격리 된 마우스 후각 동맥 위해 개발 된 장기 목욕 시스템을 적용하여, 24 시간 동안 생체 유지 될 수있다 (7).

그림 1 : 마우스 뇌 젖소를 강조 암소가 두 개의 전방 대뇌 동맥 (ACA)에서 파생 된 두 개의 내부 경동맥 동맥 (MCA)로부터 형성된다의 복부보기의 회로도;. 뇌 바닥동맥 (BA) 후부 (PCA)과 우수 (SCA)에 분기 대뇌 동맥, 두 개의 척추 동맥 (VA).
결과
PBS를 관류 마우스를 살해하고 프로토콜의 3.2 절에 설명 된대로 소는 격리됩니다. 해부가 제대로 수행 될 때, 소는 한 조각에서 와야 인해 혈관에 잔류 혈액의 부재로 약간 투명해야한다.
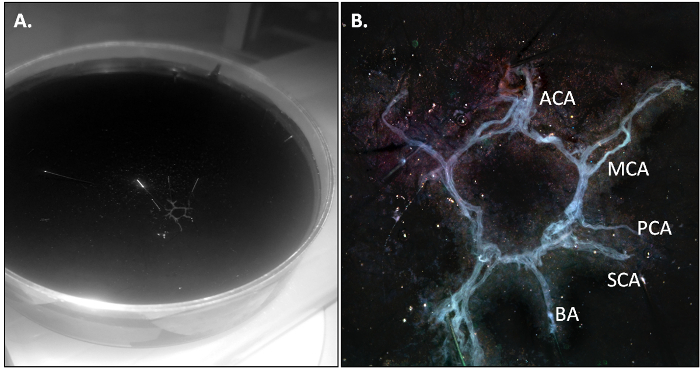
그림 2 : 분리 후 마우스 소. 10 cm 페트리 접시에서 암소...
토론
우리는 윌리스의 원의 분리 여기를 재현 프로토콜을 설명합니다. 소를 포함하는 가장 일반적인 뇌 혈관 질환은 동맥 혈관의 벽에 영향을 모두 CAA 관련 vasculopathies, 두개 내 동맥 경화 및 두개 내 동맥류이다. 위험 인자로 잘 알려져 있지만, 이들 뇌 질환의 분자 기전은 잘 알려져 있지 남아 그 발생을 예측하기위한 특정한 생물학적 마커는 부족하다. 분자 변화를 거시적 인 관찰을 연결하는 형질 전...
공개
The authors have nothing to disclose.
감사의 말
이 작품은 파리 VI 대학과 피에르 파브르 혁신 기금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
참고문헌
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유