このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ウィリスのマウスサークルを単離するためのプロトコル
要約
We describe here a reproducible protocol for isolating the mouse circle of Willis.
要約
ウィリス(のCoW)の大脳動脈輪(大脳動脈輪)または円は、脳や周囲の構造に血液を供給する光学キアズマと視床下部を取り囲む循環吻合術です。これは、脳アミロイド血管症(CAA)関連血管障害、頭蓋内アテローム性動脈硬化症と頭蓋内動脈瘤を含むいくつかの脳血管障害、に関与しています。その予防のための新規な薬物標的の同定のために、これらの疾患の根底にある分子メカニズムの研究は、動物モデルを必要とします。他のものは、ここで説明CoW.The方法は、任意のマウス系統でのCoW分離に適しており、(タンパク質産生の遺伝子の発現をスクリーニングするための大きな可能性を有しているなどの、脳血管系の単離を含むであろう一方、これらのモデルのいくつかは、トランスジェニックであってもよいです翻訳後タンパク質修飾など secretome分析、)マウスの脳の大型船舶に関する研究血管系。それはまた、単離されたマウスの嗅覚動脈のために開発された臓器槽システムを適合させることにより、ex vivoでの研究のために使用することができます。
概要
また、ウィリス(のCoW)、Willisorウィリス多角形のループの円として知られる脳動脈円(大脳動脈輪)は、)最初のそれは、光学キアズマとすることができ、視床下部の周囲に位置する循環吻合である1664にトーマス・ウィリスによって記述されました脳および周囲の構造に血液を供給する中央ハブとみなすこと。血液は、内頸動脈と椎骨動脈を経由してこの構造体に入り、それが内部の中間及び後大脳動脈を経由して、円の外に流れます。これらの動脈の各々は、円の両側の枝を左右しています。完全な円を動脈通信基底、郵便通信、及び前方( 図1及び図2)。流出動脈のいずれかに血流障害のリスクは、それによって、十分な血液がBに供給されることを保証し、頸動脈および大脳動脈の円に入る血液の融合によって最小化されます雨。この構造は、内頸動脈の重症閉塞性疾患における側副血流のための主経路として機能します。
脳血管障害のいくつかの種類の牛にその起源を持っています。最も一般的には1、2、3これらの障害が原因で血管拡張に低灌流につながる可能性があります。脳アミロイド血管症(CAA)関連血管障害、頭蓋内アテローム性動脈硬化症と頭蓋内動脈瘤であり、脳内および/またはくも膜下出血は、最終的には、虚血性または出血性脳卒中またはに変換しますせいぜい、一過性脳虚血発作。おそらく血管造影法と組み合わせた神経画像などの診断手順における最近の進歩は、それが可能な脳生検を必要とせず、臨床的にこれらの主要な脳血管疾患を診断するために行きました。それにもかかわらず、効果的かつ具体的な治療法(薬理学的または血管内)は、現在不足していると、新しい定義する必要性が存在します分子標的。
ヒトにおけるこれらの疾患の予防のための新規な薬物標的の同定は、動物モデル牛などの脳血管系を単離する方法を必要とします。このようなモデルは、頭蓋内動脈瘤、CAAまたは頭蓋内アテローム性動脈硬化症の動物モデルにおける大血管の壁に生じる、炎症性変化を含む特定の変更、にの証拠や手がかりを提供する必要があります。4、5、6
当社は、CAAのようなアルツハイマー病(AD)における血管の炎症の研究および関連疾患を容易にするために、マウスのCoWを単離するための方法を確立しました。マウスの牛を単離するためのこの方法は、疾患の進行中の炎症性脳血管遺伝子発現の評価のために開発されました。一緒に軟膜および軟膜動脈の壁内のアミロイドβ沈着の検出と、この方法は、簡単に阻止するために作ることができます鉱山炎症性脳血管壁での遺伝子発現およびAβペプチドの蓄積の間の可能な関係。くも膜下空間内の軟膜および軟膜を含む脳の血管網は、ウィリス動脈輪を形成する大きな動脈の拡張です。ここに記載された方法は、任意のマウス系統の牛を単離するために使用することができ、マウスの脳血管系の大きな血管のスクリーニング( 例えば 、遺伝子発現、タンパク質産生、および翻訳後タンパク質修飾)すべてのタイプのために使用することができます。
プロトコル
すべての手順は、動物実験(イル=ド=フランス・パリ委員会、認可4270)のためのローカルの倫理委員会の承認を得て、実験動物の管理と使用のための欧州共同体の基準に準拠して行きました。
1.麻酔
- 手術前に成体マウスにペントバルビタール(1ミリグラム/体重10gまで)を腹腔内(27ゲージの針および1-mlの注射器)の致死量を注入。
2.船舶灌流
注:血管灌流の間に目に獣医軟膏を適用する必要はありません。この手順は、(5-10分)迅速であり、動物の死で終わります。つま先のピンチと応答の欠如を確認してください。
- ちょうど胸郭の下に、腹壁および腹膜に、虹彩のはさみを使用して、切開を行い、約4センチ。
- continuその後、振動板に小切開(数ミリ長い)を作成し、E胸郭の全長に沿って振動板の切開は胸膜腔を露出させます。
- 離れて胸骨を持ち上げて、止血剤と胸骨の先端をクランプします。首に止血剤を配置します。慎重に心臓への胸骨を連結する脂肪組織をトリミングします。
- 心尖に左心室を通って15ゲージの灌流針を渡します。
- 最後に、コンセントを作成するために、肝葉の1をカットするはさみを使用しています。
注:代替出口は右心房への切開部を作成するために、虹彩のはさみを使用して作成することができます。 - 2.5ml /分の速度で作動するポンプを含むリン酸緩衝生理食塩水(PBS)の25〜50ミリリットルで動物を灌流。肝臓は血液のような湯通しをPBSに置換されるべきです。
- 肝臓からの流体が完全にクリアされた後、約5分後、灌流を停止します。
- 免疫染色や定期的な染色が計画されている場合は、パラホルムアルデヒド50mlで動物を灌流(PFA; PBS中4%)で15分間。
注:注意、PFAの煙は有毒です。 PFAと動物の灌流は、換気ドラフト内で行われるべきです。
3.脳の単離とウィリスのサークル
- 脳の単離
- 手術用ハサミで頭を削除します。
- 鼻に首から皮膚に沿って、アイリスハサミで正中切開を行います。
- 頭蓋骨を露出させ、アイリスハサミで任意の残留筋肉や脂肪組織を除去するために皮膚を切り落とします。
- 片側に大後頭孔にアイリスはさみの鋭い端を置き、慎重に(また、外耳道として知られている)外耳道に頭蓋骨の内面に沿って、それらをスライドさせます。
- 対側に3.1.4で説明切開を再現し、矢状縫合の開始に間頭頂骨の内面に沿って切断正中線を作ります。
- 植物アイリス前頭骨ではさみ、右眼の間、矢状縫合で、その後2で頭蓋骨を分割するためにそれらを開きます。
- 嗅球をつかみ、その腹面に神経接続を遮断する虹彩のはさみを使用して、脳を持ち上げます。
- 脳を外し牛の分離のための氷冷PBSを含む60 mmのペトリ皿に入れてください。完全にPBSで脳を浸します。脳は4%PFAで固定した場合(後続セク免疫染色や定期的な染色のため)、24時間4℃で4%PFAの浴に保管してください。
- ウィリス動脈輪の単離
注:解剖顕微鏡をするCoW分離のために必要とされます。脳は全体の手順を通して4℃に保たれるべきです。- 牛を可視化するために逆さまに( すなわち、その背側表面上)脳を置きます。
- (嗅覚葉の基部で前大脳動脈(ACA)をつかむために、小さな鉗子を使用して、 、図1)および及ぼす圧力容器の連続からそれらを分離します。 B( 図1)に、中大脳動脈(MCA)をカットするために、同じ手順を使用します。
- 皮質から牛を形成する主要な動脈を持ち上げて除去するために鉗子の鋭い端を使用してください。
- ピンセットで中大脳動脈(MCA)を把持することにより、脳からそれらを切断し、後方の通信動脈(PCA)の開始を持ち上げます。前方動脈(ACAとMCA)をピックアップし、前方、背側方向の視交叉上で静かにそれらを引きます。 CoWの破壊を防止するために、他の動脈に対処するための手順を中断。
- 繰り返しはdorsal-でそれらを引っ張って、3.2.2と優れたと後部小脳動脈(SCA)/(PCA)3.2.3(C、図1)および脳底動脈(BA) の(d、図1)のためのステップ前方方向。私記載された手順の最後で停止nは3.2.4。
- ピンセットで軽く引っ張ることにより、全体のCoWを削除します。氷冷PBSで満たされた60 mmのペトリ皿に牛を置き、小さなピンで所定の位置に牛を保持し、2鉗子で残っている添付の脳組織を除去します。
- またはタンパク質の抽出 - その後のRNA精製のための処理(約500 ngのRNAの抽出収率大量のRNA)のために-80℃で収穫したCoWを保管してください。
注:牛は、単離されたマウス嗅覚動脈用に開発された器官槽システムを適合させることにより、24時間のex vivoで維持することができる7。

図1:マウス脳牛をハイライト牛は2前大脳動脈(ACA)に由来している2つの内部頚動脈(MCA)、から形成されているの腹側図の略図;。脳底動脈(BA)事後(PCA)と優れた(SCA)に分岐し、脳動脈、および2つの椎骨動脈(VA)。
結果
PBS-灌流マウスが殺され、プロトコルのセクション3.2で説明したようにCoWが単離されます。解剖が正しく実行されると、牛は一枚で出てくるべきであるとによる血管系の残留血液の不在にわずかに透明であるべきです。
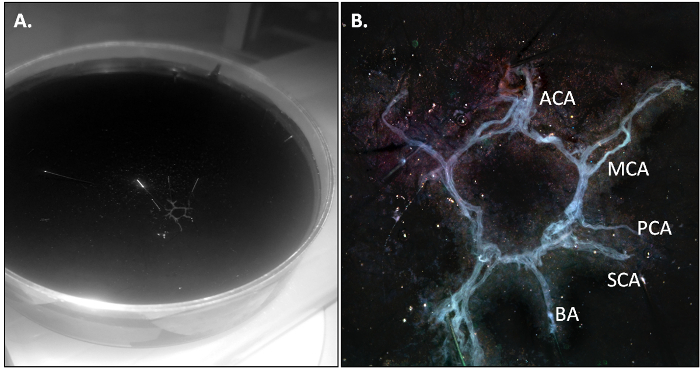
図2: 分離後のマウスのCoW。...
ディスカッション
ここではウィリス動脈輪の単離のための再現可能なプロトコルを記述します。牛を含む最も一般的な脳血管障害は、動脈血管の壁に影響を与えるのすべてがCAA関連血管障害、頭蓋内アテローム性動脈硬化症と頭蓋内動脈瘤、です。危険因子にはよく知られているが、これらの脳疾患の分子的病因はよくわかっていないままであり、その発生を予測するための特異的な生物学的マーカーが欠如?...
開示事項
The authors have nothing to disclose.
謝辞
この作品は、パリVI大学とピエールファーブルイノベーション助成金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | D8537 | |
| Dumont #55 Forceps | Fine Science Tools | 11295-51 | |
| Hardened Fine Iris Scissors | Fine Science Tools | 14090-11 | |
| Scissors - Straight / Sharp / Sharp 16.5 cm | Fine Science Tools | 14002-16 | |
| Dumont #7b Forceps | Fine Science Tools | 11270-20 | |
| Stereoscopic Zoom Microscope | Nikon | SMZ745T | |
| CellBIND Surface 60mm Culture Dish | Corning | #3295 | |
| Peristaltic Pump - MINIPULS 3 | Gilson | M312 | |
| Pentobarbital Sodique | Ceva Santé Animale | FR/V/2770465 3/1992 |
参考文献
- Beckmann, N., et al. Age-dependent cerebrovascular abnormalities and blood flow disturbances in APP23 mice modeling Alzheimer's disease. J Neurosci. 23 (24), 8453-8459 (2003).
- Sadasivan, C., Fiorella, D. J., Woo, H. H., Lieber, B. B. Physical factors effecting cerebral aneurysm pathophysiology. Ann Biomed Eng. 41 (7), 1347-1365 (2013).
- Ritz, K., Denswil, N., Stam, O., van Lieshout, J., Daemen, M. Cause and mechanisms of intracranial atherosclerosis. Circulation. 130 (16), 1407-1414 (2014).
- Tulamo, R., Frösen, J., Hernesniemi, J., Niemelä, M. Inflammatory changes in the aneurysm wall: a review. J Neurointerv Surg. 2 (2), 120-130 (2009).
- Yamada, M. Cerebral amyloid angiopathy: emerging concepts. J Stroke. 17 (1), 17-30 (2015).
- Oy, B. Intracranial atherosclerotic stroke: specific focus on the metabolic syndrome and inflammation. Curr Atheroscler Rep. 8 (4), 330-336 (2006).
- Lee, H. J., Dietrich, H. H., Han, B. H., Zipfel, G. J. Development of an ex vivo model for the study of cerebrovascular function utilizing isolated mouse olfactory artery. J Korean Neurosurg Soc. 57 (1), 1-5 (2015).
- Hosaka, K., Downes, D. P., Nowicki, K. W., Hoh, B. L. Modified murine intracranial aneurysm model: aneurysm formation and rupture by elastase and hypertension. J Neurointerv Surg. 6 (6), 474-479 (2013).
- Gauthier, S. A., Sahoo, S., Jung, S. S., Levy, E. Murine cerebrovascular cells as a cell culture model for cerebral amyloid angiopathy: isolation of smooth muscle and endothelial cells from mouse brain. Methods Mol Biol. 849, 261-274 (2012).
- Choi, S., Kim, J., Kim, K., Suh, S. Isolation and in vitro culture of vascular endothelial cells from mice. Korean J Physiol Pharmacol. 19 (1), 35-42 (2015).
- Peters, D. G., Kassam, A. B., Yonas, H., O'Hare, E. H., Ferrell, R. E., Brufsky, A. M. Comprehensive transcript analysis in small quantitiesof mRNA by SAGE-Lite. Nucleic Acids Res. 27 (24), (1999).
- Badhwar, A. Stanimirovic, Hamel, & Haqqani The proteome of mouse cerebral arteries. J Cereb Blood Flow Metab. 34 (6), 1033-1046 (2014).
- Castro, L., Brito, M., et al. Striatal neurones have a specific ability to respond to phasic dopamine release. J Physiol. 591 (13), 3197-3214 (2013).
- Hübscher, D., Nikolaev, V. Generation of transgenic mice expressing FRET biosensors. Methods Mol Biol. 1294, 117-129 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved