需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活性有机碳评估土壤中连续熏蒸孵化程序
摘要
Labile organic carbon (LOC) and the potential carbon turnover rate are sensitive indicators of changes in soil nutrient cycling processes. Details are provided for a method based on fumigating and incubating soil in a series of cycles and using the CO2 accumulated during the incubation periods to estimate these parameters.
摘要
管理措施及环境的变化能够改变土壤养分和碳循环。土壤活性有机碳,易分解碳库,对于干扰非常敏感。它也是对土壤中的微生物的一级基体,这是营养循环的基础。由于这些属性,活性有机碳(LOC)已被鉴定为用于土壤状况的指标参数。量化LOC的成交率也有助于理解土壤养分循环过程的变化。一个顺序熏蒸培养法已经发展到估算土壤LOC和电位C周转率。该方法需要熏蒸土壤样品,并在10天的潜伏期在一系列熏蒸孵化周期的量化CO 2 -C气息奄奄。不稳定的有机碳和电位C周转率,然后从积累的二氧化碳带有负指数模型外推。为进行这种方法过程描述ð。
引言
由于碳(C)和养分循环和土壤变化的敏感性及其重要的作用,土壤LOC是衡量土壤有机质质量的一个指标的重要参数。森林和农业生态系统在很大程度上依赖于养分的土壤有机质矿化作为营养来源。管理活动可以改变土壤有机碳池规模和周转率,造成营养供应1的变化。土壤有机碳组成顽抗C,其中有几千年的周转率,和LOC,其中有从几个星期到几年2,3,4周转率的两个主要组分。土壤活性C由可分解容易基材如微生物生物量碳,低分子量化合物(氨基酸,简单碳水化合物)从植物根际沉积,并分解副产品和渗沥液从植物垃圾1,4,5。由于土壤活性C是容易分解,它是管理做法和自然现象的干扰或改变土壤6高度敏感。土壤活性C作为用于有机物7分解土壤中的微生物的主要能量来源。因此,LOC影响养分循环更大程度确实比土壤有机碳8的稳定形式。土壤中的微生物也负责对由LOC 9,10,11的激发效应推动顽抗土壤有机质分解过程中发生的大多数异养呼吸。这种呼吸起着全局C周期实质性的作用,因为土壤有机碳是大约两倍,大气C 11的。
作为其在陆地生态系统的重要性因此,几种方法已被开发来估计土壤LOC。这些方法可以被划定为三个一般分类:物理,化学和生物化学。光密度分离方法是物理甲基这是由土壤有机碳分离成重或轻馏分或成粗和细颗粒有机碳12,13,14,15的消耗臭氧层物质。分离方法都比较容易进行,但是它们不经常产生一致的结果,因为这些部分与土壤类型矿物组合物,植物材料的尺寸和密度,以及土壤团粒一致性13,15变化。分离方法也产生约15 LOC只定量信息。
几种化学方法可用于LOC估计。有机碳的水萃取相对容易执行,并且这些方法往往提供容易重复的结果。然而,这些萃取不涉及可用基板的微生物15的整个范围。土壤有机碳的化学分离几种氧化方法已经被开发出来。氧化方法有特征的数量和不稳定的有机碳的质量优势虽然某些方法需要使用危险化学品的工作并且在结果15的再现方法之间的差异。酸水解的提取方法是另一种类型的可以测量的数量和LOC的质量化学分馏过程的,但这种方法的结果不会促进其生物学性质13,15的解释。
对土壤的LOC解释生化方法已经开发了。作为CO 2的呼吸测定释放由微生物活性有机C可被测定。这些检测提供了真正的矿化有机物的估计,但通常只有最不稳定化合物的测定15期间矿化。通过熏蒸孵化16和熏蒸提取17测得的土壤微生物生物量C已被用于开发约LOC推论。然而,这些程序提供C的估计中微生物生物量,而不是LOC.两个熏蒸过程包括来自非熏蒸土壤值,以确定微生物量碳的减法,但它已被提出,没有非熏蒸土壤的减法得到的值中除微生物生物量18提供C的不稳定有机级分的量度。
测量LOC连续熏蒸孵化(SFI)程序13适于从土壤微生物生物量碳计量熏蒸孵化过程16生物化学方法。该SFI方法具有一定的相对估计LOC的其他方法的优势。对于该方法的概念的基础是,LOC是微生物降解的C,它支配微生物生长和LOC是物理上访问并通过土壤中的微生物的化学降解的。在田间条件下,微生物的生长通常是由碳的可用性,营养物质的可用性,可用孔隙空间,和/或捕食的限制。这些因素是近ELIMI通过熏蒸经过NAT,从而为微生物的生长条件,畅通无阻。没有营养物中的方法的潜伏期除去。在多个熏蒸和孵化周期的过程中,微生物的生长变得被C的数量和质量(不稳定性)13限定。在孵化周期的累积二氧化碳呼出用来推断LOC用一个简单的负指数模型11,13,19。的电位C周转率也可以从指数模型的斜率导出,所以所述SFI方法具有优势的同时估计所述浓度和LOC 11的电位流动率大多数其他LOC方法。对于其他的方法,如果示踪剂如14 C的使用13只能确定在LOC的潜在流失率的信息。从而所述SFI方法是一种相对简单和廉价的用于获得既LOC及其潜在流动率的测量技术。
Access restricted. Please log in or start a trial to view this content.
研究方案
1.收集土壤的试验区单位20内并在实验条件获取的样品代表
- 确定站点属性,如坡度和土壤特性,包括质地,容重,pH值,有机地平线的深度,和/或养分含量的差异。确定小区内的植被类型的差异。使用变异系数的已知或公开的估计站点属性来估计达到预先规定的相对误差所需的样本数。
- 土壤样品使用基于现场和实验装置条件的图案的螺旋或其它收集装置。
- 对于同质条件下,使用每个实验单位内的随机采样模式。
- 在实验单元内或之字形图案要么完全随机的位置分配的采样点。
- 在每个随机点或以Z字形图案分配点样品土壤ñ。使用螺旋或其它收集装置挖掘土壤样本之前,用刷子除了矿质土壤表面的有机物。
注:SFI方法是使用从OA和低于13土层发展。进一步的测试是必要的,如果上面的oa视野可以使用SFI方法进行测试。 - 结合实验单元中采集的所有样本到单个容器和在容器内的物理混合的各个采样以创建每个实验单位的复合样品。
- 对于异构的条件,这是更为常见,使用每个实验单位内的系统抽样模式。
- 沿着各实验单元,例如中央的断面,该断面内的采样点之间的距离比的实验单元中代表变化所需的距离较小的样本的土壤。
- 沿着每个EX中的多个断面的土壤样品形成比较大的实验单位或试点单位可变性的多源网格图案perimental单位。
- 结合沿每个样采集的所有样本到单个容器和在容器内的物理混合的各个采样以创建每个断面的复合样品。
- 对于同质条件下,使用每个实验单位内的随机采样模式。
2.准备土为SFI分析
- 在冰包将样品在现场收集后冷却器立即填充。
- 一旦在设施到达在该样品在4℃下贮存直至分析,代替样品在冰箱中直至在试样制备和SFI程序进行的。
- 通过6.4毫米×6.4毫米目筛筛土壤样品。清洁每个样本之间,水网,以防止样品间污染。
- 对于每个样品,测量三个100克子样本并将100克子样本在250毫升烧杯中。封面EACħ烧杯用Parafilm和离开他们在工作台面上10天,在25℃。
3.取子样的烘干重量测定
- 在土壤样品的10天的预孵育结束时,从每个样品中取出封口膜。
- 记录的铝的重量称量船上。就拿1克土壤的所有样本并将其放置在权衡船。
- 记录潮湿土壤的重量和称重舟。
- 将称量与土壤船在105℃的烘箱中。后,将样品达到恒重,这通常是48小时后,记录的权重的称量皿和土壤。
- 减去得到湿润和干燥的土壤重量称重船内的湿润的土壤和干土所采取的权重称量体重船。通过把干土重由湿润的土壤重量潮湿的土壤比推导干燥。
4.熏蒸土壤样品
- 放置湿纸巾中的至少两个的底部(MORE可以取决于样品10.5升玻璃真空干燥器的)与瓷盘的数量是必要的。
- 对于所有的样品,称量30克土壤分成三个独立的玻璃小瓶中。用小瓶大到足以容纳40克土壤和足够窄,以适应40mm的开口内,如果使用在第5所述的培养容器设计。
- 如果使用磁带标签来识别每个30克土子样本,使用铅笔,因为熏蒸降低油墨。
- 放置两个三30克子样每个土壤样品放入真空干燥器用于熏蒸和一个子样本到真空干燥器,不会进行熏蒸。
- 在100毫升的烧杯,放置沸点足以覆盖烧杯底部石块的层。
- 倾50毫升无乙醇的氯仿( 氯仿 )插入100毫升烧杯中与沸腾石的层。放置100毫升烧杯用沸腾的石头和三氯甲烷中填充各30 g土壤干燥器的中心子样本。进行通风橱下这一步。
- 在通风橱中,使用真空煮沸氯仿熏蒸两套每个土样子样本。
- 真空连接到真空干燥器真空管。启动真空,看着氯仿开始沸腾。
- 允许氯仿从干燥器煮沸30秒和断开真空管以允许空气流回干燥器。这一步促进氯仿气体进入土壤样品。重复两次。
- 执行三氯甲烷的第四和最后的沸腾,允许它煮沸2分钟。
- 真空仍在运行,关闭密封在真空干燥器以使干燥器内的真空被保持。关闭真空并断开干燥器的真空软管。
- 通过放置在干燥器的盖和密封真空塞密封含有非熏蒸样品干燥器。 P花边在黑暗区域中的干燥器(熏蒸和非熏蒸)(诸如柜)24小时。不要重复上包含非熏蒸样本干燥器款4.7的真空程序。
5.组装容器的土样培养
- 通过一个尺寸10橡胶塞推15cm长玻璃棒在中心钻一个孔。棒直径应当足以适合通过所述孔并贴紧。
- 标记与对应于熏蒸和非熏蒸子样本识别标识为0.5L半透明广口聚丙烯瓶。
6.疏散氯仿从干燥器在通风橱
- 打开真空干燥器塞子以允许气流进入干燥器。从干燥器取下盖子,并采取样品和湿毛巾干燥器出来的。
- 使用真空,从土壤样品撤离氯仿气体。
- 将盖子的干燥器。干燥器连接到真空软管的真空。
- 开启真空泵,并允许泵五分钟运行。从干燥器断开真空管,以允许气流进入干燥器。
- 重复步骤6.3.2四倍。
7.将每个土壤次采样到培养容器(图1)进行10天的潜伏期
- 吸管加入1ml去离子水放入培养容器。一个空的玻璃小瓶连接到使用橡皮筋大小10塞子延伸玻璃棒。的玻璃小瓶的开口端应面对止动器的基础。的玻璃小瓶应该是一个尺寸足以容纳至40ml流体的。
- 将含各30 g土子样品到培养容器小瓶。
- 从原来的土壤样品添加1克非熏蒸土壤每个其相应的子样本(熏蒸和非熏蒸)作为inoculu米
- 吸管将1ml 2M的氢氧化钠插入连接到塞/玻璃棒的玻璃小瓶。推塞/玻璃棒到培养容器的顶部。覆盖用封口膜的培养容器的顶部。
- 创建包含无土壤的培养容器。组装三到五年无土壤培养容器。
注意:用于滴定的无土壤容器的样品的酸是对CO 2的矿化的发病期间,这是在第9.3以下描述的测定是必不可少的。因此,多无土容器作为对不正确的处理或无土壤培养容器,将创造二氧化碳矿化计算产生的错误,所有样品的滴定保障创建。用于滴定从没有土壤样品的容器应密切值的酸;无土壤容器样品间高度不同的酸值是可能的不正确的样品处理或滴定的结果。- 按照第5条的程序来组装培养容器。
- 按照7.1和7.4的程序。
- 放置在黑暗的存储区域中的所有培养容器在25℃。留在存储区域中的所有培养容器10天。
8.每个子样本进行滴定在潜伏期量化微生物呼吸作用产生的二氧化碳
- 除去从培养容器包含2 M氢氧化钠的玻璃小瓶。
- 吸管2毫升的1摩尔氯化钡2的成含有2M氢氧化钠的玻璃小瓶。
- 添加酚酞一滴(C 20 H 14 O 4),从吸液管或药物点滴到含有氯化钡2和NaOH的混合物中的玻璃小瓶中。放置在玻璃小瓶中的磁搅拌棒和置于玻璃小瓶上的搅拌盘。
- 随着激活搅拌盘,慢慢用滴管加0.1N盐酸,直至重新在玻璃小瓶的混合物的d-着色变清。
- 记录的HCl以改变混合物的着色的玻璃小瓶所需的量。
9.从第一熏蒸孵化周期16,21,22期间收集的数据确定微生物碳
- 在步骤3.8获得的湿润重量比由干乘以其湿润重量确定土壤中的每个子样本的干重。
- 使用确定滴定无土培养容器的HCl的平均金额。
- 用公式10天孵化期间计算二氧化碳矿化:

那里的 CO 2 = CO 10天的孵化过程中2矿化
NS =用酸滴定在无土壤培养容器样本
S =用酸滴定,在培养容器包含土壤样本
日的M =摩尔浓度Ë盐酸
E = 6,当量重量
包含在培养容器土壤的W =干重 - 用公式计算微生物量C:
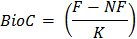
其中,BioC =土壤微生物生物量碳
土壤子样本F = CO 2矿化进行了熏蒸
从土壤子样品的NF = CO 2矿化即是非熏蒸
K =土壤微生物生物量碳矿化的分数为CO 2- 由14 C-矿化与土壤或初步测试公布的数值22的任一直接测量确定在K的值。 0.45的值通常用于K表示该测定23。
- 通过重复部分4-8七次用于第一熏蒸孵育周期被熏蒸的土壤子样本执行顺序熏蒸和孵化周期。
10. determ的INE不稳定的C和电位C周转率使用二氧化碳矿化过八熏蒸孵化周期的课程
- 使用下面的公式来确定加入到每个熏蒸后的样品土壤接种的校正因子:
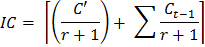
其中,IC =修正系数为接种
C'= CO 2的量从非熏蒸子样本的前10天的孵育期间
接种土壤的R =重量比为熏蒸土壤中的第一熏蒸孵化周期
(C T)=温育周期(1,2,... 8),以使得C T-1 = 0当t = 1时 - 使用下面的公式来估算每一培养每个子样本中释放的CO 2:
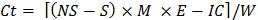
那里的Ct = CO 2孵化过程中释放
NS =用酸滴定样本在无土壤培养容器
S =用酸滴定,在培养容器包含土壤样本
IC =修正系数为接种(步骤10.1确定)
E = 6,当量重量
包含在培养容器土壤的W =干重 - 推导使用非线性回归不稳定的有机碳。
- 组织的电子表格,其包括用于对样品各样品标识符,孵化周期数(1,2,... 8),和CO 2的温育过程中释放(步骤10.2派生)。
- 能够使用非线性回归的软件,适合以下模型到数据集:

其中,Csum = CO 2的过程中八孵化周期释放的总和
LOC =土壤活性有机碳
K =潜在的周转时间
T =孵育周期(1,2,...... 8)
- 转换潜在营业额Ť由10 k的倒数乘以由于10天的潜伏期循环步骤10.3.2 IME为天。
Access restricted. Please log in or start a trial to view this content.
结果
在一系列的在美国东南部24,25,26,27进行的实验中,本文描述的已使用的所述SFI方法。总之,这些实验涵盖了多种植被类型,包括火炬松( 火炬松 ),柳枝稷( 柳枝稷 ),三叶( 美洲黑杨巴特拉姆前沼泽)和大豆(Glycine max L.大豆- )。该方法是在确定施肥中的LOC和/或电位C周转率的差异,并在所有的研究种植练习治疗敏感。有在LOC,并?...
Access restricted. Please log in or start a trial to view this content.
讨论
The SFI method is an effective protocol for detecting differences in soil LOC and potential C turnover rates over a range of management practices (such as fertilization, tillage, vegetation control, and harvest practices) and soil conditions. Soil LOC content and C turnover rate can be used to understand alterations of nutrient cycles. The SFI method also provides measurement of microbial biomass C from the first fumigation-incubation event. The ability to measure soil LOC, C turnover, and microbial biomass C concurrentl...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors have nothing to disclose.
致谢
The authors gratefully acknowledge Michelle Gonzales, Kenny Kidd, Brad Osbon, and all other personnel that conducted the laboratory procedures for these data. The authors are thankful for assistance from Andrew Scott in developing software coding to conduct model-fitting procedures. The authors also appreciate the funding from the U.S. Department of Agriculture National Institute of Food and Agriculture, Sustainable Agriculture and Research & Education, Sun Grant South Central region, and the National Council of Air and Stream Improvement that made possible the studies from which representative results provided in this paper were drawn.
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Soil auger sampling kit | JMC | PN039 | Several other manufacturers of punch augers are available |
| Parafilm | Curwood | PM999 | |
| Aluminum weighing boats | Fisherbrand | 08-732-103 | |
| General purpose drying oven | Fisher Scientific | 15-103-0511 | Many other manufacturers of general purpose laboratory ovens are available |
| 10.5 L vacuum desiccator | Corning | 3121-250 | |
| Glass scintillation vial | Wheaton | 968560 | |
| Glass threaded vials, 41 ml | Fisherbrand | 03-339-21N | |
| Chloroform, stabilized with amylenes | Sigma-Aldrich | 67-66-3 | |
| Boiling chips | Fisher Scientific | S25201 | |
| Glass rod | Fisherbrand | S63449 | |
| Size 10 rubber stopper | Fisherbrand | 14-130P | Rubber stoppers can be purchased as solid and drilled in center to install glass rod or bought with a hole to insert glass rod |
| Wide-mouth PPCO bottle, 0.5 L | ThermoScientific | 3121050016 | |
| Sodium hydroxide, reagent grade | Sigma-Aldrich | S5881 | |
| Barium chloride | Sigma-Aldrich | 202738 | |
| Phenolphthalein indicator | Fisher Scientific | S25466 | |
| Hydrochloric acid solution, 0.1 N | Fisher Scientific | SA54-4 |
参考文献
- Blair, G., et al. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Aust. J. Agric. Res. 46, 1459-1466 (1995).
- Schimel, D. S., et al. Soil organic matter dynamics in paired rangeland and cropland toposequences in North Dakota. Geoderma. 36, 201-214 (1985).
- Parton, W. J., et al. Analysis of factors controlling soil organic matter levels in great-plains grasslands. Soil Sci. Soc. Am. J. 51, 1173-1179 (1987).
- Wu, H., et al. Labile organic C and N mineralization of soil aggregate size classes in semiarid grasslands as affected by grazing management. Biol. Fertil. Soils. 48, 305-313 (2011).
- Jones, D. L., et al. Plant and mycorrhizal regulation of rhizodeposition. New Phytol. 163, 459-480 (2004).
- Harrison, K. G., et al. The effect of changing land use of soil radiocarbon. Science. 262, 725-726 (1993).
- Jinbo, Z., et al. Land use effects on the distribution of labile organic carbon fractions through soil profiles. Soil Sci Soc. Am. J. 70, 660-667 (2006).
- Whalen, J. K., et al. Carbon and nitrogen mineralization from light- and heavy-fraction additions to soil. Soil Biol Biochem. 32, 1345-1352 (2000).
- Gregorich, E. G., et al. Towards a minimum data set to assess soil organic matter quality in agricultural soils. Can. J. Soil Sci. 74, 367-385 (1994).
- Hamer, U., et al. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions. Soil Biol. Biochem. 37, 445-454 (2005).
- Feng, W., et al. Shifting sources of soil labile organic carbon after termination of plant carbon inputs in a subtropical moist forest of southwest China. Ecol. Res. 26, 437-444 (2011).
- Tisdall, J. M. Formation of soil aggregates and accumulation of soil organic matter. Structure and Organic Matter Storage in Agricultural Soils. Carter, M. R., Stewart, B. A. , Lewis Publishers. 57-96 (1996).
- Zou, X. M., et al. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biol. Biochem. 37, 1923-1928 (2005).
- Cambardella, C. A., Elliott, E. T. Particulate soil organic matter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56, 777-783 (1992).
- Strosser, E. Methods for determination of labile soil organic matter: an overview. J. Agrobiol. 27, 49-60 (2010).
- Jenkinson, D. A., Powlson, D. S. The effects of biocidal treatment on metabolism in soil V: a method for measuring soil biomass. Soil Biol. Biochem. 8, 209-213 (1976).
- Vance, E. D., et al. An extraction method for measuring soil microbial biomass C. Soil Biol. Biochem. 19, 703-707 (1987).
- De-Polli, H., et al. Chloroform fumigation-extraction labile C pool (microbial biomass C "plus") shows high correlation to microbial biomass C in Argentinian and Brazilian soils. Cienc. Suelo. 25, 15-22 (2007).
- Olson, J. S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology. 44, 322-331 (1963).
- Pennock, D., et al. Chapter 1, Unit 1, Soil sampling designs. Soil Sampling and Methods of Analysis. Carter, M. R., Gregorich, E. G. , CRC Press, Taylor & Francis Group, LLC. (2008).
- Luizao, R. C. C., et al. Seasonal variation of soil microbial biomass: the effects of clearfelling a tropical rainforest and establishment of pasture in the central Amazon. Soil Biol. Biochem. 24, 805-813 (1992).
- Horwath, W. R., Paul, E. A., et al. Microbial biomass. Methods of soil analysis part 2: microbiological and biochemical properties. Weaver, R. W. , Soil Science Society of America, Inc. 753-773 (1994).
- Jenkinson, D. S., Ladd, J. N. Microbial biomass in soil: measurement and turnover. Soil Biochemistry. Paul, E. A., Ladd, J. N. , Marcel Dekker. 415-471 (1981).
- Blazier, M. A., et al. Poultry litter fertilization impacts on soil, plant, and water characteristics in loblolly pine (Pinus taeda L.) plantations and silvopastures in the mid-South USA. Principles, application, and assessment in soil science. Gungor, E. B. O. , InTech, Inc. 43-74 (2011).
- Blazier, M. A., et al. Straw harvesting, fertilization, and fertilizer type alter soil biophysical properties in a loblolly pine plantation in the mid-South USA. Biol. Fertil. Soils. 45, 145-153 (2008).
- Blazier, M. A., et al. Loblolly pine age and density affects switchgrass growth and soil carbon in an agroforestry system. For. Sci. 58, 485-496 (2012).
- Blazier, M. A., et al. Nitrogen and carbon of switchgrass, loblolly pine, and cottonwood biofuel production systems in the Southeast United States. For. Sci. 61, 522-534 (2015).
- Zhang, M., et al. Decomposition differences of labile carbon from litter to soil in a tropical rain forest and rubber plantation of Xishuagbanna, southwest China. Eur. J. Soil Biol. 55, 55-61 (2013).
- Nelson, D. W., Sommers, L. E. Total carbon, organic carbon, and organic matter. Methods of soil analysis. Part 3: chemical methods. Sparks, D., et al. , Soil Science Society of America, Inc. 961-1090 (1996).
- Huang, L., et al. Correlation among soil microorganisms, soil enzyme activities, and removal rates of pollutants in three constructed wetlands purifying micro-polluted river water. Soil Biol. Biochem. 70, 221-228 (2012).
- Kong, L., et al. Enzyme and root activities in surface-flow constructed wetlands. Chemosphere. 76, 601-608 (2009).
- Cui, L., et al. Evaluation of nutrient removal efficiency and microbial enzyme activity in a baffled subsurface-flow constructed wetland system. Bioresour. Technol. 146, 656-662 (2013).
- Jenkinson, D. S. Determination of microbial biomass carbon and nitrogen in soil. Advances in nitrogen cycling in agricultural ecosystems. Wilson, J. R. , CAB International. 368-386 (1988).
- Sparling, G. P., et al. Interference from plant roots in the estimation of soil microbial ATP, C, N, and P. Soil Biol. Biochem. 17, 275-278 (1985).
- Christie, P., Beatte, J. A. M. Significance of sample size in measurement of soil microbial biomass by the chloroform fumigation-incubation method. Soil Biol. Biochem. 19, 149-152 (1987).
- McLaughlin, K. K., Hobbie, S. E. Comparison of labile soil organic matter fractionation techniques. Soil Sci. Soc. Am. J. 68, 1616-1625 (2004).
- Xia, X., et al. Variation of soil labile organic carbon pools along an elevational gradient in the Wuyi Mountains, China. J. Resour. Ecol. 1, 368-374 (2010).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。