Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de labile carbone organique dans le sol Utilisation des procédures séquentielles Fumigation Incubation
Dans cet article
Résumé
Labile organic carbon (LOC) and the potential carbon turnover rate are sensitive indicators of changes in soil nutrient cycling processes. Details are provided for a method based on fumigating and incubating soil in a series of cycles and using the CO2 accumulated during the incubation periods to estimate these parameters.
Résumé
Les pratiques de gestion et les changements environnementaux peuvent modifier des éléments nutritifs du sol et le cycle du carbone. Carbone organique du sol labile, une piscine facilement décomposable C, est très sensible aux perturbations. Il est également le substrat primaire pour les microorganismes du sol, ce qui est fondamental pour le recyclage des nutriments. En raison de ces caractéristiques, le carbone organique labile (LOC) a été identifié comme un paramètre d'indicateur de la santé du sol. Quantifier le taux de LOC du chiffre d'affaires contribue également à comprendre les changements dans les processus de cycle des éléments nutritifs du sol. Une méthode de fumigation d'incubation séquentielle a été développé pour estimer LOC du sol et taux de rotation du C potentiel. La méthode nécessite fumiger des échantillons de sol et de quantification du CO 2 -C respirés pendant une période de 10 jours d'incubation , au cours d' une série de cycles de fumigation-incubation. Labile C organique et le taux potentiel de chiffre d' affaires de C sont ensuite extrapolés à partir de CO 2 accumulé avec un modèle exponentiel négatif. Les procédures pour la réalisation de cette méthode sont décrireré.
Introduction
En raison de ses rôles essentiels dans le carbone (C) et le cycle des éléments nutritifs et de sa sensibilité aux changements du sol, LOC du sol est un paramètre important pour mesurer comme un indicateur de sol organique qualité de la matière. Les forêts et les agroécosystèmes dans une large mesure dépendent de la minéralisation des éléments nutritifs dans le sol de la matière organique en tant que source de nutriments. Les activités de gestion peuvent modifier la taille de la piscine et le taux de rotation du C organique du sol, ce qui entraîne des changements dans les éléments nutritifs alimentation 1. C organique du sol se compose de deux fractions primaires de C récalcitrante, qui a des taux de plusieurs milliers d' années de chiffre d'affaires, et LOC, qui a le taux de roulement de quelques semaines à quelques années 2,3,4. Le sol labile C est constitué de substrats facilement décomposables tels que la biomasse microbienne C, composés à faible poids moléculaire (acides aminés, hydrates de carbone simples) de rhizodéposition des plantes et des sous - produits de décomposition et de lixiviats de la litière végétale 1,4,5. Parce que le sol labile C est facilement décomposable, il esttrès sensible aux pratiques de gestion et les phénomènes naturels qui perturbent ou modifient le sol 6. Sol labile C sert de source d'énergie primaire pour les microorganismes du sol dans la décomposition de la matière organique 7. En tant que tel, les impacts LOC cycle des éléments nutritifs à un degré plus élevé que ne le fait des formes stables de C organique des sols 8. Les microorganismes du sol sont également responsables de la majorité de la respiration hétérotrophe qui se produit lors de la décomposition des sols en matière organique récalcitrante facilitée par l'effet d' amorçage du LOC 9,10,11. Cette respiration joue un rôle important dans les cycles mondiaux de C parce que le sol C organique est approximativement le double de celle de C atmosphérique 11.
En raison de son importance dans les écosystèmes terrestres, plusieurs méthodes ont été développées pour estimer LOC du sol. Ces méthodes peuvent être délimitées en trois catégories générales: physique, chimique et biochimique. Les méthodes de séparation densitométriques sont meth physiqueods qui consistent à séparer C organique des sols en fractions lourdes ou légères ou en grossières et fines particules organiques C 12,13,14,15. Méthodes de séparation sont relativement faciles à réaliser, mais ils ne le font pas souvent produisent des résultats cohérents parce que ces fractions varient avec la composition de type de sol minéral, végétal taille matériau et de la densité, et le sol total cohérence 13,15. Méthodes de séparation produisent également que des informations quantitatives sur LOC 15.
Plusieurs méthodes chimiques sont disponibles pour LOC estimation. extraction aqueuse de carbone organique est relativement facile à réaliser, et les méthodes fournissent souvent des résultats facilement reproductibles. Cependant, ces extractions ne concernent pas l'ensemble du spectre des substrats disponibles pour les micro - organismes 15. Plusieurs procédés d'oxydation pour le fractionnement chimique du C organique du sol ont été développés. méthodes d'oxydation ont l'avantage de caractériser la quantité et la qualité de labile organique C, Bien que certaines méthodes nécessitent un travail avec des produits chimiques dangereux et il y a variabilité entre les méthodes de la reproductibilité des résultats 15. La méthode d'extraction de l' hydrolyse acide est un autre type de procédé de fractionnement chimique qui peut mesurer la quantité et la qualité du LOC, mais les résultats de cette méthode ne facilite pas l' interprétation de ses propriétés biologiques 13,15.
méthodes biochimiques pour l'interprétation des LOC du sol ont été développés. C organique labile peut être mesurée sous forme de CO 2 libérée par les micro - organismes dans des tests respiratoires. Ces essais fournissent des estimations de la vraie matière organique minéralisable, mais en général seulement les composés les plus labiles sont minéralisés pendant les essais 15. Soil biomasse microbienne C mesurée par fumigation-incubation 16 et la fumigation-extraction 17 a été utilisé pour développer des inférences sur LOC. Toutefois, ces procédures fournissent des estimations de C de la biomasse microbienne plutôt que LOProcédures C. Les deux fumigation comprennent la soustraction de valeurs à partir du sol non fumigé pour déterminer la biomasse microbienne C, mais il a été suggéré que les valeurs obtenues sans soustraction du sol non fumigé fournir une mesure de fractions organiques labiles de C en plus de la biomasse microbienne 18 .
La fumigation séquentielle-incubation (SFI) procédure 13 de mesure LOC est une méthode biochimique adapté de la procédure de fumigation-incubation 16 pour microbienne du sol mesure biomasse C. La méthode SFI a certains avantages par rapport à d'autres méthodes d'estimation LOC. Une base conceptuelle de la méthode est que LOC est le microbiologiquement C dégradable qui régit la croissance microbienne et que LOC est physiquement accessible et chimiquement dégradable par les microorganismes du sol. Dans des conditions sur le terrain, la croissance microbienne est généralement limitée par la disponibilité de carbone, la disponibilité des nutriments, l'espace disponible de pores, et / ou la prédation. Ces facteurs sont presque elimidésigné par fumigation, créant des conditions sans entrave pour la croissance microbienne. Pas d'éléments nutritifs sont éliminés au cours de la période d'incubation de la méthode. Au cours de plusieurs cycles de fumigation et d' incubation, la croissance microbienne devient limitée par C quantité et la qualité (labilité) 13. Le CO accumulé 2 respirés pendant les cycles d'incubation est utilisé pour extrapoler LOC avec un simple modèle exponentiel 11,13,19 négatif. Le taux de rotation du C potentiel peut également être dérivé de la pente du modèle exponentiel, de sorte que la méthode SFI a l'avantage sur la plupart des autres méthodes d'estimation simultanée des concentrations et des taux de rotation du potentiel LOC 11 LOC. Pour les autres méthodes, l' information sur les taux de rotation potentiels du LOC ne peut être assurée que si les traceurs tels que 14 C sont utilisés 13. La méthode SFI est donc une technique relativement simple et peu coûteuse pour obtenir des mesures à la fois LOC et ses taux de roulement potentiels.
Protocole
1. Collecter des sols pour obtenir des échantillons représentatifs des conditions dans la zone expérimentale et dans Experimental Unités 20
- Identifier les différences dans les propriétés du site, tels que la pente et les propriétés du sol, y compris la texture, la densité apparente, le pH, la profondeur de l'horizon organique, et / ou les concentrations de nutriments. Identifier les différences de type de végétation à l'intérieur des parcelles. Utilisez des estimations connues ou publiées de coefficients de variation pour les propriétés du site pour estimer le nombre d'échantillons requis pour atteindre une erreur relative pré-spécifiée.
- sol échantillon à l'aide d'une tarière ou un autre dispositif de collecte dans un modèle basé sur le site et les conditions de l'unité expérimentale.
- Pour des conditions homogènes, utiliser un motif d'échantillonnage aléatoire au sein de chaque unité expérimentale.
- Attribuer des points d'échantillonnage à des emplacements soit complètement aléatoires dans l'unité expérimentale ou dans un motif en zigzag.
- sol échantillon à chaque point aléatoire ou à des points attribués dans un boniment zigzagn. Badigeonner côté de la matière organique à la surface du sol minéral avant d'utiliser la tarière ou un autre dispositif de collecte pour excaver échantillon de sol.
NOTE: La méthode SFI a été développée en utilisant les horizons du sol de la Oa et au- dessous 13. D'autres tests sont nécessaires si horizons au-dessus du Oa peuvent être testées en utilisant la méthode de la SFI. - Mélanger tous les échantillons prélevés dans l'unité expérimentale en un seul récipient et physiquement mélanger les échantillons individuels dans le conteneur pour créer un échantillon composite pour chaque unité expérimentale.
- Pour des conditions hétérogènes, qui sont beaucoup plus fréquentes, utiliser un modèle d'échantillonnage systématique au sein de chaque unité expérimentale.
- sols échantillon le long de la radiale dans le centre de chaque unité expérimentale de telle sorte que la distance entre les points d'échantillonnage à l'intérieur de la radiale est inférieure à la distance nécessaire pour représenter la variabilité au sein des unités expérimentales.
- sols exemples le long de plusieurs transects dans chaque exUnité expérimentale qui forment un motif de grille dans des unités relativement grandes expérimentales ou les unités expérimentales avec de multiples sources de variabilité.
- Mélanger tous les échantillons prélevés le long de chaque transect en un seul récipient et physiquement mélanger les échantillons individuels dans le conteneur pour créer un échantillon composite pour chaque transect.
- Pour des conditions homogènes, utiliser un motif d'échantillonnage aléatoire au sein de chaque unité expérimentale.
2. Préparer le sol pour le dosage SFI
- Placer les échantillons dans un sac de glace remplis refroidisseur immédiatement après le prélèvement sur le terrain.
- À l'arrivée à l'installation à laquelle les échantillons doivent être conservés jusqu'à l'analyse, placer les échantillons dans un réfrigérateur à 4 ° C jusqu'à ce que la préparation des échantillons et les procédures de la SFI sont menées.
- des échantillons de sol Sieve par 6,4 mm x 6,4 mm tamis à mailles. Nettoyer le maillage avec de l'eau entre chaque échantillon pour éviter la contamination entre les échantillons.
- Pour chaque échantillon, mesurer trois 100 sous-échantillons de g et placer les 100 g sous-échantillons dans un bécher de 250 ml. Cover each bêcher avec Parafilm et les laisser sur un comptoir pendant 10 jours à 25 ° C.
3. Prendre des sous-échantillons pour la détermination du poids sec au four
- A la fin de 10 jours de pré-incubation des échantillons de sol, retirer Parafilm de chaque échantillon.
- Enregistrez le poids d'un aluminium pèse bateau. Prendre 1 g de sol de tous les échantillons et le lieu pesée bateau.
- Noter le poids de la terre humide et peser bateau.
- Placer les bateaux avec le sol pèse dans un four à 105 ° C. Après les échantillons atteignent un poids constant, ce qui est généralement après 48 h, fiche poids des bateaux et le sol pèsent.
- Soustraire peser le poids du bateau à partir des poids prises du sol humide et le sol sec à l'intérieur du bateau peser pour obtenir le poids de sol humide et sec. Derive sec: rapport de sol humide en divisant le poids de sol sec par le poids du sol humide.
4. Fumiger échantillons de sol
- Placez une serviette en papier humide dans le fond d'au moins deux (more peut être nécessaire en fonction du nombre d'échantillons) dessiccateurs 10,5 L à vide en verre avec des assiettes en porcelaine.
- Pour tous les échantillons, peser 30 g de sol en trois flacons de verre séparés. Utilisez des flacons suffisamment grands pour contenir 40 g de sol et assez étroites pour se loger dans une ouverture de 40 mm si la conception du récipient d'incubation décrit dans la section 5 est utilisé.
- Si vous utilisez du ruban d'étiquetage pour identifier chaque 30 g sous-échantillon du sol, utiliser un crayon, car la fumigation dégrade l'encre.
- Placez deux des trois 30 sous-échantillons g pour chaque échantillon de sol dans un dessiccateur à vide pour la fumigation et un sous-échantillon dans un dessiccateur à vide qui ne sera pas effectuer la fumigation.
- Dans un bécher de 100 ml, placer une couche de pierres suffisantes pour couvrir le fond du bécher bouillante.
- Verser 50 ml de chloroforme exempt d' éthanol (CHCl 3) dans le bécher de 100 ml avec une couche de pierres d' ébullition. Placer le bêcher de 100 ml avec des pierres et le point d' ébullition du CHCI3 au centre d'un dessicateur rempli de 30 g de solsous-échantillons. Procéder à cette étape sous une hotte.
- Sous une hotte, utiliser un aspirateur pour faire bouillir l'CHCl3 pour fumiger deux ensembles de sous - échantillons par échantillon de sol.
- Connectez le vide au dessiccateur sous vide avec des tubes à vide. Démarrez le vide et regarder comme CHCl 3 commence à bouillir.
- Laisser CHCl 3 à ébullition pendant 30 secondes et débrancher le tube à vide du dessiccateur pour permettre à l' air de circuler de nouveau dans le dessiccateur. Cette étape favorise CHCl3 entrée de gaz dans les échantillons de sol. Répéter deux fois.
- Effectuer une quatrième et dernière ébullition de CHCl 3, ce qui lui permet de faire bouillir pendant 2 min.
- Avec le vide encore en cours d'exécution, fermez le sceau sur le dessiccateur sous vide de sorte que le vide dans le dessiccateur est maintenue. Éteignez l'aspirateur et débrancher le tube à vide du dessiccateur.
- Sceller le dessicateur contenant les échantillons non fumigé en plaçant un couvercle sur le dessicateur et le bouchon d'étanchéité sous vide. Placer les dessiccateurs (fumigées et non fumigées) dans une zone sombre (comme une armoire) pendant 24 heures. Ne pas répéter les procédures de vide du paragraphe 4.7 sur le dessiccateur contenant des échantillons non-fumiger.
5. Assembler Containers pour sol échantillon Incubation
- Pousser une tige de verre de 15 cm de long à travers un bouchon de caoutchouc taille 10 avec un trou percé dans le centre. Le diamètre de la tige doit être suffisante pour passer à travers le trou parfaitement.
- Etiqueter 0,5 L translucides larges bouteilles bouche en polypropylène avec identification qui correspond à l'identification du sous-échantillon fumiger et non fumiger.
6. Evacuer Chloroforme de Dessicant Sous un hottes
- Ouvrir le bouchon sur un dessicateur sous vide pour laisser l'air circuler dans le dessicateur. Retirez le couvercle du dessiccateur, et de prendre les échantillons et la serviette humide sur dessiccateur.
- Utilisez un aspirateur pour évacuer CHCl3 gaz à partir des échantillons de sol.
- Placez le couvercle sur le dessiccateur. Branchez le dessiccateur à un vide avec des tubes à vide.
- Tournez sur la pompe à vide et laisser la pompe fonctionner pendant cinq minutes. Débranchez le tube à vide du dessiccateur pour permettre le flux d'air dans le dessiccateur.
- Répétez l'étape 6.3.2 quatre fois.
7. Déplacez chaque sous-échantillon de sol dans un récipient d'incubation (figure 1) pour procéder à une incubation de 10 jours
- Introduire à la pipette 1 ml d'eau déminéralisée dans le récipient d'incubation. Connectez un flacon en verre vide à la tige de verre étendant du bouchon taille 10 à l'aide d'une bande de caoutchouc. L'extrémité ouverte de la fiole en verre doit faire face à la base du bouchon. Le flacon en verre doit être d'une taille suffisante pour contenir jusqu'à 40 ml de liquide.
- Placer un flacon contenant la sous-échantillon de 30 g de sol dans le récipient d'incubation.
- Ajouter 1 g de sol non fumigé de l'échantillon de sol d'origine à chacun de ses sous-échantillons correspondants (fumiger et fumiger non) comme inoculum.
- Introduire à la pipette 1 ml de NaOH 2 M dans le flacon en verre relié à la tige d'arrêt / verre. Pousser la tige bouchon / verre sur le dessus du récipient d'incubation. Couvrez le dessus du récipient d'incubation avec du Parafilm.
- Créer un récipient d'incubation qui ne contient pas le sol. Assembler trois à cinq sans sol conteneurs d'incubation.
REMARQUE: L'acide utilisé pour titrer des échantillons du récipient sans sol est essentielle pour la détermination de la minéralisation du CO 2 au cours de la période d'incubation, qui est décrit ci - dessous au paragraphe 9.3. A ce titre, plusieurs conteneurs de non-sols sont créés comme une protection contre une mauvaise manipulation ou un titrage d'un récipient d'incubation sans sol qui créerait une erreur dans le calcul du CO 2 de minéralisation pour tous les échantillons. L'acide utilisé pour titrer les échantillons des récipients sans sol devrait être proche de la valeur; un indice d'acide très dissemblables parmi les échantillons de conteneurs sans sol est probablement le résultat de la manipulation des échantillons incorrect ou titrage.- Suivez les procédures de l'article 5 pour assembler des récipients d'incubation.
- Suivez les procédures de 7.1 et 7.4.
- Placez tous les récipients d'incubation dans une zone de stockage obscurcie à 25 ° C. Laisser tous les récipients d'incubation dans la zone de stockage pendant 10 jours.
8. Effectuer Titration sur chaque sous - échantillon à Quantifier CO 2 Produit par Microbial Respiration au cours de la période d' incubation
- Retirer le flacon en verre contenant du NaOH 2 M à partir du récipient d'incubation.
- Introduire à la pipette 2 ml de 1 M de BaCl 2 dans le flacon en verre contenant 2 M de NaOH.
- Ajouter une goutte de phénolphtaléine (C 20 H 14 O 4) d'une pipette ou un compte- gouttes dans le flacon en verre contenant le mélange de BaCl 2 et NaOH. Placez une barre d'agitation magnétique dans le flacon en verre et placer le flacon de verre sur une plaque d'agitation.
- Avec la plaque d'agitation activé, ajouter lentement 0,1 N HCl avec une burette jusqu'à ce que le red coloration du mélange dans le flacon de verre devienne limpide.
- Enregistrer la quantité de HCl nécessaire pour changer la coloration du mélange contenu dans le flacon en verre.
9. Déterminer la biomasse microbienne C à partir de données recueillies au cours du premier cycle Fumigation-incubation 16,21,22
- Déterminer le poids sec du sol dans chaque sous-échantillon en multipliant son poids humide par le sec: humide rapport pondéral obtenu à l'étape 3.8.
- Déterminer la quantité moyenne de HCl utilisé pour titrer les récipients d'incubation sans sol.
- Calculer CO 2 minéralisée au cours de l'incubation de 10 jours selon la formule suivante :

où le CO 2 = CO 2 minéralisée au cours de l'incubation de 10 jours
NS = acide utilisé pour titrer les échantillons dans un récipient d'incubation sans sol
S = acide utilisé pour titrer des échantillons qui contenaient le sol dans le récipient d'incubation,
M = molarité de the HCl
E = 6, le poids équivalent
W = poids sec de la terre contenue dans le récipient d'incubation, - Calculer la biomasse microbienne C en utilisant la formule:
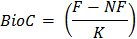
où CEOR = biomasse microbienne C
F = CO 2 minéralisée à partir des sous - échantillons de sol qui ont été fumigés
NF = CO 2 minéralisée à partir des sous - échantillons de sol qui étaient non-fumiger
K = fraction de la biomasse microbienne C minéralisé en CO 2- Déterminer la valeur de K soit par mesure directe de 14 C minéralisation dans des tests préliminaires avec le sol ou les valeurs publiées 22. Une valeur de 0,45 est couramment utilisé pour ce dosage K 23.
- Effectuer la fumigation séquentielle et cycles d'incubation en répétant les sections 4-8 sept fois pour les sous-échantillons de sol qui ont été fumigés dans le premier cycle de fumigation-incubation.
10. Détermine labile C et potentiel Taux C Chiffre d'affaires Le CO 2 minéralisée sur le cours des huit fumigation et Cycles d ' incubation
- Utilisez la formule suivante pour déterminer un facteur de correction pour l'inoculum ajoutée aux échantillons après chaque fumigation du sol:
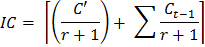
Où IC = facteur de correction pour inoculum
C '= quantité de CO 2 à partir du sous - échantillon non fumigé pendant la première incubation de 10 jours
r = rapport de poids du sol inoculum dans le sol fumigé dans le cycle d'incubation première fumigation
C t = cycle d'incubation (1, 2 ... 8), de telle sorte que C t-1 = 0 quand t = 1 - Utilisez la formule suivante pour estimer le CO 2 libéré lors de chaque incubation pour chaque sous - échantillon:
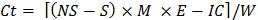
où Ct = CO 2 libéré pendant l' incubation
NS = acide utilisé pour titrer des échantillonsen aucun sol récipient d'incubation
S = acide utilisé pour titrer des échantillons qui contenaient le sol dans le récipient d'incubation,
IC = facteur de correction pour inoculum (déterminée à l'étape 10.1)
E = 6, le poids équivalent
W = poids sec de la terre contenue dans le récipient d'incubation, - Derive C organique labile en utilisant une régression non linéaire.
- Organiser une feuille de calcul qui inclut des identificateurs pour chaque échantillon de l'échantillon, le nombre de cycles d'incubation (1, 2 ... 8), et le CO 2 libéré lors de l'incubation (obtenu à l' étape 10.2).
- Utilisation d'un logiciel capable de régression non linéaire, ajuster le modèle suivant pour l'ensemble de données:

où Csum = somme de CO 2 libérée au cours des cycles d'incubation de huit
LOC = sol labile C organique
k = potentiel de temps de rotation
t = cycle d'incubation (1, 2 ... 8)
- Autre potentiel chiffre d'affaires tIme de l'étape 10.3.2 en jours en multipliant l'inverse de k par 10 en raison du cycle d'incubation de 10 jours.
Résultats
La méthode SFI a été utilisé comme décrit dans le présent document dans une série d'expériences menées dans le sud des États-Unis 24,25,26,27. Ensemble, ces expériences englobaient une variété de types de végétation, y compris le pin à encens (Pinus taeda L.), switchgrass (Panicum virgatum L.), cottonwood (Populus deltoides Bartram ex Marsh.) Et le soja (Glycine max L. Merr.). La méthode était sensible à déterminer le...
Discussion
The SFI method is an effective protocol for detecting differences in soil LOC and potential C turnover rates over a range of management practices (such as fertilization, tillage, vegetation control, and harvest practices) and soil conditions. Soil LOC content and C turnover rate can be used to understand alterations of nutrient cycles. The SFI method also provides measurement of microbial biomass C from the first fumigation-incubation event. The ability to measure soil LOC, C turnover, and microbial biomass C concurrentl...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors gratefully acknowledge Michelle Gonzales, Kenny Kidd, Brad Osbon, and all other personnel that conducted the laboratory procedures for these data. The authors are thankful for assistance from Andrew Scott in developing software coding to conduct model-fitting procedures. The authors also appreciate the funding from the U.S. Department of Agriculture National Institute of Food and Agriculture, Sustainable Agriculture and Research & Education, Sun Grant South Central region, and the National Council of Air and Stream Improvement that made possible the studies from which representative results provided in this paper were drawn.
matériels
| Name | Company | Catalog Number | Comments |
| Soil auger sampling kit | JMC | PN039 | Several other manufacturers of punch augers are available |
| Parafilm | Curwood | PM999 | |
| Aluminum weighing boats | Fisherbrand | 08-732-103 | |
| General purpose drying oven | Fisher Scientific | 15-103-0511 | Many other manufacturers of general purpose laboratory ovens are available |
| 10.5 L vacuum desiccator | Corning | 3121-250 | |
| Glass scintillation vial | Wheaton | 968560 | |
| Glass threaded vials, 41 mL | Fisherbrand | 03-339-21N | |
| Chloroform, stabilized with amylenes | Sigma-Aldrich | 67-66-3 | |
| Boiling chips | Fisher Scientific | S25201 | |
| Glass rod | Fisherbrand | S63449 | |
| Size 10 rubber stopper | Fisherbrand | 14-130P | Rubber stoppers can be purchased as solid and drilled in center to install glass rod or bought with a hole to insert glass rod |
| Wide-mouth PPCO bottle, 0.5 L | ThermoScientific | 3121050016 | |
| Sodium hydroxide, reagent grade | Sigma-Aldrich | S5881 | |
| Barium chloride | Sigma-Aldrich | 202738 | |
| Phenolphthalein indicator | Fisher Scientific | S25466 | |
| Hydrochloric acid solution, 0.1 N | Fisher Scientific | SA54-4 |
Références
- Blair, G., et al. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Aust. J. Agric. Res. 46, 1459-1466 (1995).
- Schimel, D. S., et al. Soil organic matter dynamics in paired rangeland and cropland toposequences in North Dakota. Geoderma. 36, 201-214 (1985).
- Parton, W. J., et al. Analysis of factors controlling soil organic matter levels in great-plains grasslands. Soil Sci. Soc. Am. J. 51, 1173-1179 (1987).
- Wu, H., et al. Labile organic C and N mineralization of soil aggregate size classes in semiarid grasslands as affected by grazing management. Biol. Fertil. Soils. 48, 305-313 (2011).
- Jones, D. L., et al. Plant and mycorrhizal regulation of rhizodeposition. New Phytol. 163, 459-480 (2004).
- Harrison, K. G., et al. The effect of changing land use of soil radiocarbon. Science. 262, 725-726 (1993).
- Jinbo, Z., et al. Land use effects on the distribution of labile organic carbon fractions through soil profiles. Soil Sci Soc. Am. J. 70, 660-667 (2006).
- Whalen, J. K., et al. Carbon and nitrogen mineralization from light- and heavy-fraction additions to soil. Soil Biol Biochem. 32, 1345-1352 (2000).
- Gregorich, E. G., et al. Towards a minimum data set to assess soil organic matter quality in agricultural soils. Can. J. Soil Sci. 74, 367-385 (1994).
- Hamer, U., et al. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions. Soil Biol. Biochem. 37, 445-454 (2005).
- Feng, W., et al. Shifting sources of soil labile organic carbon after termination of plant carbon inputs in a subtropical moist forest of southwest China. Ecol. Res. 26, 437-444 (2011).
- Tisdall, J. M., Carter, M. R., Stewart, B. A. Formation of soil aggregates and accumulation of soil organic matter. Structure and Organic Matter Storage in Agricultural Soils. , 57-96 (1996).
- Zou, X. M., et al. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biol. Biochem. 37, 1923-1928 (2005).
- Cambardella, C. A., Elliott, E. T. Particulate soil organic matter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56, 777-783 (1992).
- Strosser, E. Methods for determination of labile soil organic matter: an overview. J. Agrobiol. 27, 49-60 (2010).
- Jenkinson, D. A., Powlson, D. S. The effects of biocidal treatment on metabolism in soil V: a method for measuring soil biomass. Soil Biol. Biochem. 8, 209-213 (1976).
- Vance, E. D., et al. An extraction method for measuring soil microbial biomass C. Soil Biol. Biochem. 19, 703-707 (1987).
- De-Polli, H., et al. Chloroform fumigation-extraction labile C pool (microbial biomass C "plus") shows high correlation to microbial biomass C in Argentinian and Brazilian soils. Cienc. Suelo. 25, 15-22 (2007).
- Olson, J. S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology. 44, 322-331 (1963).
- Pennock, D., Carter, M. R., Gregorich, E. G., et al. Chapter 1, Unit 1, Soil sampling designs. Soil Sampling and Methods of Analysis. , (2008).
- Luizao, R. C. C., et al. Seasonal variation of soil microbial biomass: the effects of clearfelling a tropical rainforest and establishment of pasture in the central Amazon. Soil Biol. Biochem. 24, 805-813 (1992).
- Horwath, W. R., Paul, E. A., Weaver, R. W., et al. Microbial biomass. Methods of soil analysis part 2: microbiological and biochemical properties. , 753-773 (1994).
- Jenkinson, D. S., Ladd, J. N., Paul, E. A., Ladd, J. N. Microbial biomass in soil: measurement and turnover. Soil Biochemistry. , 415-471 (1981).
- Blazier, M. A., Gungor, E. B. O., et al. Poultry litter fertilization impacts on soil, plant, and water characteristics in loblolly pine (Pinus taeda L.) plantations and silvopastures in the mid-South USA. Principles, application, and assessment in soil science. , 43-74 (2011).
- Blazier, M. A., et al. Straw harvesting, fertilization, and fertilizer type alter soil biophysical properties in a loblolly pine plantation in the mid-South USA. Biol. Fertil. Soils. 45, 145-153 (2008).
- Blazier, M. A., et al. Loblolly pine age and density affects switchgrass growth and soil carbon in an agroforestry system. For. Sci. 58, 485-496 (2012).
- Blazier, M. A., et al. Nitrogen and carbon of switchgrass, loblolly pine, and cottonwood biofuel production systems in the Southeast United States. For. Sci. 61, 522-534 (2015).
- Zhang, M., et al. Decomposition differences of labile carbon from litter to soil in a tropical rain forest and rubber plantation of Xishuagbanna, southwest China. Eur. J. Soil Biol. 55, 55-61 (2013).
- Nelson, D. W., Sommers, L. E., Sparks, D., et al. Total carbon, organic carbon, and organic matter. Methods of soil analysis. Part 3: chemical methods. , 961-1090 (1996).
- Huang, L., et al. Correlation among soil microorganisms, soil enzyme activities, and removal rates of pollutants in three constructed wetlands purifying micro-polluted river water. Soil Biol. Biochem. 70, 221-228 (2012).
- Kong, L., et al. Enzyme and root activities in surface-flow constructed wetlands. Chemosphere. 76, 601-608 (2009).
- Cui, L., et al. Evaluation of nutrient removal efficiency and microbial enzyme activity in a baffled subsurface-flow constructed wetland system. Bioresour. Technol. 146, 656-662 (2013).
- Jenkinson, D. S., Wilson, J. R. Determination of microbial biomass carbon and nitrogen in soil. Advances in nitrogen cycling in agricultural ecosystems. , 368-386 (1988).
- Sparling, G. P., et al. Interference from plant roots in the estimation of soil microbial ATP, C, N, and P. Soil Biol. Biochem. 17, 275-278 (1985).
- Christie, P., Beatte, J. A. M. Significance of sample size in measurement of soil microbial biomass by the chloroform fumigation-incubation method. Soil Biol. Biochem. 19, 149-152 (1987).
- McLaughlin, K. K., Hobbie, S. E. Comparison of labile soil organic matter fractionation techniques. Soil Sci. Soc. Am. J. 68, 1616-1625 (2004).
- Xia, X., et al. Variation of soil labile organic carbon pools along an elevational gradient in the Wuyi Mountains, China. J. Resour. Ecol. 1, 368-374 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon