É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação da lábil carbono orgânico no solo usando procedimentos seqüenciais Fumigação de incubação
Neste Artigo
Resumo
Labile organic carbon (LOC) and the potential carbon turnover rate are sensitive indicators of changes in soil nutrient cycling processes. Details are provided for a method based on fumigating and incubating soil in a series of cycles and using the CO2 accumulated during the incubation periods to estimate these parameters.
Resumo
práticas de gestão e mudanças ambientais podem alterar de nutrientes do solo e ciclagem de carbono. Carbono orgânico no solo lábil, uma piscina C facilmente decomposto, é altamente sensível à perturbação. É também o principal substrato para microrganismos do solo, o que é fundamental para o ciclo de nutrientes. Devido a estes atributos, carbono orgânico lábil (LOC) tem sido identificada como um parâmetro indicador para a saúde do solo. Quantificar a taxa de rotatividade do LOC também ajuda na compreensão de mudanças nos processos de ciclagem de nutrientes do solo. Um método de fumigação incubação sequencial foi desenvolvido para estimar LOC solo e taxa de rotatividade C potencial. O método requer a fumigação de amostras de solo e quantificação de CO 2 -C respirado durante um período de incubação de 10 dias através de uma série de ciclos de incubação-fumigação. C orgânico lábil e taxa de rotatividade potencial C são então extrapolados a partir de CO 2 acumulado com um modelo exponencial negativo. Procedimentos para a realização deste método são descreverd.
Introdução
Devido às suas funções vitais em carbono (C) e ciclagem de nutrientes e sua sensibilidade às mudanças do solo, LOC solo é um importante parâmetro para medir como um indicador da qualidade da matéria orgânica do solo. Florestas e agroecossistemas para um grande grau dependem da mineralização dos nutrientes em matéria orgânica do solo como fonte de nutrientes. Actividades de gestão pode alterar o tamanho da piscina e taxa de rotatividade do solo C orgânico, resultando em mudanças no fornecimento de nutrientes 1. C orgânico do solo consiste em duas fracções primárias de C recalcitrantes, que tem taxas de rotatividade de vários milhares de anos, e LOC, que tem taxas de rotatividade de algumas semanas a alguns anos 2,3,4. Solo lábil C consiste em substratos facilmente degradáveis, tais como biomassa microbiana C, compostos de baixo peso molecular (aminoácidos, carboidratos simples) a partir rizodeposição planta, e subprodutos de decomposição e lixiviados a partir de resíduos vegetais 1,4,5. Por causa do solo lábil C é facilmente decomposto, éaltamente sensível às práticas de gestão e fenómenos naturais que perturbam ou alteração do solo 6. Solo lábil C serve como fonte primária de energia para os microrganismos do solo na decomposição da matéria orgânica 7. Como, impactos LOC ciclismo tais nutrientes a um grau maior do que as formas estáveis de solo orgânico C 8. Os microorganismos do solo também são responsáveis pela maior parte da respiração heterotrófica que ocorre durante a decomposição da matéria orgânica do solo recalcitrante facilitado pelo efeito de priming LOC 9,10,11. Esta respiração desempenha um papel substancial em ciclos globais C porque C orgânico do solo é aproximadamente o dobro da C atmosférica 11.
Como resultado da sua importância nos ecossistemas terrestre, vários métodos têm sido desenvolvidos para estimar LOC solo. Estes métodos podem ser delineados em três classificações gerais: física, química, bioquímica e. métodos de separação densitométricos são meth físicaods que consistem em separar orgânica do solo C em frações pesadas ou leves ou em grosso e partículas finas orgânica C 12,13,14,15. Métodos de separação são relativamente fáceis de executar, mas não o fazem muitas vezes produzem resultados consistentes porque essas frações depende da sua composição tipo de solo mineral, vegetal tamanho do material e densidade, e agregar consistência do solo 13,15. Métodos de separação também produzir apenas informação quantitativa sobre LOC 15.
Vários métodos químicos estão disponíveis para a estimativa LOC. extracção aquosa de carbono orgânico é relativamente fácil de realizar, e os métodos geralmente fornecem resultados facilmente reprodutíveis. No entanto, estas extracções não envolvem todo o espectro de substratos disponíveis para os microrganismos 15. Vários métodos de oxidação para fracionamento químico do solo C orgânico têm sido desenvolvidos. métodos de oxidação têm a vantagem de caracterizar a quantidade e qualidade de lábil C orgânica, Embora alguns métodos requerem trabalho com produtos químicos perigosos, e existe variabilidade entre os métodos na reprodutibilidade dos resultados 15. O método de extracção por hidrólise ácida é um outro tipo de processo de fraccionamento químico que pode medir a quantidade e qualidade de LOC, mas os resultados deste método não facilitar a interpretação das suas propriedades biológicas 13,15.
métodos bioquímicos para interpretação do LOC solo têm sido desenvolvidos. Lábil C orgânico pode ser medido como CO 2 liberado por microorganismos em ensaios de respiração. Estes ensaios fornecer estimativas de matéria orgânica mineralizável verdade, mas normalmente apenas os compostos mais instáveis são mineralizados durante os ensaios 15. Solo biomassa microbiana C medidos por fumigação-incubação de 16 e fumigação-extração 17 foi usado para desenvolver inferências sobre LOC. No entanto, estes procedimentos fornecer estimativas de C da biomassa microbiana em vez de LOC. Ambos fumigação procedimentos incluem a subtracção de valores de solo não fumigado para determinar C da biomassa microbiana, mas tem sido sugerido que os valores obtidos sem subtracção do solo não fumigado fornecer uma medida de fracções orgânicas lábeis de C, além de biomassa microbiana 18 .
O procedimento seqüencial de fumigação-incubação (SFI) 13 para medir LOC é um método bioquímico adaptado do procedimento de fumigação-incubação 16 para microbiana do solo medição de biomassa C. O método SFI tem algumas vantagens em relação a outros métodos de estimativa LOC. A base conceitual para o método é que LOC é o microbially C degradável que governa o crescimento microbiano e que LOC é fisicamente acessível e quimicamente degradáveis por microrganismos do solo. Em condições de campo, o crescimento microbiano é normalmente limitada pela disponibilidade de carbono, disponibilidade de nutrientes, espaço poroso disponíveis, e / ou predação. Esses fatores são quase eliminado por fumigação, criando condições desimpedidos para o crescimento microbiano. Sem os nutrientes são removidos durante o período de incubação do método. Ao longo de vários ciclos de fumigação e de incubação, o crescimento microbiano torna-se limitada pela quantidade e qualidade C (labilidade) 13. O CO 2 acumulado respirado durante os ciclos de incubação é usada para extrapolar LOC com um simples negativa modelo 11,13,19 exponencial. A taxa de rotação C potencial também pode ser derivado a partir do declive do modelo exponencial, de modo que o método SFI tem a vantagem sobre a maioria dos outros métodos de estimativa LOC simultaneamente as concentrações e taxa de rotação potencial de LOC 11. Para outros métodos, informações sobre as potenciais taxas de rotatividade de LOC só pode ser verificado se traçadores tais como 14 C são usados 13. O método SFI é, portanto, uma técnica relativamente simples e de baixo custo para a obtenção de medidas de ambas as suas taxas de volume de negócios potenciais LOC e.
Protocolo
1. Recolha do solo para obter amostras representativas das condições dentro da Área de Experimental e dentro Experimental Unidades 20
- Identificar quaisquer diferenças de propriedades do site, tais como propriedades de declive e solo, incluindo textura, densidade, pH, profundidade horizonte orgânico, e / ou concentrações de nutrientes. Identificar as diferenças de tipo de vegetação dentro de parcelas. Use estimativas conhecidas ou publicados de coeficientes de variação para as propriedades do site para estimar o número de amostras necessárias para atingir um erro relativo de pré-especificado.
- solo de amostra usando uma verruma ou outro dispositivo de recolha em um padrão baseado em local e condições unidade experimental.
- Para condições homogêneas, use um padrão de amostragem aleatória dentro de cada unidade experimental.
- Atribuir pontos de amostragem em ambos os locais completamente aleatórios dentro da unidade experimental ou em ziguezague.
- solo amostra em cada ponto de amostragem ou em pontos atribuídos em um padrão em ziguezaguen. Afastar matéria orgânica a partir da superfície do solo mineral antes de usar o parafuso sem fim ou outro dispositivo de recolha de amostra para escavar solo.
NOTA: O método SFI foi desenvolvido utilizando horizontes do solo do Oa e abaixo de 13. Mais testes é necessário se horizontes acima do Oa pode ser testado usando o método SFI. - Combine todas as amostras colhidas no âmbito da unidade experimental em um único recipiente e misturar fisicamente as amostras individuais dentro do recipiente para criar uma amostra composta para cada unidade experimental.
- Para condições heterogêneas, que são muito mais comuns, usar um padrão de amostragem sistemática dentro de cada unidade experimental.
- solos de exemplo ao longo do corte transversal no centro de cada unidade experimental de tal modo que a distância entre pontos de amostragem dentro do corte transversal é menor do que a distância necessária para representar a variabilidade dentro das unidades experimentais.
- solos de amostras ao longo de vários transectos dentro de cada exunidade perimental que formam um padrão de grade em relativamente grandes unidades experimentais ou unidades experimentais com múltiplas fontes de variabilidade.
- Combine todas as amostras coletadas ao longo de cada transecto em um único recipiente e misturar fisicamente as amostras individuais dentro do recipiente para criar uma amostra composta para cada transecto.
- Para condições homogêneas, use um padrão de amostragem aleatória dentro de cada unidade experimental.
2. Prepare-se do solo para o ensaio SFI
- Colocar as amostras em um bloco de gelo cheia refrigerador imediatamente após a colheita no campo.
- Após a chegada à unidade em que as amostras deverão ser armazenadas até amostras de análise, colocar no frigorífico a 4 ° C até que a preparação da amostra e os procedimentos do IFC são realizadas.
- amostras de solo peneira através de uma peneira de malha 6,4 mm x 6,4 mm. Limpar a malha com água entre cada amostra para evitar a contaminação entre amostras.
- Para cada amostra, medida três subamostras de 100 g e 100 g colocar as subamostras num copo de 250 ml. tampa each copo com Parafilm e deixá-los em uma bancada durante 10 dias a 25 ° C.
3. Subamostras demorar para Determinação peso seco em estufa
- No final dos 10 dias de pré-incubação de amostras de solo, remova Parafilm de cada amostra.
- Grave o peso de uma lata de alumínio pesam barco. Tome 1 g de solo de todas as amostras e coloque em pesam barco.
- Grave o peso do solo úmido e pesar barco.
- Coloque a barcos com solo pesar num forno a 105 ° C. Depois de as amostras atingir um peso constante, o que é geralmente após 48 horas, os pesos de gravação do solo barcos e pesar.
- Subtrair pese peso de barco a partir dos pesos tomadas do solo úmido e solo seco dentro do barco pesar para obter o peso úmido e seco do solo. Derivar a seco: relação solo úmido pela divisão do peso solo seco pelo peso solo úmido.
4. As amostras de solo Fumigar
- Coloque uma toalha de papel húmido no fundo de, pelo menos, dois (MORe pode ser necessária, dependendo do número de amostras) dessecadores 10,5 L de vácuo de vidro com pratos de porcelana.
- Para todas as amostras, pesar 30 g de solo em três frascos de vidro separados. Use frascos grandes o suficiente para armazenar 40 g de solo e estreitas o suficiente para caber dentro de uma abertura de 40 mm se a projeto recipiente de incubação descrito no capítulo 5 é utilizado.
- Se usando fita rotulagem para identificar cada 30 g subamostra de solo, usar lápis, porque a fumigação degrada tinta.
- Colocar duas das três subamostras de 30 g de cada amostra de solo num exsicador de vácuo para a fumigação e uma sub-amostra num exsicador de vácuo que não irá realizar a fumigação.
- Em um copo de 100 ml, colocar uma camada de pedras suficientes para cobrir o fundo do copo em ebulição.
- Pour 50 ml de clorofórmio isento de etanol (CHCl 3) na proveta de 100 ml com uma camada de pedras de ebulição. Colocar a proveta de 100 ml com pedras de ebulição e CHCl 3 no centro de um exsicador cheio com 30 g de solosubamostras. Realizar este passo sob uma coifa.
- De acordo com um exaustor, usar um vácuo para ferver a CHCl3 para fumigar dois conjuntos de sub-amostras por amostra de solo.
- Ligue o vácuo para o secador de vácuo com tubos de vácuo. Comece o vácuo e ver como CHCl3 começa a ferver.
- Permitir CHCl3 a ferver durante 30 segundos e desligue o tubo de vácuo do secador para permitir que o ar flua de volta para o exsicador. Este passo promove CHCl3 entrada do gás para os amostras de solo. Repita duas vezes.
- Realizar uma quarta e última fervura de CHCl 3, permitindo que a ferver durante 2 min.
- Com a vácuo ainda em execução, feche o selo no exsicador de vácuo para que o vácuo dentro do secador é mantida. Desligue o vácuo e desligue o tubo de vácuo do secador.
- Selar o exsicador contendo as amostras não fumigada, colocando uma tampa no exsicador e de vedação da tampa de vácuo. Pate os dessecadores (fumigado e não fumigadas) em uma área escurecida (tal como um armário) durante 24 h. Não repetir os procedimentos de vácuo da subseção 4.7 no exsicador contendo amostras não fumigado.
5. Monte Contentores para Solo Incubação Amostra
- Empurrar uma vareta de vidro 15 centímetros de comprimento através de uma rolha de borracha de tamanho 10 com um furo no centro. O diâmetro da haste deve ser suficiente para caber confortavelmente através do orifício.
- Rotular 0,5 L translúcidas largura garrafas de polipropileno boca com identificação que corresponde à identificação subamostra fumigado e não fumigado.
6. Evacuate clorofórmio de dessecadores Sob um Exaustor de Fumo
- Abrir o batente em um exsicador de vácuo para permitir que o fluxo de ar para o exsicador. Retire a tampa do secador, e tomar as amostras ea toalha úmida para fora do secador.
- Usar um vácuo para evacuar CHCl3 gás a partir de amostras de solo.
- Colocar a tampa no exsicador. Ligue o secador a um vácuo com tubulação vácuo.
- Ligar a bomba de vácuo e permitir a bomba funcione durante cinco minutos. Desconecte o tubo de vácuo do secador para permitir o fluxo de ar para o secador.
- Repita o passo 6.3.2 quatro vezes.
7. Mova cada subamostra de solo dentro de um recipiente de incubação (Figura 1) Conduzir uma incubação de 10 Dia
- Pipete 1 mL de água desionizada num recipiente de incubação. Conectar um frasco de vidro vazio à vara de vidro que se estende a partir da rolha de tamanho 10 usando uma tira de borracha. A extremidade aberta do frasco de vidro deve estar voltada para a base da rolha. O frasco de vidro deve ser de um tamanho suficiente para acomodar até 40 ml de líquido.
- Coloque um frasco contendo o solo sub-amostra de 30 g para dentro do recipiente de incubação.
- Adicionar 1 g de solo não fumigado a partir da amostra original do solo para cada um dos seus sub-amostras correspondentes (fumigado e não fumigado) como inoculum.
- Pipete 1 mL de NaOH a 2 m para dentro do frasco de vidro ligada à haste de tampão / de vidro. Empurrar a haste de tampão / de vidro sobre o topo do recipiente de incubação. Cobrir a parte superior do recipiente de incubação com Parafilm.
- Criar um recipiente de incubação que contém nenhum solo. Montar três a cinco recipientes de incubação no-solo.
NOTA: O ácido utilizado para titular as amostras de reservatórios sem solo é essencial para a determinação de CO 2 durante a mineralização do período de incubação, que é descrito abaixo na subsecção 9.3. Como tal, vários contentores no-solo são criados como uma salvaguarda contra a manipulação incorreta ou titulação de um recipiente de incubação no-solo que criaria um erro de cálculo mineralização de CO 2 para todas as amostras. O ácido utilizado para titular amostras dos recipientes no-solo deve ser próximo de valores; um valor de ácido altamente desiguais entre as amostras de contentores no-solo é provavelmente o resultado de manipulação da amostra incorreta ou titulação.- Siga os procedimentos da seção 5 para montar recipientes de incubação.
- Siga os procedimentos de 7.1 e 7.4.
- Coloque todos os recipientes de incubação numa área de armazenamento escureceu a 25 ° C. Deixar todos os recipientes de incubação na área de armazenamento por 10 dias.
8. Execute Titulação em cada subamostra para quantificar CO 2 Produzido por Microbial respiração durante o período de incubação
- Retirar o frasco de vidro contendo o NaOH 2 M a partir do recipiente de incubação.
- Pipetar 2 ml de 1 M de BaCl2 no frasco de vidro contendo NaOH 2 M.
- Adicionar uma gota de fenolftaleína (C 20 H 14 O 4) a partir de uma pipeta ou conta-gotas de medicamento para dentro do frasco de vidro contendo a mistura de BaCl2 e NaOH. Colocar uma barra de agitação magnética no frasco de vidro e coloque o frasco de vidro numa placa de agitação.
- Com a placa de agitação ativado, adicionar lentamente HCl 0,1 N, com uma bureta até o red coloração da mistura no frasco de vidro se torna claro.
- Registar a quantidade de HCI necessário para mudar a coloração da mistura no frasco de vidro.
9. Determinar C da biomassa microbiana a partir de dados coletados durante o primeiro ciclo de fumigação-incubação 16,21,22
- Determinar o peso seco de solo em cada subamostra multiplicando o seu peso húmido por a seco: razão de peso húmido obtido na etapa 3.8.
- Determinar a quantidade média de HCl utilizado para titular os recipientes de incubação no-solo.
- Calcular CO 2 mineralizado durante a incubação de 10 dias utilizando a fórmula:

onde CO 2 = CO 2 mineralizado durante os 10 dias de incubação
NS = ácido utilizado para titular amostras no recipiente de incubação sem solo
S = ácido utilizado para titular amostras que continham solo no recipiente de incubação
M = molaridade the HCl
E = 6, o peso equivalente
W = massa seca de solo contido no recipiente de incubação - Calcule C da biomassa microbiana utilizando a fórmula:
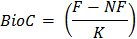
onde BIOC = C da biomassa microbiana
F = CO 2 mineralizado a partir do solo subamostras que foram fumigados
NF = CO 2 mineralizado da sub-amostras de solo que eram não-fumigado
K = fração microbiana mineralizada biomassa C em CO 2- Determinar o valor de K por qualquer medição direta de 14 C mineralização em testes preliminares com o solo ou valores publicados 22. Um valor de 0,45 é comumente utilizado para o K para este ensaio 23.
- Execute fumigação sequencial e ciclos de incubação, repetindo seções 4-8 sete vezes para os sub-amostras de solo que foram fumigadas no primeiro ciclo de fumigação-incubação.
10. determine lábil C e Potencial Taxa C Volume de negócios Usando CO 2 mineralizada ao longo de os Oito fumigação e de incubação Cycles
- Use a seguinte fórmula para determinar um fator de correção para o inóculo do solo adicionado a amostras após cada fumigação:
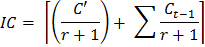
Onde IC = factor de correcção para o inóculo
C '= quantidade de CO 2 a partir do sub-amostra não fumigados durante a primeira incubação de 10 dias
r = razão de peso de solo inóculo de solo fumigado no ciclo de incubação primeira fumigação
C t = ciclo de incubação (1, 2 ... 8), de tal modo que C t-1 = 0 quando t = 1 - Use a seguinte fórmula para estimar o CO 2 liberado durante cada incubação para cada subamostra:
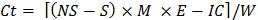
onde Ct = CO 2 liberado durante a incubação
NS = ácido utilizado para titular amostrasem no-solo recipiente de incubação
S = ácido utilizado para titular amostras que continham solo no recipiente de incubação
IC = factor de correcção para o inóculo (determinado na etapa 10.1)
E = 6, o peso equivalente
W = massa seca de solo contido no recipiente de incubação - Derivar C orgânico lábil por meio de regressão não-linear.
- Organizar uma folha de cálculo que inclui identificadores para cada amostra para a amostra, do número de ciclos de incubação (1, 2 ... 8), e CO2 libertados durante a incubação (derivado no passo 10.2).
- Usando um software capaz de regressão não-linear, ajuste o seguinte modelo para o conjunto de dados:

onde CSUM = a soma de CO 2 liberado durante os ciclos de incubação oito
LOC = solo lábil C orgânica
k = tempo de giro potencial
t = ciclo de incubação (1, 2 ... 8)
- Converso potencial volume de negócios time do passo 10.3.2 em dia por multiplicação do inverso do coeficiente k por 10, devido ao ciclo de incubação de 10 dias.
Resultados
O método SFI tem sido usado como descrito neste trabalho em uma série de experimentos realizados no sudeste dos Estados Unidos 24,25,26,27. Juntos, esses experimentos englobava uma variedade de tipos de vegetação, incluindo pinheiros loblolly (Pinus taeda L.), switchgrass (Panicum virgatum L.), cottonwood (Populus deltoides Bartram ex Marsh.) E de soja (Glycine max L. Merr.). O método foi sensível a determinar diferenças em LOC e / ou...
Discussão
The SFI method is an effective protocol for detecting differences in soil LOC and potential C turnover rates over a range of management practices (such as fertilization, tillage, vegetation control, and harvest practices) and soil conditions. Soil LOC content and C turnover rate can be used to understand alterations of nutrient cycles. The SFI method also provides measurement of microbial biomass C from the first fumigation-incubation event. The ability to measure soil LOC, C turnover, and microbial biomass C concurrentl...
Divulgações
The authors have nothing to disclose.
Agradecimentos
The authors gratefully acknowledge Michelle Gonzales, Kenny Kidd, Brad Osbon, and all other personnel that conducted the laboratory procedures for these data. The authors are thankful for assistance from Andrew Scott in developing software coding to conduct model-fitting procedures. The authors also appreciate the funding from the U.S. Department of Agriculture National Institute of Food and Agriculture, Sustainable Agriculture and Research & Education, Sun Grant South Central region, and the National Council of Air and Stream Improvement that made possible the studies from which representative results provided in this paper were drawn.
Materiais
| Name | Company | Catalog Number | Comments |
| Soil auger sampling kit | JMC | PN039 | Several other manufacturers of punch augers are available |
| Parafilm | Curwood | PM999 | |
| Aluminum weighing boats | Fisherbrand | 08-732-103 | |
| General purpose drying oven | Fisher Scientific | 15-103-0511 | Many other manufacturers of general purpose laboratory ovens are available |
| 10.5 L vacuum desiccator | Corning | 3121-250 | |
| Glass scintillation vial | Wheaton | 968560 | |
| Glass threaded vials, 41 mL | Fisherbrand | 03-339-21N | |
| Chloroform, stabilized with amylenes | Sigma-Aldrich | 67-66-3 | |
| Boiling chips | Fisher Scientific | S25201 | |
| Glass rod | Fisherbrand | S63449 | |
| Size 10 rubber stopper | Fisherbrand | 14-130P | Rubber stoppers can be purchased as solid and drilled in center to install glass rod or bought with a hole to insert glass rod |
| Wide-mouth PPCO bottle, 0.5 L | ThermoScientific | 3121050016 | |
| Sodium hydroxide, reagent grade | Sigma-Aldrich | S5881 | |
| Barium chloride | Sigma-Aldrich | 202738 | |
| Phenolphthalein indicator | Fisher Scientific | S25466 | |
| Hydrochloric acid solution, 0.1 N | Fisher Scientific | SA54-4 |
Referências
- Blair, G., et al. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Aust. J. Agric. Res. 46, 1459-1466 (1995).
- Schimel, D. S., et al. Soil organic matter dynamics in paired rangeland and cropland toposequences in North Dakota. Geoderma. 36, 201-214 (1985).
- Parton, W. J., et al. Analysis of factors controlling soil organic matter levels in great-plains grasslands. Soil Sci. Soc. Am. J. 51, 1173-1179 (1987).
- Wu, H., et al. Labile organic C and N mineralization of soil aggregate size classes in semiarid grasslands as affected by grazing management. Biol. Fertil. Soils. 48, 305-313 (2011).
- Jones, D. L., et al. Plant and mycorrhizal regulation of rhizodeposition. New Phytol. 163, 459-480 (2004).
- Harrison, K. G., et al. The effect of changing land use of soil radiocarbon. Science. 262, 725-726 (1993).
- Jinbo, Z., et al. Land use effects on the distribution of labile organic carbon fractions through soil profiles. Soil Sci Soc. Am. J. 70, 660-667 (2006).
- Whalen, J. K., et al. Carbon and nitrogen mineralization from light- and heavy-fraction additions to soil. Soil Biol Biochem. 32, 1345-1352 (2000).
- Gregorich, E. G., et al. Towards a minimum data set to assess soil organic matter quality in agricultural soils. Can. J. Soil Sci. 74, 367-385 (1994).
- Hamer, U., et al. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions. Soil Biol. Biochem. 37, 445-454 (2005).
- Feng, W., et al. Shifting sources of soil labile organic carbon after termination of plant carbon inputs in a subtropical moist forest of southwest China. Ecol. Res. 26, 437-444 (2011).
- Tisdall, J. M., Carter, M. R., Stewart, B. A. Formation of soil aggregates and accumulation of soil organic matter. Structure and Organic Matter Storage in Agricultural Soils. , 57-96 (1996).
- Zou, X. M., et al. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biol. Biochem. 37, 1923-1928 (2005).
- Cambardella, C. A., Elliott, E. T. Particulate soil organic matter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56, 777-783 (1992).
- Strosser, E. Methods for determination of labile soil organic matter: an overview. J. Agrobiol. 27, 49-60 (2010).
- Jenkinson, D. A., Powlson, D. S. The effects of biocidal treatment on metabolism in soil V: a method for measuring soil biomass. Soil Biol. Biochem. 8, 209-213 (1976).
- Vance, E. D., et al. An extraction method for measuring soil microbial biomass C. Soil Biol. Biochem. 19, 703-707 (1987).
- De-Polli, H., et al. Chloroform fumigation-extraction labile C pool (microbial biomass C "plus") shows high correlation to microbial biomass C in Argentinian and Brazilian soils. Cienc. Suelo. 25, 15-22 (2007).
- Olson, J. S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology. 44, 322-331 (1963).
- Pennock, D., Carter, M. R., Gregorich, E. G., et al. Chapter 1, Unit 1, Soil sampling designs. Soil Sampling and Methods of Analysis. , (2008).
- Luizao, R. C. C., et al. Seasonal variation of soil microbial biomass: the effects of clearfelling a tropical rainforest and establishment of pasture in the central Amazon. Soil Biol. Biochem. 24, 805-813 (1992).
- Horwath, W. R., Paul, E. A., Weaver, R. W., et al. Microbial biomass. Methods of soil analysis part 2: microbiological and biochemical properties. , 753-773 (1994).
- Jenkinson, D. S., Ladd, J. N., Paul, E. A., Ladd, J. N. Microbial biomass in soil: measurement and turnover. Soil Biochemistry. , 415-471 (1981).
- Blazier, M. A., Gungor, E. B. O., et al. Poultry litter fertilization impacts on soil, plant, and water characteristics in loblolly pine (Pinus taeda L.) plantations and silvopastures in the mid-South USA. Principles, application, and assessment in soil science. , 43-74 (2011).
- Blazier, M. A., et al. Straw harvesting, fertilization, and fertilizer type alter soil biophysical properties in a loblolly pine plantation in the mid-South USA. Biol. Fertil. Soils. 45, 145-153 (2008).
- Blazier, M. A., et al. Loblolly pine age and density affects switchgrass growth and soil carbon in an agroforestry system. For. Sci. 58, 485-496 (2012).
- Blazier, M. A., et al. Nitrogen and carbon of switchgrass, loblolly pine, and cottonwood biofuel production systems in the Southeast United States. For. Sci. 61, 522-534 (2015).
- Zhang, M., et al. Decomposition differences of labile carbon from litter to soil in a tropical rain forest and rubber plantation of Xishuagbanna, southwest China. Eur. J. Soil Biol. 55, 55-61 (2013).
- Nelson, D. W., Sommers, L. E., Sparks, D., et al. Total carbon, organic carbon, and organic matter. Methods of soil analysis. Part 3: chemical methods. , 961-1090 (1996).
- Huang, L., et al. Correlation among soil microorganisms, soil enzyme activities, and removal rates of pollutants in three constructed wetlands purifying micro-polluted river water. Soil Biol. Biochem. 70, 221-228 (2012).
- Kong, L., et al. Enzyme and root activities in surface-flow constructed wetlands. Chemosphere. 76, 601-608 (2009).
- Cui, L., et al. Evaluation of nutrient removal efficiency and microbial enzyme activity in a baffled subsurface-flow constructed wetland system. Bioresour. Technol. 146, 656-662 (2013).
- Jenkinson, D. S., Wilson, J. R. Determination of microbial biomass carbon and nitrogen in soil. Advances in nitrogen cycling in agricultural ecosystems. , 368-386 (1988).
- Sparling, G. P., et al. Interference from plant roots in the estimation of soil microbial ATP, C, N, and P. Soil Biol. Biochem. 17, 275-278 (1985).
- Christie, P., Beatte, J. A. M. Significance of sample size in measurement of soil microbial biomass by the chloroform fumigation-incubation method. Soil Biol. Biochem. 19, 149-152 (1987).
- McLaughlin, K. K., Hobbie, S. E. Comparison of labile soil organic matter fractionation techniques. Soil Sci. Soc. Am. J. 68, 1616-1625 (2004).
- Xia, X., et al. Variation of soil labile organic carbon pools along an elevational gradient in the Wuyi Mountains, China. J. Resour. Ecol. 1, 368-374 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados