Method Article
通过重组酶介导的盒式交换在重组人多能干细胞的快速高效生成
摘要
这里,我们报告在先前所描述的系统,提高了在人多能干细胞(hPSCs)的AAVS1轨迹基于RMCE迅速和有效的基因编辑方法。使用这种技术,基因系可迅速而可靠地进行适当的比较研究产生,促进与hPSCs转基因介导的研究。
摘要
即使通过CRISPR-Cas9,人类多能干细胞(hPSCs)的遗传修饰导致基因靶向技术的革命仍然是费时。比较研究使用重组线,融入避风港转基因位点可从使用特定网站定位的重组酶,如Cre重组酶或FLPE的方法,这是更快速,更不容易脱靶效应中受益。这样的方法已被描述,但它们不显著跑赢基因在大多数方面定位。用锌指核酸酶,我们先前创建在包含GFP-潮霉素-TK表达盒hPSCs的AAVS1轨迹的主细胞系,通过异型FRT序列侧翼。在这里,我们将介绍使用此行来执行FLPE重组酶介导的盒式交换(RMCE)的程序。主ÇELL线转染用RMCE供体载体,其含有一个启动子嘌呤霉素抗性,并与FLPE重组酶。两个正(嘌呤霉素)和负极(FIAU)的选择方案的应用导致RMCE的选择而不随机整合。 RMCE在15天与100%的效率产生完全多能性特征多克隆转基因株系。尽管最近描述了AAVS1轨迹的限制,便于系统铺平了道路,在同基因设置HPSC转基因的方式,是必要的对比研究,并支持半高通量遗传筛选进行功能分析的收益/损失否则会是非常费时。
引言
有针对性的基因重组在研究许多领域促进了快速发展。在小鼠中,基因组编辑和干细胞研究之间的协同作用已经允许基因功能和基因调控的复杂机制的增加了解。这样的进步,预计在人多能干细胞(hPSCs)为好,虽然多年以来人类胚胎干细胞的所述第一隔离(胚胎干细胞),和诱导后人多能干细胞(人iPS细胞),基因的编辑已构成一个技术障碍。通过有针对性的核酸,锌指核酸酶(ZFNs),转录激活因子样效应核酸酶(TALEN),或基因组工程的最新进展集群定期相互间隔短回文重复/ CRISPR相关蛋白9(CRISPR / Cas9)使我们能够克服这些困难,使得定向重组的有效方法1 - 3。
在M特异位点乌斯基因组,允许在没有像ROSA26,HPRT1,或COL1A1不良影响稳定的,可靠的,和无处不在的转基因表达,遗传研究的性能已经成为必不可少的工具。安全港座位允许等基因背景不同线路的小鼠之间的可比性分析。这不能用标准的随机整合的方法,这是与像插入突变,剂量依赖性的效果,或杂色转基因表达公知的限制相关联来实现。基因编辑易用性和灵活性,安全港位点是通过使用位点特异性重组酶的目标像酶Cre或翻转酶(FLPE),其特异性识别靶序列(loxP序列或FRT,分别)和催化相同的目标之间的高效重组增加。由于这些特性,使用的loxP或FRT序列中预先集成安全港位点的重组酶介导的基因编辑是在小鼠反式使用的常用工具成因。除了磁带盒插入或相同的靶序列之间介导切除,利用不相容的loxP或FRT位点允许重组酶介导的盒式交换(RMCE)4。
在人类,试图找出避风港位点已经进行了。鼠标直系HPRT,尽管它与失功能莱-尼综合征,和ROSA26协会已定位在hPSCs。HPRT报道迅速沉默ESC转基因表达,像ROSA26,其维持在转基因表达的能力终末分化细胞未研究5 - 7。由于CCR5基因的纯合无效突变似乎在人体耐受性良好,其作为避风港的价值进行了评估。CCR5是针对并上报维持在不同的人类细胞系,包括胚胎干细胞8,9稳定的转基因表达。然而,后者未在长期培养过程中的克隆水平证明,和无处不在的转基因表达中未三个胚层的分化后代证实。AAVS1中,腺相关病毒2型(AAV)的自然整合位点,进行了测试在人类胚胎干细胞为好,因为报道抵抗转基因沉默10。后来,许多团体使用的AAVS1轨迹和描述于未分化hPSCs稳定的转基因表达,以及在其所有三个胚层的分化后代,无论是在体外和体内 2,8,11,12。最近的结果仍然细微差别这些发现,为AAVS1基因被发现施加体外可变转基因抑制未分化的胚胎干细胞和肝细胞的后代13。
使用随机整合的途径和方法附加筛选研究,以确定单拷贝整合的目的是找到格诺期间hPSCs扩增和分化14,15到转基因沉默耐麦克风整合位点。总体来说,到现在为止,没有任何基因组位点已被完全验证为hPSCs及其后代一个安全的港湾;普适稳定的转基因表达,不仅在hPSCs而且在体外和体内的分化后代的适当位置的确定,仍有待解决。在所有的研究基因座,尽管它的局限性,AAVS1仍然是最好的,其特征在于与在干细胞研究最使用。
RMCE已hPSCs在一些这些位点6,7,14,16的顺利进行,主要使用Cre重组酶,即使有迹象表明FLPE比的Cre 17更有效。在所有这些情况下,被用于重组菌落的选择一个正药物抗性盒。虽然成功的,这些程序并不构成了标准的基因 - 技术进步采用的ZFNs编辑程序,TALENS或CRISPR / Cas9,作为一个单一的抗生素筛选过程,不排除随机整合,并要求克隆筛选,以确定正确的目标克隆。
在此过程中,我们描述的方法来在hPSCs在AAVS1轨迹使用(在预集成的磁带盒内)的阳性结合(传入盒内)和阴性选择,其允许的多克隆转基因系的产生在±15天用执行RMCE 100%的效率和免费随机整合事件。因此,这种方法代表了超出hPSCs目前描述RMCE技术进步。
研究方案
1.转染含有FRT-HPSC主细胞系的制备
- 下开启或关闭使用胚胎干细胞或无饲养的iPSC介质,分别为( 表1)灭活的小鼠胚胎成纤维细胞(IMEF)的标准方法培养的hESC / IPSC的主细胞系。制备hPSCs 2(上馈线)或1(无饲养)孔中每个实验条件下的6孔板中。
- 观察培养,当细胞达到60 - 70%汇合,板块耐药IMEF(iDR4)。简要地说,涂层用0.5mL的0.1%明胶溶液在12孔板的必要井和在室温下孵育5分钟。板每孔125000 iDR4s孵育O / N与IMEF中( 表1)。
2. HPSC转由核转
- 在37℃以下的一天,预孵育的hESC / IPSC的培养物用新鲜培养基,包括10μM的Rho相关的蛋白激酶(ROCK)抑制剂(Y-27632),1小时。 ñ分机,采取从冰箱的hESC转染溶液预先温热至室温。
- 准备1毫升,每核转条件核转电镀液( 表1)。就拿IMEF中关井,用1毫升室温PBS洗,并加入核转染的500微升电镀液。转移等500μL到无菌1.5毫升管和它们在37℃至存储电镀。注意:典型RMCE实验包含RMCE施主的分子比率三种不同的条件:2 pFLPe载体:0,2:1,和0:1。
- 分离胚胎干细胞/的iPSC成单细胞悬浮液。
- 取下媒体,用2毫升RT的PBS清洗,并添加1毫升的胰蛋白酶0.05%的Accutase馈线或无饲养HPSC文化,分别。孵育7(胰蛋白酶)或2 - 5(的Accutase)分钟,在37℃。对于治疗的Accutase - 细胞必须保持宽松,但附后。
- 小心地从孵化器,并没有删除板llowing细胞分离,通过抽吸除去解离剂。加1的hESC毫升媒体并轻轻冲洗所述板表面上的媒体,避免起泡游离松散的细胞。确保细胞是在一个单一的细胞悬浮液。
- 收集在清洁和无菌的15或50毫升管中的细胞。用1mL的hESC培养基洗井和收集细胞在相同的15或50毫升管中。采取50微升等分试样用于使用细胞计数装置计数(在下一步骤)。记下收集的体积,并计算总细胞数。降速细胞在300×g离心在RT 5分钟。
- 悬浮用5毫升血清吸管和轻柔吹打细胞沉淀的悬浮液10 6个细胞/ mL的PBS。避免起泡。传送每个实验条件(约2×10 6个细胞)来清洁,无菌的15毫升管2毫升。
- 虽然离心,预削RMCE供体- pFLPe质粒在10微升的最大体积混合。
- 转移pFLPe(6.5 KB)的2.5微克到一个干净,无菌1.5毫升管。的RMCE供体载体13的1分子比率为pFLPe矢量:一个2加。例如,大约10 12 KB RMCE供体载体的微克。
- 与核转着手,避免所有步骤起泡。
注:某些HPSC转协议适用2.4步之前的额外消耗IMEF一步。然而,在实践中,IMEF是在单个悬架不显著改变转染效率轻微细胞级分,也不会建立污染重组细胞,因为它们是非增殖。此外,这是必要在转染过程中增加存活率迅速进行。由于这些原因,IMEF耗尽不施加。- 除去iDR4板和1.5毫升管的电镀液从培养箱。一次一个管子,小心吸取掉的PBS,而不会干扰细胞沉淀。除去尽可能。轻轻吹打重悬以100μL的转染溶液沉淀。细胞悬液转移到含有质粒混合1.5毫升管,轻轻混匀。
- 转移细胞-DNA混合到transfector反应杯,注意不要引入气泡。介绍在nucleofector设备试管和应用程序A13(馈线培养细胞)或F16(馈线免费)。
注意:其他的转染方法或nucleofector设备可能需要这些程序或转染条件的优化。 - 再拿比色皿,并使用在核转染试剂盒提供的一次性移液管,收集通过应用镀介质的0.5 mL和吸取的所有卷的内容。迅速进行这一步,但轻轻一运动。
- 板滴在12-WELL板包含iDR4和电镀液500μL。在接下来的实验条件2.6.4 - 重复步骤2.6.1。
- 放置培养皿上在孵化一个架子,慢慢来回移动和侧方向均匀地分布在细胞悬浮液。孵育它的下一个媒体变化之前24小时,以使细胞在10μMROCK抑制剂(Y-27632)的存在下进行恢复。
细胞3.阳性和阴性选择接受RMCE
- 每日更换培养基(1毫升/孔),以及2 - 3天转染后,开始选择用100纳克嘌呤霉素/毫升。
注:阳性和阴性选择试剂的最佳浓度需要为每个新产生HPSC主细胞系通过实验确定。执行杀曲线13,使用主细胞系,以确定低剂量(浓度在这7后最小的视觉毒性明显选择d的,但文化不杂草丛生),最佳剂量(在此所有细胞都死了之后选择的7天的最低浓度),和高剂量(即引起明显毒性浓度,经过2杀死所有的细胞 - 3天)为嘌呤霉素和Fialuridine(FIAU)。- 吸出胚胎干细胞中。用1毫升的PBS洗涤。人类胚胎干细胞添加培养基100毫微克/嘌呤霉素毫升。
- 观察细胞的生长,使死亡和增长是平衡的。每天都在变化的媒体嘌呤,接下来的步骤3.1.1。当增长速度超越细胞死亡,增加25块嘌呤含量 - 50纳克/毫升,最多250毫微克/毫升。持续5嘌呤选择 - 7天。
- 3 - 嘌呤开始挑选,周围6天转染后4 d后,开始与0.5μMFIAU选择。每天都在变化的媒体和保持FIAU不超过7天的连续。
4. RMCE线扩建及表征
- 胎牛血清至在PBS中的细胞加起来的5%的最终浓度。转移细胞到一个干净的FACS管细胞过滤器,并保持他们在冰上。
注:细胞生存力是在这些条件下高,所以它是可能的,但不是必要的,以用于非存活细胞( 例如,7-AAD或PI)的荧光染色。 - 立即着手分析仪细胞分析仪流量和记录20,000 - 30000的事件。有关人士分析,使用WT阴性对照样品上文GFP或TDT背景花期的大门。
- 转移细胞到一个干净的1.5mL管中。降速在300×g离心在RT 5分钟,吸出上清液。继续DNA提取使用商业试剂盒,并按照制造商的说明。存放的干粒料在-20℃的纬度呃分析。
- 25分钟-根据图3中的条件和表2 13执行的PCR样品上含有1x DNA凝胶染色在150V进行15 2%琼脂糖凝胶制备标准PCR反应。分析凝胶仪运行。
结果
使用AAVS1特异性ZNFs,生成和描述13含异型FRT靶序列完全表征人类胚胎干细胞/ iPSC的主细胞系。含FRT-主细胞系维持多能性和基因组完整性的ZFN处理之后和稳定地在体外和体内表达的GFP。 RMCE通过与FLPE重组酶和RMCE施主载体( 图1A)的主细胞系的共转染进行。 RMCE载体包含在AAVS1主细胞系的那些侧翼转基因相同的FRT序列图1B监控使用组成型表达TDT PZ RMCE:。F3-P CAGGS tdTPH-F转染后,HPSC形成均匀地分布在细胞的小团体该iDR4 MEF层,并转HPSC同时表达GFP,以及暂态TDT( 图1B,D 2)。允许细胞2回收 - 3在开始选择之前ð转染后。阳性选择首先开始使用嘌呤霉素的低剂量,以有利于RMCE施主插入。嘌呤霉素在开始轻轻涂抹,因为最初的大量细胞死亡可能导致单个细胞进行重组,使它们无法生存的过程。在随后的日子里,嘌呤霉素浓度需要,以允许所述重组细胞长成小菌落而nonrecombined细胞逐渐死亡可以逐步升高到最佳剂量。
3 - 启动正选择(约6Ð转染后)4 d后,负面的选择开始,为了只为FRT介导的重组事件进行选择。 RMCE导致胸苷激酶(TK)自杀基因的损失,从而Fialuridine(FIAU)的灵敏度。在这一点上应用阴性选择,其中2小群- 4 GFP - / TDT +(RMCE)细胞能够承受FIAU( 图1B,D 6)的最佳浓度,可以防止随机整合,因为在这样的事件,在AAVS1轨迹TK基因不受影响。同时发生FRT介导与随机整合是极不可能的,被后来的表征( 图2B)在没有随机整合事件表明了这一点。
混合RMCE GFP - / TDT +菌落继续增长,而变得更均匀,因此由D 9 - 10转染后,一些没有完全选择混合RMCE菌落可以发现( 图1B)。 GFP - / TDT + RMCE菌落两者RMCE施主和FLPE仅当本(2:1)的使用,而RMCE不会在没有FLPE的发生(2:0)。与FIAU直到第13天全部选择- 15转染后产生了均匀的绿色荧光蛋白- / TDT +文化性即RMCE得到15天13,平均12.8±6.8(N = 6)普罗R / FIAU r克隆。流式细胞仪新生成RMCE线(迪普罗R / FIAUřRMCE菌落合并在nonclonal细胞群体)的表征证实了细胞的100%呈现RMCE GFP - / TDT +表型( 图2A)。当没有荧光报道的组成型表达RMCE供体被使用,所得到的迪普罗R / FIAUřRMCE HPSC线是均匀的GFP - 。
的nonclonal RMCE线的PCR表征表明了充分的盒式交换(没有主细胞系可以被检测的带盒的痕迹)和使用的选择程序产生随机自由集成线路(两者RMCE供体和的FLPE表达矢量)( 图2B)。这些结果由s进一步证明outhern印迹,此外,我们证明了RMCE线均保持多能性13。这使得它不再需要进行任何随机整合的全基因组评估或在例行RMCE实验多能性测试。总之,使用这个协议中,在自由随机整合的AAVS1轨迹HPSC的转基因细胞系可以容易地在15天与100%的效率,并且不需要广泛表征的生成。

图1:RMCE 示意图概述 ( 一 )RMCE选择程序的时间表。左:主细胞系(MCL),窝藏FRT-侧翼盒表达GFP和潮霉素-TK(三角形)与FLPE表达载体(由2A自我裂解肽连接的)中,通过核转染(NF)转染和在RMCE供体载体,WHICH包含一个启动子的嘌呤霉素抗性基因(剪接受体- SA-迪普罗R)和一个可变试验盒(Ⅹ)。右:选择嘌呤(红色三角形)和FIAU(蓝线)结束后得到新的RMCE线(RMCEL)。 (B)的RMCE使用组成型TDT表达供体和供体DNA和FLPE的DNA不同比率(0:1,2:1,2:0)用荧光显微镜监测(GFP -红色荧光-绿色荧光,TDT)在不同的的时间点。 D 2和6:比例尺代表100微米。 ð10:比例尺代表200微米。 请点击此处查看该图的放大版本。
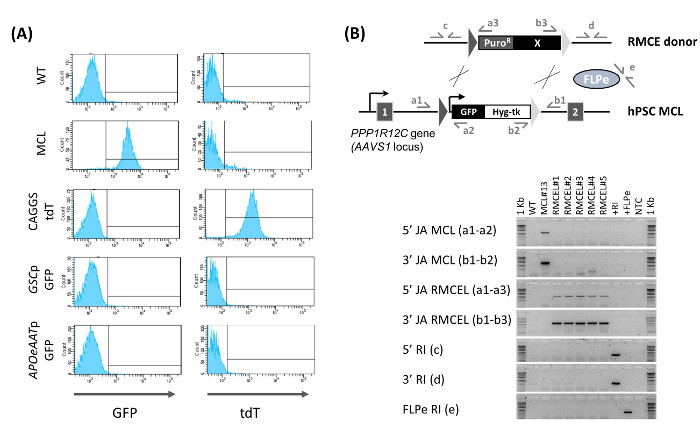
图2:RMCE线的表征 (A)RMCE测定流式细胞仪。 GFP和TDT表达示出用于WT线,主细胞系(MCL),以及使用组成型TDT表达载体(CAGGS TDT)为D 15核转染后新生成的RMCE线,或用GFP供体通过一个GOOSECOID启动子驱动(GSCP GFP,定形内胚层标记物)或AAT启动子(APOeAATp绿色荧光蛋白,肝细胞标记物)。 RMCE的(B)的确认(5'/ 3'JA RMCEL),缺席的主细胞系的(MCL)盒(5'/ 3'JA MCL),和缺乏随机整合的(5'/ 3'/ FLPE RI )通过PCR,使用所描绘的引物对。 DNA从WT,MCL,RMCE线(1 - 5),捐助RMCE向量(+ RI),FLPE表达载体和无模板对照(NTC)的使用。从图修改(Ordovas 等人 ,2015年),13。 请点击此处查看该图的放大版本。
="1"> - 页面内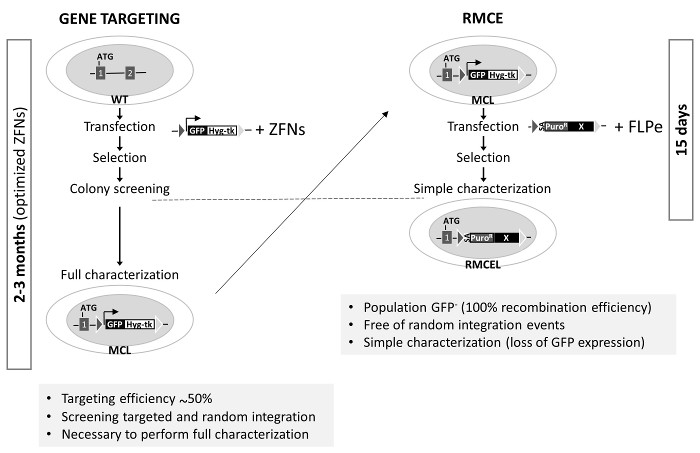
图 3. RMCE-合适主细胞株和基因的比较在 AAVS1左RMCE定位的产生 :基因打靶使用了共转染用供体(盒在图1A中的主细胞系的产生描述未修改野生型细胞,MCL)和具体的优化的ZFN。这个过程完成全面鉴定需要长达3个月。右:RMCE通过与FLPE矢量施主的共转染进行的,并在15天中产生完全表征线。在AAVS1基因打靶的效率是以前的研究1,2。 请点击此处查看该图的放大版本。
表1.媒体组成。
| 化验 | 前锋 | 相反 | 扩增子 | PCR循环 | ||
| 5'JA MCL | CACTTTGAGCTCTACTGGCTTC | CGTTACTATGGGAACATACGTCA | 1.1 KB | 95ºC,5' - [95ºC,30'' - 68°C(-0.5ºC/周),1 30''] X15 - [95ºC,30'' - 58ºC,30'' - 72ºC,1'30''] X25 - 72ºC,5' | ||
| 3'JA MCL | TAACTGAAACACGGAAGGAG | AAGGCAGCCTGGTAGACA | 1.4 KB | 95°C下,5' - [95°C下,30'' - 68℃(-0.5ºC/循环),1'30''] X15 - [95°C下,30'' - 58ºC,30'' - 72ºC, 1'30''] X25 - 72ºC,5' | ||
| 5'JA RMCEL | CACTTTGAGCTCTACTGGCTTC | CATGTTAGAAGACTTCCTCTGC | 1.1 KB | 95°C下,5' - [95°C下,30'' - 68℃(-0.5ºC/循环),1'30''] X15 - [95°C下,30'' - 58ºC,30'' -72ºC,1'30''] X25 - 72ºC,5' | ||
| 3'JA RMCEL | TTCACTGCATTCTAGTTGTGG | AAGGCAGCCTGGTAGACA | 1.5 KB | 95°C下,5' - [95°C下,30'' - 68℃(-0.5ºC/循环),1'30''] X15 - [95°C下,30'' - 58ºC,30'' - 72ºC, 1'30''] X25 - 72ºC,5' | ||
| 5'RI DONOR | GTACTTTGGGGTTGTCCAG | TTGTAAAACGACGGCCAG | 0.5 KB | 95ºC,5' - [95ºC,30'' - 60ºC,30'' - 72ºC,30''] X25 - 72ºC,5' | ||
| 3'RI DONOR | CCTGAGTTCTAACTTTGGCTC | ACACAGGAAACAGCTATGAC | 0.5 KB | 95ºC,5' - [95ºC,30'' - 60ºC,30'' - 72ºC,30''] X25 - 72ºC,5' | ||
| RI FLPE | CCTAGCTACTTTCATCAATTGTG | GTATGCTTCCTTCAGCACTAC | 0.65 KB | 95ºC,5' - [95ºC,30'' - 60ºC,30'' - 72ºC,30''] X25 - 72ºC,5' | ||
用于PCR的基因分型。从Ordovas 等人,2015年13改性表2引物集 。
讨论
在安全港的基因位点的编辑方法有待开发转基因在hPSCs一个必不可少的工具。虽然AAVS1的安全港角色,最近被质疑对某些应用13,18,该位点目前仍然是最好的特征来源于人的细胞系。它在hPSCs局限性的认识可以帮助获取可靠的数据。因此,AAVS1仍有望成为有用的站点,例如,对于GAIN-功能失和研究或要求内和确定的遗传背景之间的等基因上下文因子诱导/组成型表达。
该AAVS1轨迹已通过使用的ZFN,TALEN或CRISPR / Cas9 1,2,19许多组的目标。这些核酸显著增加同源重组的效率在一个确定的轨迹。然而,这一进程筛选并充分体现正确靶克隆,随意自由的INTEG配给并保持多能性和基因组的完整性可能需要长达3个月(使用优化的基因编辑工具)( 图3)。最后两个可以通过脱靶核酸酶活性产生的可能突变而引起。这里使用的RMCE系统,但是,提供了一个快速,高效,优雅的方式来实现这一目标只有两个星期,一旦特异性重组酶靶序列被预先集成到AAVS1轨迹。正/负选择和适当的选择程序的使用是造成基因编辑由RMCE的AAVS1轨迹简化的主要因素。
新转基因系的基因型表征显著减少(没有克隆筛选是必要的),以及相关联的脱靶核酸酶活表征由于FLPE为FRTS特异性呈现可有可无。表征也可以在常规RMCE实验通过展示减少从主细胞系( 图2A)GFP表达的完全丧失,因为充分的盒式交换和缺乏随机整合的已被充分利用PCR( 图2B)显示出与Southern印迹13。使用正/负的选择也构成与以前的报告的主要区别。先前在hPSCs描述RMCE,无论是在AAVS1或其他基因座若干组,仅采用单一的阳性选择步骤7,14,16。这并不构成在与核酸进行基因编辑的一大技术优点,因为克隆筛选具有以证明在克隆水平正确整合和不存在随机整合的可同样进行。
在多个人类胚胎干细胞/ iPSC系本RMCE系统的使用需要在每个独立的线路的AAVS1轨迹所描述的含有FRT-盒的preintegration。然而,一旦产生,其快速性和简单性使得有可能开发否则上面提到的应用中定义的等基因设置半高通量遗传筛选将是技术上非常费时。此外,所有的RMCE载体用于靶向与的ZFN轨迹的PZ AAVS1基因靶向载体内构造,但TALENS或CRISPR / Cas9也报告。该RMCE向量的对偶是产生多行中具有或不具有FRT hPSCs确定的转基因是非常有用的。例如,一击证明成功地由RMCE进行了确定的遗传筛选将理想需要在多个HPSC线进行测试,以证实结果。在没有多RMCE,适合主细胞系时,可以进行直接利用基因核酸命中定位。在RMCE载体的双重特性的工具,得到了广大组20证实。在这项研究中,基因修正在源自患者的进行额颞叶痴呆(FTD)而承受引起PROGRANULIN(PGRN)的表达缺失的突变iPS细胞。通过在还原PGRN水平盒的AAVS1轨迹的ZFN介导的插入基因互补,校正与所述突变的存在相关联corticogenesis缺陷表型。此外,通过在WT的hESC RMCE产生的可比线被用作外源PGRN表达的控制。
在没有重组菌落,检查RMCE供体载体转染效率。优于30%的转染效率,得到上述结果。较低的转染效率降低重组效率。最后,已在AAVS1轨迹生成的RMCE系统,但它也适用于任何其它轨迹。
披露声明
The authors have nothing to disclose.
致谢
L.O. was funded by IWT/OZM/090838, IACS BPAMER3/08/04, and the Government of Aragon FMI048/08; RB by IWT fellowship SB-121396; M.P. by FWO 1288714N; and R.S. by the Dutch Diabetes Foundation. N.H., J.V., K.C., and Q.C. were supported by IWT fellowships SB-121396, SB-101230, SB-91228, and SB-093228, respectively. Funding to C.M.V. was from FWO G.0667.07, G.0975.11, and KU Leuven (EIW-B4855-EF/05/11, ETH-C1900-PF, EME-C2161-GOA/11/012), IWT-HEPSTEM, BELSPO-IUAP-DEVREPAIR, FP7-HEMIBIO (266777).
材料
| Name | Company | Catalog Number | Comments |
| DR4 Mouse Embryonic Fibroblasts (MEF) | AMS bio | GSC-6204G | hPSC culture on feeers |
| CF-1 MEF, mitomycin-C treated | AMS Bio | GSC-6001M | |
| EmbryoMax 0.1% Gelatin Solution | Millipore | ES-006-B | iMEF plating |
| DMEM/F-12, HEPES | Gibco | 31330-038 | |
| KnockOut Serum Replacement | Gibco | 10828-028 | |
| L-Glutamine | Sigma Aldrich | G8540 | For hESC medium |
| L-Glutamine 200 mM | Gibco | 25030-081 | For iMEF medium |
| 2-Mercaptoethanol 50 mM | Gibco | 31350-010 | |
| MEM Non-Essential Amino Acids Solution (100X) | Gibco | 11140-035 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Human basic FGF | Peprotech | 100-18C | |
| Y-27632 in Solution | VWR | 688001-500 | |
| DMEM High Glucose | Gibco | 41965-039 | |
| Fetal Bovine Serum | Sigma Aldrich | F7524 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300-054 | hPSC culture on feeders |
| Matrigel hESC qualified | VWR | 734-1440 | |
| mTeSR1 complete medium kit | Stem cell technologies | 05850 | For Feeder free culture |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | For feeder free culture |
| Y-27632 in solution | VWR | 56726 | |
| Human Stem Cell Nucleofector Kit 2 | Lonza | VVPH-5022 | |
| Puromycine Dihydrochloride | Gibco | A11138-03 | |
| FIAU (Fialuridine) | ABX | 2910 | |
| Hygromycin B | Sigma Aldrich | H3274 | |
| pFLPe | Modified to from pCAGGS-FLPe (MES4488, Open Biosystems) to remove puromycin | ||
| RMCE donors | - | - | Modified from pZ donor AAVS1 puromycin vector (PZD0020-1KT, Sigma Aldrich)13 |
| 5mL Round Bottom Polystyrene Test Tube, with Cell Strainer | Falcon | 352235 | |
| PureLink Genomic DNA kit | Invitrogen | K182001 | |
| GoTaq Flexi DNA Polymerase | Promega | M8298 | |
| Agarose | Sigma | A9539 | |
| SYBR Safe DNA Gel Stain | Invitrogen | S33102 | |
| Nucleofector 2b Device | Lonza (Amaxa) | AAB-1001 | |
| NucleoCounter NC-100 | Chemometec | NC-100 | |
| BD FACS Canto | BD Biosciences | 337175 | |
| NucleoCassette | Chemometec | 941-0002 |
参考文献
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nat. Biotechnol. 29 (8), 731-734 (2011).
- Hockemeyer, D., et al. Efficient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-finger nucleases. Nat. Biotechnol. 27 (9), 851-857 (2009).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Baer, A., Bode, J. Coping with kinetic and thermodynamic barriers: RMCE, an efficient strategy for the targeted integration of transgenes. Curr. Opin. Biotechnol. 12 (5), 473-480 (2001).
- Sakurai, K., et al. Efficient integration of transgenes into a defined locus in human embryonic stem cells. Nucleic Acids Res. 38 (7), e96 (2010).
- Irion, S., et al. Identification and targeting of the ROSA26 locus in human embryonic stem cells. Nat. Biotechnol. 25 (12), 1477-1482 (2007).
- Di Domenico, A. I., Christodoulou, I., Pells, S. C., McWhir, J., Thomson, A. J. Sequential genetic modification of the hprt locus in human ESCs combining gene targeting and recombinase-mediated cassette exchange. Cloning Stem Cells. 10 (2), 217-230 (2008).
- Lombardo, A., et al. Site-specific integration and tailoring of cassette design for sustainable gene transfer. Nat. Methods. 8 (10), 861-869 (2011).
- Lombardo, A., et al. Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery. Nat. Biotechnol. 25 (11), 1298-1306 (2007).
- Simth, J. R., et al. Robust , Persistent Transgene Expression in Human Embryonic Stem Cells Is Achieved with AAVS1-Targeted Integration. Stem Cells. 26, 496-504 (2008).
- DeKelver, R. C., et al. Functional genomics, proteomics, and regulatory DNA analysis in isogenic settings using zinc finger nuclease-driven transgenesis into a safe harbor locus in the human genome. Genome Res. 20 (8), 1133-1142 (2010).
- Qian, K., et al. A simple and efficient system for regulating gene expression in human pluripotent stem cells and derivatives. Stem Cells. 32 (5), 1230-1238 (2014).
- Ordovás, L., et al. Efficient Recombinase-Mediated Cassette Exchange in hPSCs to Study the Hepatocyte Lineage Reveals AAVS1 Locus-Mediated Transgene Inhibition. Stem Cell Reports. 5 (5), 918-931 (2015).
- Du, Z. -. W., Hu, B. -. Y., Ayala, M., Sauer, B., Zhang, S. -. C. Cre recombination-mediated cassette exchange for building versatile transgenic human Embryonic Stem Cells lines. Stem Cells. 27, 1032-1041 (2009).
- Papapetrou, E. P., et al. Genomic safe harbors permit high β-globin transgene expression in thalassemia induced pluripotent stem cells. Nat. Biotechnol. 29 (1), 73-78 (2011).
- Ramachandra, C. J., et al. Efficient recombinase-mediated cassette exchange at the AAVS1 locus in human embryonic stem cells using baculoviral vectors. Nucleic Acids Res. 39 (16), e107 (2011).
- Takata, Y., Kondo, S., Goda, N., Kanegae, Y., Saito, I. Comparison of efficiency between FLPe and Cre for recombinase-mediated cassette exchange in vitro and in adenovirus vector production. Genes to Cells. 16 (7), 765-777 (2011).
- Mizutani, T., Li, R., Haga, H., Kawabata, K. Transgene integration into the human AAVS1 locus enhances myosin II-dependent contractile force by reducing expression of myosin binding subunit 85. Biochem. Biophys. Res. Commun. 465 (2), 270-274 (2015).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Raitano, S., et al. Restoration of progranulin expression rescues cortical neuron generation in an induced pluripotent stem cell model of frontotemporal dementia. Stem Cell Reports. 4 (1), 16-24 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。