Method Article
Быстрое и эффективное создание рекомбинантного человеческого плюрипотентных стволовых клеток с помощью рекомбинантному-опосредованной кассетные бирже в
В этой статье
Резюме
Мы сообщаем быстрый и эффективный способ редактирования гена , основанный на RMCE в AAVS1 локуса плюрипотентных стволовых клеток человека (hPSCs) , который усовершенствует ранее описанных системах. С помощью этого метода, изогенных линий могут быть быстро и надежно генерироваться для собственных сравнительных исследований, содействие Трансгенез-опосредованного исследования с hPSCs.
Аннотация
Даже с революцией генных таргетирования технологий во главе с CRISPR-cas9, генетической модификации человека плюрипотентных стволовых клеток (hPSCs) по - прежнему занимает много времени. Сравнительные исследования, которые используют рекомбинантные линии с трансгенов интегрированы в безопасной гавани локусов может извлечь выгоду из подходов, которые используют сайт-специфических целевых рекомбиназ, как Cre или FLPe, которые являются более быстрым и менее склонны к вне целевых эффектов. Такие способы были описаны, хотя они этого не делают значительно опережать ген таргетирования в большинстве аспектов. Использование нуклеазы цинка пальцами, ранее мы создали линию мастер - клеток в AAVS1 локус hPSCs , который содержит GFP-гигромицину тк , выражающую кассету, по бокам гетеротипичной последовательностей FRT. Здесь мы описываем процедуры для выполнения FLPe рекомбиназа-опосредованного обмена кассета (RMCE), используя эту строку. Мастер сELL линия трансфицируют вектором донора RMCE, который содержит пуромицин сопротивление без промотора, и с FLPe рекомбиназы. Применение как программы селекции положительный (Пуромицин) и отрицательные (ФИАУ) приводит к выбору RMCE без случайных интеграций. RMCE генерирует полностью охарактеризован плюрипотентных поликлональные трансгенные линии в 15 г с 100% эффективностью. Несмотря на недавно описал ограничения AAVS1 локуса, легкость системы прокладывает путь к HPSC трансгеноза в изогенных настройках, необходимо для проведения сравнительных исследований, а также позволяет полу-высокой пропускной способности генетические экраны для усиления / потери функционального анализа , который бы в противном случае отнимает много очень много времени.
Введение
Целенаправленное генома рекомбинации способствовало быстрое развитие во многих областях исследований. У мышей, синергия между редактирования генома и исследования стволовых клеток позволило добиться более глубокого понимания сложного механизма функции генов и регуляции генов. Такой прогресс, как ожидается, в человеческих плюрипотентных стволовых клеток (hPSCs), а также, хотя и в течение многих лет с момента первого выделения эмбриональных стволовых клеток человека (ЭСК), а затем и человека индуцированных плюрипотентных стволовых клеток (hiPSCs), редактирование ген представляет собой технический барьер , Последние достижения в области генной инженерии с использованием целевых нуклеазы-цинковый палец нуклеаз (ZFNs), активатора транскрипции, как эффекторные нуклеазы (Talen) или кластерной регулярно interspaced короткий палиндромные повторы / CRISPR-ассоциированный белок 9 (CRISPR / cas9) позволили нам преодолеть эти трудности, делая целевой рекомбинации эффективный процесс 1 - 3.
Удельная локусы в мУз генома , которые позволяют стабильную, надежную и повсеместное экспрессию трансгена в отсутствие побочных эффектов , таких как Rosa26, Hprt1 или COL1A1, стали важными инструментами в выполнении генетических исследований. Safe Harbor локусы позволяют сравнительный анализ между различными линиями мышей в изогенных контекстах. Это не может быть достигнуто с использованием стандартных методов случайной интеграции, которые связаны с известными ограничениями, как инсерционного мутагенеза, дозозависимое эффектов или пестрой экспрессии трансгена. Джин редактирования легкость и гибкость в безопасной гавани локусов увеличивается за счет использования конкретных участков целевых рекомбиназ как Cre или флиппазы (FLPe), которые специфически распознают последовательности-мишени (LoxP или FRT, соответственно) и катализируют эффективной рекомбинации между идентичными целям. Благодаря этим характеристикам, рекомбиназа-опосредованной редактирование гена с использованием LoxP или FRT последовательности в предварительно интегрированных безопасной гавани локусов является обычным инструментом, используемым в транс мышигенеза. В дополнение к вставке кассеты или иссечения опосредованного между идентичными последовательностями - мишенями, использование несовместимых LoxP или FRT сайтов позволяет рекомбинантному-опосредованный обмен кассеты (RMCE) 4.
У человека, пытается определить безопасные локусы гавань проводились. Мышь ортологичными HPRT, несмотря на ассоциацию с Леша-Nyhan синдром с потерей функции и ROSA26 были направлены в hPSCs. HPRT сообщалось быстро заглушить экспрессию трансгена в ESC и, как ROSA26, его способность поддерживать экспрессию трансгена в терминально дифференцированных клеток не было исследовано 5 - 7. Поскольку гомозиготные нулевая мутация гена CCR5 , как представляется, хорошо переносится в организме человека, его ценность в качестве безопасной гавани была оценена. CCR5 была направлена и сообщил , чтобы поддерживать стабильную экспрессию трансгенов в различных клеточных линиях человека, в том числе ESCs 8,9. Однако,последняя не была доказана на клоновых уровне в течение долгосрочного культуры, и экспрессия вездесущи трансген не была продемонстрирована в дифференцированном потомстве трех зародышевых слоев. AAVS1, сайт естественная интеграция Адено связанного типа Вирус 2 (AAV), был протестирован в ЭСК , а также, из - за о резистентности к воздействию трансгенов глушителей 10. Позже, многие группы использовали локус AAVS1 и описал стабильную экспрессию трансгенов в недифференцированных hPSCs, а также в их дифференцированное потомство всех трех зародышевых листков, как в пробирке и в естественных условиях 2,8,11,12. Недавние результаты , тем не менее Nuance эти выводы, как было обнаружено , что локус AAVS1 оказывать переменное ингибирование трансгенов в пробирке в недифференцированных ЭСК и гепатоцитов потомстве 13.
Дополнительные исследования скрининга с использованием случайных подходов и методов интеграции, чтобы определить единую интеграцию копирования с целью поиска Геномикрофонные сайтов интеграции , устойчивые к трансгенов глушителей в процессе расширения и дифференциации 14,15 hPSCs. В целом, до сих пор ни один геномный сайт не был полностью подтверждено в качестве безопасной гавани в hPSCs и их потомству; идентификация соответствующего сайта для повсеместного стабильной экспрессии трансгенов, не только в hPSCs , но и в их потомстве дифференцированных в пробирке и в естественных условиях, еще предстоит решить. Среди всех изученных локусов и , несмотря на свою ограниченность, AAVS1 остается самым охарактеризован и наиболее часто используемых в исследованиях стволовых клеток.
RMCE была успешно проведена в hPSCs в некоторых из этих локусов 6,7,14,16, используя в основном Cre рекомбиназу, даже если есть признаки того, что FLPe более эффективен , чем Cre 17. Во всех этих случаях, один положительный кассета устойчивости к лекарственному средству была использована для отбора рекомбинантных колоний. Несмотря на успех, эти процедуры не представляют собой технический прогресс по сравнению со стандартными генноредактирования процедуры с использованием ZFNs, Таленс или CRISPR / cas9, как единый антибиотик процедура отбора не исключает случайных интеграций и требует скрининга колонии, чтобы правильно идентифицировать целевых клонов.
В этой процедуре, мы опишем методы для выполнения RMCE в hPSCs в на AAVS1 локуса с использованием комбинации положительных ( в пределах входящего кассеты) и отрицательный ( в пределах предварительно интегрированные кассеты) выборы , которые позволяют для генерации поликлональных трансгенных линий в ± 15 дней с КПД 100% и свободным от случайных событий интеграции. Таким образом, этот метод представляет собой прогресс за пределами описанных в настоящее время RMCE технологий в hPSCs.
протокол
1. Приготовление FRT-содержащих HPSC Мастер клеточной линии трансфекцию
- Культура чЭСК / IPSC линии мастер - клеток при стандартных процедур или выключить инактивированных эмбриональных фибробластов мыши (КПКО) , с использованием чЭСК или отходящей среде без IPSC, соответственно (таблица 1). Подготовьте 2 (на фидерах) или 1 (фидерных свободных) скважин hPSCs в 6-луночный планшет для каждого экспериментального состояния.
- Обратите внимание на культуру, и когда клетки достигают 60 - 70% слитности, плиты лекарственной устойчивостью КПКО (iDR4). В кратком изложении, пальто необходимые лунки 12-луночного планшета с 0,5 мл 0,1% раствора желатина и инкубируют в течение 5 мин при комнатной температуре. Тарелка 125000 iDR4s на лунку и инкубировать O / N с КПКО среды (таблица 1).
2. HPSC Трансфекция по Nucleofection
- На следующий день, предварительно инкубировать чЭСК / IPSC культуры свежей средой, в том числе 10 мкМ Rho-ассоциированной протеинкиназа (ROCK) ингибитор (Y-27632), в течение 1 ч при 37 ° С. Nвнутр, принять решение чЭСК трансфекцию из холодильника предварительно нагреться до комнатной температуры.
- Подготовка 1 мл nucleofection металлизации среды (таблица 1) на каждое условие nucleofection. Возьмите КПКО среду от лунки, промывают 1 мл PBS при комнатной температуре, и добавьте 500 мкл nucleofection металлизированный среды. Перенесите другие 500 мкл в стерильные 1,5 мл пробирки и хранить их при температуре 37 ° С до посева. Примечание: Типичный RMCE эксперимент состоит из трех различных условий с молекулярными соотношениями донора RMCE: pFLPe векторов 2: 0, 2: 1 и 0: 1.
- Отделить чЭСК / IPSC в суспензии отдельных клеток.
- Взлет СМИ, промойте его 2 мл RT PBS и прибавляют 1 мл 0,05% трипсина или Accutase на фидерных или фидерных свободных HPSC культур, соответственно. Выдержите в течение 7 (трипсин), или и 2 - 5 (Accutase) мин при 37 ° С. Для лечения Accutase - клетки должны оставаться свободным, но прилагается.
- Осторожно снимите пластину из инкубатора и безllowing клетки для отсоединения, удалите диссоциации агента путем аспирации. Добавить 1 мл ЭСК СМИ и диссоциируются свободные клетки, осторожно промывке носитель на поверхности пластины, избегая пенообразования. Убедитесь в том, что клетки находятся в одной клеточной суспензии.
- Собирают клетки в чистой и стерильной 15 или 50 мл трубки. Промыть лунки 1 мл чЭСК сред и сбора клеток в том же 15 или 50 мл трубки. Возьмем 50 мкл аликвоты для подсчета (на следующем этапе) с помощью устройства подсчета клеток. Запишите объем сбора и подсчета общего количества клеток. Спин вниз клетки при 300 мкг в течение 5 мин при комнатной температуре.
- Ресуспендируют осадок клеток к суспензии 10 6 клеток / мл с помощью PBS , используя 5 мл серологической пипеткой и осторожно пипеткой. Избегать образования пены. Передача 2 мл на условия эксперимента (примерно 2 х 10 6 клеток) для очистки, стерильные 15 мл пробирок.
- В то время как центрифугирование, предварительностричь в RMCE донорно pFLPe плазмид смешивает в максимальном объеме 10 мкл.
- Передача 2,5 мкг pFLPe (6,5 Кб) на чистую, стерильную 1,5 мл трубки. Добавление 2: молекулярное соотношение 1 вектора донора RMCE 13 к вектору pFLPe. Например, приблизительно 10 мкг вектора донора 12 Kb RMCE.
- Продолжайте nucleofection, избегая пенообразования на всех этапах.
Примечание: Некоторые протоколы трансфекции HPSC применить дополнительный КПКО шаг истощения перед шагом 2.4. Тем не менее, на практике, является КПКО незначительная часть клеток в суспензии отдельных, что существенно не меняет эффективность трансфекции, и не будет создавать контаминирующие рекомбинантные клетки, так как они не являются пролиферативная. Кроме того, очень важно, чтобы быстро переходить в процессе трансфекции для повышения жизнеспособности. По этим причинам, КПКО истощение не применяется.- Снимите пластину iDR4 и 1,5 мл пробирки с металлизированный средойиз инкубатора. Одна трубка в то время, пипеткой от ФБС осторожно, не нарушая клеточный осадок. Удалить как можно больше. Ресуспендируют осадок 100 мкл раствора для трансфекции, осторожно пипеткой. Передача суспензии клеток в 1,5 мл пробирку, содержащую плазмидных смеси и осторожно перемешать.
- Перенести смесь клеток ДНК к transfector кювете, обращая внимание, чтобы не вводить пузырьков. Введем кювету в Nucleofector устройства и применять программу А13 (клетки, культивируемые на фидерах) или F16 (фидерных бесплатно).
Примечание: Другие методы трансфекции или Nucleofector устройства могут потребовать оптимизации этих программ или условий трансфекции. - Пересдача кювету и, используя одноразовые пипетки передачи имеющихся в наборе nucleofection, собирать его содержимое, применяя 0,5 мл гальванического среды и аспирационного весь объем. Провести этот шаг быстро, но мягко и в одно движение.
- Тарелка по каплям в 12-шELL пластину, содержащую iDR4 и 500 мкл среды металлизированный. Повторите шаги 2.6.1 - 2.6.4 для следующего условия эксперимента.
- Место культуры блюдо на полку в инкубаторе и переместить его медленно взад и вперед и из стороны в сторону для равномерного распределения суспензии клеток. Инкубируйте в течение 24 ч до начала следующего изменения средств массовой информации, чтобы позволить клеткам восстанавливаться в присутствии 10 мкМ ингибитора ROCK (Y-27632).
3. Положительный и отрицательный отбор клеток Проходят RMCE
- Изменение культуры средств массовой информации в день (1 мл / лунку) и 2 - 3 d после трансфекции, начните выделение с помощью 100 нг / мл пуромицин.
Примечание: Оптимальные концентрации положительных и отрицательных реагентов отбора должны быть определены экспериментально для каждого вновь изготовленный мастер клеточной линии HPSC. Выполните 13 убийств кривую, используя линию клеток мастер , чтобы определить низкие дозы (концентрации , при которой минимальная визуальная токсичность проявляется после того, как 7d отбора, но культура не зарастает), оптимальная доза (самая низкая концентрация, при которой все клетки мертвы через 7 суток отбора), а также высокая доза (концентрация, которая вызвала явную токсичность, убивая всех клеток после 2 - 3 г) для обоих пуромицин и Fialuridine (ФИАУ).- Аспирируйте среду чЭСК. Промыть 1 мл PBS. Добавить чЭСК среды с 100 нг / мл пуромицин.
- Обратите внимание на рост клеток, так что смерть и рост сбалансированы. Изменение среды с пуромицин ежедневно, после шага 3.1.1. Когда скорость роста обгоняет гибель клеток, повышение концентрации пуромицин в блоках 25 - 50 нг / мл до максимум 250 нг / мл. Продолжить выбор пуромицин в течение 5 - 7 суток.
- 3 - 4 d после начала выбора пуромицин, около 6 день после трансфекции, начните выделение с помощью 0,5 мкМ ФИАУ. Изменение средств массовой информации ежедневно и поддерживать ГАФИ не более 7 дней подряд.
4. Расширение и характеристика RMCE линий
- Добавьте фетальной телячьей сыворотки к клеткам в PBS до конечной концентрации 5%. Передача клетки в чистую пробирку с FACS ячейки фильтра и держать их на льду.
Примечание: Жизнеспособность клеток высока в этих условиях, так что это возможно, но не обязательно, использовать флуоресцентный краситель для нежизнеспособных клеток (например, 7-AAD или PI). - Немедленно приступить к анализу в проточном цитометре анализатор клеток и записывать 20000 - 30000 событий. Для анализа, установить ворота выше или GFP ТДТ фоне цветении с использованием образца отрицательного контроля WT.
- Перенести клетки в чистую 1,5 мл трубки. Спин вниз со скоростью 300 мкг в течение 5 мин при комнатной температуре и аспирата супернатант. Перейдите к экстракции ДНК с использованием коммерческого набора и следовать инструкциям производителя. Хранить сухой осадок при -20 ° С в течение LatАнализ эр.
- Подготовка стандартных ПЦР - реакций , в соответствии с условиями , на рисунке 3 и в таблице 2 13 образцы подвергали электрофорезу PCR на агарозном геле 2% , содержащий 1x гель - ДНК пятна при 150 V в течение 15 - 25 мин.. Анализ проход анализатора геля.
Результаты
Использование AAVS1 ZNFs - специфических, полностью охарактеризованные линии клеток мастер чЭСК / IPSC , содержащие гетеротипические последовательности - мишени FRT были получены и описаны 13. В FRT-содержащие линии мастер - клеток поддерживали плюрипотентности и целостность генома после лечения ZFN и стабильно выражается GFP в пробирке и в естественных условиях. RMCE осуществляется котрансфекции мастер клеточных линий с FLPe рекомбиназой и векторов доноров RMCE (Рис . 1А) RMCE векторы содержат идентичные последовательности FRT с теми , в клеточной линии мастер AAVS1 фланговых трансген Рисунок 1B контролирует RMCE с помощью конститутивно , выражающую ТДТ PZ:.. F3-P CAGGS tdTPH-F После трансфекции HPSC образуют небольшие группы клеток , равномерно распределенных по слой iDR4 MEF, и трансфицировали HPSC выражают как GFP, а также переходных ТДТ (рис 1B, D 2). Клетки могут восстановиться в течение 2 - 3d после трансфекции перед началом выбора. Положительный отбор впервые начал использовать низкую дозу пуромицин, чтобы способствовать введение доноров RMCE. Пуромицин применяется осторожно в начале, потому что начальная массивная гибель клеток может привести к одиночных клеток, подвергающихся рекомбинации, что делает их не в состоянии пережить процесс. В последующие дни концентрация пуромицин необходимо повысить ступенчато до оптимальной дозы, с тем чтобы рекомбинантные клетки расти в небольших колоний в то время как nonrecombined клетки постепенно умирают.
3 - 4 d после начала позитивной селекции (около 6 D после трансфекции), негативный отбор начинается для того, чтобы выбрать только для FRT-опосредованной рекомбинации. RMCE приводит к потере тимидинкиназы (ТК), ген самоубийства и, следовательно, чувствительность к Fialuridine (ФИАУ). Отрицательный отбор применяется в этой точке, в которой небольшие кластеры 2 - 4 GFP - / TDT + (RMCE) клеткиспособны выдерживать оптимальные концентрации ФИАУ (рис 1B, D 6), предотвращает случайное интеграцию, потому что в таких событиях, ген Тк в локус AAVS1 остается неизменным. Встречаемость одновременного FRT-опосредованной и случайной интеграции весьма маловероятно, о чем свидетельствует отсутствие случайных событий интеграции позже во время определения характеристик (Фигура 2В).
Приготовленный RMCE GFP - / ТДТ + колонии продолжают расти, в то время становится все более однородным, так что D 9 - 10 после трансфекции, некоторые не полностью выбранные смешанные RMCE колонии можно найти (рис 1B). GFP - / TDT + RMCE колонии присутствуют только тогда , когда оба RMCE донора и FLPe (2: 1) используются, в то время как RMCE не происходит при отсутствии FLPe (2: 0). Полный выбор с ФИАУ до 13 дня - 15 после трансфекции приводит к однородной GFP - / + ТДТ КУЛЬТУРАе. RMCE дает в среднем 12,8 ± 6,8 (n = 6) колоний Puro R / ГАФИ R в течение 15 дней 13. Проточная цитометрия характеристики вновь сгенерированном RMCE линии (RMCE колонии Пуро R / ГАФИ R объединенные в неклональную популяции клеток) , подтверждает , что 100% клеток представляют RMCE GFP - / TDT + фенотип (фиг.2А). Когда RMCE доноры без конститутивной экспрессии флуоресцентного репортера используются, в результате Puro R / ГАФИ R RMCE HPSC линия однородно GFP -.
ПЦР характеристика неклональную RMCE линии демонстрирует полный кассетный обмен (отсутствие следов кассеты ведущей клеточной линии могут быть обнаружены) и что программа выбора используется для генерации случайных интеграции свободных линий (как донора RMCE и FLPe-выражения вектор) (Фигура 2В). Эти результаты были дополнительно подтверждена сouthern - блот и, кроме того, мы показали , что RMCE линии остаются плюрипотентные 13. Это делает его больше нет необходимости не проводить либо геному оценку случайной интеграции или испытание плюрипотентности во время рутинных экспериментов RMCE. Таким образом, с использованием этого протокола, HPSC трансгенные клеточные линии в AAVS1 локуса , свободного от случайной интеграции может быть легко генерируется в 15 г с 100% -ной эффективностью и без необходимости экстенсивной характеристики.

Рисунок 1: Схема RMCE (A) Хронология программы селекции RMCE.. Слева: мастер-клеточная линия (MCL), укрывательство FRT-фланкирован кассету (треугольники), которые выражают GFP и гигромицину тк (связаны 2А саморасщепляющиеся пептидов), трансфицируют с помощью nucleofection (NF) с FLPe-выражающей вектора и вектор донор RMCE, ВГIch содержит ген пуромицин промотора сопротивления (сплайсинг акцептор - SA- Puro R) и переменную экспериментальную кассету (X). Справа: новая RMCE линия (RMCEL), полученный после завершения отбора с пуромицин (красный треугольник) и ФИАУ (синяя линия). (B) RMCE использованием конститутивный ТДТ-выражающую доноров и различные соотношения ДНК донора и FLPe ДНК (0: 1, 2: 1, 2: 0) отслеживается с помощью флуоресцентной микроскопии (GFP - зеленая флуоресценция, ТДТ - красная флуоресценция) при различных моменты времени. D 2 и 6: масштабные линейки представляют 100 мкм. D 10: масштабные линейки представляют 200 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
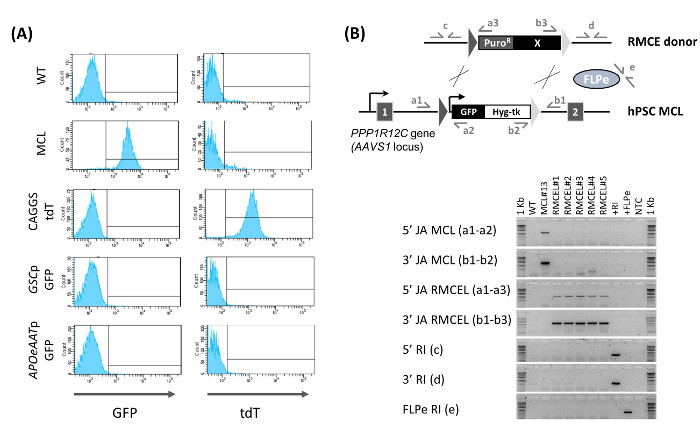
Рис . 2: Характеристика RMCE линий (А) Определение RMCE попроточной цитометрии. GFP и экспрессия ТДТ показан для WT линии, мастер - клеточная линия (MCL), и вновь генерироваться RMCE линия D 15 пост-nucleofection с использованием конститутивный ТДТ-экспрессионного вектора (CAGGS ТДТ), или доноры с GFP обусловлен GOOSECOID промотора (GSCP GFP, окончательное энтодермы маркер) или AAT промотор (APOeAATp GFP, гепатоцитов маркер). (B) Подтверждение RMCE (5 '/ 3' JA RMCEL), отсутствие мастер - клеточной линии в (MCL) кассета (5 '/ 3' JA MCL), а также отсутствие случайной интеграции (5 '/ 3' / FLPe RI ) с помощью ПЦР с использованием пары праймеров, изображенных. ДНК из WT, MCL, RMCE линии (1 - 5) были использованы, донор RMCE вектор (+ RI), FLPe вектор экспрессии, и никакого контроля шаблонов (NTC). Рисунок редактировался (Ordovas и др., 2015) 13. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
в-странице = "1"> 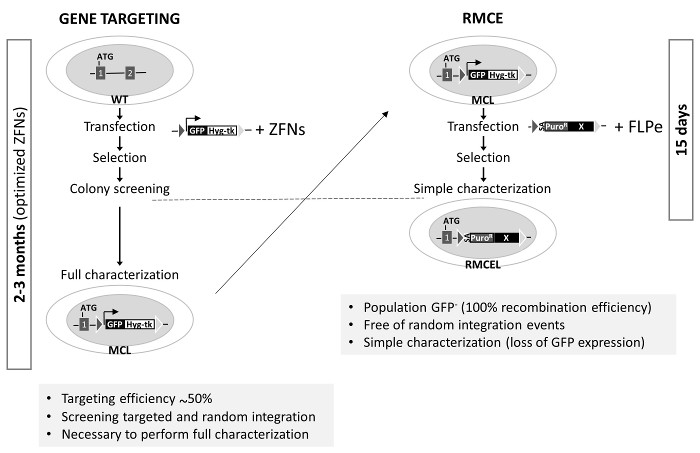
Рисунок 3. Генерация RMCE-подходит Мастер клеточной линии и сравнение Gene Targeting с RMCE в AAVS1 . Слева: Ген нацеливание использует неизмененные клетки WT, которые трансфицировали с донором (кассета , описанной на рисунке 1А для генерации мастер - клеточной линии , MCL) и специфические оптимизированные ZFNs. Процесс завершения полной характеристики занимает до 3-х месяцев. Справа: RMCE осуществляется котрансфекции донора с векторами FLPe, и полностью охарактеризован линия генерируется в 15 г. Эффективность ориентации генов в AAVS1 от предыдущих исследований , 1,2. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Таблица 1. Медиа состав.
| анализ | Вперед | Задний ход | Amplicon | ПЦР цикл | ||
| 5'JA MCL | CACTTTGAGCTCTACTGGCTTC | CGTTACTATGGGAACATACGTCA | 1.1 Kb | 95 ºC, 5 '- [95 ºC, 30' '- 68 ° С (-0,5 ° С / цикл), 1' 30 ''] X15 - [95 ° С, 30 '' - 58 ° С, 30 '' - 72 ° С, 1 '30' '] X25 - 72 ° С, 5' | ||
| 3'JA MCL | TAACTGAAACACGGAAGGAG | AAGGCAGCCTGGTAGACA | 1.4 Kb | 95 ° С, 5 '- [95 ° С, 30' '- 68 ° С (-0,5 ° С / цикл), 1' 30 ''] X15 - [95 ° С, 30 '' - 58 ° С, 30 '' - 72 ° С, 1 '30' '] X25 - 72 ° С, 5' | ||
| 5'JA RMCEL | CACTTTGAGCTCTACTGGCTTC | CATGTTAGAAGACTTCCTCTGC | 1.1 Kb | 95 ° С, 5 '- [95 ° С, 30' '- 68 ° С (-0,5 ° С / цикл), 1' 30 ''] X15 - [95 ° С, 30 '' - 58 ° С, 30 '' -72 ° С, 1 '30' '] X25 - 72 ° С, 5' | ||
| 3'JA RMCEL | TTCACTGCATTCTAGTTGTGG | AAGGCAGCCTGGTAGACA | 1,5 Кб | 95 ° С, 5 '- [95 ° С, 30' '- 68 ° С (-0,5 ° С / цикл), 1' 30 ''] X15 - [95 ° С, 30 '' - 58 ° С, 30 '' - 72 ° С, 1 '30' '] X25 - 72 ° С, 5' | ||
| 5'RI ДОНОРСКАЯ | GTACTTTGGGGTTGTCCAG | TTGTAAAACGACGGCCAG | 0,5 Kb | 95 ° С, 5 '- [95 ° С, 30' '- 60 ° С, 30' '- 72 ° С, 30' '] X25 - 72 ° С, 5' | ||
| 3'RI ДОНОРСКАЯ | CCTGAGTTCTAACTTTGGCTC | ACACAGGAAACAGCTATGAC | 0,5 Kb | 95 ° С, 5 '- [95 ° С, 30' '- 60 ° С, 30' '- 72 ° С, 30' '] X25 - 72 ° С, 5' | ||
| RI FLPe | CCTAGCTACTTTCATCAATTGTG | GTATGCTTCCTTCAGCACTAC | 0,65 Kb | 95 ° С, 5 '- [95 ° С, 30' '- 60 ° С, 30' '- 72 ° С, 30' '] X25 - 72 ° С, 5' | ||
Таблица 2. Наборы праймеров , используемые для ПЦР Генотипирование. Редактировался Ordovas и др., 2015 13.
Обсуждение
методы редактирования генов в безопасные гавани локусам остаются важным инструментом для разработки трансгенеза в hPSCs. Хотя безопасная гавань характер AAVS1 недавно была поставлена под сомнение в некоторых приложениях 13,18, этот локус в настоящее время остается лучшим в характеризуется человеческих клеточных линий , полученных. Осознание своих ограничений в hPSCs может помочь получить достоверные данные. Поэтому AAVS1 по - прежнему ожидается, будет полезный сайт, например, для амплитудно и с потерей функции исследований или индуцируемого / конститутивной экспрессии факторов , которые требуют изогенных контекст внутри и между определенными генетическими фонов.
AAVS1 локус был мишенью многих групп с использованием ZFNs, Talen или CRISPR / cas9 1,2,19. Эти нуклеазы значительно повысить эффективность гомологической рекомбинации в определенном локусе. Тем не менее, процесс проверки и полностью характеризуют правильно ориентированные клоны, свободные от случайного INTEGрацион и для поддержания плюрипотентности и геном целостности может занять до 3 -х месяцев ( с использованием оптимизированных инструментов редактирования генов) (рисунок 3). Последние два могут быть вызваны возможных мутаций, порожденных нуклеазы активности за пределами целевой. Система RMCE используется здесь, однако, предлагает быстрый, эффективный и элегантный способ для достижения этой цели всего за две недели после того , как рекомбинантному конкретные целевые последовательности предварительно интегрированные в AAVS1 локуса. Использование положительного / отрицательного отбора и соответствующей программы отбора являются основными факторами , способствующими упрощения редактирования генов в локусе AAVS1 по RMCE.
Генотипическая характеристика новых трансгенных линий значительно снижается (не клоновая скрининг не требуется), а также характеристики, связанные с грязно-мишени нуклеазная активность оказывается необязательной из-за специфики FLPe для FRTS. Характеристика также может быть снижена в обычных экспериментах RMCE, демонстрируяполная потеря экспрессии GFP из мастер - клеточной линии (рис 2А), так как полная замена кассеты и отсутствие случайной интеграции уже достаточно продемонстрирована с помощью ПЦР (фиг.2В) и Саузерн - блот - 13. Использование положительного / отрицательного отбора также составляет основную разницу с предыдущими отчетами. Несколько групп , которые ранее описанные RMCE в hPSCs, либо в AAVS1 или других локусах, использовали только один позитивный шаг выбора 7,14,16. Это не представляет собой основные технические преимущества по сравнению с редактированием гена, выполняемой с нуклеаз, потому что скрининг колонии должен быть в равной степени выполняться для того, чтобы продемонстрировать правильную интеграцию и отсутствие случайной интеграции на клонального уровне.
Использование этой системы RMCE в нескольких чЭСК / IPSC линий требует preintegration описанного FRT-содержащего кассету в AAVS1 локуса каждой независимой линии. Тем не менее, как только генерируется,его быстрота и простота позволяет развивать полу высокую пропускную способность генетических экранов в определенных изогенных настроек для приложений, упомянутых выше, которые в противном случае были бы технически очень много времени. Кроме того, все векторы RMCE построены в векторе рЪ AAVS1 ген-таргетинга , используемый для целевой локус с ZFNs, но Таленс или CRISPR / cas9 были также зарегистрированы. двойственности RMCE вектора является весьма полезным для создания нескольких линий для определенного трансгена в hPSCs с или без FRT. Например, один удар продемонстрировал успех в определенном генетическом скрининге, проведенного RMCE в идеале должны были бы быть проверены в нескольких строках HPSC для подтверждения результатов. При отсутствии нескольких RMCE-пригодных линий клетки-хозяина, прямой ген нацеливание удара с использованием нуклеазы может быть выполнена. Полезность двойственного характера векторов RMCE было доказано нашей группой 20. В этом исследовании, коррекция гена проводилась в пациенте полученныхЛобно - височная деменция (FTD) иПСК , которые несут мутацию вызывает PROGRANULIN (PGRN) выражение дефицита. Ген комплементационный по ZFNs-опосредованной вставки в AAVS1 локуса кассеты , что восстановленный PGRN уровней, исправлены дефектный фенотип в corticogenesis , связанной с наличием мутации. Кроме того, сопоставимое линия была сгенерирована с помощью RMCE в WT ЭСК для использования в качестве контроля для экзогенной PGRN выражения.
При отсутствии рекомбинантных колоний, проверить эффективность трансфекции вектора-донора RMCE. эффективность трансфекции, превосходящие 30% -ным выходом, результаты которого приведены выше. Снижение эффективности трансфекции уменьшают эффективность рекомбинации. И, наконец, система RMCE была сформирована в локусе AAVS1, но оно применимо к любым другим локусом.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
L.O. was funded by IWT/OZM/090838, IACS BPAMER3/08/04, and the Government of Aragon FMI048/08; RB by IWT fellowship SB-121396; M.P. by FWO 1288714N; and R.S. by the Dutch Diabetes Foundation. N.H., J.V., K.C., and Q.C. were supported by IWT fellowships SB-121396, SB-101230, SB-91228, and SB-093228, respectively. Funding to C.M.V. was from FWO G.0667.07, G.0975.11, and KU Leuven (EIW-B4855-EF/05/11, ETH-C1900-PF, EME-C2161-GOA/11/012), IWT-HEPSTEM, BELSPO-IUAP-DEVREPAIR, FP7-HEMIBIO (266777).
Материалы
| Name | Company | Catalog Number | Comments |
| DR4 Mouse Embryonic Fibroblasts (MEF) | AMS bio | GSC-6204G | hPSC culture on feeders |
| CF-1 MEF, mitomycin-C treated | AMS Bio | GSC-6001M | |
| EmbryoMax 0.1% Gelatin Solution | Millipore | ES-006-B | iMEF plating |
| DMEM/F-12, HEPES | Gibco | 31330-038 | |
| KnockOut Serum Replacement | Gibco | 10828-028 | |
| L-Glutamine | Sigma Aldrich | G8540 | For hESC medium |
| L-Glutamine, 200 mM | Gibco | 25030-081 | For iMEF medium |
| 2-Mercaptoethanol, 50 mM | Gibco | 31350-010 | |
| MEM Non-Essential Amino Acids Solution (100x) | Gibco | 11140-035 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Human basic FGF | Peprotech | 100-18C | |
| Y-27632 in Solution | VWR | 688001-500 | |
| DMEM High Glucose | Gibco | 41965-039 | |
| Fetal Bovine Serum (FBS) | Sigma Aldrich | F7524 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300-054 | hPSC culture on feeders |
| Matrigel, hESC qualified | VWR | 734-1440 | |
| mTeSR1 complete medium kit | Stem cell technologies | 05850 | For Feeder-free culture |
| StemPro Accutase Cell Dissociation Reagent | Gibco | A1110501 | For feeder-free culture |
| Y-27632 in solution | VWR | 56726 | |
| Human Stem Cell Nucleofector Kit 2 | Lonza | VVPH-5022 | |
| Puromycine Dihydrochloride | Gibco | A11138-03 | |
| FIAU (Fialuridine) | ABX | 2910 | |
| Hygromycin B | Sigma Aldrich | H3274 | |
| pFLPe | Modified to from pCAGGS-FLPe (MES4488, Open Biosystems) to remove puromycin | ||
| RMCE donors | - | - | Modified from pZ donor AAVS1 puromycin vector (PZD0020-1KT, Sigma Aldrich)13 |
| 5 mL Round Bottom Polystyrene Test Tube, with Cell Strainer | Falcon | 352235 | |
| PureLink Genomic DNA kit | Invitrogen | K182001 | |
| GoTaq Flexi DNA Polymerase | Promega | M8298 | |
| Agarose | Sigma | A9539 | |
| SYBR Safe DNA Gel Stain | Invitrogen | S33102 | |
| Nucleofector 2b Device | Lonza (Amaxa) | AAB-1001 | |
| NucleoCounter NC-100 | Chemometec | NC-100 | |
| BD FACS Canto | BD Biosciences | 337175 | |
| NucleoCassette | Chemometec | 941-0002 |
Ссылки
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nat. Biotechnol. 29 (8), 731-734 (2011).
- Hockemeyer, D., et al. Efficient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-finger nucleases. Nat. Biotechnol. 27 (9), 851-857 (2009).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Baer, A., Bode, J. Coping with kinetic and thermodynamic barriers: RMCE, an efficient strategy for the targeted integration of transgenes. Curr. Opin. Biotechnol. 12 (5), 473-480 (2001).
- Sakurai, K., et al. Efficient integration of transgenes into a defined locus in human embryonic stem cells. Nucleic Acids Res. 38 (7), e96(2010).
- Irion, S., et al. Identification and targeting of the ROSA26 locus in human embryonic stem cells. Nat. Biotechnol. 25 (12), 1477-1482 (2007).
- Di Domenico, A. I., Christodoulou, I., Pells, S. C., McWhir, J., Thomson, A. J. Sequential genetic modification of the hprt locus in human ESCs combining gene targeting and recombinase-mediated cassette exchange. Cloning Stem Cells. 10 (2), 217-230 (2008).
- Lombardo, A., et al. Site-specific integration and tailoring of cassette design for sustainable gene transfer. Nat. Methods. 8 (10), 861-869 (2011).
- Lombardo, A., et al. Gene editing in human stem cells using zinc finger nucleases and integrase-defective lentiviral vector delivery. Nat. Biotechnol. 25 (11), 1298-1306 (2007).
- Simth, J. R., et al. Robust , Persistent Transgene Expression in Human Embryonic Stem Cells Is Achieved with AAVS1-Targeted Integration. Stem Cells. 26, 496-504 (2008).
- DeKelver, R. C., et al. Functional genomics, proteomics, and regulatory DNA analysis in isogenic settings using zinc finger nuclease-driven transgenesis into a safe harbor locus in the human genome. Genome Res. 20 (8), 1133-1142 (2010).
- Qian, K., et al. A simple and efficient system for regulating gene expression in human pluripotent stem cells and derivatives. Stem Cells. 32 (5), 1230-1238 (2014).
- Ordovás, L., et al. Efficient Recombinase-Mediated Cassette Exchange in hPSCs to Study the Hepatocyte Lineage Reveals AAVS1 Locus-Mediated Transgene Inhibition. Stem Cell Reports. 5 (5), 918-931 (2015).
- Du, Z. -W., Hu, B. -Y., Ayala, M., Sauer, B., Zhang, S. -C. Cre recombination-mediated cassette exchange for building versatile transgenic human Embryonic Stem Cells lines. Stem Cells. 27, 1032-1041 (2009).
- Papapetrou, E. P., et al. Genomic safe harbors permit high β-globin transgene expression in thalassemia induced pluripotent stem cells. Nat. Biotechnol. 29 (1), 73-78 (2011).
- Ramachandra, C. J., et al. Efficient recombinase-mediated cassette exchange at the AAVS1 locus in human embryonic stem cells using baculoviral vectors. Nucleic Acids Res. 39 (16), e107(2011).
- Takata, Y., Kondo, S., Goda, N., Kanegae, Y., Saito, I. Comparison of efficiency between FLPe and Cre for recombinase-mediated cassette exchange in vitro and in adenovirus vector production. Genes to Cells. 16 (7), 765-777 (2011).
- Mizutani, T., Li, R., Haga, H., Kawabata, K. Transgene integration into the human AAVS1 locus enhances myosin II-dependent contractile force by reducing expression of myosin binding subunit 85. Biochem. Biophys. Res. Commun. 465 (2), 270-274 (2015).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Raitano, S., et al. Restoration of progranulin expression rescues cortical neuron generation in an induced pluripotent stem cell model of frontotemporal dementia. Stem Cell Reports. 4 (1), 16-24 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены