需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
自动定量分析细胞计数程序使用ImageJ插件
摘要
This paper describes the quantification of hemocytometer and migration/invasion micrographs through two new open-source ImageJ plugins Cell Concentration Calculator and migration assay Counter. Furthermore, it describes image acquisition and calibration protocols as well as discusses in detail the input requirements of the plugins.
摘要
健康的ImageJ的国家研究所是一个功能强大,免费的图像处理软件套件。 ImageJ的具有可有效地用于计算各种生物颗粒全面粒子分析算法。当计数大量细胞样品,血细胞计数仪呈现与问候时间的瓶颈。同样地,从与ImageJ的插件细胞计数迁移/侵袭测定法计数的膜,虽然准确,分外劳动密集型的,主观的和声名狼藉用于使手腕疼痛。为了满足这一需求,我们开发了内ImageJ的两个插件用于自动血球(或已知体积)和迁移/侵袭细胞计数的唯一任务。这两个插件依靠获得高品质的显微照片以最小的背景的能力。他们很容易使用,对于大样本容量,内置分析工具的快速计算和分析,帮助计数的校准优化。通过组合的核心原则与自动计数算法和后计数分析细胞计数的S,这大大增加了与该迁移测定可以不准确性的任何损失进行处理的容易性。
引言
体外细胞计数是在广泛的组织培养实验的一个重要的基本技术。准确地确定在培养细胞的数目为实验的重复性和标准化1,2-必不可少的。细胞计数可以手动使用血细胞计数器以及使用各种自动化方法,各有各的优点和缺点3,4,5来执行。大多数的细胞计数的自动化方法属于两类,那些使用库尔特原理或流式细胞仪中的一个。犁刀计数器利用细胞电阻,以确定细胞数量和大小。他们是快速,准确,价格比流式细胞仪。然而,它们很少用于仅细胞计数,由于其相当大的成本相比,人工计数3。流式细胞仪,在另一方面,是昂贵的,但它们有许多应用,例如细胞计数,细胞形状,ST的分析ructure和测量内部细胞标记物4,5。使用以下两种原则的机器都可以从许多制造商。人工计数是可以承受的,但费时,并受偏压而自动化方法来提供关于整个人工计数所需要的时间的一小部分,但使用昂贵的机器6。
其他常见的细胞培养过程是在体外细胞运动性测定法,即,细胞迁移和侵入7。迁移和侵袭测定法通常用于研究细胞运动和侵袭响应于趋化反应。另外,它们被广泛地用于研究胚胎发育,分化,炎症反应,并转移多种细胞类型7-11的。已迁移或侵入通过迁移测定的多孔膜细胞可以在两种不同的方式来量化。首先,通过用荧光染料染色的细胞中,分离来回中号使用荧光读取器12的膜,和定量。定量的这种方法的一个限制是,没有记录可以保持膜的,并且没有可能用于进一步分析13。第二量化方法被用于迁移/侵袭细胞中固定并用荧光染料或更常见的是,与细胞学染料如结晶紫,甲苯胺蓝染料或苏木精;然后细胞用这些膜这是一个非常耗时的任务12,13的倒置显微图像手动定量。
为了克服手动细胞计数的缺点,二可靠和准确的对细胞浓度和迁移测定自动细胞计数器被开发。这些自动细胞计数算法是为ImageJ的开发与使用Oracle的Java计算机语言的插件。 ImageJ的是HEA国立研究所开发一个公共的,广泛使用的图像处理工具第l(NIH)14,15;因此,写这些插件ImageJ的有利于方便地集成到生物群落。
相比手工计数细胞计数的自动化,确保高吞吐量和再现性。尽管其它可用的软件和插件可用于通过图像分析5,16,17,细胞浓度计算器插件来计算细胞浓度是快,也可以处理的细胞和治疗的稀释液。此外,这两个计数器所有结果和计算可以保存和出口。在本文所描述的两个插件是通过使用解剖显微镜的使用相衬显微镜的活细胞成像和大视场(全膜捕捉)成像迁移实验膜进行了优化。该插件是免费提供从下载安装说明:http://peng.lab.yorku.ca/imagej-plugins。
研究方案
1.复式显微镜和摄像机设置(细胞浓度计算器)
- 增加灯泡亮度完整与光调节旋钮,切换到4X物镜,并确保相衬滤波器被选中。
注意:任何倒置显微镜进行组织培养与黑暗的背景, 例如,PHP相衬,可以按照标准的显微镜和照相机过程中使用。 - 在显微镜的软件,集图像采集设置为默认值。
注:请参阅显微镜的用户手册,以找到这些设置的位置。- 设置"亮度","对比度"和"饱和"为100%,"γ"和"增益"为1.0。
注:根据不同的软件,"亮度"和"对比度"可能默认为0%的值,而不是100%。 - 设置图像的黑白使用最高分辨率availabl被捕获E(可达1,600 x 1200像素(PX)或更大)。
注:0%'饱和'是足够的,如果黑白设置不可用。
- 设置"亮度","对比度"和"饱和"为100%,"γ"和"增益"为1.0。
- 将一个标准的血球到显微镜台上,拍摄图像如( 图1A)中描述;这是"音量校正图像"。调整曝光时间的要求。
2.图像体积校准
- 打开ImageJ的,并从插件菜单,启动细胞浓度计算器(CCC)的插件, 如插件>分析仪>'细胞浓度计算器"。
- 如果右侧的"图像体校准"面板不可见,点击"校准"来证明这一点。
- 在ImageJ的,从步骤1.3("文件">"打开")和CCC点击"获取图像尺寸"按钮,打开"音量校正图像"。
注意:这将在两个图像填充宽度和身高文本框与自动像素的图像分辨率。 - 在ImageJ的,选择"直线工具"旁边的选择工具,并通过点击和拖动光标画一条直线横跨血球主(P)的整个长度( 图1B) -方证实。
- 按"M"键显示包含直线测量结果窗口。键入从长度列中的值到CCC( 图1B)的"P-平方长度'的文本框。
- 点击"计算图像体"按钮,输出的图像批量进入图像容量文本框。或者,如果该图像的体积是已知的,请在NL卷成图像体文本框。
- 点击"保存"按钮。
注:该插件现在校准。
3.相机曝光校正
- 下面的单元格的收获通过血球计数仪,称重传感器的10微升计数于血细胞计数仪室并将其放在显微镜舞台。
- 从步骤1.2使用相同的设置,调整曝光时间,以使血球的背景线消失。
- 调节焦距,使得细胞内部比细胞膜较暗,指示该单元的中心的横截面,而不是磁极内聚焦。
- 进一步调整曝光,使得细胞不会过度和类似于在( 图1C)所描绘的那些。
注:轻微可见血球线是可以接受的。它建议保存或记录这些设置,以保持精度和再现性。
4.图像采集
- 对于每个细胞样品中,负载10微升到血球两院提高统计推断功率2。放置在血细胞计数器在显微镜舞台成像。
注意:每个图像的分辨率和放大倍率必须是一样的"音量校正图像"。该插件计算任何选定文件夹的所有图像;保持图像在同一文件夹一起计算。- 如果文件名自动递增功能是可用的,打开它,并确保每个图像捕捉,以提高吞吐量后不显示。
注:手动保存并关闭每个图像会大大拖慢进程。请参见显微镜的用户手册的信息,自动递增功能的可用性。 - 虽然以上(5-10),建议增大精度捕捉血球的中心区域的至少3个非重叠的图像。
注:避免两个顶部和腔室的底部区域如细胞倾向于在两个位置中的密度增加。采取相同数量的图像的每一个腔室中。这是在计算所需的插件的正常运作。
- 如果文件名自动递增功能是可用的,打开它,并确保每个图像捕捉,以提高吞吐量后不显示。
5.图像计数和稀释
- 在CCC中,单击"细胞计数",并观察选择目录对话框。选择一个文件夹进行计数。
- 选择一个文件夹后,观察样品编号输入框。 4.1.2输入每个房间拍摄的图像, 即数量,并单击"确定"。该插件现在算上所有的JPG,TIFF和PNG按字母顺序排列所选文件夹中的图像。
注:单击"查看示例"按钮,将弹出样品查看器窗口显示有关统计样本的信息。样品浓度为每室中取出所有图像的平均浓度。与无单位浓度的样品可以被添加到该列表中,例如加入的药物或小分子的治疗。- 讲述的细胞样品,如果浓度相同的样本(第4节)的计数范围内显著变化。
注:要计算稀释对所有t他数样本,CCC自动使用式C 1 V 1 = C 2 V 2。
- 讲述的细胞样品,如果浓度相同的样本(第4节)的计数范围内显著变化。
- 使用播种的情况下每200微升15,000个细胞到96孔板+1额外的30口井:
- 文本框设置于C2标签的15,000右侧和浓度体积文本框200,改变相邻的组合框单元"μL"。
注:该插件将最终计算出细胞/毫升的浓度。 - 确保音量组合框已选择V2(最终体积),并在文本框中正确输入6200(200微升×(30 + 1)),在单位体积组合框中选择"微升"。
- 文本框设置于C2标签的15,000右侧和浓度体积文本框200,改变相邻的组合框单元"μL"。
- 点击"计算稀释"到当前输入的稀释液添加到底部左侧的列表框中。
注意:每添加一个稀释,也就迎刃而解了每个样品并在树右图显示。每个条目上双击扩大。 - 点击ŧ他下面的"查看示例"按钮"保存"按钮,写入文件的所有样本数据和稀释。
- 注意:这些数据可以随时通过点击"加载",然后选择保存的文件进行恢复。
6.迁移和侵袭(计数器)
- 执行使用标准Boyden小室法7-9的迁移和入侵检测。
- 细胞迁移后/入侵,仔细反相和轻轻拍打取出卡壳内的媒体。灯芯远离任何多余的介质通过触摸边缘到纸巾粘附到膜的底部。
注:膜本身不要触摸到的毛巾,这可能会除去粘附细胞。 - 固定并染色的细胞作为报道7-9中设置与含有每行一个24孔板〜了不同的解决方案的500微升, 例如 ,固色剂,着色漆1,着色漆2,和双蒸水(DDH 2 O的)。填充用1X PBS吨的第二板Ø切割前放置插入英寸
- 将它们放置在装满DDH 2 O的水井洗刀片和填充的DDH 2 O刀片反演擦拭离开细胞前沥干水分。
- 使用干净棉签从膜,注意不要损伤膜的顶部除去未迁移/非侵入细胞。是周围的膜的边缘彻底。
- 用剃刀或解剖刀切膜,小心地将膜(底部朝上)转移到干净的载玻片上。
- 加安装溶液的一小滴的下方和在膜的上部,并用薄的盖玻片覆盖。
注意:避免在安装解决方案中俘获的气泡保持计数的准确性。
7.解剖范围和相机设置
- 打开显微镜的光源和摄像头。
注:请参阅有关详细说明,在显微镜的用户手册。 - 风趣欣显微镜的软件,集图像采集设置为默认值。
注:如果平均功能存在,建议的四个值。这是平均和图像采集时间的程度之间的良好的折衷。同样,锐化的程度很小,会增加图像的保真度。- 设置"亮度","对比度"和"饱和"为100%,"γ"和"增益"为1.0。
注:根据不同的软件,"亮度"和"对比度"可能默认为0%的值,而不是100%。 - 设置显示(实时),并拍摄分辨率为它们的最大设置(可达1,600 x 1200像素和2,592点¯x1,944像素,分别)。
注:显示分辨率可如果刷新速率太慢根据需要进行调整。较低的分辨率将使它更难以精确地聚焦,但增加刷新率。
- 设置"亮度","对比度"和"饱和"为100%,"γ"和"增益"为1.0。
- 对于解剖范围的阶段,用纯白色backgroUND;黑色或玻璃背景是不够的。
- 从两个灵活的LED灯使用上述阶段的光源,最好到右侧和左侧的舞台。
注:以下级光源将照亮迁移实验膜可随后计数的精确度产生负面影响在毛孔。 - 放置完成迁移试验膜幻灯片搬上了舞台。看着由软件显示的实时图像,与变焦调节旋钮调整放大倍数使单膜的边缘只是内的摄像机视场。
注:放置在滑动到玻璃板上上层建筑白色背景阶段可以更容易地操纵用于成像的幻灯片。 - 调整光源的位置(7.6.1)和暴露时间以尽可能接近再现尽可能在图2A中所描绘的理想图象。取决于亮度,5-60毫秒的曝光时间应该足够了。
注意:我们的目标是用尽可能少的背景颜色尽可能和不降低图像保真度, 即一个均匀地照明膜,曝光过度,导致可见的细胞的损失,以产生一个图像。- 左侧和右侧的光源在相对于滑动低角度定位。这将有助于消除背景染色和色差。尽量保持各光源的对面到另一个。
注意:当机动每个光源到位,关闭等客。这有助于照明的区域本身更容易,更准确地居中到膜上。
- 左侧和右侧的光源在相对于滑动低角度定位。这将有助于消除背景染色和色差。尽量保持各光源的对面到另一个。
- 删除幻灯片和白平衡使用显微镜软件的单一按钮单击图像。
注:显微镜现在校准。除许多设置尽可能为将来使用并注意光源的位置和强度。
8.图像采集和平面场
- 内的软件,设置捕捉文件夹位置,捕捉每膜一张图片。以下的通用模板命名图片:名称- ###, 如控制- 001.tif,控制- 002.tif,测试药物- 001.tif,等等。
注:最佳的图像效果,保存图像文件类型为TIFF比其他有损格式,如JPEG。
注意:图片不能下仍将被计算一般模板,但不会受到到自动分组及平场。- 如果平场校正需要,为每张幻灯片找到一个空白区域,并采取命名约定以下空白图:名称 - 空白。
注意:空白是不含膜和代表的背景照明幻灯片的区域。 - 成像前,立即通过施加压力在盖玻片压平每个膜,并删除尽可能多的被困气泡越好。
- 如果平场校正需要,为每张幻灯片找到一个空白区域,并采取命名约定以下空白图:名称 - 空白。
- 在ImageJ的,去插件,打开TC插件; 例如,插件>分析>' Transwell小柜台"。
- 在TC,点击"平场"按钮,观察选择目录对话框。选择其中膜图像保存的文件夹。
注意:仅保存与上面的一般模板图像将被自动平面场校正并保存在一个所选择的文件夹中称为平面场的新文件夹。参见图2B为一个平面场校正图像的一个例子。
9.配置设置
- 打开ImageJ的迁移实验膜图像("文件">"打开"),并选择图像>调整>"颜色阈值..."。观察颜色阈值窗口调整将被过滤什么颜色出来的形象。
- 在窗口的底部,设置阈值法"Shanbhag',阈值颜色"白色",以及色彩空间"RGB"(红,绿,蓝);取消选中黑暗的背景,如果选中。
- 调整前通过单击并拖动标记为0,底部的滑块,滑块255(离开底部的滑块255)。确保图像是全白。
- 调整绿色和红色顶部滑块直到只有细胞核是可见的。
注意:选择将所用的细胞染色完全变化的设置。参见图2C。 - 在TC插件,输入RGB顶部滑块到相关的配置设置"RGB阈值"文本框的值。点击"添加/修改"按钮,并覆盖配置。
- 在1保留尺寸范围的下限和上限值 - 无穷大。
- 在配置设置面板中,单击"保存"将设置写入到硬盘驱动器。
10.计数图片和校准
- 打开TC插件(8.2),然后点击"文件夹伯爵",并观察选择目录对话框。选择文件夹以计数的ND等待它完成。
- 每个计数样本被自动添加到主表中。键列'伯爵','质量'和'校准?"。
注:未校准数在列"区域范围"显示的区域内每个膜粒子的数量。
注:质量范围约为-0.8至1.7; Q≥0.5是可以接受的。- 注意勾选"校准?如果列的图像被边裁校准根据它的相似到理想的指标。
注:质量和校准可能表明当前设置可能不足。如果正确的"颜色阈值"和"大小范围"后,已经选择和校准仍然建议,原来的检查和计形象应该是一个有效的计数的最终决定因素。
- 注意勾选"校准?如果列的图像被边裁校准根据它的相似到理想的指标。
- 选择标志?校准表的所有样品。
- 右键单击在T他表并选择重新计数>"建议的大小"。这将有叙述,建议最小颗粒面积的图像。
- 再次右击并选择"显示简介"。观察粒子领域的频率散点图。一个理想的图像将有类似很长的右尾正态分布, 即钟形曲线图。 见图3B。
- 调整下大小不等,如果需要的话,通过选择样本,右击并选择重新计数>"手动设置"。观察手动设置对话框。输入所需的设置,然后点击计数使用新的设置来讲述的形象。
- 要手动调整计数,选择的样品中,右键单击表,并选择"使用计数开放形象"。观察与代表由插件计数每个粒子红色标记的原始图像。
注意:叙事>'显示计数二进制映像'是有用的检查有多好我ndividual细胞正在由颜色阈值解析。- 要添加一个计数,按住"Ctrl"和左击。观察在将被添加到样品总数的光标位置的标记。要删除标记,请右键单击图像。该插件将最接近删除标记光标。
- 要删除一组标记,使用ImageJ的一个选择工具选择感兴趣区域(ROI)的区域。按住Ctrl键,右键单击图像和ROI内的所有标记将被删除。请遵守"计数"列中的手机号码。
11.保存/打开结果与导出为CSV
- 在TC,转到菜单栏,然后单击"文件">"保存结果"。观察保存结果对话框。选择一个名称和目标,并点击"保存"。
- 使用"文件">"打开结果"加载包含在主表中显示的所有数据的文件,INCLUDIN克情节。
注:该结果文件保存的图像保存在目录中如果原始图像保存,"打开原始图像"和"打开图像与计数"功能将失败后感动。 - 要重置图像目录,选择样本,右键单击表,并选择"重置图像目录"。注意选择目录对话框。选择新的文件夹,并且如果存在的图像,目录将被复位。重新保存结果文件。
- 使用"文件">"打开结果"加载包含在主表中显示的所有数据的文件,INCLUDIN克情节。
- 要保存一个逗号分隔值(CSV)文件,在菜单栏进入"文件">"导出到.csv"。这产生具有与平均组织成统计组样品数和平均值的标准误差的文件;它的布局是专为普通的图形程序的快速图形。
注:统计组是基于TC中创建的组。- 如果样本遵循的一般命名模板,选择的样本是GRouped,点击右键,选择"自动分组"。这增加了样品具有相同的"姓名"到同一组。使用例如控制 - 1,控制 - 2,治疗 - 1,治疗 - 2:两个控制将被添加到该组"控制"和处理,以"治疗"。
- 双击到组手动添加个样品的样品的'集团'细胞和打字的组名。选择样本被加入到这个组中,点击右键,选择"添加到组"。
结果
细胞浓度计算器
图1呈现CCC校准和可数的图像采集的整个过程。 图1A和1B描绘了在像素P-正方形长度的P平方校准图像和计算。 CCC确定在使用公式给定体积的细胞浓度:
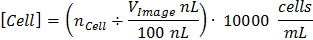
血球的P-...
讨论
关键步骤,故障排除和限制
自动计算方法的本质,特别是那些颗粒的分析,就必须确定这些粒子的数学能力。因此,这两种细胞浓度计算器和迁移测定计数器的精度majorly依赖图像保真度,也就是,所捕获的图像如何酷似细胞样品或迁移测定膜。因此的至上重要性跟随显微镜和相关软件校准协议尽可能最好。这包括限制的背景噪声,减少了不必要的颗粒,捕捉明亮,均匀对焦的?...
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by the Canadian Institute of Health Research to CP (OR 142730 and OR 89931). We would like to thank Jelena Brkic for her initial idea of binary particle analysis in ImageJ.
材料
| Name | Company | Catalog Number | Comments |
| HyClone Classical Liquid Media: RPMI 1640 - With L-Glutamine | Fisher Scientific | SH3002702 | Cell culturing media |
| Fetal bovian serum (FBS) | GIBCO BRL | P00015 | Media suppliment |
| HTR8/SVneo trophoblast cell line | Cells were obtained from Dr. Charles Graham (Queen’s University, Kingston, Canada) | Software is designed to work with any cell line. | |
| Trypsin | GIBCO BRL | 27250-018 | Prepared as 0.20% (w/v) in 10 µM EDTA 1x PBS |
| Accutase | Innovative Cell Technologies | AT104 | |
| 10 cm cell culture plates | SARSTEDT | 833902 | Any tissue culture treated plates will be suitable |
| Transwell Polyester Membrane Inserts - 8.0 µm Pore size | Costar 3422 ordered from Fisher Scientific | 7200150 | For 24-well plates; Pore size: 8.0 µm; 6.5 mm diameter; 0.33 cm2 growth area |
| HARLECO Hematology Stains and Reagents, EMD Millipore - Soluntions 1, 2 & 3 | EMD Millipore and ordered from VWR | 65044A, B, & C | Hemacolor stain set consists of three 500 ml (16.9 oz.) poly bottles & includes a methanol fixative (Solution 1), an eosin or acid stain (Solution 2), and a methylene blue or basic stain (Solution 3) |
| Cotton Tipped Applicator | Puritan Medical | 806-WC | |
| Single-edge industrial razor blades | VWR | 55411 - 055 | Thickness: 0.30 mm (0.012") |
| Microscope Slides - Precleaned/Plain | Fisher Scientific | 12550A3 | Dimentions: 25 mm x 75 mm x 1.0 mm |
| Fisherbrand Cover Glasses - Rectangles no. 1 | Fisher Scientific | 12-545E | Thickness: 0.13 to 0.17 mm; Size: 50 mm x 22 mm |
| Fisher Chemical Permount Mounting Medium | Fisher Scientific | SP15-500 | |
| Leica Stereo dissecting microscope | Leica Microsystems | The microsope is equipped with Leica microscope camera Model MC170 HD & camera software is Leica App. Suite (LAS E2) Version 3.1.1 [Build: 490]. Microscope parts: LED3000 Spot Light Illumination Model: MEB126, Leica M80 Optic Carrier Model M80, Objective achromat 1.0X, WD=90 mm Model: MOB306 & Objective achromat 0.32X, WD=303 mm Model: MOB315, Video Objective 0.5X Model: MTU-293 | |
| Hemacytometer | Assistant Germany | 0.100 mm Depth - 0.0025 mm2 | |
| Olympus inverted light microscope | Olympus Corporation | CKX41SF | The microsope is equipped with Lumenera Infinity 1-2 2.0 Megapixel CMOS Color Camera & camera software is Infinity analyze Version 6.5.2 |
| Laminar flow cabinet 1300 Series A2 | Thermo Scientific | Model: 1375 | Any laminar flow cabinet for cell culture work will be suitable |
| Cell culture incubator | Thermo Scientific | Model: 370 | Any cell culture incubator will be suitable - Cells were cultured under humidefied environment, 5% CO2, 37 °C |
| ImageJ | NIH | Version 1.50e | Minimum version required |
| Java Runtime Environment | Oracle | Version 1.8.0_66 | Minimum version required |
参考文献
- Ricardo, R., Phelan, K. Counting and Determining the Viability of Cultured Cells. J. Vis. Exp. (16), e752 (2008).
- Using a Hemacytometer to Count Cells. Basic Methods in Cellular and Molecular Biology Available from: https://www.jove.com/science-education/5048/using-a-hemacytometer-to-count-cells (2016)
- Graham, M. D. The coulter principle: foundation of an industry. J. Lab. Autom. 8 (6), 72-81 (2003).
- Ormerod, M. G., Imrie, P. R., Walker, J. M., Pollard, J. W. Flow cytometry. Animal Cell Culture. , 543-558 (1990).
- Eliceiri, K. W., et al. Biological Imaging Software Tools. Nat. Methods. 9 (7), 697-710 (2013).
- Louis, K. S., Siegel, A. C., Stoddart, J. M. Cell viability analysis using Trypan blue: manual and automated methods. Mammalian Cell Viability: Methods and Protocols. , 7-12 (2011).
- Scott, W. N., Langdon, S. P. Invasion and motility assays. Cancer Cell Culture: Methods and Protocols. , 225-229 (2004).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro Cell Migration and Invasion Assays. J. Vis. Exp. (88), e51046 (2014).
- Luo, L., et al. MicroRNA-378a-5p promotes trophoblast cell survival, migration and invasion by targeting Nodal. J. Cell Sci. 125, 3124-3132 (2012).
- Adorno, M., et al. A Mutant-p53/Smad Complex Opposes p63 to Empower TGFbeta-Induced Metastasis. Cell. 137, 87-98 (2009).
- Chung, T. K. H., et al. Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1. Int. J. Cancer. 130, 1036-1045 (2012).
- Kramer, N., et al. et al. In vitro cell migration and invasion assays. Mutat. Res./Rev. Mutat. 752, 10-24 (2013).
- Al-Khazraji, B. K., Medeiros, P. J., Novielli, N. M., Jackson, D. N. An automated cell-counting algorithm for fluorescently-stained cells in migration assays. Biol. Proced. Online. 13, 1-6 (2011).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics Intern. 11, 36-42 (2004).
- Grishagin, I. V. Automatic cell counting with ImageJ. Anal. Biochem. 473, 63-65 (2015).
- Thomas, C. R., Paul, G. C. Applications of image analysis in cell technology. Curr. Opin. Biotech. 7 (1), 35-45 (1996).
- . Appreciating data: warts, wrinkles and all. Nat. Cell Biol. 8, 203 (2006).
- Rossner, M., Yamada, K. M. What's in a picture? The temptation of image manipulation. J. Cell Biol. 166, 11-15 (2004).
- . Count objects in an image in Adobe Photoshop. Helpx.adobe.com. , (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。