JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
ImageJ에 플러그인을 사용하여 셀 카운팅 절차의 자동화 된 정량 및 분석
요약
This paper describes the quantification of hemocytometer and migration/invasion micrographs through two new open-source ImageJ plugins Cell Concentration Calculator and migration assay Counter. Furthermore, it describes image acquisition and calibration protocols as well as discusses in detail the input requirements of the plugins.
초록
건강의 ImageJ에 국립 연구소는 강력하고 자유롭게 사용할 이미지 처리 소프트웨어 제품군입니다. ImageJ에 다양한 생물학적 입자를 계산하기 위해 효과적으로 사용할 수있는 포괄적 인 입자 분석 알고리즘을 보유하고 있습니다. 세포 샘플들의 다수를 카운트하면 혈구 시간 관련하여 병목 현상을 나타낸다. 마찬가지로, 상기 ImageJ에 플러그인 셀 카운터와 마이그레이션 / 침공 분석에서 막을 계산 정확하지만, 손목 통증을 일으키는 매우 노동 집약적 주관적인, 그리고 악명입니다. 이러한 요구를 해결하기 위해, 우리는 자동 혈구 (또는 알려진 볼륨) 및 마이그레이션 / 침략 세포 계수의 유일한 작업 ImageJ에 내 두 개의 플러그인을 개발했다. 두 플러그인 최소 배경 고품질 현미경 사진을 획득 할 수있는 능력에 의존한다. 그들은 사용하기 쉽고 카운트 교정에 도움 내장 된 분석 도구와 큰 샘플 크기의 빠른 계산과 분석에 최적화되어 있습니다. 핵심 원리를 결합하여자동화 된 계산 알고리즘 및 사후 분석 계산 셀 카운터 (S)이 크게 이동 분석 정확도의 손실없이 처리 될 수있는 용이성을 증가시킨다.
서문
시험 관내 세포 카운트에서 조직 배양 실험의 넓은 범위의 중요한 기본 기술이다. 정확하게 배양 세포의 수를 결정하는 실험 재현성 표준화 1,2- 필수적이다. 세포는 혈구 계산을 사용뿐만 아니라 자동화 된 방법의 다양한 고유의 장점과 단점 3,4,5- 각을 사용하여 수동으로 수행 될 수있다. 세포 계수에 대한 자동화 된 방법의 대부분은 두 개의 클래스, 콜터 원리를 사용하거나 유동 세포 계측법이 그 중 하나에 속한다. 콜터 카운터는 세포 수와 크기를 결정하기 위해 셀의 전기 저항을 이용한다. 이들은 유동 세포 계측기보다 빠르고 정확하고 저렴하다. 그러나, 이들은 거의 수동 계산 3 비교 인해 상당한 비용 만 세포 카운팅에 사용되지 않는다. 한편, 세포 계측기 흐름 비싸다 있지만 휴대 계산, 셀 형상, 명세서의 분석과 같은 많은 응용 분야를 가지고ructure 측정 내부 셀은 4,5 마커. 이 두 원칙 중 하나를 사용 기계는 많은 제조 업체에서 사용할 수 있습니다. 자동화 된 방법은 수동 계산에 필요한 시간의 일부와 함께하지만 비싼 기계 (6)을 사용하는 동안 수동 계산은 저렴하지만 시간과 바이어스의 적용을받습니다.
다른 일반적인 세포 배양 과정은 시험 관내 세포 운동성 분석, 즉, 세포 이동 및 침입 7이다. 마이그레이션 및 침략 분석은 일반적으로 화학 주성 응답에 대한 응답으로 세포 운동성 및 침입을 조사하는 데 사용됩니다. 또한, 이들은 널리 여러 세포 유형 7-11 배아의 발달, 분화, 염증성 반응 및 전이를 연구하기 위해 사용된다. 마이그레이션 분석의 다공질 막을 통해 이전 또는 침입 한 세포는 두 가지 방법으로 정량화 될 수있다. 첫째, 형광 염료로 염색 세포를 해리하여 이리저리형광 판독기 (12)를 사용하여 막 및 정량화 해요. 정량이 방법의 제한은 기록 막의 유지 될 수 없으며 추가 분석 13 가능성이 없다는 것이다. 마이그레이션에 대한 두 번째 정량 방법은 / 고정 및 크리스탈 바이올렛, 톨루이딘 블루 염색 또는 헤 마톡 실린과 같은 세포 학적 염료와 더 일반적으로 형광 염료, 염색되는 세포를 침공된다 그 다음 세포는 수동으로 매우 시간이 걸리는 작업 12,13 이들 막의 반전 현미경 이미지를 사용하여 정량화된다.
수동 세포 계수의 단점을 극복하기 위해, 세포 농도 및 마이그레이션 분석을위한 두 신뢰성 있고 정확한 자동 세포 계수기가 개발되었다. 이러한 자동 세포 계수기 알고리즘 오라클 자바 컴퓨터 언어를 사용하여 플러그인으로 ImageJ에 대해 개발되었다. ImageJ에는 난방 국립 연구소에서 개발 한 공공 및 널리 사용되는 이미지 처리 도구입니다l 번째 (NIH) 14, 15; 따라서, ImageJ에 이러한 플러그인을 작성하는 것은 생물학적 지역 사회에 쉽게 통합을 용이하게합니다.
세포 계수의 자동화는 수동 계산에 비해 높은 처리량과 재현성을 보장합니다. 다른 가능한 소프트웨어 및 플러그인은 이미지 분석 5,16,17, 세포 농도 계산기 플러그인을 통해 세포 농도를 계산하기 위해 사용될 수 있지만 고속이며 또한 세포 치료의 희석 처리 할 수있다. 또한,이 두 카운터에서 모든 결과 및 계산을 저장하고 내보낼 수 있습니다. 이 논문에서 설명 된 두 개의 플러그인 해부 범위의 사용을 통해 생균 이미징 마이그레이션 분석 멤브레인 큰 시야 (전체 막 캡처) 이미징 위상차 현미경의 사용을 위해 최적화된다. http://peng.lab.yorku.ca/imagej-plugins : 플러그인은에서 설치 지침을 다운로드 자유롭게 사용할 수 있습니다.
프로토콜
1. 복합 현미경과 카메라 설정 (세포 농도 계산기)
- 빛 조절 노브 전체에 전구의 밝기를 높이 4 배 대물 렌즈로 전환하고, 위상차 필터가 선택되어 있는지 확인.
참고 : 어두운 배경과 조직 문화에 대한 모든 역 위상차 현미경, 예를 들어, PHP는 위상차, 표준 현미경 카메라 절차에 따라 사용할 수 있습니다. - 현미경의 소프트웨어 내에서 기본값으로 이미지 캡쳐 설정을 설정합니다.
참고 : 이러한 설정의 위치를 찾기 위해 현미경의 사용 설명서를 참조하십시오.- '밝기', '대비', 그리고 100 % '포화'와 '감마'및 1.0 '이득'을 설정합니다.
참고 : 소프트웨어에 따라, '밝기'와 '대비'는 0 %의 값 대신 100 %로 기본 수 있습니다. - 설정 이미지는 검은 색과 흰색이 가장 높은 해상도 availabl를 사용하여 캡처 할전자 (1,600 X 1,200 픽셀 (픽셀) 이상).
참고 : 흑백 설정을 사용할 수없는 경우 0 %의 '포화'충분하다.
- '밝기', '대비', 그리고 100 % '포화'와 '감마'및 1.0 '이득'을 설정합니다.
- 현미경 스테이지로 표준 혈구를 배치하고 (도 1a)에 도시 된 바와 같이 이미지를 캡처; 이것은 '볼륨 교정 이미지'입니다. 필요에 따라 노출 타이밍을 조정합니다.
2. 이미지 볼륨 교정
- 오픈 ImageJ에와 플러그인 메뉴에서 셀 농도 계산기 (CCC) 플러그인, 예를 들어, 플러그인> 분석기> '셀 농도 계산기'를 시작합니다.
- 오른쪽 '이미지 볼륨 교정'패널이 보이지 않으면, 그것을 보여주기 위해 '교정'을 클릭합니다.
- ImageJ에에서 '가져 오기 이미지 차원'버튼을 단계 1.3 ( '파일'> '열기')에서와 CCC 클릭의 '볼륨 교정 이미지'를 엽니 다.
참고 :이 두 이미지를 입력합니다 너비와자동 픽셀 이미지 해상도와 높이 텍스트 상자. - ImageJ에에서 선택 도구에 '직선 도구'다음 선택하고 클릭하고 커서를 드래그하여 (그림 1B)에서 설명 -square 혈구 차 (P)의 전체 길이에 걸쳐 직선을 그립니다.
- 직선 측정을 포함하는 결과 창을 표시 할 수있는 'M'키를 누르십시오. CCC의 'P-평방 길이'텍스트 상자 (그림 1B)로 길이 열에서 값을 입력합니다.
- 출력에 '이미지 볼륨을 계산'버튼을 이미지 볼륨 텍스트 상자에 이미지 볼륨을 클릭합니다. 이미지 볼륨이 이미 알려진 경우 선택적으로, 상기 이미지 량 입력란에 내셔널 리그 볼륨 입력.
- '저장'버튼을 클릭합니다.
참고 : 플러그인 지금 교정.
3. 카메라의 노출 보정
- 에 대한 다음과 같은 세포 수확혈구의 챔버에 혈구, 부하 세포의 10 μL를 통해 계산하고 현미경 스테이지에 배치합니다.
- 혈구의 배경 라인 사라지게되도록 단계 120에서 동일한 설정을 사용하여, 노광 시간을 조정한다.
- 셀의 내부는 중앙 교차 셀의 부분이 아닌 극 내의 포커스를 나타내는 세포막보다 어둡게되도록 초점을 조정한다.
- 또한, 세포가 과다하지 않도록 노출을 조정하고 (도 1C)에 도시 된 것과 유사.
참고 : 약간 보이는 혈구 라인이 허용됩니다. 정확성과 재현성을 유지하기 위해 이러한 설정을 저장하거나 기록하는 것이 좋습니다.
4. 이미지 인식
- 각각의 세포 샘플의 경우, 혈구의 양 챔버에 부하 10 μL 통계적 추론 능력이 증가합니다. 현미경 단계에 혈구를 배치이미징.
주 : 각 이미지의 해상도와 배율이 '볼륨 교정 이미지'와 동일해야합니다. 플러그인은 선택된 폴더의 모든 이미지를 계산; 유지 이미지는 같은 폴더에 함께 계산한다.- 파일 이름의 자동 증가 기능을 사용할 수있는 경우, 전원을 켜 각각의 이미지가 처리량을 증가 캡처 후 표시되지 않습니다 있는지 확인하십시오.
참고 : 수동으로 저장하고 크게 과정을 느리게 각 이미지를 폐쇄. 자동 증가 기능의 가용성에 대한 자세한 내용은 현미경의 사용 설명서를 참조하십시오. - 이상 (5-10)의 정확도를 높이기 위해 추천되었지만 혈구의 중앙 영역의 적어도 세 개의 비 중첩 이미지를 캡처.
참고 : 세포가 두 위치에서 밀도가 증가하는 경향 상단과 챔버의 하부 영역 모두를 피하십시오. 각 실 화상에 대해 동일한 번호를 가라. 이 계산하는 동안 플러그인의 적절한 기능에 필요합니다.
- 파일 이름의 자동 증가 기능을 사용할 수있는 경우, 전원을 켜 각각의 이미지가 처리량을 증가 캡처 후 표시되지 않습니다 있는지 확인하십시오.
5. 이미지 계수 및 희석
- CCC에서 '셀 카운트'를 클릭하고 디렉터리를 선택 대화 상자를 관찰합니다. 폴더를 선택 계산합니다.
- 폴더를 선택한 후 시료 번호 입력 창을 관찰한다. 챔버 당 촬영 한 이미지, 즉, 4.1.2의 번호를 입력하고 '확인'을 클릭합니다. 플러그인은 이제 알파벳 순서에서 선택한 폴더의 모든 JPG, TIFF 및 PNG 이미지를 계산합니다.
참고 : '샘플 뷰어'버튼을 클릭하면 계산 샘플에 대한 정보를 표시하는 샘플 뷰어 창을 가져올 것이다. 샘플 농도는 챔버 당 찍은 모든 이미지의 평균 농도이다. 단위없는 시료 농도는 약물 또는 소분자 치료의 추가로,이리스트에 추가 될 수있다.- 농도가 동일한 샘플 (섹션 4)의 카운트 내에서 상당히 다를 경우 세포 샘플을 재검 표.
주 : 모든 희석을 계산하기 위해 t그가 계산-샘플을, CCC는 자동으로 화학식 C 1 V 1 = C 2 V 2를 사용합니다.
- 농도가 동일한 샘플 (섹션 4)의 카운트 내에서 상당히 다를 경우 세포 샘플을 재검 표.
- 추가로 96 웰 플레이트 + 1의 30 우물에 파종의 200 μL 당 15,000 세포 시나리오를 사용하여
- 'μL'에 인접 콤보 상자 단위를 변경, 15,000에 C2 레이블의 오른쪽과 200 농도 볼륨 텍스트 상자에 텍스트 상자를 설정합니다.
참고 : 플러그인이 궁극적으로 세포 / mL의 농도를 계산합니다. - 반드시 볼륨 콤보 박스 V2 선택한 (최종 부피)을 확인하고 오른쪽 텍스트 박스의 볼륨 단위 콤보 박스 'μL'를 선택하면 (6200) (200 μL의 × (30 + 1))를 입력한다.
- 'μL'에 인접 콤보 상자 단위를 변경, 15,000에 C2 레이블의 오른쪽과 200 농도 볼륨 텍스트 상자에 텍스트 상자를 설정합니다.
- 왼쪽 아래 목록 상자에 현재 입력 희석을 추가하는 '계산 희석'을 클릭합니다.
주 : 각 첨가 희석, 각 샘플에 대해 해결 될 것이고, 우측의 트리도 표시. 각 항목을 두 번 클릭 확장합니다. - 클릭 t그는 '샘플 뷰어'버튼 아래에 '저장'버튼을 모든 샘플 데이터와 희석을 파일에 쓸 수 있습니다.
- 참고 :이 데이터는 '로드'를 클릭하고 저장된 파일을 선택하여 언제든지 복구 할 수 있습니다.
6. 마이그레이션 및 침략 (카운터)
- 표준 보이든 챔버 방법 7-9을 사용하여 마이그레이션 및 침략 분석을 수행합니다.
- 세포 마이그레이션 한 후 / 침략주의 깊게 반전 부드럽게 눌러 삽입 내에서 용지를 제거합니다. 심지 멀리 초과 매체는 종이 타월에 가장자리를 터치하여 멤브레인의 하단에 부착.
참고 :이 부착 된 셀을 제거 할 수 있습니다, 수건에 막 자체를 만지지 마십시오. - 수정 및 다른 솔루션의 ~ 포함하는 각 행과 설정 24 웰 플레이트에 500 μl를보고 7-9으로 세포를 염색, 예를 들어, 정착액, 얼룩 하나, 얼룩 2를 두 번 증류수 (DDH 2 O). 1X PBS의 t와 제 2 플레이트를 채우기O를 절단하기 전에의 삽입을 배치합니다.
- 반전에 의해 세포를 멀리 보라고 전에 물을 배수 DDH 2 O 가득 우물로 배치하여 삽입을 씻고 DDH 2 O와 삽입물을 입력합니다.
- 멤브레인이 손상되지 않도록 막 돌보는의 상단에서 해제 마이그레이션 / 취소 침입 세포를 제거하기 위해 깨끗한면 주걱을 사용합니다. 멤브레인의 가장자리 주위에 철저해야합니다.
- 깨끗한 유리 슬라이드에 막 (바닥면을 위로) 전송 신중하게 면도칼이나 메스를 사용하여 막을 잘라.
- 아래 멤브레인의 상단에 장착 용액의 작은 방울을 추가하고 얇은 커버 슬립으로 다룹니다.
참고 : 계산의 정확성을 유지하기 위해 설치 솔루션 내에서 거품을 트래핑하지 마십시오.
7. 범위 및 카메라 설정을 해부
- 현미경의 광원과 카메라를 켭니다.
참고 : 자세한 지침은 현미경의 사용 설명서를 참조하십시오. - 재치현미경의 소프트웨어 설정 이미지 캡쳐 설정을 힌은 기본값입니다.
주 : 평균화 기능이 존재하는 경우, 4 인 값이 권장된다. 이는 평균 및 영상 획득 시간의 정도 사이 좋은 타협이다. 마찬가지로, 선명의 작은 정도는 이미지 충실도를 증가시킬 수있다.- '밝기', '대비', 그리고 100 % '포화'와 '감마'및 1.0 '이득'을 설정합니다.
참고 : 소프트웨어에 따라, '밝기'와 '대비'는 0 %의 값 대신 100 %로 기본 수 있습니다. - 최대 설정으로 설정 디스플레이 (실시간) 캡처 해상도 (1,600 X 1,200 픽셀 및 2592 X 1944 픽셀, 각각).
주 : 디스플레이 해상도 리프레시 속도가 너무 느린 경우 필요에 따라 조정될 수있다. 낮은 해상도는 더 어려워 정확하게 초점을 맞출 수 있도록하지만, 재생 빈도를 증가시킬 것이다.
- '밝기', '대비', 그리고 100 % '포화'와 '감마'및 1.0 '이득'을 설정합니다.
- 해부 범위 스테이지를 들어, 백색 고체를 backgro에 사용싶게; 검은 색 또는 유리 배경이 부족합니다.
- 우측으로 두 개의가요 LED 조명으로부터 바람직하게는, 상기 스테이지의 광원을 사용하여 스테이지의 왼쪽.
주 : 광원 부정적인 후속 계산의 정확성에 영향을 미칠 수있는 마이그레이션 분석 막 내의 기공을 조명 아래 단계를했다. - 무대 위에 완성 된 마이그레이션 분석 막 슬라이드를 놓습니다. 단일 막의 가장자리 단지 카메라의 시야 내에 있도록 소프트웨어로 표시되는 실시간 영상을 보면, 줌 조정 노브로 배율을 조정한다.
참고 : 유리 접시에 슬라이드를 배치는 솟다 흰색 배경 단계는 쉽게 이미징을위한 슬라이드를 기동 할 수 있습니다. - 가능한 한 근접도 2a에 도시 된 이상적인 이미지를 재현하는 광원 위치 (7.6.1) 및 노출 시간을 조정한다. 밝기에 따라 5-60 MS의 노출 시간은 충분합니다.
노트:목표는 가시 세포의 손실로 이어지는 가능한 적은 배경 색상 즉 이미지 충실도를 저하시키지 않고 균일 한 조명 막 과다에 의한 이미지를 생성하는 것이다.- 슬라이드에 낮은 각도로 왼쪽과 오른쪽 광원을 배치합니다. 이 배경 얼룩과 색수차를 제거하는 데 도움이됩니다. 다른 직접 반대 각각의 광원을 유지하십시오.
참고 : 위치에 각각의 광원을 조종하는 동안, 다른 전원을 끄십시오. 이것은 그 자체보다 쉽고 정확하게 막 위에 조명 영역의 중심을 돕는다.
- 슬라이드에 낮은 각도로 왼쪽과 오른쪽 광원을 배치합니다. 이 배경 얼룩과 색수차를 제거하는 데 도움이됩니다. 다른 직접 반대 각각의 광원을 유지하십시오.
- 슬라이드 및 화이트 밸런스 현미경 소프트웨어에서 하나의 버튼 클릭을 사용하여 이미지를 제거합니다.
주 : 현미경 지금 교정. 향후 사용을 위해 가능한 한 많은 설정을 저장하고 광원의 위치와 강도의 주를 가지고.
8. 이미지 인식 및 Flatfield () 현재
- 소프트웨어 내에서 설정캡처 폴더 위치 및 캡처 막 당 하나의 이미지입니다. 의 일반적인 템플릿 다음 이미지 이름 : 이름 - 등등 001.tif 및 - 예를 들어, ###, 제어 - 001.tif, 제어 - 002.tif, 시험 약을.
주 : 최상의 이미지 검색 결과를 들어, JPEG 등의 손실 형식을 통해 티파니와 같은 이미지 파일 형식을 저장합니다.
참고 : 이미지가 여전히 계산됩니다 일반 템플릿을 다음하지하지만 자동 그룹화 및 평면 수비에 적용 대상이되지 않는다.- Flatfield () 현재 수정이 필요한 경우, 각 슬라이드의 빈 영역을 발견하고 명명 규칙 다음 빈 이미지를 촬영 : 이름 - 빈.
주 : 빈 더 막을 포함하지 배경 조명을 나타내는 슬라이드의 영역입니다. - 즉시 촬상 전에 커버 슬립 위에 압력을인가함으로써 각각의 막 평탄화 가능한 많은 포획 된 기포를 제거한다.
- Flatfield () 현재 수정이 필요한 경우, 각 슬라이드의 빈 영역을 발견하고 명명 규칙 다음 빈 이미지를 촬영 : 이름 - 빈.
- ImageJ에에서 플러그인으로 이동하여 TC 플러그인을 엽니 다; 예를 들어, 플러그인>> & # 분석39; 트랜스 웰 카운터 '.
- TC 내에서 'Flatfield () 현재'버튼을 클릭 디렉토리를 선택 대화 상자를 관찰합니다. 막 이미지가 저장된 폴더를 선택합니다.
참고 : 위의 일반 템플릿으로 저장 한 이미지 만 자동으로 수정 및 선택한 폴더 내에 Flatfield () 현재라는 새 폴더에 저장 Flatfield () 현재됩니다. Flatfield () 현재 보정 된 이미지의 예는도 2b를 참조하십시오.
9. 구성 설정
- 마이그레이션 분석 막 ImageJ에있는 이미지 ( '파일'> '열기')를 선택 이미지> 조정> '컬러 임계 값 ...'을 엽니 다. 이미지의 필터링됩니다 어떤 색상을 조정하는 컬러 임계 값 창을 준수하십시오.
- 창 하단의 'RGB'(적색, 녹색, 청색)으로 설정 임계 화 방법 'Shanbhag'에, '화이트'에 대한 임계 값 색상, 색 공간에서; 선택한 경우 선택을 취소 어두운 배경입니다.
- 상단 조정클릭하고 0 ~ 255의 범위에 마커와 하단의 슬라이더를 드래그하여 슬라이더 (255에서 바닥 슬라이더를 떠나). 이미지가 완전히 흰색 있는지 확인합니다.
- 만 핵이 보일 때까지 녹색과 빨간색 위쪽 슬라이더를 조정합니다.
참고 : 사용되는 세포 얼룩에 따라 완전히 달라집니다 선택한 설정. 도 2c를 참조하십시오. - 위원회 플러그인에서 입력 관련 환경 설정 'RGB 임계 값'텍스트 상자에 RGB 상단 슬라이더의 값. '추가 / 수정'버튼을 클릭하고 설정을 덮어 씁니다.
- 1의 크기 범위 하한과 상한 값을 남겨 - 무한합니다.
- 환경 설정 패널 내 하드 드라이브에 설정을 작성하는 '저장'을 클릭합니다.
10. 계수 이미지 및 교정
- 위원회 플러그인 (8.2)을 열고 '폴더를 계산'을 클릭하고 디렉터리를 선택 대화 상자를 관찰합니다. 폴더를 선택하는 것은 계산에이 끝날 때까지 차 기다립니다.
- 각 계산 샘플은 자동 기본 테이블에 추가된다. 키 열은 '백작', '품질'및 '교정?'입니다.
주 : 비 - 보정 카운트 열 '지역 범위'표시 영역 내의 막 당 입자의 수이다.
참고 : 품질은 약 -0.8 ~ 1.7의 범위; Q ≥ 0.5 허용됩니다.- 에 확인 표시를 준수 '보정?' 이미지가 교정을 받았습니다 열 경우 이상적인 측정과의 유사성을 기반으로.
참고 : 품질 및 교정 모두 현재 설정이 가능 부족한 것을 제안 할 수 있습니다. 적절한 '색상 임계 화'와 '크기 범위'후 선택되었습니다 및 교정은 여전히 원래의 검사를 제안하고 이미지가 유효한 수의 최종 결정해야한다 계산됩니다.
- 에 확인 표시를 준수 '보정?' 이미지가 교정을 받았습니다 열 경우 이상적인 측정과의 유사성을 기반으로.
- 교정에 대한 신고 됨 테이블의 모든 샘플을 선택합니다.
- t에서 마우스 오른쪽 단추로 클릭테이블을 선택 재계 그가> '크기를 제안'. 이 제안 된 최소 입자 영역으로 이미지를 재 계산됩니다.
- 다시 오른쪽 버튼으로 클릭하고 '보기 플롯'를 선택합니다. 입자 영역의 주파수 분산 플롯을 관찰한다. 이상적인 이미지, 즉 긴 마우스 오른쪽 꼬리 정규 분포, 종 곡선을 닮은 그래프해야합니다. 도 3b를 참조하십시오.
- 샘플, 마우스 오른쪽 버튼으로 클릭을 선택하고 재계> '수동 설정'을 선택하여 필요한 경우, 낮은 크기 범위를 조정합니다. 수동 설정 대화 상자를 관찰한다. 원하는 설정을 입력하고 새로운 설정으로 이미지를 재 계산하는 카운트를 클릭합니다.
- 수동으로 수를 조정 오른쪽 테이블을 클릭하면, 샘플을 선택하고 '카운트 열기 이미지'를 선택합니다. 플러그인에 의해 계산 각각의 입자를 나타내는 빨간색 마커 원본 이미지를 관찰한다.
참고 : 재계는> 방법을 잘 확인하는 것이 유용 할 수있는 '쇼 이진 이미지를 계산'전ndividual 세포 컬러 임계 값에 의해 해결되고있다.- 수를 추가하려면 'Ctrl 키를'좌 클릭을 개최합니다. 샘플 총 수에 추가됩니다 커서 위치에 마커를 관찰한다. 마커를 제거하려면 이미지를 마우스 오른쪽 클릭합니다. 플러그인은 커서에 가장 가까운 마커를 제거합니다.
- 마커의 그룹을 제거하기 위해, ROI (region of interest)를 선택 ImageJ에있는 선택 도구를 사용한다. 'Ctrl'키를 누른 상태에서 이미지를 마우스 오른쪽 버튼으로 클릭하고 ROI 내부의 모든 마커가 제거됩니다. '백작'열에서 세포 수를 관찰한다.
11. 저장 / 결과 열기 및 CSV로 내보내기
- > '저장 결과'TC에서 메뉴 표시 줄로 이동하고 '파일'을 클릭합니다. 저장 결과 대화 상자를 관찰한다. 이름과 대상을 선택하고 '저장'을 클릭합니다.
- '결과 열기'가 기본 테이블에 표시되는 모든 데이터를 포함하는 파일을로드 includin에> '파일을'사용g 줄거리.
참고 : 결과 파일은 이미지에 저장된 디렉토리를 저장하는 원래의 이미지가 실패합니다 기능 '카운트 열기 이미지', '열기 원본 이미지'등을 저장 한 후 이동합니다.. - 이미지 디렉토리를 다시 샘플을 선택하려면 오른쪽 테이블을 클릭하고 '이미지 디렉토리 재설정'을 선택합니다. 디렉토리를 선택 대화 상자를 관찰한다. 새 폴더를 선택하고 이미지가 존재하는 경우, 디렉토리가 재설정됩니다. 결과 파일을 다시 저장합니다.
- '결과 열기'가 기본 테이블에 표시되는 모든 데이터를 포함하는 파일을로드 includin에> '파일을'사용g 줄거리.
- 메뉴 바에서, 쉼표로 구분 된 값 (CSV) 파일을 저장하려면 '.csv로 내보내기' '파일'>로 이동합니다. 이는, 평균 통계 그룹으로 구성 샘플 카운트 및 평균의 표준 오차를 가진 파일을 생성한다; 레이아웃은 일반적인 그래프 프로그램의 빠른 그래프를 위해 설계되었습니다.
참고 : 통계 그룹은 TC 내에서 생성 된 그룹을 기반으로합니다.- 샘플은 일반적으로 명명 템플릿을 따른다면, GR로 샘플을 선택ouped 마우스 오른쪽 버튼으로 클릭하고 '자동 그룹화'를 선택합니다. 이는 동일한 그룹에 동일한 '이름'으로 샘플을 추가한다. 두 컨트롤이 '치료'에 그룹 '제어'및 치료에 추가 할 것 : 1, 제어 - - 2, 치료 - - 1, 치료 2 예 컨트롤을 사용하여.
- 그룹 이름을 두 번 클릭하여 그룹에 수동으로 샘플의 '그룹'셀 입력을 샘플을 추가합니다. 선택 샘플은 마우스 오른쪽 버튼을 클릭하고 '그룹에 추가',이 그룹에 추가합니다.
결과
세포 농도 계산기
그림 1은 CCC의 교정 및 가산 이미지 수집의 전체 프로세스를 제공합니다. 도 1a와 1b는 픽셀 P-평방 길이의 P-광장 교정 이미지와 계산을 묘사한다. CCC는 식을 이용하여 소정의 부피로 세포 농도를 결정
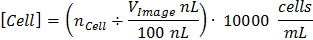
토론
중요한 단계, 문제 해결 및 제한 사항
자동화 된 계산 방법의 특성상 입자 분석의 상세들은, 이들 입자를 정의하는 수학적인 기능을 필요로한다. 따라서, 세포 농도 계산기 마이그레이션 분석 계수기 모두의 정확도는 상기 캡쳐 된 이미지는 세포 샘플 또는 마이그레이션 분석 막과 유사한 방법에 가깝게, 즉 이미지 충실도 majorly에 의존한다. 따라서 가능한 한 가장으로 현미경 ?...
공개
The authors declare that they have no competing financial interests.
감사의 말
This work was supported by the Canadian Institute of Health Research to CP (OR 142730 and OR 89931). We would like to thank Jelena Brkic for her initial idea of binary particle analysis in ImageJ.
자료
| Name | Company | Catalog Number | Comments |
| HyClone Classical Liquid Media: RPMI 1640 - With L-Glutamine | Fisher Scientific | SH3002702 | Cell culturing media |
| Fetal bovian serum (FBS) | GIBCO BRL | P00015 | Media suppliment |
| HTR8/SVneo trophoblast cell line | Cells were obtained from Dr. Charles Graham (Queen’s University, Kingston, Canada) | Software is designed to work with any cell line. | |
| Trypsin | GIBCO BRL | 27250-018 | Prepared as 0.20% (w/v) in 10 µM EDTA 1x PBS |
| Accutase | Innovative Cell Technologies | AT104 | |
| 10 cm cell culture plates | SARSTEDT | 833902 | Any tissue culture treated plates will be suitable |
| Transwell Polyester Membrane Inserts - 8.0 µm Pore size | Costar 3422 ordered from Fisher Scientific | 7200150 | For 24-well plates; Pore size: 8.0 µm; 6.5 mm diameter; 0.33 cm2 growth area |
| HARLECO Hematology Stains and Reagents, EMD Millipore - Soluntions 1, 2 & 3 | EMD Millipore and ordered from VWR | 65044A, B, & C | Hemacolor stain set consists of three 500 ml (16.9 oz.) poly bottles & includes a methanol fixative (Solution 1), an eosin or acid stain (Solution 2), and a methylene blue or basic stain (Solution 3) |
| Cotton Tipped Applicator | Puritan Medical | 806-WC | |
| Single-edge industrial razor blades | VWR | 55411 - 055 | Thickness: 0.30 mm (0.012") |
| Microscope Slides - Precleaned/Plain | Fisher Scientific | 12550A3 | Dimentions: 25 mm x 75 mm x 1.0 mm |
| Fisherbrand Cover Glasses - Rectangles no. 1 | Fisher Scientific | 12-545E | Thickness: 0.13 to 0.17 mm; Size: 50 mm x 22 mm |
| Fisher Chemical Permount Mounting Medium | Fisher Scientific | SP15-500 | |
| Leica Stereo dissecting microscope | Leica Microsystems | The microsope is equipped with Leica microscope camera Model MC170 HD & camera software is Leica App. Suite (LAS E2) Version 3.1.1 [Build: 490]. Microscope parts: LED3000 Spot Light Illumination Model: MEB126, Leica M80 Optic Carrier Model M80, Objective achromat 1.0X, WD=90 mm Model: MOB306 & Objective achromat 0.32X, WD=303 mm Model: MOB315, Video Objective 0.5X Model: MTU-293 | |
| Hemacytometer | Assistant Germany | 0.100 mm Depth - 0.0025 mm2 | |
| Olympus inverted light microscope | Olympus Corporation | CKX41SF | The microsope is equipped with Lumenera Infinity 1-2 2.0 Megapixel CMOS Color Camera & camera software is Infinity analyze Version 6.5.2 |
| Laminar flow cabinet 1300 Series A2 | Thermo Scientific | Model: 1375 | Any laminar flow cabinet for cell culture work will be suitable |
| Cell culture incubator | Thermo Scientific | Model: 370 | Any cell culture incubator will be suitable - Cells were cultured under humidefied environment, 5% CO2, 37 °C |
| ImageJ | NIH | Version 1.50e | Minimum version required |
| Java Runtime Environment | Oracle | Version 1.8.0_66 | Minimum version required |
참고문헌
- Ricardo, R., Phelan, K. Counting and Determining the Viability of Cultured Cells. J. Vis. Exp. (16), e752 (2008).
- Using a Hemacytometer to Count Cells. Basic Methods in Cellular and Molecular Biology Available from: https://www.jove.com/science-education/5048/using-a-hemacytometer-to-count-cells (2016)
- Graham, M. D. The coulter principle: foundation of an industry. J. Lab. Autom. 8 (6), 72-81 (2003).
- Ormerod, M. G., Imrie, P. R., Walker, J. M., Pollard, J. W. Flow cytometry. Animal Cell Culture. , 543-558 (1990).
- Eliceiri, K. W., et al. Biological Imaging Software Tools. Nat. Methods. 9 (7), 697-710 (2013).
- Louis, K. S., Siegel, A. C., Stoddart, J. M. Cell viability analysis using Trypan blue: manual and automated methods. Mammalian Cell Viability: Methods and Protocols. , 7-12 (2011).
- Scott, W. N., Langdon, S. P. Invasion and motility assays. Cancer Cell Culture: Methods and Protocols. , 225-229 (2004).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro Cell Migration and Invasion Assays. J. Vis. Exp. (88), e51046 (2014).
- Luo, L., et al. MicroRNA-378a-5p promotes trophoblast cell survival, migration and invasion by targeting Nodal. J. Cell Sci. 125, 3124-3132 (2012).
- Adorno, M., et al. A Mutant-p53/Smad Complex Opposes p63 to Empower TGFbeta-Induced Metastasis. Cell. 137, 87-98 (2009).
- Chung, T. K. H., et al. Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1. Int. J. Cancer. 130, 1036-1045 (2012).
- Kramer, N., et al. et al. In vitro cell migration and invasion assays. Mutat. Res./Rev. Mutat. 752, 10-24 (2013).
- Al-Khazraji, B. K., Medeiros, P. J., Novielli, N. M., Jackson, D. N. An automated cell-counting algorithm for fluorescently-stained cells in migration assays. Biol. Proced. Online. 13, 1-6 (2011).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics Intern. 11, 36-42 (2004).
- Grishagin, I. V. Automatic cell counting with ImageJ. Anal. Biochem. 473, 63-65 (2015).
- Thomas, C. R., Paul, G. C. Applications of image analysis in cell technology. Curr. Opin. Biotech. 7 (1), 35-45 (1996).
- . Appreciating data: warts, wrinkles and all. Nat. Cell Biol. 8, 203 (2006).
- Rossner, M., Yamada, K. M. What's in a picture? The temptation of image manipulation. J. Cell Biol. 166, 11-15 (2004).
- . Count objects in an image in Adobe Photoshop. Helpx.adobe.com. , (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유