需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
高通量,实时,细胞内的抗菌活性的双读出测试和真核细胞的细胞毒性
摘要
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
摘要
细胞内的抗菌活性和真核细胞的细胞毒作用的传统措施,依靠端点检测。这样的端点检测要求,如细胞裂解,菌落形成单位的确定,或试剂除了读出之前一些额外的实验步骤。时,例如,在高通量筛选执行数以千计测定的,对于这些类型的测定所需要的下游努力是相当大的。因此,为了便于高通量抗菌发现,我们开发了实时测定以同时识别的细胞内细菌生长抑制剂和评估的真核细胞的细胞毒性。具体地讲,实时的细胞内细菌生长的检测用标记与任一细菌勒克斯操纵子( 第一代测定法)或荧光蛋白记者( 第二代,正交测定)细菌筛选菌株已启用。无毒的,细胞膜非透性,核酸结合染料巨噬细胞的最初感染过程中也被加入。这些染料被排除在活细胞。然而,非存活的宿主细胞失去膜完整性允许进入和核DNA的荧光标记(脱氧核糖核酸)。值得注意的是,DNA结合与荧光量子产率,提供了宿主细胞死亡的基于溶液的读出一个大的增加有关。我们已经使用该组合测定法来执行在微孔板格式的高通量筛选,并通过显微镜来评估细胞内的生长和细胞毒性。值得注意的是,抗微生物剂可显示协同作用,其中当一起施用两种或更多种抗微生物剂的组合效果是,当分别施加大于。测试体外抗细胞内病原体的协同作用,通常是一个很大的任务,因为在不同浓度的抗生素的组合排列必须评估。然而,我们发现,我们的实时检测与自动化,数字化配送技术相结合permitted轻便协同测试。使用这些方法,我们能够系统地调查了大量抗菌药物单独的行动,并结合对细胞内病原体, 嗜肺军团菌。
引言
在车厢内临时增加或居住病原体很难根除治疗。预留或相对专性细胞内的病原体,如嗜肺军团菌 , 立克次体 , 布鲁氏菌。 ,土拉弗朗西斯菌 , 结核分枝杆菌。往往需要长时间抗菌治疗疗程治愈,可能范围从个月甚至数年。此外,细胞外的病原体可能暂时占据利基内并以这种方式通过抗生素治疗一般疗程逃脱通关,后来冒出来启动毒感染的新一轮。 金黄色葡萄球菌和1肠杆菌科细菌尿路感染2,3两日益认识到的例子。因此,从根本上药物发现的目标是,以确定渗透到细胞内的区室新颖抗微生物剂。最佳治疗迅速消灭胞内生物体和防止通过亚抑制抗微生物暴露性的发展是特别理想的。
为此,我们开发了一种高通量筛选技术来识别细胞内渗透剂抗菌药物靶向模型病原体, 嗜肺军团菌的细胞内生长。 4既往临床观察表明,标准的药敏试验并没有准确地对这种微生物体内的治疗功效预测。 5具体地,这是因为主要类别抗微生物剂,如β内酰胺类和氨基糖苷类的,虽然针对无菌生长军团菌非常有效,没有充分渗透到其中, 军团驻留的胞内区室。 5,6后来的证据表明,在技术上更复杂的细胞生长测定有效预测临床疗效。 7 不幸的是,这些测定是极其费力的端点测定法,要求感染巨噬细胞,用抗微生物剂处理过的,在不同的时间点被裂解为菌落形成单位计数。此类测定法是不实际的大规模做,不适合于高通量药物筛选。
因此,我们开发的技术为细胞内细菌生长的实时确定。 6这是通过使用或者通过一个细菌萤光素酶操纵子8的集成改性的细菌菌株的9记者(第二代,正交检测,这里描述的)来实现(第一代测定中,如前所述)4或荧光蛋白到细菌染色体中。以这种方式,发光或荧光信号提供细菌数的替代,实时读数。
然而,这些属性没有解决在细胞内infectio一个主要混杂因素Ñ测定法,对宿主细胞的脱靶效应。具体地,宿主细胞的死亡固有地限制细胞生长和导致的抗微生物效果的假阳性鉴定。在筛选库,许多化合物是真核细胞的毒性,例如假阳性将压倒真抗微生物剂,因此需要大量的后续,端点细胞毒性测定法进行解析。
因此,这是极大的兴趣的,以便能够同时评估真核细胞生存力和细胞内生长。值得注意的是,非存活的真核细胞的特征是细胞膜完整性的损失。该测试细胞膜的渗透性探针可以因此用于评估细胞生存力。我们以前的特点一系列推定细胞膜非透性,荧光,DNA结合染料的访问和染色死细胞的核DNA的能力。 4在结合核DNA,这些染料显示quantu大幅增加米荧光产量造成了后台解决方案增加了荧光信号。因此,这些染料提供真核细胞死亡的定量读数。 4值得注意的是,我们发现几个人正在无毒自己长期合作孵育J774巨噬细胞中。当最初的感染过程中加入的,它们提供了一种实时的,可以由一个微板荧光计来测量或观察到的微观真核细胞死亡的荧光读数。
因此,通过组合使用细菌记者和无毒,膜不通透性的,DNA结合染料,我们能够发展一种简单的,非破坏性的,实时的检测,以测量细菌负荷,同时真核细胞的细胞毒性。此法使我们能够在384孔板筛选〜万知的生物活性物质,包括〜250抗菌剂和> 24万的小分子与功能上未鉴定的活性,抑制细胞内生长的能力嗜肺军团菌 ,而在同一时间产生用于每个化合物的真核细胞的细胞毒性数据。 6我们对军团菌生长的细胞内已知的抗菌药物分析是这种类型迄今为止最全面的探索。 6
根据我们的测定形式的效率,在组合使用时,我们也随之探讨已知抗微生物剂的潜在的协同作用。其中最常见的协同作用试验中,所谓的棋盘测定中,被标准地通过评估两个或更多抗微生物剂的两倍连续稀释的组合效果进行。 10在这些试验中,当两个或多个抗微生物剂都大于每个单独施加的效果的总和施加一起协同作用是由更大的效果的观察中定义。值得注意的是,迄今为止,只有专注和反对细胞内嗜肺军团菌进行选择性的协同测试因为涉及传统的端点检测乘以所需的组合排列的巨大努力。
为了方便协同测试,我们在自动化数字胶技术相结合6利用我们的实时细胞生长/真核细胞毒性实验的。这种自动化允许我们以分配溶于DMSO或单独或在384孔格式组合水溶液的化合物的系列稀释。 11此外,这种强大的液体处理技术,使我们能够轻松地执行更高的分辨率,平方根的二(而不是标准的,较低的分辨率,加倍)稀释组合在我们的二维实现更高水平的特异性,棋盘的协同作用分析。用两倍稀释系列12时,该分辨率是在解决有关再现性的协同作用字段关注特别有价值。最后,我们的分析是定量的,也疗法安伏测量抑制等级。其结果,在测定捕获的抑制信息的全部,在等高线等效线图表达的,其中isocontours与生长抑制的类似水平连接的组合的浓度。 6该绘图策略允许组合剂量-反应曲线的可视化。为了说明我们的方法,我们描述我们的协议进行这些检测并显示代表性的结果。
研究方案
1.实时细胞内生长和真核细胞毒性测定
- 准备宿主细胞(J774A.1细胞)
- 培养J774A.1 小家鼠巨噬细胞样细胞悬浮在RPMI 1640用9%铁补充的牛血清。最初通道在组织培养瓶中。细胞在15ml培养基中已经成为一个75cm 2的组织培养瓶中铺满后,通过刮擦和稀释分裂到65毫升的相同类型的介质中,其中15毫升返回到组织培养瓶和50毫升转移到250毫升细菌摇瓶中。
- 对于规模化,文化悬浮于250毫升和/或填充到五分之一体积组织培养基千毫升细菌的烧瓶。通过以大约每分钟120转设定转速通气。对于持续增长,孵化正好5%的CO 2和37℃。
- 当他们在范围达到密度收获细胞2.5×10 6个细胞/ ml至5×10 6个细胞/ ml。确保死细胞百分比(通过台盼蓝染色最容易测定)不超过25%,如死细胞会在细胞毒性测定增加的背景噪声。
- 板在白色,组织培养处理过的,384孔微孔板在30微升组织培养基中5×10 4 J774A.1细胞每孔。孵育微孔板过夜,以实现对实验的每天90%汇合。
- 准备发光或荧光嗜肺军团菌
- 通过嗜肺军团菌 (LP02 :: flaA基因::勒克斯8)适宜的培养基上的细菌, 也就是缓冲木炭酵母提取物(BCYE)中。如果使用胸苷营养缺陷型菌株,补充介质用100微克/毫升胸苷。通过在一个新的BCYE板厚厚扩频生物体和(从冷冻的储存如果)(从以前的盘通路如果)孵育一天或两到三天,以获得汇合准备细菌实验的补丁增长。
- 通过将10克酵母提取物,10个克N-制备BCYE板- (2-乙酰氨基)-2-氨基乙烟酸,0.35g K 2 HPO 4,和950毫升去离子水1克二氢钾α酮戊二酸。调整与氢氧化钾(≥2.5毫升11.9摩尔溶液)pH值6.9。
- 加入琼脂15克和2克活性炭;并带来至1L总体积。加入磁力搅拌棒和高压灭菌。至55℃,冷介质和含有0.4克L-半胱氨酸和0.42克铵铁(III)柠檬酸溶解在去离子水添加过滤灭菌的溶液。使用磁搅拌盘前浇培养皿混合。
- 对于无菌生长培养基嗜肺军团菌生长的测试,并用于所有BCYE化学试剂相结合,除了木炭准备ACES,酵母提取物肉汤(AYE)和琼脂。过滤消毒,并立即使用,或者冻结以后的实验。
- 在SA悬浮生物用于J774A.1细胞用100μg/ ml的胸苷补充适当我组织培养基。
- 通过嗜肺军团菌 (LP02 :: flaA基因::勒克斯8)适宜的培养基上的细菌, 也就是缓冲木炭酵母提取物(BCYE)中。如果使用胸苷营养缺陷型菌株,补充介质用100微克/毫升胸苷。通过在一个新的BCYE板厚厚扩频生物体和(从冷冻的储存如果)(从以前的盘通路如果)孵育一天或两到三天,以获得汇合准备细菌实验的补丁增长。
- 巨噬细胞感染
- 添加感兴趣的测试化合物(筛选化合物,以及阳性和阴性对照细菌生长抑制和真核细胞裂解)。优选地,在≥500x溶解储备溶液在DMSO(二甲基亚砜)或水溶液,以允许车辆的足够稀释。
- 虽然库存溶液可以冷冻贮存,避免不稳定化合物和抗微生物剂冻融循环。
- 稀释发光细菌的目标的在组织培养基中2.5×10 6 CFU(菌落形成单位)/米和荧光报道标记的细菌到1.0×10 7 CFU / ml和添加适当的非毒性,膜不通透性,核酸-在2.5倍最终测定浓度结合染料。
- 加入20微升混合物到每个J774A.1文化很好,最终测定体积50微升,最终菌浓度为1×10 6 CFU /毫升(勒克斯操纵子记者)或4×10 10 6 CFU /毫升(荧光蛋白报告)。
- CO 2的100%在37℃下1-3天,在5%的相对湿度,以防止蒸发的边缘效应。
- 添加感兴趣的测试化合物(筛选化合物,以及阳性和阴性对照细菌生长抑制和真核细胞裂解)。优选地,在≥500x溶解储备溶液在DMSO(二甲基亚砜)或水溶液,以允许车辆的足够稀释。
- 检测读数
- 阅读微孔板发光仪和荧光为适合记者细菌的生长和真核细胞的毒性被使用。
- 为了避免温度相关的边缘效应,热微孔板发光读数之前通过放置在一个单一的层平衡一个实验台上用盖子微开大约20分钟(或在有盖的生物安全柜关闭大约10分钟)。
- 返回如果在稍后的时间点实时读出希望微孔板孵化器。
- 阅读微孔板发光仪和荧光为适合记者细菌的生长和真核细胞的毒性被使用。
2.数据分析
- 正常化数据正负CONtrols计算百分比或折叠抑制细胞内细菌的生长和细胞毒性百分比为真核细胞。
- 为了评估测定鲁棒性,计算为细菌生长抑制和细胞毒性阳性和阴性对照之间的统计分离使用Z因子(Z')的分析,其中Z'= 1 - 3(σP +σN)/ |μ 的p +μÑ |。在此公式中,σp和σn分别为正和负对照孔,分别标准偏差; μp和μn分别为正和负对照孔的平均值,分别为。
- 用于高通量筛选测定法,计算标准z得分(或其它替代方案中,定量的统计度量),以评估感兴趣的测试化合物的作用。另外,计算简单折叠减少或登陆倍减少作为一个潜在的生理上更相关影响幅度为衡量几何复制细菌。
3.单和多维( 即协同)剂量反应测试及数据解读
- 如在协议第1节准备的巨噬细胞和细菌。
- 感染或无菌孵化只是之前,在高端加实验兴趣的抗菌剂以串行,二倍稀释系列,跨越的目标,完全消除生长的浓度(即最小抑菌浓度或MIC)和低结束浓度没有显示出明显的活性。
- 使用自动液体处理系统,以促进通过直接,自动除了根据制造商的协议抗菌稀释的单剂量 - 反应和组合协同作用的测试设置。
- 考虑使用子二倍稀释的,例如,841 / 54841eq1.jpg"/> - 倍稀释系列,和测定复制以增加数据的准确性和可重复性。
- 对于巨噬细胞的感染,稀发光细菌以在组织培养基中的目标2.5×10 6 CFU(菌落形成单位)/毫升。加入20μl混合物的每个J774A.1培养孔,最终测定体积50微升,最终菌浓度为1×10 6 CFU / ml的;并在37℃下在5%CO 2,在100%相对湿度下孵育。
- 为无菌增长试验,稀发光细菌在AYE介质1×10 6 CFU / ml的终浓度,加入50微升到384孔板的每个孔中并在5%CO 2在37℃孵育 在100%的相对湿度。
- 计算抑制细菌生长的抗菌组合分数抑制剂浓度指标。在组合导致细菌○完全或> 99%抑制每种药物(A,B,。。n)的"一个"本身FIC 一个 =化合物的浓度"a"的通过的最小抑制剂浓度分为:rowth,计算各个部分抑菌浓度(FIC 的a,b,正。)如下。 。使用相同的公式,计算出FIC B, 等,然后计算组合FIC指数或
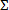 FIC = FIC A + FIC B +。 。 .FIC N每个抑制组合。
FIC = FIC A + FIC B +。 。 .FIC N每个抑制组合。 - 使用偏离最远的从1.0到评估协同作用的组合索引。考虑≤0.5的截止作为协同效应保守指示和≥4,拮抗剂效果。 12
- 情节等效线图,等高线等效线图,和/或等值面等效线图的组合效应为6替代图形表示。
结果
微孔板细胞生长试验
图1图中的检测步骤。示出的自动化的步骤可以手动完成。然而,可以通过使用液体处理系统大大地促进。
图2示出了从384孔微孔板,双读出,实时的细胞内生长,并用军团菌菌株(LP02)标有任一个勒克斯操纵子( 图
讨论
我们描述了细胞内的细菌的生长和宿主细胞的细胞毒作用的同时检测的实时检测。有在协议中的几个关键步骤。首先,对于健壮测定性能,必须有细菌和细胞毒性读数之间有足够的光谱分离。这样的分离是本征为萤光素酶操纵子记者和荧光DNA结合染料的组合。然而,根据我们的经验( 表1-3, 图2),使用双荧光读出要求的不重叠的荧光信号( 例如 ,利用一个远红?...
披露声明
The authors have nothing to disclose.
致谢
研究这个手稿报告是由过敏和美国国立卫生研究院传染病研究所根据奖号R01AI099122到JEK的内容完全是作者的责任的支持,并不一定代表全国学院的官方意见健康。我们想从体外培育牛黄,朗伍德筛选基金和/或国家筛选实验室感谢詹尼弗·史密斯,大卫·罗贝尔,苏蒋道格洪水,肖恩·约翰斯顿,珍妮弗·纳莱,斯图尔特鲁德尼茨基,保仁,理查德兆,和Rachel监狱长卓越的生物防御和新兴他们在开发和高通量筛选试验的表现帮助传染病(由U54AI057159支持)新英格兰地区中心。我们还要感谢肯尼斯·P·史密斯对稿件有益的意见。
材料
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
参考文献
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。