Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüksek Verimli, gerçek zamanlı, Hücre içi Antimikrobiyal Aktiviteleri Çift okuma Test ve Ökaryotik Hücre Sitotoksisite
Bu Makalede
Özet
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
Özet
Hücre içi antimikrobiyal aktivite ve ökaryot hücre sitotoksisite geleneksel önlemler uç nokta deneyleri güveniyor. Böyle uç nokta tahlilleri gibi hücre erimesi, koloni oluşturan birim tespiti veya reaktif ilave olarak okunmasını önce birkaç ek deneysel adımlar gerektirir. Örneğin, yüksek verimli bir tarama sırasında deneyleri binlerce gerçekleştirirken, tahliller, bu tür için gerekli alt çaba dikkate değerdir. Bu nedenle, yüksek verimli bir antimikrobiyal keşif kolaylaştırmak için, eş zamanlı olarak hücre içi bakteri büyümesine nin inhibitörlerini teşhis etmek ve ökaryotik hücre sitotoksisitesini değerlendirmek için gerçek zamanlı bir tahlil geliştirilmiştir. Spesifik olarak, gerçek zamanlı olarak, hücre içi bakteri büyümesi tespit bakteriyel lux operon'u (1. nesil tahlili) ya da floresan protein muhabir (2. nesil dik deney) ya da bakteriyel bir tarama suşları işaretleyerek sağlanmıştır. Toksik olmayan, hücre zan-geçirgen olmayan, nükleik asit bağlayıcı bir boyaAyrıca makrofaj ilk enfeksiyon sırasında ilave edildi. Bu boyalar, canlı hücreler dahil edilmemiştir. Ancak, cansız konakçı hücreler girişi ve nükleer DNA floresan etiketleme (deoksiribonükleik asit) izin membran bütünlüğünü kaybeder. Özellikle, DNA, konakçı hücre ölümünün bir çözelti bazlı okunmasını sağlar flüoresan kuantum verimi büyük bir artış ile ilişkili bağlama. Bu mikro-biçiminde bir yüksek girdi boyunca araştırma yapmak ve mikroskopla hücre büyüme ve sitotoksikliğinin değerlendirilmesi için bu kombine tahlili kullanılmıştır. Özellikle, antimikrobik birlikte uygulanır, iki ya da daha çok antimikrobik maddenin kombine etkisi ayrı uygulandığında daha büyük olan sinerji sergileyebilir. Farklı konsantrasyonlarda antibiyotik kombinasyon permütasyon değerlendirilmesi gerektiğini gibi hücre içi patojenlere karşı in vitro sinerji Test normalde olağanüstü bir iştir. Ancak, bizim gerçek zamanlı tahlil otomatik, dijital dağıtım teknolojisi p ile kombine bulunduuyduruk sinerji testi ermitted. Bu yaklaşımları kullanarak, sistematik hücre içi patojen Legionella pneumophila karşı karşıya antimikrobiyal çok sayıda eylem ve birlikte anket başardık.
Giriş
Hücre içi bölümlerinde geçici büyümek veya ikamet patojenler terapötik tedavisi zordur. Zorlayıcı yada nispeten gibi Legionella pneumophila, Coxiella burnetii, Brucella spp gibi hücre içi patojenler zorunlu. Francisella tularensis ve Mycobacterium spp. genellikle aylar hatta yıllar arasında değişebilir tedavisi için antibiyotik tedavisi ders uzamış gerektirir. Ayrıca, hücre dışı patojenler geçici hücre içi nişler işgal ve bu şekilde antimikrobiyal tedavinin normal kurslar açıklığı kaçmak ve daha sonra öldürücü enfeksiyon yeni mermi başlatmak için ortaya çıkabilir. Staphylococcus aureus 1 ve üropatojenik Enterobacteriaceae 2,3 enfeksiyonları iki giderek tanınan örneklerdir. Bu nedenle, temel bir ilaç keşif hedefi hücre içi bölmelere nüfuz yeni antimikrobiyal tespit etmektir. Optimal tedavi hızla ortadan kaldırmak içinhücre içi organizmalar ve alt önleyici antimikrobiyal maruz kalma yoluyla direnç gelişmesini önlemek, özellikle tercih edilir.
Bu amaçla, biz modeli patojen Legionella pneumophila hücre içi büyüme hedefleyen hücre içi sızan antimikrobiyallerin tanımlamak için bir yüksek verimli bir tarama teknolojisini geliştirdi. 4 Önceki klinik gözlemler, standart antimikrobiyal duyarlılık testi doğru bu organizmaya karşı in vivo terapötik etkinlik tahmin etmediğini göstermektedir. Bu β-laktamlar ve aminoglikozid olarak antimikrobik temel sınıfları, aksenik biçimde yetiştirilen Legionella karşı son derece etkili olmasına rağmen, yeterli Legionella bulunan hücre içi nüfuz çünkü 5 Özellikle, bu oldu. 5,6 Daha sonra delil teknik olarak daha karmaşık hücre içi büyüme analizleri etkili bir klinik etkinliğini tahmin önerdi. 7 Ne yazık ki, bu deneyler koloni oluşturan birim sayımı için farklı zamanlarda noktalarında parçalanması gereken antimikrobik tedavi edilen enfekte makrofajlar, gerektiren son derece zahmetli uç noktaları deneyleri idi. Bu gibi deneyler, büyük ölçekte yapılacak pratik değildir ve yüksek verimli ilaç keşfi için uygun değildir.
Bu nedenle, hücre içi bakteri büyümesine, gerçek zamanlı saptanması için teknoloji geliştirilmiştir. 6 Bu bakteriyel kromozoma 4 ya da floresan proteini (daha önce tarif edilen, birinci kuşak deneyi) ya da bakteriyel lusiferaz operon 8 entegrasyonu ile modifiye edilmiş bir bakteri suşu kullanılarak 9 muhabir (burada tarif edilen ikinci kuşak, dik deney) gerçekleştirilmiştir. Bu şekilde, ışık veren veya flöresanlı bir sinyal bakteriyel sayısının bir taşıyıcı, gerçek zamanlı olarak okunmasını sağlar.
Ancak, bu nitelikler hücre içi infectio büyük bir karıştırıcı adresi yokn deneyleri, konakçı hücreler üzerinde hedef dışı etkiler. Özellikle, konakçı hücre ölümü doğal hücre büyümesini sınırlar ve antimikrobiyal etki yanlış pozitif bulmaktır. Tarama kütüphanelerinde olduğu gibi birçok bileşik ökaryotik hücre toksik, böyle yanlış pozitif takipte, çözüm için son nokta sitotoksisite deneyleri çok sayıda gerektiren, gerçek antimikrobiyal korkutur olacağını vardır.
Bu durumda, aynı anda ökaryotik hücre canlılığı ve hücre içi büyümeyi değerlendirmek mümkün büyük ilgi olmuştur. Özellikle, canlı olmayan ökaryotik hücrelerin karakteristik hücre zarı bütünlüğünün kaybıdır. hücre membranının geçirgenliği test probları, bu nedenle, hücre canlılığını değerlendirmek için de kullanılabilir. Daha önce ulaşmak ve ölü hücrelerin nükleer DNA leke putatif hücre zan-geçirgen olmayan, floresan, DNA bağlayıcı boyaların bir dizi becerisi ile karakterize edilir. 4 nükleer DNA bağlayıcı, bu boyalar, kuantum bir büyük artışı gösterecektirArka plan çözüm floresan üzerinde artan sinyal sonuçlanan m floresan verim. Bu nedenle, bu boyalar, ökaryotik hücre ölümünün kantitatif okuma sağladı. 4 Özellikle, biz birkaç J774 makrofajlar ile uzun süreli işbirliği inkübasyon sırasında kendileri toksik olmayan olduğu bulundu. ilk enfeksiyon sırasında ilave zaman, gerçek zamanlı, mikroskopik bir mikro florimetre ile ölçülür ve gözlemlenebilir ökaryotik hücre ölümünün flüoresan okuması sağlamaktadır.
Bu nedenle, bir bakteri muhabir ve toksik olmayan, zar geçirgenliği olmayan kullanımını birleştirerek, DNA bağlayıcı boyalar, biz bakteri yükü ve aynı zamanda ökaryotik hücre sitotoksisitesini hem ölçmek için basit, tahribatsız, gerçek zamanlı test geliştirmek başardık. Bu deney, US hücre içi büyümesini inhibe etme yeteneği için ~ de dahil olmak üzere fonksiyonel olarak karakterize edilmemiş aktivitesi 250 antimikrobiyal ve> 240,000 küçük molekülleri 384 oyuklu plaka biçiminde ekran ~ 10,000 bilinen biyoaktif maddelerin sağladıLegionella pneumophila, aynı zamanda her bir bileşik için ökaryotik hücre sitotoksisite verileri oluştururken. Legionella hücre içi büyümeye karşı bilinen antimikrobiyal 6 Yaptığımız analizler bugüne kadar bu tip en kapsamlı araştırma oldu. 6
bir arada kullanıldığında, bizim deney formatının verimliliği göre, aynı zamanda, daha sonra bilinen antimikrobiyal potansiyel sinerjistik etkiler araştırdı. En yaygın sinerji testlerinin bir sözde dama deneyi, standart olarak iki ya da daha çok antimikrobik maddenin iki kat seri dilüsyonları kombinasyon etkilerinin değerlendirilmesi ile gerçekleştirilir. İki ya da daha çok antimikrobik madde, ayrı olarak uygulanan her etkilerin toplamından daha birlikte uygulandığında, bu deneylerde 10, sinerji daha etkisinin gözlenmesi ile tanımlanır. Unutmayın ki, şimdiye kadar, sadece odaklanmış ve seçici sinerji testi, hücre içi Legionella pneumophila karşı yapıldı gerekli birleştirici permütasyon ile çarpılır geleneksel uç nokta deneylerinde yer alan büyük bir çaba çünkü.
Sinerji testi kolaylaştırmak için, otomatik dijital dağıtım teknolojisi 6 ile birlikte bizim gerçek zamanlı hücre içi büyüme / ökaryot sitotoksisite deneyi kullandı. Bu otomasyon DMSO veya sulu bir çözelti tek başına ya da 384-kuyucuklu bir biçimde kombine içinde çözülmüş bileşiklerinin seri seyreltmeleri dağıtmak için izin. 11 Ayrıca, bu tür sağlam sıvı taşıma teknolojisi kolayca daha yüksek çözünürlük gerçekleştirmek için bize izin, kare-kök-iki (yerine standart daha düşük çözünürlük, katlama), iki boyutlu olarak özgüllüğünün yüksek düzeylerine ulaşmak için seyreltme kombinasyonları, dama tahtası sinerji analiz. İki katlı bir seyreltme serisi 12 kullanırken bu çözünürlük tekrarlanabilirlik ilgili sinerji alanında endişeleri ele özellikle değerliydi. Son olarak, bizim tahlil nicel ve ayrıca therefore inhibisyon geçişleri ölçüldü. Bunun bir sonucu olarak, deney büyüme inhibisyonu benzer olan kombinasyon konsantrasyonları bağlantı isocontours olan isocontour isobolograms içinde eksprese önleyici tüm bilgileri, yakalanan. 6 Bu çizim stratejisi kombinatoryal doz-yanıt eğrilerinin görselleştirme sağladı. Bizim metodoloji göstermek için, bu analizleri gerçekleştirmek için bizim protokol tarif ve temsili sonuçlar göstermektedir.
Protokol
1. Gerçek Zamanlı Hücre içi Büyüme ve Ökaryotik Hücre Sitotoksisite Tahlili
- Hazırlama Konukçu Hücreler (J774A.1 Hücreleri)
- % 9 demir takviye buzağı serumu RPMI 1640 içinde süspansiyon kültür J774A.1 Mus musculus makrofaj benzeri hücre. doku kültürü şişelerinde İlk geçit. Hücreler ortam içinde 15 ml 75 cm 2 doku kültürü şişesi içinde Biraraya getirilen sonra 15 ml doku kültürü şişesi döndürülür ve 50 mi aktarıldığı ortamı aynı tip, 65 ml kazıma ve seyreltme ile bölünmüş 250 ml'lik bir bakteriyel çalkalayıcı şişeye.
- 250 ml ve / veya doku kültür ortamı ile beşte biri hacime kadar doldurulmuş 1.000 mi bakteriyel şişelerinde süspansiyon içinde ölçek büyütme, kültür için. Dakikada yaklaşık 120 devirde dönme hızı ayarlanarak havalandırınız. Istikrarlı büyüme için tam% 5 CO 2 ve 37 ° C'de inkübe edin.
- Bunlar aralığında yoğunluğa ulaşmak Hasat hücreleri 2.5 x 10 6 hücre/ 5 x 10 6 hücre / ml aralığındadır. ölü hücreler sitotoksisite deneylerinde arka plan gürültüsünü artacak olarak,% 25 geçmemesi (en kolay Tripan mavisi ile test) ölü hücre yüzdesini emin olun.
- Beyaz levha, doku 384 oyuklu mikro 30 ul doku kültürü ortamında 5 x 10 4 J774A.1 hücre göz başına, kültür-işlemden geçirildi. Deney gününde% 90 izdiham elde etmek için mikro gece boyunca inkübe edin.
- Hazırlama Işıklı veya Floresan Legionella pneumophila
- Passage L. pneumophila (Lp02 :: Flaa :: lüks 8) uygun ortamda bakteriler, yani tamponlu kömür maya özütü (BCYE) orta. Bir timidin okzotrofik suşu kullanılarak durumunda, 100 ug / ml timidin ile orta tamamlar. konfluent elde etmek için yeni bir BCYE plaka üzerinde kalın organizmaların yayılması ve (donmuş stoktan ise) (önceki plaka geçidinden ise) bir gün kuluçka ya da iki üç gün ile deneyler için bakteri yamaları hazırlayınbüyüme.
- 10 g maya ekstresi, 10 g N çözülmesiyle BCYE tabak hazırlayın - HPO 4- (2-asetamido) -2-aminoetansülfonik asit, 0.35 g K 2 ve deiyonize su 950 ml içinde 1 g monobazik potasyum α-ketoglutarat. Potasyum hidroksit (11.9 mol çözeltisi ≥2.5 mi) ile pH 6.9 olacak şekilde ayarlanır.
- 15 g agar ve 2 g aktif kömür ilave et; 1 L nihai hacme getirmek. Manyetik bir karıştırma çubuğu ve otoklav ekleyin. 55 ° C'ye soğutun, orta ve deiyonize su içinde çözülmüş 0,4 g L-sistein ve 0.42 g amonyum demir (III) sitrat ihtiva eden ilave filtre ile sterilize edilmiş çözeltiler. Petri plakaları dökme önce karıştırmak için mıknatıs karıştırma plakası kullanın.
- Aksenik büyüme ortamında L. pneumophila büyüme testi için, kömür dışında BCYE için kullanılan bütün kimyasal reaktifler birleştirerek ACES-maya özü suyu (AYE) hazırlamak ve ağar. Filtre sterilize ve hemen kullanmak, ya da daha sonra deneyler için dondurma.
- sa süspanse organizmalarUygun şekilde, 100 ug / ml timidin takviyesi ile J774A.1 hücreler için kullanılan me doku kültürü ortamı.
- Passage L. pneumophila (Lp02 :: Flaa :: lüks 8) uygun ortamda bakteriler, yani tamponlu kömür maya özütü (BCYE) orta. Bir timidin okzotrofik suşu kullanılarak durumunda, 100 ug / ml timidin ile orta tamamlar. konfluent elde etmek için yeni bir BCYE plaka üzerinde kalın organizmaların yayılması ve (donmuş stoktan ise) (önceki plaka geçidinden ise) bir gün kuluçka ya da iki üç gün ile deneyler için bakteri yamaları hazırlayınbüyüme.
- makrofaj Enfeksiyon
- (Bakteri üremesi inhibisyonunun ve ökaryotik hücre erimesi açısından tarama bileşikleri ve pozitif ve negatif kontroller) çıkar test bileşiklerinin ekleyin. Tercihen, aracın yeterli seyreltme sağlamak için DMSO (dimetil sülfoksit) veya sulu bir çözelti içinde ≥500x de stok solüsyonları çözülür.
- stok çözeltileri donmuş olarak muhafaza edilmesi de, kararsız bileşikler ve antibiyotiklere donma-erime döngülerinden kaçınmak.
- Doku kültür ortamı içinde 2.5 x 10 6 CFU (koloni oluşturucu birim) / m ve flüoresan raportör etiketli bakteriler 1.0 x 10 7 cfu / ml hedef ve uygun, toksik olmayan, membran geçirgenliği olmayan nükleik asit- eklemek için ışık yayan bakterilerin seyreltin 2.5x nihai deney konsantrasyonu boya bağlama.
- her bir J774A.1 kültür karışımı 20 ul ekle, nihai deney hacmi50 ul nihai bakteri konsantrasyonu 1 x 10 6 CFU / ml (lux operon raportör) veya 4 x 10 10 6 CFU / ml (floresan protein raportör).
- % 100 CO 2 5% 1-3 gün boyunca 37 ° C'de buharlaşan kenar etkileri önlemek için bağıl nemi inkübe edin.
- (Bakteri üremesi inhibisyonunun ve ökaryotik hücre erimesi açısından tarama bileşikleri ve pozitif ve negatif kontroller) çıkar test bileşiklerinin ekleyin. Tercihen, aracın yeterli seyreltme sağlamak için DMSO (dimetil sülfoksit) veya sulu bir çözelti içinde ≥500x de stok solüsyonları çözülür.
- Tahlil Okuma
- gazetecilere için uygun olarak bir mikroplaka luminometresiyle ve florimetrede bakteriyel büyüme ve ökaryotik hücre toksisitesini Oku kullanılır.
- termal (yaklaşık 10 dakika boyunca ya da kapaklı bir biyolojik güvenlik kabini kapalı olarak) yaklaşık 20 dakika boyunca aralık kapaklı bir laboratuar tezgah üzerinde tek kat olarak yerleştirme öncesinde lüminesans okuma mikropleytin denge, sıcaklık ilişkili kenar etkileri önlemek için.
- Daha sonra zaman noktalarında gerçek zamanlı okuma isteniyorsa inkübatör için mikropleytin dönün.
- gazetecilere için uygun olarak bir mikroplaka luminometresiyle ve florimetrede bakteriyel büyüme ve ökaryotik hücre toksisitesini Oku kullanılır.
2. Veri Analizi
- Pozitif ve negatif con veri normalleştirmekTrols ökaryotik hücrelerin hücre içi bakteriyel büyüme ve yüzde sitotoksisite için yüzde veya kat-engellenmesini hesaplamak için.
- P + n u u | 3 (σ P + σ n) / - deney sağlamlığını değerlendirmek için, = 1 'Z analiz Z-faktörü (Z)' kullanılarak bakteri büyümesi inhibisyonu ve sitotoksisite hem de pozitif ve negatif kontroller arasındaki istatistiksel ayırma hesaplamak |. Bu denklem, σ p ve σ n, sırasıyla pozitif ve negatif kontrol kuyuları, standart sapmaları göstermektedir; μ p ve u n, sırasıyla, pozitif ve negatif kontrol kuyuları için ortalama değerlerdir.
- yüksek verimli tarama deneyleri için, ilgi konusu test bileşiklerinin etkilerini değerlendirmek için standart z değerleri (ya da diğer bir alternatif, kantitatif istatistiksel ölçümleri) hesaplar. Alternatif olarak, basit bir kat azalma hesaplamak veya daha alakalı potansiyel fizyolojik olarak azalma kat log geometrik kopyalayan bakteriler için etki büyüklüğü ölçüsü.
3. Tek ve Çok boyutlu (yani, Sinerji) Doz-yanıt Test ve Veri Yorumlama
- Protokol 1. bölümde tarif edildiği gibi makrofajların ve bakteri hazırlayın.
- Hemen önce enfeksiyon veya aksenik inkübasyon (yani minimal inhibitör konsantrasyon veya MIC) ve düşük yüksek ucunda yayılarak amacı ile, seyreltme serisi iki katına, bir seri tamamen büyümeyi ortadan kaldıran bir konsantrasyon deneysel ilgi antimikrobiyal eklemek belirgin bir aktivite gösteren bir son konsantrasyona.
- üreticinin protokolüne göre bir antimikrobiyal dilüsyonları doğrudan otomatik ilavesi ile tek doz-yanıt ve kombinatoryal sinerji testi kurulumu kolaylaştırmak için otomatik bir sıvı taşıma sistemi kullanın.
- Örneğin, alt-katlama seyreltileri kullanılması düşünülebilir841 / 54841eq1.jpg "/> - seyreltme serisi katlayın ve tahlil verilerinin doğruluğu ve tekrarlanabilirliği artırmak için çoğaltır.
- Makrofaj Enfeksiyon için, ışık yayan bakterilerin doku kültür ortamı içinde 2.5 x 10 6 CFU (koloni oluşturucu birim) / ml hedef seyreltin. Her bir J774A.1 kültür, nihai deney hacmi 50 ul, nihai bakteri konsantrasyonu, 1 x 10 6 CFU / mL karışımın 20 ul ekle; ve% 100 nispi nemde,% 5, 37 ° C'de CO2 inkübe edin.
- Aksenik büyüme testi için, hay ortamı içinde, 1 x 10 6 CFU / ml'lik nihai bir konsantrasyona kadar ışık yayan bakterilerin seyreltilmesi 384 oyuklu plakanın her oyuğuna 50 ul% 5 CO2 içinde 37 ° C'de inkübe % 100 nispi nemde.
- Bakteri büyümesini inhibe antimikrobiyal kombinasyonlar için fraksiyonel inhibitör konsantrasyonu endeksi hesaplayın. Bakteriyel g tam veya>% 99 inhibisyon ile sonuçlanır kombinasyon halinde her bir ilaç (a, b,. n.) içinrowth, (FIC A, B, n,...), ayrı ayrı, kesirli önleyici konsantrasyon hesaplanması aşağıdaki gibidir: FIC a = bileşiğinin konsantrasyonu "bir" minimal inhibitör konsantrasyonu ile bölünen, "a" tek başına. . Sonra birleştirici FIC indeksi hesaplamak veya vb FIC b hesaplamak, aynı formül kullanılarak
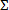 FIC FIC a + b + FIC =. . Her bir inhibitör kombinasyon için .FIC n.
FIC FIC a + b + FIC =. . Her bir inhibitör kombinasyon için .FIC n. - sinerjiyi değerlendirmek için 1.0 ila uzağa sapma kombinatoryal endeksi kullanın. tutucu bir sinerjistik etkinin göstergesi ve ≥ 4, bir antagonist etki olarak ≤ 0.5 bir kesim düşünün. 12
- Konu, isobolograms isocontour isobolograms ve / veya isosurface kombinasyon etkileri 6 alternatif grafik temsilleri isobolograms.
Sonuçlar
Mikrolevha hücre büyüme deneyi
Şekil 1 tahlil adımlarını diyagramları. gösterilen otomatik adımlar elle yapılabilir. Ancak, verim büyük ölçüde sıvı taşıma sistemleri kullanılarak kolaylaştırılır.
Şekil 2, bir 384 gözlü mikroplaka, çift okuma, gerçek zamanlı hücre içi büyüme ve (Lp02) ya da lux oper...
Tartışmalar
Bu hücre içi bakteriyel büyüme ve konakçı hücre sitotoksisite eş zamanlı olarak saptanması için gerçek zamanlı analizler açıklanmaktadır. Protokolde birkaç kritik adımlar vardır. İlk olarak, sağlam tahlil performansı için, bakteri ve sitotoksisite okumalarla arasında yeterli spektral ayırma olmalıdır. Bu ayırma lusiferaz operon muhabir ve floresan DNA bağlayıcı boyaların kombinasyonlar için esastır. Bununla birlikte, deneyim (Tablo 1-3, Şekil 2), çift...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu yazıda bildirilen araştırma içeriği sadece yazarların sorumluluğundadır Jek ödül numarası R01AI099122 altında Allerji ve Ulusal Sağlık Enstitüleri Enfeksiyon Hastalıkları Ulusal Enstitüsü tarafından desteklenen ve mutlaka Ulusal Enstitüsü resmi görüşlerini temsil etmemektedir Sağlık. Biz ICCB-Longwood Eleme Tesisi ve / veya Ulusal Tarama Laboratuarı için Jennifer Smith, David Wrobel, Su Chiang Doug Flood, Sean Johnston, Jennifer Nale Stewart Rudnicki Paul Yan Richard Siu ve Rachel Warden teşekkür etmek istiyorum Mükemmellik New England Bölge Merkezleri biyosavunma ve geliştirme ve yüksek verimli tarama deneyleri performans onların yardım için (U54AI057159 tarafından desteklenen) Bulaşıcı Hastalıklar Gelişen. Biz de yazının yararlı yorumlar için Kenneth P. Smith teşekkür etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
Referanslar
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır