Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокая пропускная способность, в режиме реального времени, двойного считывания Тестирование внутриклеточного антимикробной активности и эукариотической клетки цитотоксичность
В этой статье
Резюме
A high throughput, real-time assay was developed to simultaneously identify (1) eukaryotic cell-penetrant antimicrobials targeting an intracellular bacterial pathogen, and (2) assess eukaryotic cell cytotoxicity. A variation on the same technology was thereafter combined with digital dispensing technology to enable facile, high-resolution, dose-response, and two- and three-dimensional synergy studies.
Аннотация
Традиционные меры внутриклеточного антимикробной активности и эукариотических клеток цитотоксичности полагаются на конечных анализов. Такие конечные точки анализы требуют несколько дополнительных экспериментальных шагов до начала считывания, такие как лизис клеток, определение элементарной колониеобразующих или добавления реагента. При выполнении тысячи анализов, например, во время высокопроизводительного скрининга, усилие вниз по течению, необходимое для этих типов анализов значительна. Поэтому, чтобы облегчить высокую пропускную способность противомикробное открытие, мы разработали анализ в режиме реального времени для одновременного идентификации ингибиторов внутриклеточного роста бактерий и оценки эукариотической клетки цитотоксичность. В частности, обнаружение внутриклеточный рост бактерий в режиме реального времени стало возможным благодаря маркировке бактериальных штаммов скрининга либо с бактериальным лк оперона (1 - е поколение) для анализа или флуоресцентный белок репортеров (2 - го поколения, ортогональным анализ). Нетоксичное, клеточная мембрана-impermeant, кислотно-связывающий краситель нуклеиновойТакже была добавлена во время первичного инфицирования макрофагов. Эти красители исключаются из жизнеспособных клеток. Тем не менее, нежизнеспособные клетки-хозяева теряют целостность мембраны, разрешающий вход и флуоресцентного мечения ядерной ДНК (дезоксирибонуклеиновой кислоты). Следует отметить, что связывание с ДНК связано с большим увеличением флуоресцентного квантовым выходом, который обеспечивает считывание решение на основе гибели клетки-хозяина. Мы использовали этот комбинированный анализ для выполнения экран высокой пропускной способностью в формате микропланшетов, а также для оценки внутриклеточного роста и цитотоксичности с помощью микроскопии. Следует отметить, что противомикробные может демонстрировать синергизм в которых комбинированное действие двух или более антимикробных при применении вместе больше, чем при применении по отдельности. Тестирование на синергии в пробирке против внутриклеточных патогенов , как правило, чудовищный задача , как должна быть оценена комбинаторные перестановками антибиотиков при различных концентрациях. Тем не менее, мы обнаружили, что наши в режиме реального времени анализа в сочетании с автоматизированной, цифровой технологии раздаточного рermitted легкое тестирование синергии. Используя эти подходы, мы были в состоянии систематически обследовать действие большого числа одних антимикробных и в сочетании с внутриклеточным патогеном, легионелл.
Введение
Возбудители, которые растут или временно проживают в внутриклеточным трудно терапевтически искоренить. Облигатные или относительно облигатные внутриклеточные патогены , такие как легионелл, Coxiella burnetii, Brucella SPP. , Francisella tularensis и Mycobacterium SPP. часто требуют длительного курса антибактериальной терапии для лечения, которые могут варьироваться от нескольких месяцев до даже лет. Кроме того, внеклеточные патогены могут скоротечно занимают внутриклеточные ниши и таким образом избежать зазора обычными курсами антибактериальной терапии, а затем появляются, чтобы начать новые раунды вирулентных инфекции. Золотистый стафилококк 1 и уропатогенные Enterobacteriaceae 2,3 инфекции два все чаще признаются примеры. Таким образом, основной целью обнаружения наркотиков является выявление новых противомикробных препаратов, которые проникают во внутриклеточные отсеки. Оптимальная терапия быстро ликвидироватьвнутриклеточные микроорганизмы и предотвратить развитие резистентности через суб-ингибиторной антимикробного воздействия особенно желательно.
С этой целью мы разработали технологию высокопроизводительного скрининга для выявления внутриклеточных-пенетранта противомикробные препараты , нацеленные на внутриклеточный рост модели патогена, легионелл. 4 Предыдущие клинические наблюдения указывают на то, что стандартное тестирование чувствительность к антибиотикам не точно предсказать , в естественных условиях терапевтической эффективности против этого организма. 5 В частности, это произошло потому , что основные классы противомикробных , таких как бета-лактамов и аминогликозидов, хотя они весьма эффективны против axenically выращенного Legionella, не в достаточной степени проникают в внутриклеточные отсеки , где Legionella проживает. 5,6 Впоследствии данные свидетельствуют о том, что технически более сложные анализы внутриклеточного роста эффективно предсказали клиническую эффективность. 7 К сожалению, эти анализы были чрезвычайно трудоемкие анализы конечных точек, требующих зараженных макрофаги, противомикробные препараты, чтобы быть лизируют в разное время точек для колониеобразующих единицы перечисления. Такие анализы являются непрактичными делать в больших масштабах и непригодны для обнаружения наркотиков с высокой пропускной способностью.
Таким образом, мы разработали технологию для определения в реальном времени внутриклеточного роста бактерий. 6 Это было достигнуто за счет использования бактериального штамма модифицированного путем интеграции либо бактериальной люциферазы оперон 8 (проба первого поколения, описанный ранее) 4 или флуоресцентный белок 9 репортеров (второго поколения, ортогональный анализе описано здесь) в бактериальную хромосому. Таким образом, люминесцентный или флуоресцентный сигнал обеспечивает заменяющим, в режиме реального времени отсчет бактериального числа.
Тем не менее, эти атрибуты не затрагивают основную confounder внутриклеточного infectioп анализы, вне цели воздействия на клетки-хозяева. В частности, гибель клетки-хозяина по своей сути ограничивает внутриклеточный рост и приводит к ложной положительной идентификации антимикробного эффекта. Поскольку многие соединения в библиотеках скрининга являются эукариотической клетки токсические, такие ложные срабатывания будут подавлять истинные противомикробные средства, что требует большого количества наблюдения, конечная точка цитотоксичности для разрешения.
Таким образом, это был большой интерес, чтобы быть в состоянии оценить жизнеспособность клеток эукариот и внутриклеточный рост одновременно. Следует отметить, что характеристика нежизнеспособных эукариотических клеток является потеря целостности клеточных мембран. Поэтому Зонды, которые проверяют проницаемость клеточной мембраны, могут быть использованы для оценки жизнеспособности клеток. Ранее мы охарактеризовали способность ряда предполагаемо клеточных мембран-impermeant, флуоресцентный, ДНК-связывающих красителей для доступа и окрашивает ядерную ДНК мертвых клеток. 4 При связывании ядерную ДНК, эти красители показывать значительное увеличение quantuм флуоресцентный выход приводит к увеличению сигнала над фоном раствора флуоресценции. Таким образом, эти красители при условии количественного считывания эукариотической клеточной гибели. 4 Следует отметить, что мы обнаружили , что некоторые были не токсичны сами по себе в течение длительного совместной инкубации с J774 макрофагами. При добавлении во время первичной инфекции, они обеспечили в режиме реального времени, флуоресцентный отсчет эукариотической клеточной смерти, которая может быть измерена с помощью микропланшет флуориметре или наблюдаемую микроскопически.
Таким образом, путем объединения использование бактериального репортера и нетоксичного, мембранная-impermeant, ДНК-связывающие красители, мы смогли разработать простой, неразрушающий, в режиме реального времени анализа для измерения как бактериальной нагрузки и эукариотической клетки цитотоксичность одновременно. Этот анализ позволил нам экран в 384-луночного формата пластины ~ 10000 известных биоактивных включая ~ 250 антимикробные и> 240000 малые молекулы с функционально неохарактеризованной активностью по способности ингибировать внутриклеточный ростЛегионелл, в то же время при создании эукариотических данных цитотоксичности для каждого соединения. 6 Наш анализ известных антимикробных против внутриклеточного роста легионелл был наиболее полное исследование этого типа на сегодняшний день. 6
На основе эффективности нашего формате анализа, мы также исследовали в дальнейшем потенциально синергетические эффекты известных антимикробных при использовании в комбинации. Одним из наиболее распространенных тестов синергии, так называемый шахматный анализ, Стандартно выполняется путем оценки комбинаторных эффектов двукратными серийными разведениями двух или более противомикробных препаратов. 10 В этих анализах, синергизм определяется наблюдением большего эффекта , когда два или более противомикробные препараты применяются вместе , чем сумма эффектов каждого применяемого отдельно. Следует отметить, что до сих пор, только целенаправленным и селективным тестирование синергии проводили против внутриклеточных легионелл из-за больших усилий, участвующих в традиционных конечных точек анализов, умноженное на комбинаторных перестановок требуется.
Для облегчения тестирования синергии, мы использовали наш реального времени внутриклеточного роста / эукариотической анализа на цитотоксичность в сочетании с автоматизированной цифровой технологией раздаточного 6. Это автоматизации позволило нам обойтись серийных разведений соединений, растворенных в диметилсульфоксиде или в отдельности или в комбинации в виде 384-водного раствора. 11 Кроме того, такая надежная технология жидкости обработка позволила нам легко выполнять более высокое разрешение, квадратного корня из двух (а не стандарт, более низкое разрешение, удвоение) комбинации разбавления для достижения более высоких уровней специфичности в нашем двумерная, в шахматном порядке синергии анализ. Это разрешение было особенно ценно в решении проблем в области синергии о воспроизводимости при использовании двукратном разбавлении серии 12. И, наконец, наш анализ был количественным, а также TherEfore измеряется градаций торможения. В результате, анализ захватили полноту ингибиторной информации, экспрессируемый в isocontour isobolograms, в котором isocontours соединить комбинаторные концентрации с аналогичными уровнями ингибирования роста. 6 Эта стратегия позволила визуализировать построение комбинаторных кривых доза-ответ. Чтобы проиллюстрировать нашу методологию, мы описываем наш протокол для выполнения этих анализов и показывают репрезентативные результаты.
протокол
1. в реальном масштабе времени внутриклеточный роста и эукариотической клетки цитотоксичности
- Подготовка клетки-хозяева (J774A.1 клетки)
- Культура J774A.1 Mus Musculus макрофагами , как клетки в суспензии в среде RPMI 1640 с 9% железа с добавкой сыворотки теленка. Первоначально канал в культуре ткани колбы. После того, как клетки становятся конфлюэнтными в 75 см 2 культуре ткани колбу в 15 мл среды, разделить их скребком и разбавлением до 65 мл с тем же типом среды, из которых 15 мл возвращают в колбу с тканевой культурой и 50 мл переносят в 250 мл бактериальной шейкер колбу.
- Для расширения масштабов, культуры в суспензии в 250 мл и / или 1000 мл бактериальных колб, заполненных до одной пятой объема с тканевой культуральной среде. Аэрируйте путем установки скорости вращения при приблизительно 120 оборотов в минуту. Для последовательного роста, инкубировать ровно в 5% CO 2 и 37 ° С.
- Урожай клетки , когда они достигают плотности в диапазоне 2,5 × 10 6 клеток/ мл до 5 × 10 6 клеток / мл. Убедитесь, что мертвый процент клеток (наиболее легко анализировали с помощью окрашивания трипановым синим) не превышает 25%, а мертвые клетки увеличат фоновый шум в цитотоксичности.
- Тарелка в белом цвете, культуре ткани лечение, 384-луночных микропланшетов при 5 × 10 4 клеток J774A.1 в 30 мкл тканевой культуральной среде на лунку. Инкубируйте микропланшеты в течение ночи, чтобы достигнуть 90% сплошности на день эксперимента.
- Подготовка люминесцентный или флуоресцентный легионелл
- Прохождение L. pneumophila (LP02 :: Flaa :: лк 8) бактерии на соответствующей среде, то есть, буферный древесный уголь дрожжевой экстракт (BCYE) среды. При использовании тимидина ауксотрофного штамма, дополняют среду с 100 мкг / мл тимидина. Подготовить участки бактерий для экспериментов путем распространения организмов толстым слоем на новой BCYE пластине и инкубирования в один прекрасный день (если из предыдущей пластины прохода) или два-три дня (если из замороженной), чтобы получить сливающиесярост.
- Готовят BCYE пластины путем растворения 10 г дрожжевого экстракта, 10 г N - (2-ацетамидо) -2-аминоэтансульфоновая кислоты, 0,35 г K 2 HPO 4, и 1 г одноосновного калия α-кетоглутарат в 950 мл деионизированной воды. Доведения рН до 6,9 с помощью гидроксида калия (≥2.5 мл 11,9 М раствора).
- Добавьте 15 г агара и 2 г активированного угля; и довести до 1 л конечного объема. Добавление магнитной мешалкой и автоклав. Охлаждающей среды до 55 ° С и добавляют стерилизованным фильтрацией растворов, содержащих 0,4 г L-цистеин и 0,42 г аммоний железа (III) цитрат, растворенный в деионизированной воде. Используйте магнит мешалка для смешивания перед заливкой чашек Петри.
- Для тестирования роста pneumophila L. в аксенными среде роста, готовят ACES-дрожжевой экстракт бульон (Айе) путем объединения всех химических реагентов , используемых для BCYE древесный уголь , за исключением и агар. Фильтр стерилизовать и использовать сразу или заморозить для дальнейших экспериментов.
- Ресуспендируют организмы в продая среда тканевой культуры использовали для J774A.1 клеток с 100 мкг / мл тимидина добавок в зависимости от обстоятельств.
- Прохождение L. pneumophila (LP02 :: Flaa :: лк 8) бактерии на соответствующей среде, то есть, буферный древесный уголь дрожжевой экстракт (BCYE) среды. При использовании тимидина ауксотрофного штамма, дополняют среду с 100 мкг / мл тимидина. Подготовить участки бактерий для экспериментов путем распространения организмов толстым слоем на новой BCYE пластине и инкубирования в один прекрасный день (если из предыдущей пластины прохода) или два-три дня (если из замороженной), чтобы получить сливающиесярост.
- Макрофаги инфекции
- Добавить представляющих интерес тестируемых соединений (скрининга соединений, а также положительный и отрицательный контроль для бактериального ингибирования роста и эукариотических клеток лизис). Предпочтительно, чтобы растворить маточные растворы при ≥500x в ДМСО (диметилсульфоксид), или водный раствор, чтобы обеспечить достаточное разбавление транспортного средства.
- Хотя исходные растворы можно хранить в замороженном виде, избежать циклов замораживания-оттаивания для лабильных соединений и противомикробных препаратов.
- Развести светящихся бактерий к мишенью 2,5 х 10 6 КОЕ (колониеобразующих единица) / м и флуоресцентные репортерные-меченых бактерий до 1,0 × 10 7 КОЕ / мл в тканевой культуральной среде , и добавить соответствующий нетоксичный, мембранно-impermeant, нуклеиновые кислоты- связывание красителя в 2.5x конечной концентрации для анализа.
- Добавьте 20 мкл смеси для каждой J774A.1 культуры хорошо, конечный объем анализа50 мкл, конечная концентрация бактериальной 1 × 10 6 КОЕ / мл (люкс оперон репортер) или 4 х 10 10 6 КОЕ / мл (флуоресцентный репортер белка).
- Инкубируют при 37 ° С в течение 1-3 дней в атмосфере 5% СО 2 при 100% относительной влажности , чтобы предотвратить испарительные краевых эффектов.
- Добавить представляющих интерес тестируемых соединений (скрининга соединений, а также положительный и отрицательный контроль для бактериального ингибирования роста и эукариотических клеток лизис). Предпочтительно, чтобы растворить маточные растворы при ≥500x в ДМСО (диметилсульфоксид), или водный раствор, чтобы обеспечить достаточное разбавление транспортного средства.
- Анализ счётчика
- Read бактериальный рост и токсичности эукариотической клетки на микропланшет-фотометр и флуориметре, применительно к репортерам используется.
- Для того, чтобы избежать температурных ассоциированных с краевыми эффектами, термически уравновешивания микропланшетов перед чтением люминесценции путем размещения в один слой на лабораторном столе с крышками приоткрыта в течение приблизительно 20 мин (или в кабинете биологической безопасности с крышками выключенном в течение примерно 10 мин).
- Возвращение микропланшетов в инкубатор, если в режиме реального времени считывания в более поздние моменты времени желательно.
- Read бактериальный рост и токсичности эукариотической клетки на микропланшет-фотометр и флуориметре, применительно к репортерам используется.
Анализ 2. Данные
- Нормализация данных в положительной и отрицательной кондля расчета управления установлен процент или Fold-торможение для внутриклеточного роста бактерий и процент цитотоксичности для эукариотических клеток.
- Для оценки анализа надежности, расчета статистического разделения между положительным и отрицательным контролем как для бактериального ингибирования роста и цитотоксичности с использованием Z-фактор (Z ') анализа , где Z' = 1 - 3 (σ р + σ п) / | х р + ц п |. В этом уравнении, о р и σ п являются стандартные отклонения для положительных и отрицательных контрольных скважин, соответственно; μ р и ц п представляют собой средние значения для положительных и отрицательных контрольных лунок, соответственно.
- Для скрининга с высокой пропускной способностью, вычисления стандартных Z-баллы (или другой альтернативы, количественные статистические показатели) для оценки воздействия испытуемых соединений, представляющих интерес. В качестве альтернативы, рассчитать простую Наклоняемый сокращение или лог-кратное снижение как потенциально физиологически более актуальной мера эффекта величины для геометрически реплицирующимися бактерий.
3. Одно и многомерный (т.е. Synergy) доза-ответ Тестирование и интерпретация данных
- Приготовьте макрофаги и бактерии, как описано в разделе 1 протокола.
- Непосредственно перед инфекцией или аксенными инкубации, добавить противомикробные препараты экспериментального интереса к сериалу, удвоение серии разбавления, с целью Spanning на высоком конце концентрацию , которая полностью исключает рост (т.е. минимальная подавляющая концентрация или MIC) и низким положить конец концентрации, которая не проявляет никакой очевидной активностью.
- Используйте автоматизированную систему обработки жидкости для облегчения однократную дозу-ответ и комбинаторной установку тестирования синергии путем прямого, автоматического добавления антимикробных разведениях в соответствии с протоколом производителя.
- Рассмотрим использование суб-удвоенных разведений, например,841 / 54841eq1.jpg "/> - кратной серии разведений, и анализ размножается для повышения точности и воспроизводимости данных.
- Для макрофагальной инфекции, разбавить люминесцирующие бактерии мишенью 2,5 × 10 6 КОЕ (колониеобразующих единица) / мл в тканевой культуральной среде. Добавьте 20 мкл смеси для каждой культуры J774A.1, а конечный объем анализа 50 мкл, конечная концентрация 1 бактериальной х 10 6 КОЕ / мл; и инкубировать при 37 ° С в 5% CO 2 при 100% относительной влажности.
- Для аксенными испытаний на рост, разбавленные светящихся бактерий до конечной концентрации 1 × 10 6 КОЕ / мл в среде AYE, добавляют по 50 мкл в каждую лунку 384-луночного планшета и инкубировать при 37 ° С в 5% CO 2 при 100% относительной влажности.
- Вычислить дробный индекс концентрации ингибитора для антимикробных комбинаций, которые ингибируют рост бактерий. Для каждого лекарственного средства в комбинации (а, б,.. П), что приводит к полному или> 99% ингибирования бактериального гrowth, рассчитать индивидуальную дробной подавляющей концентрации (FIC а, б, п...) следующим образом : FIC а = концентрация соединения "а" , разделенное на минимальной концентрации ингибитора "а" сам по себе. , Используя ту же формулу, вычислить FIC B, и т.д. Затем вычислить комбинаторный индекс FIC или
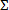 FIC = FIC а + FIC B +. , .FIC П для каждой тормозной комбинации.
FIC = FIC а + FIC B +. , .FIC П для каждой тормозной комбинации. - Используйте комбинаторный индекс, который отклоняется от 1,0 дальше всего для оценки эффекта синергии. Рассмотрим отсечку ≤0.5 как консервативную указанием синергетического эффекта и ≥4, эффект антагониста. 12
- Участок isobolograms, isocontour isobolograms, и / или изоповерхность isobolograms 6 в качестве альтернативных графических представлений комбинаторных эффектов.
Результаты
Микропланшетов внутриклеточный анализ роста
Рисунок 1 Схемы этапы анализа. Автоматизированные шаги, показанные могут быть выполнены вручную. Однако пропускная способность значительно облегчается с использованием жидких с?...
Обсуждение
Мы описываем анализы в режиме реального времени для одновременного обнаружения внутриклеточного роста бактерий и клетки-хозяина цитотоксичности. Есть несколько важных шагов в протоколе. Во-первых, для надежного проведения анализа, должно быть достаточным, спектральное разделение ме...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Исследования сообщили в этой рукописи была поддержана Национальным институтом аллергии и инфекционных заболеваний Национального института здоровья под номером награду R01AI099122 к JEK Содержание является исключительно ответственности авторов и не обязательно отражает официальную точку зрения Национального института Здоровье. Мы хотели бы поблагодарить Дженнифер Смит, Дэвид Wrobel, Су Чан, Даг Flood, Шон Джонстон, Дженнифер Nale, Стюарт Рудницкий, Пол Ян, Ричард С.Ю., и Рэйчел Стража из Screening фонда ICCB-Longwood и / или национальной лаборатории скрининга для Новой Англии региональных центров передового опыта в Biodefense и вновь возникающих инфекционных болезней (при поддержке U54AI057159) за их помощь в разработке и выполнении скрининговых исследований с высокой пропускной способностью. Мы также хотели бы поблагодарить Кеннет П. Смита за полезные замечания по рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| J774A.1 cells | American Type Culture Collection | TIB-67 | Host cell |
| ACES | Sigma-Aldrich | A9758 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Yeast extract, ultrafiltered | Becton-Dickinson/Difco | 210929 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; lower grades may cause impaired growth and/or alter sensitivity of Legionella to growth inhibitors |
| Alpha-ketoglutaric acid, monopotassium salt | Sigma-Aldrich | K2000 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Sodium pyruvate | Sigma-Aldrich | P5280 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Potassium phosphate, dibasic | Thermo Fisher Scientific | P288-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| L-cysteine | Sigma-Aldrich | C-7755 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Ammonium iron(III) citrate | Sigma-Aldrich | F5879 | For making buffered charcoal yeast extract agar and buffered yeast extract medium; ferric pyrophosphate may be used instead but is more difficult to weigh accurately |
| Potassium hydroxide solution, concentrated | Thermo Fisher Scientific | SP236-500 | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Deonized water | N/A | N/A | For making buffered charcoal yeast extract agar and buffered yeast extract medium |
| Thymidine (tissue culture grade) | Sigma-Aldrich | T1895 | For supplementing both RPMI 1640 and buffered yeast extract agar/medium — lower grade thymidine may be used for the latter, but may cause impaired cell growth and/or cell death in RPMI 1640 |
| RPMI 1640, standard formulation | Corning via Thermo Fisher Scientific | 10-040-CV | For growing J774A.1 cells prior to plating; includes 2 mM L-glutamine |
| RPMI 1640 lacking phenol red | Corning via Thermo Fisher Scientific | 17-105-CV | For plating J774A.1 cells in 384 well dishes (not suitable for growth prior to plating); also lacks L-glutamine — supplement to 2 mM before use |
| L-glutamine, 200 mM in 0.85% NaCl (tissue culture grade) | HyClone via Thermo Fisher Scientific | SH30034.02 | For supplementing RPMI 1640 lacking L-glutamine, to 2 mM final concentration |
| Iron-supplemented calf serum | Gemini Bioproducts | 100-510 | For supplementing RPMI 1640, to 9.1% final concentration |
| Trypan Blue solution | Sigma-Aldrich | T8154 | For staining for J774A.1 cell death determination while counting cell density |
| SYTOX Green, 5 mM solution in DMSO | Thermo Fisher Scientific | S7020 | For staining for J774A.1 cell death determination by fluorescence reading or epifluorescence microscopy (in conjunction with orange-red or far red fluorescent bacteria). Use at 125 nM final concentration. |
| Cell culture incubator | Thermo Fisher Scientific | 13-255-26 | For incubation of J774A.1 cells (both before and after infection); can also be used for incubation of bacteria, or a standard atmosphere incubator can be used instead) |
| Orbital shaker | BellCo Glass | 7744-01010 | For shaking incubation of J774A.1 cells before infection; fits inside cell culture incubator; includes shaker base 7744-01000 and tray 7740-01010 (these are also available separately) |
| Shaker flasks (250 ml) | ChemGlass Life Sciences | CLS-2038-04 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (250 ml) | BellCo Glass | 7744-16250 | For shaking incubation of J774A.1 cells before infection |
| Shaker flasks (1,000 ml) | ChemGlass Life Sciences | CLS-2038-07 | For shaking incubation of J774A.1 cells before infection |
| Shaker clamps for flasks (1,000 ml) | BellCo Glass | 7744-16100 | For shaking incubation of J774A.1 cells before infection |
| Sponge foam caps for flasks (250 ml-1,000 ml) | ChemGlass Life Sciences | CLS-1490-038 | For shaking incubation of J774A.1 cells before infection; reduces risk of contamination relative to standard metal caps |
| MultiDrop Combi programmable multichannel peristaltic pump | Thermo Fisher Scientific | 5840300 | For dispensing J774A.1 cells, medium, and bacterial suspension containing fluorophores to large numbers of 384 well dishes |
| Combi standard bore manifold | Thermo Fisher Scientific | 24072670 | Default predispense volume of 20 μl is insufficient to compensate for settling — increase to 80 μl |
| White 384 well dishes treated for tissue culture | Corning | 3570 | For reading luminescence and fluorescence; Greiner catalog # 781080 also tested successfully |
| DMSO (tissue culture grade, in sealed ampoules) | Sigma-Aldrich | D2650 | For dissolving positive control and test compounds |
| Azithromycin | Sigma-Aldrich | PHR1088 | Antibiotic positive control |
| Saponin (from Quillaja bark) | Sigma-Aldrich | S-4521 | Cytoxicity positive control |
| Multichannel pipettor | Thermo Fisher Scientific | Finnpipette | For transfer of fixed amounts of positive control compounds; pipettor must have digital dispensing with detents to enable repetitive fixed volume dispensing |
| Epson pin transfer robot | Epson/ICCB-L | (Custom equipment) | For transfer of fixed amounts of test compounds from library arrays |
| D300 digital dispensing system | Hewlett-Packard via Tecan | D300 | For transfer of variable amounts of test compounds ranging from 11 picoliters to 10 µl |
| T8+ cartridges for D300 digital dispensing system | Hewlett-Packard via Tecan | T8+ | For dispensing test compounds |
| Epifluorescence microscope with computer-connected digital camera | Nikon | Ti | For live cell imaging; any standard fluorescent microscope can substitute, with phase contrast or DIC optics, capable of imaging green (fluorescein), orange-red to red (Texas Red), and far-red (Cy5) fluorescence, with 100X oil objective for highest resolution |
| Glass-bottom tissue culture dishes | MatTek Corporation | P35G-1.5-20-C | For live cell imaging. Dishes such as the MatTek allow microscopic visualization at 600X or 1,000X magnification through use of an inverted epifluorescent or confocal microscope. These specific dishes are 3.5 cm nominal diameter, 3.3 cm inside diameter, with 20 mm diameter #1.5 thickness cover slips inserted into the bottoms. |
| Photoshop CS6 | Adobe | Adobe photoshop or similar programs can be used to pseudocolor and merge light microscopic and fluorescent images. | |
| Mathematica 10 | Wolfam | For generation of two-dimensioonal isocontour isobolograms and three-dimensional surface isobolograms. |
Ссылки
- Garzoni, C., Kelley, W. L. Staphylococcus aureus: new evidence for intracellular persistence. Trends Microbiol. 17 (2), 59-65 (2009).
- Rosen, D. A., et al. Utilization of an intracellular bacterial community pathway in Klebsiella pneumoniae urinary tract infection and the effects of FimK on type 1 pilus expression. Infect Immun. 76 (7), 3337-3345 (2008).
- Blango, M. G., Mulvey, M. A. Persistence of uropathogenic Escherichia coli in the face of multiple antibiotics. Antimicrob Agents Chemother. 54 (5), 1855-1863 (2010).
- Chiaraviglio, L., Kirby, J. E. Evaluation of impermeant, DNA-binding dye fluorescence as a real-time readout of eukaryotic cell toxicity in a high throughput screening format. Assay Drug Dev Technol. 12 (4), 219-228 (2014).
- Edelstein, P. H. Antimicrobial chemotherapy for legionnaires' disease: a review. Clin Infect Dis. 21 Suppl 3, S265-S276 (1995).
- Chiaraviglio, L., Kirby, J. E. High-Throughput Intracellular Antimicrobial Susceptibility Testing of Legionella pneumophila. Antimicrob Agents Chemother. 59 (12), 7517-7529 (2015).
- Pedro-Botet, L., Yu, V. L. Legionella: macrolides or quinolones?. Clin Microbiol Infect. 12 Suppl 3, 25-30 (2006).
- Coers, J., Vance, R. E., Fontana, M. F., Dietrich, W. F. Restriction of Legionella pneumophila growth in macrophages requires the concerted action of cytokine and Naip5/Ipaf signalling pathways. Cell Microbiol. 9 (10), 2344-2357 (2007).
- Chu, J., et al. Non-invasive intravital imaging of cellular differentiation with a bright red-excitable fluorescent protein. Nat Methods. 11 (5), 572-578 (2014).
- Eliopoulos, G. M., Moellering, R. C., Lorian, V. Ch. 9. Antimicrobial combinations. In: Antibiotics in Laboratory Medicin. , 330-396 (1996).
- Jones, R. E., Zheng, W., McKew, J. C., Chen, C. Z. An alternative direct compound dispensing method using the HP D300 digital dispenser. J Lab Autom. 18 (5), 367-374 (2013).
- Odds, F. C. Synergy, antagonism, and what the chequerboard puts between them. J Antimicrob Chemother. 52 (1), (2003).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat Biotechnol. 22 (12), 1567-1572 (2004).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9 (10), 1005-1012 (2012).
- Berger, K. H., Merriam, J. J., Isberg, R. R. Altered intracellular targeting properties associated with mutations in the Legionella pneumophila dotA gene. Mol Microbiol. 14 (4), 809-822 (1994).
- Berger, K. H., Isberg, R. R. Two distinct defects in intracellular growth complemented by a single genetic locus in Legionella pneumophila. Mol Microbiol. 7 (1), 7-19 (1993).
- Vogel, J. P., Isberg, R. R. Cell biology of Legionella pneumophila. Curr Opin Microbiol. 2 (1), 30-34 (1999).
- Kirby, J. E., Isberg, R. R. Legionnaires' disease: the pore macrophage and the legion of terror within. Trends Microbiol. 6 (7), 256-258 (1998).
- Kirby, J. E., Vogel, J. P., Andrews, H. L., Isberg, R. R. Evidence for pore-forming ability by Legionella pneumophila. Mol Microbiol. 27 (2), 323-336 (1998).
- Vogel, J. P., Andrews, H. L., Wong, S. K., Isberg, R. R. Conjugative transfer by the virulence system of Legionella pneumophila. Science. 279 (5352), 873-876 (1998).
- Song, H., Fares, M., Maguire, K. R., Sidén, A., Potácová, Z. Cytotoxic Effects of Tetracycline Analogues (Doxycycline, Minocycline and COL-3) in Acute Myeloid Leukemia HL-60 Cells. PLoS ONE. 9 (12), e114457 (2014).
- Isberg, R. R., Falkow, S. A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12. Nature. 317 (6034), 262-264 (1985).
- Niles, A. L., Moravec, R. A., Riss, T. L. Update on in vitro cytotoxicity assays for drug development. Expert Opin Drug Discov. 3 (6), 655-669 (2008).
- Niles, A. L., Moravec, R. A., Riss, T. L. In vitro viability and cytotoxicity testing and same-well multi-parametric combinations for high throughput screening. Curr Chem Genomics. 3, 33-41 (2009).
- Mayr, L. M., Bojanic, D. Novel trends in high-throughput screening. Curr Opin Pharmacol. 9 (5), 580-588 (2009).
- Dunlap, P., Thouand, G., Marks, R. Biochemistry and genetics of bacterial bioluminescence. Bioluminescence: Fundamentals and Applications in Biotechnology - Volume 1. 1, 37-64 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены