需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
脂肪酸鉴定
摘要
We propose a protocol to identify fatty acids without the need to purify them. It combines information on the retention times with the mass spectra of three types of fatty acid derivatives: fatty acid methyl esters (FAMEs), 4,4-dimethyl oxazoline derivatives (DMOX), and 3-pyridylcarbinyl esters (picolinyl).
摘要
的芽孢杆菌种含有支链和不饱和脂肪酸(FAS)的甲基支链的多样的位置(异或反异)和双键。在FA组成的变化发挥细菌的适应了至关重要的作用,以他们的环境。这些修改意味着在异相对于反异支链的FA的比例的变化,并在的FA相对不饱和与饱和的FA,以在特定位置产生双键的比例。在FA轮廓的精确识别是必要了解芽孢杆菌物种的适应机制。
许多从芽孢杆菌的FA都没有可商购的。这里提出的策略识别的FA通过与三种类型的FA衍生物的质谱相结合上的保留时间(由等效链长(ECL)的计算)信息:脂肪酸甲酯(脂肪酸甲酯),4,4-二甲基恶唑啉衍生物(DMOX),和3 pyridylcarbinyl酯(皮考)。该方法可以识别的FA,而不需要净化未知的FA。
比较从蜡样芽胞杆菌制备的标准商业混合物FAME色谱型材允许直链的识别饱和的FA时,ECL的计算,并假设在其他的FA的身份。的脂肪酸甲酯支链饱和的FA,异或反异,显示在ECL恒定负移位相比,具有相同数目的碳的直链饱和的FA。不饱和的FA的脂肪酸甲酯可以通过它们的分子离子的质量进行检测,并导致在ECL正移位相比相应的饱和的FA。
的FA的和分支位置的不饱和的FA的双键位置可以通过甲代吡啶并DMOX衍生物的电子电离质谱分别进行识别,。这种方法确定所有未知的饱和支ED FAS,不饱和直链FAS和从蜡样芽孢杆菌提取物的不饱和支的FA。
引言
脂肪酸甲基酯(FAME)气相色谱(GC)为脂质表征的基本方法。它迅速分离和短提取步骤后量化的样品的各种脂肪酸(FAS)。酸甲酯衍生物是极不稳定的,稳定的和惰性朝色谱柱,从而避免拖尾峰。他们的身份是相当简单的,当样本包括知名的FA,因为色谱配置文件登载或比较的标准。此外,校准标准关于各种的FA的量化的重复注射是不需要的,因为它们对火焰离子化检测器(FID)1几乎恒定的响应。
除了FID,质谱(MS)检测提供了一个互补组的信息,以确认脂肪酸甲酯。然而,当脂肪酸甲酯使用电子电离(EI)充电,由此产生的光谱并不总是允许日FA精细结构的E识别。例如,分支位置( 即,支甲基)很难预测,因为诊断离子是很难检测1和目标离子丰度的特性的改变是依赖于机器的,防止使用质谱库2。另一个挑战在于确定双键的位置,因为EI使双键迁移。因此,具有不同双键位置的FA的异构体不能由它们的质谱鉴别。幸运的是,其他的工具已经开发了FA鉴定。例如,存在和支化或中的FA双键的位置可以通过计算等效链长(ECL)3进行推测。
其它衍生方法导致不同的质谱,依赖于一个双键或支链甲基的位置。 4,4-二甲基唑啉衍生物(DMOX)4允许EASŸ识别单不饱和脂肪酸双键的位置。 3- pyridylcarbinyl酯(甲代吡啶酯)衍生物允许甲基的位置的明确识别支链的FA 5。结合色谱保留(ECL)和质谱(DMOX和甲代吡啶)的信息允许对大部分的FA的鉴定,而不需要使用纯化的复杂的方法,因为需要用于核磁共振(NMR)谱,进行结构表征1无可争辩方法。
芽孢杆菌属,包括一些人类和动物病原体的细菌,都能够定殖高度多样化龛,因此被广泛分布于环境6。间的芽孢杆菌属,FA组成是由物种的生态位的影响,在FA模式调制,以适应范围广泛的环境变化( 例如 ,生长培养基,温度,pH 等 )7-9。因为在标准化条件生长期间通过芽孢杆菌属物种的FA图案的相对同质性,FA组成的测定是用来定义芽孢杆菌物种的主要标准之一。 芽孢杆菌属的一个独特属性是含有12-17个碳10-12用异和反异异构体是适应的对环境条件的关键决定因素之间的比支链的FA的丰度。 杆菌物种还通过改变不饱和脂肪酸的比例适应环境的波动。在一些物种中,如蜡状芽孢杆菌,二脂肪酸去饱和酶中创建与适应9不同的角色烷基链13的不同位置上的双键。 芽孢杆菌属的实施例说明的精确识别所述双键位置和FA分支的重要性。搜集ively, 芽孢杆菌 FA模式的识别有几个有用的应用程序。这里,我们提出了一种克服经典GC-MS分析的固有局限性芽孢 FA图案识别的新颖GC-MS的方法。
这种创新的方法,可以直接使用原料的生物材料,和由现有技术的组合的:保留时间(ECL)和不同的FA衍生物(FAME,DMOX和甲代吡啶酯)的质谱信息。
我们用下面的FA命名。 I,A和n表示异,反异甲基支链的,直链脂肪酸,分别。不饱和的FA由名为C:d,其中C是在脂肪酸的碳原子数以及d的数目的双键的数量。 Δx表示双键,其中双键位于第x个碳-碳键,从该羧酸端计数的位置。
研究方案
1.细菌培养
- 通过扩频将100μl的LB(Luria液体-Bertani培养基)在30℃培养菌株的过夜培养物,LB琼脂培养基的板的表面上制备的细菌( 蜡状芽孢杆菌菌株ATCC 14579)的草坪。过夜孵育所述板在30℃。
2. ECL:等效链长
- 计算ECL如下:
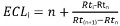 搭配:
搭配:
我,感兴趣的溶质;
n中,直链饱和脂肪酸甲酯溶质之前洗脱的碳原子数我;
的n + 1中,直链饱和脂肪酸甲酯的溶质后洗脱的碳原子数我;
RTI,RTN,RT(N + 1)上述的FAME峰的保留时间。
注意:通过标准的混合物的注射获得直链饱和脂肪酸的甲酯的保留时间(BAME)。
3. FAME制备及分析
- 为了通过从琼脂平板刮落,以获得脂质的脂肪酸,收获细菌细胞和细菌的40毫克(鲜重,相当于10 9活细胞)转移到10ml玻璃管螺丝帽和PTFE密封。
- 通过下文详述的酯键的方法14,15进行酯交换反应。
- 在甲醇加入5毫升的0.2M的KOH的新鲜细菌细胞,并在37℃下孵育1小时。这个反应由碱性甲醇分解的,打破在脂的酯链接并产生脂肪酸甲酯。
- 加入1毫升1M乙酸将pH值降低至7.0。检查其pH值试纸。
- 加入3毫升己烷提取脂肪酸甲酯。
- 在室温下转移上清液(有机相)转化为清洁管和浓缩通过蒸发在氮气下的连续流,以获得约200微升的提取物。将样品转移到与插入一个GC小瓶。
- 注入提取成气相色谱 - 质谱(GC-MS)系统。
4. GC / MS条件
- 注入FAME样品到装有毛细管柱ZB-WAX(长度30米;直径0.25毫米;膜厚为0.25μm)的GC-MS仪器。
- 设置注入口(在无分流模式)温度至250℃。使用氦作为载气,用37厘米/秒的线速度。保持在50℃的烘箱温度下进行1分钟,增加至190℃以20℃/分钟的速度,并以2℃/分钟的速率进一步提高到230℃的最终温度。
- 为MS,在70伏特记录由电子电离(EI)的质谱,并设置50和400原子质量单位(AMU)(2次扫描/秒)之间的采集的总离子电流。
- 当需要时,注射在相同的条件下excep DMOX和甲代吡啶基衍生物t是温度程序烘箱如下:
DMOX:50℃(1分钟),20℃/分钟直到210℃和2℃/分钟直到240℃(5分钟);
甲代吡啶:6℃(1分钟),20℃/分钟直到220℃和2℃/分钟直到250℃(20分钟)。
5.代吡啶酯准备从16 FAME
- 蒸发从第3节的FAME提取与氮气流(至少10mg干基料)和在1毫升无水二氯甲烷溶解。
- 制备钾叔叔丁醇在四氢呋喃中的1.0M溶液。
- 添加FAME提取和0.2毫升3吡啶甲醇0.1毫升溶液在步骤5.2制成。
- 加热在40℃下在密闭的小瓶中的溶液30分钟。
- 在冷却至室温后,加入精制去离子水(2毫升,见材料表 )和己烷(4ml)中。用涡旋混合,让相分离,并收集有机相。
- 博士ý它加入无水硫酸钠,直至有机相是完全清楚的。它转移到一个干净的试管中。然后蒸发至200微升。将样品转移到与插入一个GC小瓶。
6. DMOX准备从17 FAME
- 蒸发从第3节的FAME提取用氮气(至少10mg干基料)的流动。
- 向FAME干提取物,加入250毫克的2-氨基-2-甲基-1-丙醇。用氮气冲洗容器,添加一个塞子,并将其放置在一个加热块过夜,在190℃。
- 在冷却至室温后,加入3毫升二氯甲烷的管,和5ml纯化的去离子水(见材料表 )。
- 摇相分离,然后取出水相。
- 洗涤有机相用5毫升水。摇相分离,然后取出水相。
- 加入无水硫酸钠,直至有机相干燥是完全清楚,将其转移到一个干净的试管中。在氮气流中蒸发,直至达到200微升的体积。将样品转移到与插入一个GC小瓶。
结果
从细菌细胞FA识别该战略提出了如图1所示 。每一步都提供了互补的光谱信息或有关色谱保留的信息。步骤1包括使用标准溶液初步FA鉴定。第2步允许FAME EI谱和ECL的解释,以初步确定的产品。步骤3识别支链-FAS的确切分布位置。最后,第4步确定的不饱和的FA双键的精确位置。
FAME和ECL
讨论
在表1所示的的FA色谱轮廓对应蜡状芽孢杆菌 ATCC 14579生长在琼脂平板的表面。当细菌在充气液体介质在相同温度下8生长得到类似的轮廓。在液体培养基中生长的细菌的情况下,细菌的生物量是通过生长培养基的离心收集,并可以根据取决于生长条件8,19先前描述协议来洗涤。由蜡状芽孢杆菌产生的各种的FA的识别允许在的FA的比例细变化突变对低温7,9-
披露声明
The authors declare that they have no competing financial interests.
致谢
作者感谢MISON托马斯对他的技术支持,并藉由完整雷切尔修订的手稿。
材料
| Name | Company | Catalog Number | Comments |
| GC/MS | Shimadzu | QP2010 | |
| capillary column ZB WAX | Phenomenex | 7HG-G007-11 | 30 m x 0.25 mm x 0.25 µm |
| Methanol Lichrosolv | VWR | 1.06018.2500 | |
| potassium hydroxide | Aldrich | P1767 | |
| THF | Hipersolv Chromanorm | 28559.320 | |
| Dichloromethane | Hipersolv Chromanorm | 23373.320 | |
| Hexane | Hipersolv Chromanorm | 24575.320 | |
| 3-pyridinemethanol | Aldrich | P6-680-7 | |
| potassium tertiobutoxide | Aldrich | 156671 | |
| 2-amino-2-methyl-1-propanol | A-9879 | ||
| MilliQ Academic | Millipore | ZMQS50001 | |
| Bacterial Acid Methyl Ester (BAME) Mix | Sigma-Aldrich | 47080-U Supelco |
参考文献
- Christie, W. W., Han, X. . Lipid Analysis 4th Edition. , (2010).
- HÜbschmann, H. -. J. . Handbook of GC-MS: fundamental and application. Third edition. , (2015).
- Sasser, M. Identification of Bacteria by Gas Chromatography of Cellular Fatty Acids. MIDI Technical note. 101, 1-6 (1990).
- Spitzer, V. Structure analysis of fatty acids by gas chromatography - Low resolution electron impact mass spectrometry of their 4,4-dimethyloxazoline derivatives - A review. Prog Lipid Res. 35 (4), 387-408 (1996).
- Harvey, D. J., Christie, W. W. . Advances in lipid methodology. Volume 1. , 19-80 (1992).
- Diomande, S. E., Nguyen-The, C., Guinebretière, M. -. H., Broussolle, V., Brillard, J. Role of fatty acids in Bacillus environmental adaptation. Front Microbiol. 6, (2015).
- Brillard, J., et al. Identification of Bacillus cereus Genes Specifically Expressed during Growth at Low Temperatures. Appl Environ Microbiol. 76 (8), 2562-2573 (2010).
- de Sarrau, B., et al. Influence of Anaerobiosis and Low Temperature on Bacillus cereus Growth, Metabolism, and Membrane Properties. Appl Environ Microbiol. 78 (6), 1715-1723 (2012).
- Diomandé, S. E., et al. Involvement of the CasK/R two-component system in optimal unsaturation of the Bacillus cereus fatty acids during low-temperature growth. Int J Food Microbiol. 213, 110-117 (2015).
- Berkeley, R. C. W., Heyndrickx, M., Logan, N., De Vos, P., Berkeley, R. C. W. . Applications and Systematics of Bacillus and Relatives. , 1-7 (2002).
- Kämpfer, P. Limits and Possibilities of Total Fatty Acid Analysis for Classification and Identification of Bacillus Species. System. Appl. Microbiol. 17 (1), 86-98 (1994).
- Kaneda, T. Fatty-acids of genus bacillus - example of branched-chain preference. Bacteriol Rev. 41 (2), 391-418 (1977).
- Chazarreta Cifre, L., Alemany, M., de Mendoza, D., Altabe, S. Exploring the Biosynthesis of Unsaturated Fatty Acids in Bacillus cereus ATCC 14579 and Functional Characterization of Novel Acyl-Lipid Desaturases. Appl Environ Microbiol. 79 (20), 6271-6279 (2013).
- Sasser, M., et al. Identification of Bacillus anthracis from culture using gas chromatographic analysis of fatty acid methyl esters. J AOAC Int. 88 (1), 178-181 (2005).
- Schutter, M. E., Dick, R. P. Comparison of fatty acid methyl ester (FAME) methods for characterizing microbial communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Destaillats, F., Angers, P. One-step methodology for the synthesis of FA picolinyl esters from intact lipids. J Am Oil Chem Soc. 79 (3), 253-256 (2002).
- Fay, L., Richli, U. Location of double-bonds in polyunsaturated fatty-acids by gas-chromatography mass-spectrometry after 4,4-dimethyloxazoline derivatization. J Chromatogr. 541 (1-2), 89-98 (1991).
- Zhang, J. Y., Yu, Q. T., Liu, B. N., Huang, Z. H. Chemical modification in mass spectrometry IV-2-alkenyl-4,4-dimethyloxazolines as derivatives for the double bond location of long-chain olefinic acids. Biol Mass Spect. 15 (1), 33-44 (1988).
- de Sarrau, B., et al. Unsaturated fatty acids from food and in the growth medium improve growth of Bacillus cereus under cold and anaerobic conditions. Food Microbiol. 36 (2), 113-122 (2013).
- Miwa, T. K., Mikolajczak, K. L., Earle, F. R., Wolff, I. A. Gas chromatographic characterization of fatty acids.Identification constants for mono- and dicarboxylic methyl esters. Anal Chem. 32 (13), 1739-1742 (1960).
- van Den Dool, H., Kratz, P. A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography. J Chromatogr A. 11, 463-471 (1963).
- Stransky, K., Jursik, T., Vitek, A. Standard equivalent chain length values of monoenic and polyenic (methylene interrupted) fatty acids. J High Res Chromatogr. 20 (3), 143-158 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。