需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
斑马鱼发展长期成像的多功能安装方法
摘要
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
摘要
斑马鱼胚胎提供了一个理想的实验系统来研究复杂的形态发生过程,由于其方便可及性和光学透明性。特别是,后体伸长是在胚胎发育,使多个组织变形一起作用以引导体轴的一个大的部分形成一个基本过程。为了通过长期延时成像观察这一过程,有必要利用一个安装技术,允许足够的支撑,以传递到显微镜和采集过程中保持在正确的方向的样品。此外,安装也必须提供为后体区的生长移动的足够的自由度,而不影响它的正常发育。最后,必须有一定程度的安装方法,允许在不同的影像调校成像的多功能性。在这里,我们提出了一个安装技术成像后身体elongatio发展N的斑马鱼斑马鱼D.。该技术包括安装胚胎,使得头部和卵黄囊区域几乎完全包含在琼脂糖,而留下了后体区伸长和正常发育。我们将展示如何能够适应直立,倒立和垂直光表镜调校。虽然该协议的重点是安装胚胎的体内后成像,它可以很容易地适应的斑马鱼发育的多个方面的实时成像。
引言
后体伸长是在胚胎发育的基本过程,其中胚胎延伸以形成体轴的很大一部分。它是一个复杂的形态发生过程,其中多细胞行为起作用协调以产生个体组织的水平的形态的一个例子。这些差分组织变形然后一起作用在整个结构水平,以产生后验体的延伸率。要了解这些过程是如何被控制和开发过程中的协调,我们一定能够按照这些流程在多尺度( 即在分子,细胞,细胞群体和组织的水平),并直接将之与整个结构的形态。
斑马鱼的胚胎是理想的成像后的身体伸长其光学透明性和小尺寸允许微创光成像的应用方法很适合于LIVË成像。 1这已通过一系列最近的出版物中,在分子的水平已经阐明后身体发展光证明,2个单细胞,3和组织间的行为,4以及在细胞群体和整个器官的水平。 五
先进的成像技术如共焦,多光子显微术和选择性平面照明显微镜(SPIM)正在使发育过程的长期成像降低光毒性和光致漂白的效果。活样品的安装鲁棒技术,以实现三个目标是必需的:1)足够的支持,以转移到显微镜和采集期间过程中保持在正确的方向的样品,2)样品的运动的足够的自由度以允许的生长在不影响其正常DEVEL后部本体区域opment,最后3)在一定程度上的安装方法的通用性,允许在不同的影像调校影像。
此协议引入了成像斑马鱼D.鱼发展的安装技术。该技术包括安装胚胎,使得头部和卵黄囊区域几乎完全包含在琼脂糖,而留下的后体区伸长和正常发育。因此,它也是对显影体的其他区域的长期成像作为琼脂糖使得能够通过标准的光成像技术成像的适当的方法。这个协议演示安装在横向取向的胚胎的,虽然它也可以安装在变质取向胚胎。它将进一步展示如何适应直立,倒立和垂直光表镜的设置方法。
研究方案
1.溶液的制备和拉玻璃针
- 在4毫克/毫升使三卡因(3-氨基苯甲酸乙酯,也称为3-氨基苯甲酸乙酯)的25倍原液在20mM Tris pH值8.8和使该溶液的pH为7.在分装用4mL的和存储-20℃。
注:麻醉三卡因优先作用于神经电压门控钠通道从而阻断肌肉抽搐和运动6。 - 使在0.17毫克/毫升在E3的胚胎培养基的最终浓度三卡因的工作溶液。 7
注:使三卡因即兴工作溶液作为该溶液的pH值漂移。 - 通过加热,在微波的溶液溶解该低熔点琼脂糖到的在一个50毫升管的E3胚胎培养基1.5%的最终浓度。让这个解决方案平衡至42 - 45°C在任何一个水浴或台式孵化器。如果准备大型立式菜光片成像(步骤4),使一个附加的25毫升1%的标准熔融琼脂糖在E3的胚胎培养基。
- 用硼硅玻璃长丝毛细管的外径1.20毫米,ID0.69毫米,长10 mm尺寸。
- 如果毛细血管被拉在设备和试剂 ,使用以下设置的表说明的加热丝针拉马类型:热火600,120拉,速度50,时间225,压力500。一对尖锐的钳,断线针刚刚过去的点,它弯曲创造一个干净和锋利的针定向胚胎和去除多余的琼脂糖。的微型手术刀也可使用以除去过量的琼脂糖。
2.嵌入胚胎的倒立或直立显微镜
- 提高胚胎高达E3胚胎中期的适当阶段。 7
- 在所需的阶段,dechorionate胚胎一双锋利的钳的双眼dissec下方婷显微镜。
- 孵育dechorionated胚胎在三卡因工作溶液至少5分钟。
- 一旦熔化的琼脂糖溶液冷却到45℃,使用玻璃巴斯德吸管向dechorionated胚胎直接与E3介质的最小转移转移到50ml管中。
- 用约1ml安装介质一起取出胚胎,并添加约。 100微升的胚胎与10毫米微孔35毫米的玻璃底培养皿的中心圆一起安装培养基。
- 作为安装介质是设置,将胚胎琼脂糖的朝外( 图1A)的尾部的圆的边缘。使用毛细管针以保持胚胎在所需的横向取向直至凝胶被完全地设置。图像后身体发育,应注意在定向作为横向的方向尽可能胚胎。因此,在保持通过仔细调适这个位置的胚胎TS与毛细管针。
注意:多个胚胎可以在此时加入到安装盘,如果需要的话。如果是这种情况,传送琼脂糖低熔入盘的第一和胚胎添加到琼脂糖滴的中心。然后,推胚胎出到玻璃环的边缘,并且定向到所需的位置。多达六个胚胎可以安装这种方式之前琼脂糖变得固化。
3.去除多余琼脂糖围绕车身后部
注意:这部分描述由琼脂糖从围绕后部身体区域去除的步骤。在后体伸长的情况下,重要的是要确保尾可以生长出正常。通过除去琼脂糖之后的胚胎已通过琼脂糖被完全包含,胚胎为左括由头部区和大约一半的卵黄囊。
- 一旦琼脂糖下降已成立,淹没培养皿迪与三卡因工作液sh的。
- 下用透射光碱解剖双目显微镜,调整反射镜位置与入射光的角度,使得强烈的对比允许在琼脂糖削减要通过操作清楚地看到。
- 执行切割1( 图1),使用毛细管针或微型手术刀切割沿蛋黄琼脂糖中途,从一个位置只是后侧到成形心脏字段的体节5( 第 5的位置前体节)。
- 开始如图所示相邻的成形心脏初始切割,并通过琼脂糖到玻璃的充分的方法。
- 保持毛细管或微型手术刀琼脂糖深处,慢慢地看到上下,而开始进行切长在胚胎, 如图1所示。切尽量靠近胚胎尽可能无穿刺胚胎或蛋黄。
- 接着,使削减2和3( 图1 ),从对胚胎的位置,并用切去一路下跌到玻璃开始见底菜。使切割2,使得它相切的前5体节,允许充分dorsalward展开后的身体。使在90°角与蛋黄表面切割3并从HEARTFIELD开始。
注:切割琼脂糖直到玻璃圆的边缘( 如图1)助剂中除去琼脂糖作为一个完整的块(步骤3.6)。然而,这是没有必要的。 - 在切口1和3的交叉点开始,朝着切口2的端部缓慢对角线切割而慢慢以撞出周围后体琼脂糖的平方向上抬起。
注意:在某些情况下,这将在一个块中被释放,并在操作在一气呵成完成。在其他情况下,可能需要多次尝试DIS-小屋周围胚胎的所有琼脂糖。 - 有一对锋利的钳子,去除脱落b从胚胎中琼脂糖的锁。为了帮助在此过程中,将琼脂糖件移动到盘的一侧,并使用培养皿的壁作为支撑翻开出琼脂糖片。
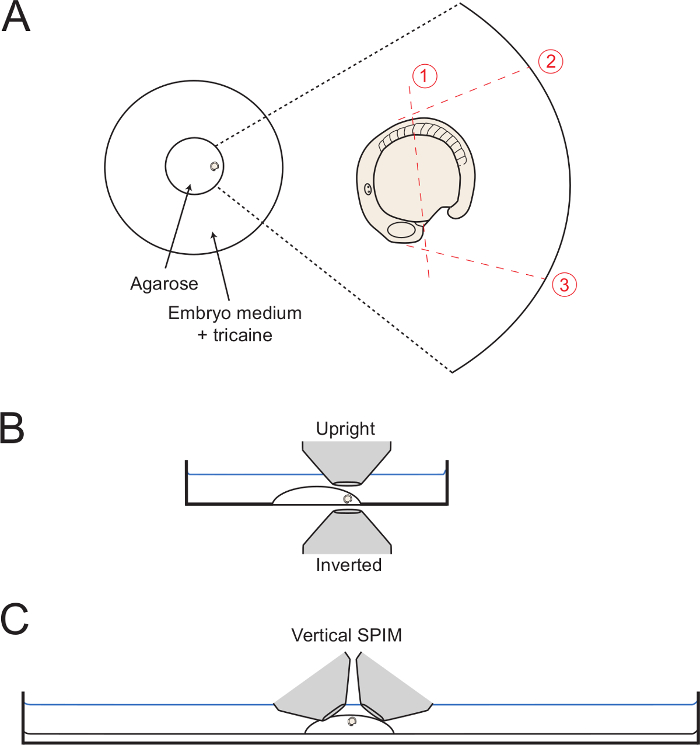
图1:安装调校的图。 (A)图显示了培养皿的中央玻璃环内的安装胚胎的位置。右边是通过周围琼脂糖与dottted红线所示每个连续砍胚胎的变焦。 ( 二 )安装的胚胎是在图解侧位片显示易于为倒置和直立目标的访问。 (C),显示胚胎如何安装垂直光片影像调校类似的双字母组合。 请CLICK这里查看该图的放大版本。
- 如果肌肉抽搐不完全阻塞在该点,从4毫克/毫升,pH为7原液添加三卡因滴。
4.胚胎安装立式灯表显微镜
注:这是上面列出的方法的变化可以让众多的目标,通过垂直导向SPIM访问样本成像。该变化背后的想法是解除样品比盘底部略高,以允许两个成像目标容易获得。
- 样品安装前,涂层100毫米的塑料陪替氏培养皿,在E3的培养基1%琼脂糖至5毫米的高度,并允许设置。
- 地点1 mL的低融点琼脂糖一滴的菜的中心,并允许设置。
- 在低熔点琼脂糖胚胎嵌入在部分二,然而,这一次,从50毫升管取出胚胎用溶液(0.5毫升)墨滴较小的琼脂糖并放置在1之上这一小滴的菜的中心毫升下降。
- 使用毛细管针放置胚胎的小滴的中心,并且直到凝胶被设置保持其正确的方位。
- 洪水与三卡因工作液的培养皿去除多余的琼脂糖在第3节,但没有通过1%的标准琼脂糖垫切割。
结果
上面概述的协议细节斑马鱼胚胎的安装长期时间推移成像一个通用的技术。这样的一个例子示于图2A和在动画/视频图1。胚胎在mRNA的编码photoconvertible荧光蛋白kikumeGR 1细胞阶段注入。在15体节阶段如上所述并成像为12小时与10倍的物镜的倒置共聚焦显微镜它们封片。所得共焦堆栈被最大限度突出显示为所示。这个电影清楚地表明,后体被允许在整个?...
讨论
这种安装技术使得胚胎转移到显微镜和目的是在多尺度下后身体伸长了长期的时间推移成像实验过程中仍然保持。此外,它是通用的,因为它允许在两个直立和倒置显微镜调校成像和一个建议是为如何可以进一步适于垂直取向SPIM制成。
在本协议中的一个关键步骤是仔细去除周围后身体即允许这种结构的正常发展的重要多余的琼脂糖。除去周围的蛋黄的顶部琼脂糖特别是当在?...
披露声明
The authors have nothing to disclose.
致谢
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
材料
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
参考文献
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。