Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine vielseitige Montagemethode für Langzeit Imaging von Zebrabärblingentwicklung
In diesem Artikel
Zusammenfassung
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Zusammenfassung
Zebrabärbling-Embryonen bieten eine ideale experimentelle System komplexe morphogenetischen Prozesse zu untersuchen aufgrund ihrer leichten Zugänglichkeit und optische Transparenz. Insbesondere ist hintere Körperdehnung ein wesentlicher Prozess in der embryonalen Entwicklung, durch die Verformungen mehrere Gewebe zusammen, um die Bildung eines großen Teils der Körperachse zu lenken handeln. Um diesen Prozess durch langfristige Zeitraffer-Bildgebung zu beobachten, ist es notwendig, eine Montagetechnik zu verwenden, die ausreichende Unterstützung ermöglicht es, Proben in der richtigen Ausrichtung während der Übertragung an das Mikroskop und den Erwerb zu halten. Darüber hinaus muss die Montage bieten auch ausreichende Bewegungsfreiheit für das Auswachsen des hinteren Körperbereich ohne seine normale Entwicklung zu beeinflussen. Schließlich muss ein gewisses Maß an Vielseitigkeit des Montage Methode, um Bildgebung auf verschiedenen Abbildungsaufbauten ermöglichen. Hier präsentieren wir eine Montagetechnik für die Abbildung der Entwicklung des hinteren Körpers Elongation in der Zebrabärbling D. rerio. Diese Technik beinhaltet Embryonen, so dass der Kopf und Dottersack Regionen sind fast vollständig in Agarose enthalten, während das Weglassen der hinteren Körperbereich zu verlängern und zu entwickeln, die normalerweise Montage. Wir werden zeigen , wie sich dies für aufrecht, umgekehrt und vertikale Lichtbogen - Mikroskopie - Set-ups angepasst werden. Während dieses Protokoll Embryonen für die Bildgebung bei der Montage für den hinteren Körper konzentriert, könnte es leicht für die Live-Bildgebung von mehreren Aspekten der Zebrabärblingentwicklung angepasst werden.
Einleitung
Posterioren Körper Dehnung ist ein wesentlicher Prozess bei der Embryonalentwicklung, durch die der Embryo ein großer Teil der Körperachse zu bilden, erstreckt. Es ist ein Beispiel eines komplexen morphogenetic Prozess, bei dem mehrere Zellverhalten koordinativ die Morphogenese auf der Ebene der einzelnen Gewebe zu erzeugen, wirken. Diese unterschiedlichen Gewebedeformationen dann zusammen wirken, um die Dehnung des hinteren Körpers an der gesamten Strukturebene zu erzeugen. Um zu verstehen , wie diese Prozesse werden gesteuert , und während der Entwicklung koordiniert, müssen wir in der Lage sein , diese Verfahren bei mehreren Skalen zu folgen (dh auf der Ebene von Molekülen, Zellen, Zellpopulationen und Gewebe) , und dieses an die Morphogenese der gesamten Struktur direkt zu beziehen .
Zebrabärbling-Embryonen sind für die Bildgebung hintere Körperdehnung ideal als ihre optische Transparenz und die geringe Größe ermöglicht die Anwendung der minimal-invasiven Bildgebung Licht nähert sich gut für Live-Bildgebung. 1 Dieses wurde durch eine Reihe neuerer Publikationen belegt worden , die Licht auf hintere Körperentwicklung auf der Ebene von Molekülen vergossen haben, 2 Einzelzellen, 3 und inter Gewebe Verhaltensweisen, 4 sowie auf der Ebene der Zellpopulation und ganze Organ. 5
Advanced Imaging-Techniken wie konfokale Multiphotonenmikroskopie und selektive Ebene Beleuchtung Mikroskopie (SPIM) ermöglichen die langfristige Darstellung von Entwicklungsprozessen mit einer verminderten Wirkung von Licht Toxizität und Photobleaching. Robusten Techniken für die Montage von lebenden Proben benötigt werden drei Ziele zu erreichen: 1) eine ausreichende Unterstützung für das Mikroskop während der Übertragung Proben in der richtigen Ausrichtung zu halten und während der Aufnahme, 2) eine ausreichende Bewegungsfreiheit der Probe für das Auswachsen zu ermöglichen von der hintere Körperbereich ohne seine normale Entwick beeinflussenwicklung und schließlich 3) ein gewisses Maß an Vielseitigkeit des Montageverfahrens Bildgebung auf verschiedenen Imaging-Setups zu ermöglichen.
Dieses Protokoll stellt eine Montagetechnik zum Abbilden der Entwicklung der Zebrabärbling D. rerio. Diese Technik beinhaltet Embryonen so dass der Kopf und yolk sac Regionen fast vollständig in Agarose enthalten, während Verlassen der posterior Körperbereich zu verlängern und zu entwickeln, die normalerweise Montage. Als solches ist es auch ein geeignetes Verfahren für die Langzeit-Bildgebung von anderen Regionen des Entwicklungs Körper als die Agarose Bildgebung durch Standardlichtabbildungstechniken ermöglicht. Dieses Protokoll veranschaulicht in einer seitlichen Ausrichtung von Embryonen Befestigungs, obwohl es auch möglich ist, Embryonen in alternativen Orientierungen zu montieren. Es wird weiter zeigen, wie das Verfahren zur aufrechten, umgedreht und vertikale Lichtbogen-Mikroskopie-Setups anzupassen.
Protokoll
1. Herstellung von Lösungen und Pulled Glasnadel
- Machen Sie eine 25x Stammlösung von Tricaine (3-Amino benzoesäureethylester, die auch als Ethyl-3-aminobenzoat) bei 4 mg / ml in 20 mM Tris pH 8,8 und bringen diese Lösung bei pH 7. Aliquot von 4 ml und an einem -20 ° C.
HINWEIS: Das Anästhetikum Tricaine wirkt bevorzugt auf neuronalen spannungsgesteuerten Natriumkanäle dadurch blockiert Muskelzuckungen und Bewegung 6. - Machen Sie eine Arbeitslösung von Tricaine bei einer Endkonzentration von 0,17 mg / ml in E3 Embryo Medium. 7
HINWEIS: Stellen Sie die Tricaine Arbeitslösung unvorbereitet wie der pH-Wert dieser Lösung driftet. - Man löst den niedrigschmelzender Agarose bis zu einer Endkonzentration von 1,5% in E3 embryo-Medium in einem 50 ml-Röhrchen, indem die Lösung in einer Mikrowelle erhitzt wird. entweder in einem Wasserbad oder Benchtop-Inkubator 45 ° C - Lassen Sie diese Lösung auf 42 ins Gleichgewicht. Wenn die Vorbereitung große Gerichte für vertikaleLichtbogen-Bildgebung (Schritt 4), zusätzlich 25 ml 1% Standard Schmelzen Agarose in E3 Embryo Medium.
- Verwenden Sie Borosilikatglas mit Filament Kapillaren mit Abmessungen von 1,20 mm OD, ID 0,69 mm, Länge 10 mm.
- Wenn Kapillaren von der Art der Heizung Faden Nadel Abzieher beschrieben in der Tabelle von Geräten und Reagenzien gezogen wird , verwenden Sie die folgenden Einstellungen: Wärme 600, Pull 120, Geschwindigkeit 50, Zeit 225, Druck 500. Mit einem Paar scharfe Zange, Pause die Nadel gerade hinter dem Punkt, an dem es biegt sich für orientierende Embryonen eine saubere und scharfe Nadel zu schaffen und überschüssige Agarose zu entfernen. Ein Mikroskalpell kann auch verwendet werden, um überschüssige Agarose zu entfernen.
2. Einbettung von Embryonen für Inverted oder Upright Mikroskopie
- Heben Sie die Embryonen in E3 Embryo Medium auf die entsprechende Bühne. 7
- Bei der erforderlichen Stufe dechorionate Embryonen mit einem Paar von scharfen Pinzette unter einem Binokular dissecting Mikroskop.
- Inkubieren Sie die dechorionated Embryonen für mindestens 5 min in der Tricaine Arbeitslösung.
- Sobald die geschmolzene Agarose-Lösung auf 45 ° C abgekühlt ist, verwenden, um eine Glaspasteurpipette den dechorionated Embryo direkt in das 50 ml-Röhrchen mit minimaler Übertragung von E3 Medium zu übertragen.
- Entfernen Embryo zusammen mit etwa 1 ml Medium Montage und fügen Sie ca.. 100 & mgr; l mit einem 10 mm Mikrotiterplatten-Medium zusammen mit dem Embryo mit dem zentralen Kreis einer 35 mm Glasboden-Petrischale Montage.
- Da die Montagemedium setzt, um den Embryo an den Rand des Kreises der Agarose mit dem Schwanz nach außen (Abbildung 1A) gegenüber zu bewegen. Verwenden Sie die Kapillarnadel den Embryo in der gewünschten seitlichen Ausrichtung zu halten, bis das Gel vollständig eingestellt. Um das Bild zu hinteren Körperentwicklung, achten Sie darauf, den Embryo in eine seitliche einer Orientierung wie möglich zu orientieren. Daher halten den Embryo in dieser Stellung durch vorsichtiges adjustments mit der Kapillare Nadel.
HINWEIS: Mehrere Embryonen kann an dieser Stelle auf die Montageschale gegeben werden, falls erforderlich. Wenn dies der Fall ist, übertragen, das niedrigschmelzende Agarose in die Schale erste und die Embryonen in der Mitte der Agarose Tropfen hinzu. Drücken Sie dann die Embryonen aus zu den Rändern des Glasring und orientieren in die gewünschte Position. Bis zu sechs Embryonen können auf diese Weise montiert werden, bevor die Agarose verfestigt wird.
3. Entfernen von überschüssiger Agarose Rund um den Hinterleib
Hinweis: Dieser Abschnitt beschreibt das Verfahren, mit dem Agarose aus dem Bereich entfernt wird, um den hinteren Körper umgibt. Im Falle von posterior Körperdehnung, ist es wichtig, dass der Schwanz normalerweise wachsen-out kann zu gewährleisten. Durch das Entfernen der Agarose nach der Embryo durch Agarose vollständig aufgenommen wurde, wird der Embryo durch den Kopfbereich und etwa die Hälfte der Dottersack eingeschlossen gelassen.
- Nachdem die Agarose Tropfen gesetzt hat, überfluten die Petri-dish mit der Tricaine Arbeitslösung.
- Unter einem Sezieren Binokular mit einer Durchlichtbasis, passen Sie die Spiegelposition und der Winkel des einfallenden Lichts, so dass der starke Kontrast für die Schnitte in der Agarose ermöglicht, durch den Betrieb deutlich zu sehen.
- Zur Durchführung geschnitten 1 (Abbildung 1), verwenden Sie die Kapillar - Nadel oder die Mikro-Skalpell die Agarose auf halbem Weg entlang der Dotter zu schneiden, aus einer Position posterior nur zur Formherzfeld in die Position des somite 5 (5. anterioren Somiten).
- Starten Sie den ersten Schnitt neben dem Inneres bilden, wie gezeigt, und die vollständige Weg durch die Agarose auf das Glas.
- Halten Sie die Kapillare oder Mikroskalpell tief in der Agarose und langsam sah nach oben und unten , während beginnen einen langen Schnitt über den Embryo zu machen , wie 1 gezeigt Abbildung. Schneiden Sie so nah an der Embryo wie möglich, ohne den Embryo oder Eigelb Punktierung.
- Als nächstes stellen Schnitte 2 und 3 (Abbildung 1 ) Aus der Position gegenüber dem Embryo beginnt und mit dem Schnitt bis auf das Glas ganzen Weg Bodenschale. Machen Sie 2 geschnitten, so dass sie tangential zu den ersten 5 Somiten ist, so dass eine uneingeschränkte dorsalwärts des hinteren Körpers entfaltet. Machen Sie 3 schneiden in einem Winkel von 90 ° mit dem Eigelb Oberfläche und ausgehend von der Heartfield.
HINWEIS: Das Schneiden des Agarose , bis der Rand des Glaskreis hilft bei der Entfernung der Agarose als kompletter Block (Schritt 3.6) (wie in Abbildung 1 gezeigt). Jedoch ist dies nicht notwendig. - Beginnend an der Kreuzung der Schnitte 1 und 3 machen einen langsamen Diagonalschnitt gegen Ende des Schnitts 2, während sich langsam nach oben, um das Anheben des quadratischen Agarose rund um den hinteren Körper zu entfernen.
Anmerkungen: In einigen Fällen wird dies in einem Block freigegeben werden und der Betrieb wird in einem Arbeitsgang abgeschlossen. In anderen Fällen kann es mehrere Versuche, dis-lodge alle Agarose rund um den Embryo nehmen. - Mit einem Paar scharfe Zange, entfernen Sie das verdrängt bSchlösser von Agarose aus dem Embryo Medium. in diesem Prozess zu unterstützen, die Agarose-Stücke auf die Seite der Schale bewegen und die Wand der Petrischale als Träger verwenden, während die Agarose-Stücke herausheben.
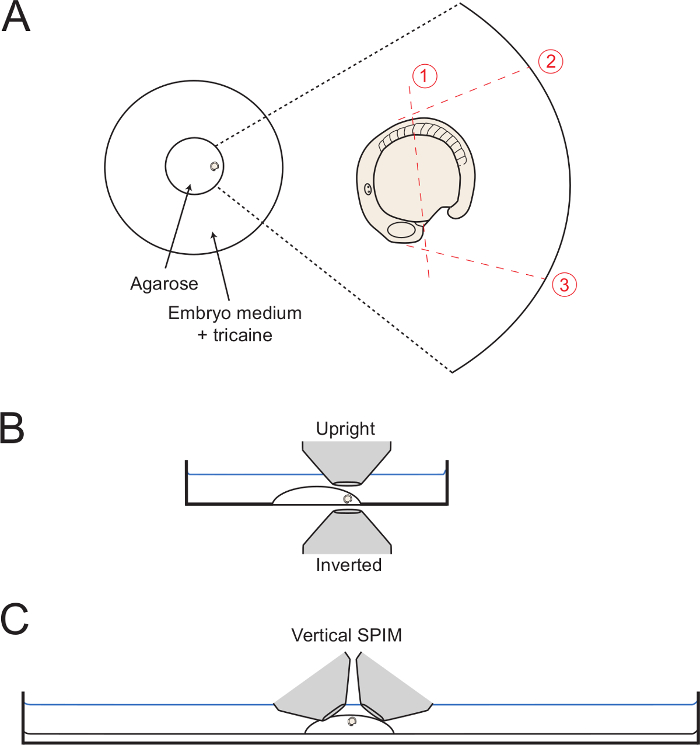
Abbildung 1: Diagramme von Montage - Set-ups. (A) Das Diagramm zeigt die Position des montierten Embryo innerhalb der Mitte Glasring einer Petrischale. Auf der rechten Seite ist ein lautes Summen des Embryos mit jedem aufeinanderfolgenden Schnitt durch die mit dottted roten Linien Agarose gezeigt umgibt. (B) Die montierten Embryonen ist in der Seitenansicht diagrammed Anzeige der Leichtigkeit des Zugangs für Kehr- und aufrecht Ziele. (C) Ein ähnliches digram zeigt , wie Embryonen können für vertikale Lichtbogen Abbildungsaufbauten montiert werden. Bitte click hier eine größere Version dieser Figur zu sehen.
- Wenn Muskelzucken nicht vollständig an diesem Punkt blockiert wird, fügen Tropfen Tricaine aus der Stammlösung von 4 mg / ml, pH 7.
4. Montage von Embryonen für vertikale Lichtbogen-Mikroskopie
Hinweis: Dies ist eine Variante der oben beschriebenen Methode, dass für den Zugriff mehrerer Ziele umrissenen ermöglicht Abbilden von Proben durch vertikal orientierte SPIM. Die Idee hinter dieser Variante wird die Probe geringfügig höher als der Boden der Schale zu heben, um einen einfachen Zugang von zwei Abbildungsziele zu ermöglichen.
- Vor Montage zu probieren, Mantel eine 100 mm Petrischale aus Kunststoff mit 1% Agarose in E3 Medium bis zu einer Höhe von 5 mm und stehen lassen.
- Geben Sie einen Tropfen von 1 ml mit niedrigem Schmelzpunkt Agarose in die Mitte des Tellers und stehen lassen.
- Einbetten von Embryonen in niedrigschmelzender Agarose, wie in Abschnitt 2. Dieses Mal jedoch, entfernen Sie den Embryo aus dem 50-ml-TubeAgarose mit einem kleineren Tropfen Lösung (0,5 ml) und legen diese kleinen Tropfen auf dem 1 ml in der Mitte der Schale fallen.
- Verwenden Sie die Kapillarnadel den Embryo in der Mitte des kleinen Tropfen zu platzieren und zu pflegen ihre korrekte Ausrichtung bis Gel festgelegt ist.
- Fluten die Schale mit Tricaine Arbeitslösung und entfernen Sie das überschüssige Agarose, wie in Abschnitt 3, jedoch ohne durch das Polster von 1% Standard-Agarose-Schneiden.
Ergebnisse
Das Protokoll oben skizzierte Details eine vielseitige Technik zur Montage von Genaktivität für die Langzeit Zeitraffer-Bildgebung. Ein Beispiel hierfür ist in 2A und in animierter / Video - 1 gezeigt. Die Embryonen wurden in der 1-Zell-Stadium injiziert mit mRNA, die das Photokonvertierbare fluoreszierendes Protein kikumeGR kodiert. Am 15 Somiten Stadium wurden sie wie oben beschrieben montiert und für 12 h auf einem invertierten konfokalen Mikrosko...
Diskussion
Diese Befestigungstechnik ermöglicht Embryonen noch während der Übertragung an das Mikroskop und über an folgenden hinteren Körperdehnung mehrere Längenskalen dem Ziel eines langfristigen Zeitraffer-Imaging Experimente gehalten werden. Darüber hinaus ist es vielseitig, dass sie für die Bildgebung auf beiden aufrechten und der inversen Mikroskopie Aufbauten erlaubt, und ein Vorschlag gemacht wird, wie dies weiter vertikal ausgerichtet SPIM angepasst werden.
Ein entscheidender Schritt ...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materialien
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Referenzen
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten