A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטת הרכבה צדדית עבור Long Term הדמיה של פיתוח דג זברה
In This Article
Summary
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Abstract
עוברי דג זברה להציע מערכת ניסיונית אידיאלית ללמוד תהליכים מורכבים המוךפו"גנטי שהולכים בשל קלויות נגישות ושקיפות אופטית שלהם. בפרט, התארכות גוף האחורי הוא תהליך חיוני בהתפתחות עוברית שבאמצעותו דפורמציות רקמות מרובות לפעול יחד כדי לכוון את ההיווצרות של חלק גדול של ציר הגוף. על מנת להתבונן בתהליך זה על ידי הדמיה לטווח ארוכת זמן לשגות יש צורך לנצל טכניקת הרכבה המאפשרת תמיכה מספקת כדי לשמור על דגימות בכיוון הנכון במהלך העברת המיקרוסקופ והרכישה. בנוסף, ההרכבה חייבת גם לספק חופש מספיק תנועה של התולדה של אזור הגוף האחורי מבלי להשפיע ההתפתחות התקינה שלו. לבסוף, חייב להיות מידה מסוימת ב צדדי של שיטת ההרכבה לאפשר הדמיה על סט-אפ הדמיה המגוון. כאן, אנו מציגים טכניקת הרכבת הדמיה בפיתוח elongatio גוף האחוריn של דג הזברה ד rerio. טכניקה זו כרוכה הרכבה עוברת כך אזורי צק הראש והחלמון כמעט כלולים כולו agarose, ומותיר מחוץ לו באזור הגוף האחורי להאריך ולהתפתח באופן תקין. אנו נראים כיצד זה יכול להיות מותאם עבור קופצים להגדיר מיקרוסקופ זקוף, הפוך ואנכי אור גיליון. בעוד פרוטוקול זה מתמקד הרכבה עוברת הדמיה של הגוף האחורי, זה יכול בקלות להיות מותאם עבור הדמית החיה של היבטים רבים של פיתוח דג זברה.
Introduction
התארכות גוף האחורית היא תהליך חיוני בהתפתחות עוברית שבאמצעותו העובר משתרע מהווה חלק גדול של ציר הגוף. זוהי דוגמא של תהליך מורכב המוךפו"גנטי שהולך שבאמצעותו התנהגויות תאים מרובות לפעול בצורה מתואמת כדי ליצור את morphogenesis ברמה של רקמות פרט. דפורמציות רקמות הפרש אלה ולאחר מכן לפעול יחד כדי ליצור את ההתארכות של הגוף האחורי ברמת המבנה כולו. כדי להבין כיצד תהליכים אלה נשלטים ומתואמים במהלך פיתוח, אנחנו חייבים להיות מסוגלים לעקוב אחר התהליכים האלה בקני מידה מרובות (כלומר ברמה של מולקולות, תאים, אוכלוסיות תאים ורקמות) ולהתייחס זה ישירות morphogenesis של המבנה כולו .
עוברי דג זברה הם אידיאליים עבור התארכות גוף אחורי הדמיה כמו השקיפות האופטית שלהם והגודל קטן מאפשרים ליישום הדמית אור פולשנית מתקרבים גם מתאים ליבהדמית דואר. 1 זה כבר שמעיד סדרת הפרסומים האחרונים כי שפכו אור על התפתחות גוף אחורית ברמה של מולקולות, 2 תאים בודדים, 3 והתנהגויות בין רקמות, 4 וכן ברמה של אוכלוסיית תא כולו איברים. 5
שיטות הדמיה מתקדמות כגון confocal, מיקרוסקופיה-פוטון רב מיקרוסקופיה תאורת מטוס סלקטיבית (SPIM) מאפשרות הדמיה לטווח הארוך של תהליכים התפתחותיים עם ירידת ההשפעה רעילה אור צילום לבן. טכניקות חזקות עבור ההרכבה של דגימות חיות נדרשות להשיג שלוש מטרות: 1) תמיכה מספקת כדי לשמור על דגימות בכיוון הנכון במהלך העברה המיקרוסקופ במהלך רכישה, 2) חופש מספיק תנועה של המדגם כדי לאפשר את התולדה של באזור הגוף האחורי מבלי להשפיע devel הרגילopment, ולבסוף 3) במידה מסוימת ב צדדי של שיטת ההרכבה לאפשר הדמיה על סט-אפ הדמיה המגוון.
פרוטוקול זה מציג טכניקת הרכבת הדמיה בפיתוח של דג הזברה ד rerio. טכניקה זו כרוכה הרכבה עוברים כך אזורים שק ראש וחלמון כמעט כלולים כולו agarose, תוך השארת באזור הגוף האחורי להאריך ולהתפתח באופן תקין. ככזה, הוא גם בשיטה מתאימה ההדמיה לטווח הארוך של אזורים אחרים בגוף מתפתח כמו agarose מאפשר הדמיה על ידי שיטות הדמית אור רגילות. פרוטוקול זה מדגים הרכבה של עוברים בכיוון לרוחב, אם כי אפשר גם לעלות עוברים אוריינטציות alterative. עוד יציגו כיצד להתאים את השיטה עבור זקוף, פנימה ובמאונך setups מיקרוסקופ אור גליון.
Protocol
1. הכנת פתרונות ומשך מחט זכוכית
- הכן פתרון מניות 25x של Tricaine (3-אמינו אתיל אסתר חומצה בנזואית, המכונה גם אתיל 3-aminobenzoate) בשעה 4 מ"ג / מ"ל ב 20 מ"מ טריס pH 8.8 ולהביא פתרון זה ב- pH 7. Aliquot ב -4 מ"ל ולאחסן ב -20 ° C.
הערה: Tricaine ההרדמה פועל באופן מועדף על תעלות נתרן מתח מגודרות עצביות ובכך חוסם שרירי עוויתות ותנועה 6. - הכן פתרון עבודה של Tricaine בריכוז סופי של 0.17 מ"ג / מ"ל במדיום העובר E3. 7
הערה: הפוך את Tricaine פתרון עובדת מראש כמו ה- pH של פתרון זה נסחף. - ממיסים את נקודת התכה נמוכה agarose לריכוז סופי של 1.5% בטווח הבינוני העובר E3 בתוך שפופרת 50 מ"ל על ידי חימום הפתרון במיקרוגל. תנו פתרון זה לאזן ל -42 - 45 ° C באחת באמבט מים או בחממה הספסל העליון. אם מכינים מנות גדולות עבור אנכיהדמית אור גיליון (שלב 4), לבצע 25 מיליליטר נוסף של 1% היתוך תקן agarose במדיום עובר E3.
- השתמש זכוכית בורוסיליקט עם נימים נימה עם ממדים של 1.20 מ"מ OD, מזהה 0.69 מ"מ, אורך 10 מ"מ.
- אם נימים נמשכים לסוג חולץ מחט חימום-נימה שמתואר בטבלה של ציוד ריאגנטים, השתמש את ההגדרות הבאות: חום 600, משיכת 120, מהירות 50, זמן 225, לחץ 500. עם זוג מלקחיים חדים, הפסקה המחט בעבר רק את הנקודה שבה זה מכופף ליצור מחט נקי וחד עבור orientating עוברים והסרת agarose עודף. אזמל מיקרו-כן, ניתן להשתמש כדי להסיר agarose עודף.
Embedding 2. עוברים על הפוך או מיקרוסקופי Upright
- הרם את העוברים עד השלב המתאים במדיום העובר E3. 7
- בשלב נדרש, עובר dechorionate עם זוג מלקחיים חדים מתחת dissec המשקףמיקרוסקופ טינג.
- דגירה עוברים dechorionated עבור 5 דקות לפחות הפתרון עובד Tricaine.
- לאחר פתרון agarose מומסת מתקרר ל -45 מעלות צלזיוס, השתמש פיפטה זכוכית פסטר להעביר את העובר dechorionated ישירות לתוך שפופרת 50 מ"ל עם העברת מינימלי של מדיום E3.
- הסר העובר יחד עם כ 1 מ"ל של הרכבה בינונית ומוסיפים כ. 100 μl של הרכבה בינונית יחד עם העובר למעגל המרכזי של צלחת פטרי 35 מ"מ עם תחתית זכוכית עם microwell 10 מ"מ.
- ככל הרכבה בינונית שוקעת, להזיז את העובר עד קצה המעגל של agarose עם הזנב כלפי חוץ (איור 1 א). השתמש מחט הנימים לשמור על העובר בכיוון לרוחב הרצוי עד ג'ל מוגדר לחלוטין. כדי פיתוח גוף התמונה האחורי, לטפל להתמצא העובר כמו לרוחב אוריינטציה ככל האפשר. לכן, לשמור על העובר בתפקיד זה על ידי adjustmen הזהירts עם המחט נימי.
הערה: ניתן להוסיף עוברים מרובים כדי בצלחת גוברת בשלב זה, אם נדרש. אם זה המקרה, להעביר את נמוכה להמיס agarose לתוך המנה הראשונה ולהוסיף את העוברים למרכז הירידה agarose. לאחר מכן, דחף את העוברים אל הקצוות של הטבעת הזכוכית להתמצא לתוך המיקום הרצוי. עד שישה עוברים יכול להיות מותקן בדרך זו לפני agarose הופך הקרושה.
הסרת 3. עודף Agarose סביב הגוף האחורי
הערה: סעיף זה מתאר את ההליך שבאמצעותו agarose יוסר האזור שמסביב הגוף האחורי. במקרה של התארכות הגוף האחורי, חשוב להבטיח כי הזנב יכול לגדול-אאוט כרגיל. על ידי הסרת agarose לאחר שהעובר נכללה לחלוטין על ידי agarose, העובר ונותר מוקפת באזור הראש כמחצית שק החלמון.
- לאחר ירידת agarose קבעה, להציף את di פטריsh עם הפתרון עובד Tricaine.
- תחת מיקרוסקופ המשקפת לנתח עם בסיס מועבר-אור, להתאים את המיקום במראה זווית אור האירוע כזה כי הניגוד החזק מאפשר קיצוץ agarose להיראות בבירור במהלך כל הניתוח.
- כדי לבצע לחתוך 1 (איור 1), השתמש מחט נימי או-אזמל מיקרו לחתוך את אמצע הדרך agarose לאורך חלמון, מתוך עמדה רק האחורי לשדה הלב להרכיב את עמדת somite 5 (5 th somite הקדמי).
- התחל את החתך הראשוני סמוך ללב להרכיב כמוצג, והדרך מלאה דרך agarose אל הזכוכית.
- שמור את נימי או מיקרו-אזמל עמוק בתוך agarose, וראיתי לאט ולמטה תוך מתחילים לעשות חתך ארוך על העובר כפי שמוצג באיור 1. גזור קרוב לעובר ככל האפשר ללא ניקוב העובר או חלמון.
- לאחר מכן, לבצע חתכים 2 ו -3 (איור 1 ), החל מעמדת נגד העובר ועם לחתוך הולך כל הדרך למטה אל הכוס תחתית צלחת. הפוך לחתוך 2 כך שהוא משיק 5 somites הראשון, המאפשר dorsalward מלא התגלגלות של הגוף האחורי. הפוך לחתוך 3 בזווית של 90 מעלות עם משטח החלמון החל HEARTFIELD.
הערה: חיתוך agarose עד קצה עיגול זכוכית (כפי שמוצג באיור 1) עזרי בהסרת agarose כבלוק שלם (שלב 3.6). עם זאת, זה לא הכרחי. - החל בצומת של חתכים 1 ו -3, לעשות חתך אלכסוני איטי לקראת סוף לחתוך 2 תוך הרמת לאט כלפי מעלה על מנת לשחרר את הכיכר של agarose המקיפים את הגוף האחורי.
הערות: במקרים מסוימים, זה ישוחרר בבלוק אחד בתום הניתוח בבת אחת. במקרים אחרים, זה עלול לקחת כמה ניסיונות דיס-Lodge כל agarose סביב העובר. - עם זוג מלקחיים חדים, להסיר את b וחלצהמנעולים של agarose מן המדיום העובר. כדי לסייע בתהליך זה, להעביר את חתיכות agarose אל דופן הכלי ולהשתמש קיר צלחת פטרי כתמיכה תוך הרמת את חתיכות agarose.
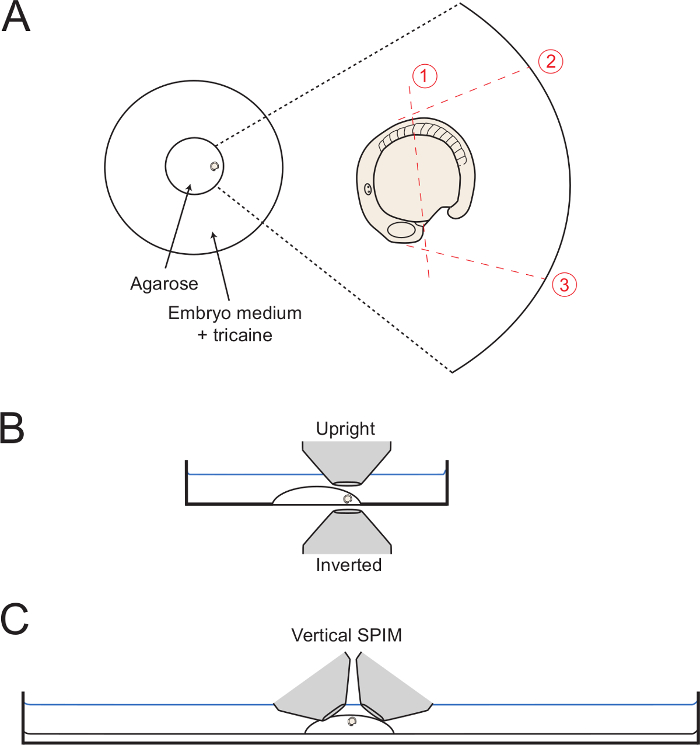
איור 1: תרשימים של גדר קופצת שמה. (א) התרשים מראה את המיקום של העובר רכוב בתוך טבעת זכוכית במרכז צלחת פטרי. מימין זום של העובר עם כל חתך רצוף דרך הסובבים לראות agarose עם קווים אדומים dottted. (ב) עוברי הרכוב diagrammed לאור לרוחב הצגת קלות הגישה לשתי מטרות הפוכות וזקופות. (ג) digram דומה מראה כיצד עובר יכול להיות מותקן עבור קופצים להגדיר הדמית גיליון אור אנכית. אנא CLאיכס כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- אם התכווצויות שרירים אינה חסומה לחלוטין בנקודה זו, להוסיף טיפות Tricaine מפתרון המניות של 4 מ"ג / מ"ל, pH 7.
4. הרכבה של עוברים אנכיים אור גיליון מיקרוסקופי
הערה: זוהי וריאציה על השיטה שתוארה לעיל המאפשרת הגישה של יעדים מרובים עבור הדמיה של דגימות ידי SPIM אנכית-חוקית. הרעיון מאחורי וריאציה זו הוא להרים המדגם גבוה במעט התחתונה של המנה, כדי לאפשר גישה קלה של שתי מטרות הדמיה.
- לפני לדגום הרכבה, מעיל צלחת פטרי פלסטיק 100 מ"מ עם agarose 1% בטווח הבינוני E3 עד לגובה של 5 מ"מ ולאפשר להגדיר.
- מניחים ירידה של 1 מ"ל agarose נקודת התכה נמוכה אל מרכז הצלחת ולאפשר להגדיר.
- עוברים שבץ agarose נקודת התכה נמוכה כמו בסעיף 2. עם זאת, הפעם, להסיר את העובר מהצינור 50 מ"לagarose של עם ירידה קטנה של פתרון (0.5 מ"ל) ומקום טיפה קטנה זו על גבי 1 מ"ל לרדת במרכז המנה.
- השתמש מחט הנימים למקם את העובר במרכז הטיפה הקטנה ולשמור הכיוון הנכון שלה עד מוגדר ג'ל.
- להציף את המנה עם פתרון Tricaine עבודה להסיר את agarose העודף כאמור בסעיף 3 אבל בלי לחתוך דרך הכרית של 1% agarose הסטנדרטי.
תוצאות
הפרוטוקול שתואר לעיל פרטי שיטה תכליתית עבור ההרכבה של עוברי דג זברה עבור הדמית הזמן לשגות לטווח ארוך. דוגמא לכך היא שמוצגת באיור 2 א ו בסרטון אנימציה / וידאו איור 1. עוברים הוזרקו בשלב 1 תא עם mRNA המקודד את החלבון פלורסנט photoconvertible kikumeGR...
Discussion
טכניקה זו מאפשרת הרכבה עוברת להישמר עדיין במהלך העברת המיקרוסקופ ושוב לטווח ארוך ניסויי הזמן לשגות הדמיה שמטרתה הבאה התארכות גוף אחורית בסקאלות אורך המרובה. יתר על כן, זה הוא תכליתי בכך שהיא מאפשרת הדמיה משני מיקרוסקופיה זקוף הפוך בחרו קופץ, וכן המלצה ניתנת למען איך ...
Disclosures
The authors have nothing to disclose.
Acknowledgements
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materials
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
References
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved