È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo di montaggio versatile per il lungo termine Imaging di sviluppo Zebrafish
In questo articolo
Riepilogo
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Abstract
embrioni di zebrafish offrono un sistema sperimentale ideale per studiare processi morfogenetici complessi a causa della loro facilità di accessibilità e trasparenza ottica. In particolare, l'allungamento del corpo posteriore è un processo essenziale nello sviluppo embrionale da cui più deformazioni tissutali agiscono insieme per dirigere la formazione di una grande parte dell'asse corpo. Per osservare questo processo time-lapse imaging a lungo termine è necessario utilizzare una tecnica di montaggio che consente il supporto sufficiente a mantenere campioni nell'orientamento corretto durante il trasferimento al microscopio e acquisizione. Inoltre, il montaggio deve anche fornire sufficiente libertà di movimento per la conseguenza della regione di corpo posteriore senza alterarne il normale sviluppo. Infine, ci deve essere un certo grado di versatilità del metodo di montaggio per consentire imaging diverse immagini set-up. Qui vi presentiamo una tecnica di montaggio per l'imaging lo sviluppo di posteriori elongatio corpon nel zebrafish D. rerio. Questa tecnica comporta embrioni tale che le regioni della testa e del sacco vitellino sono quasi interamente inclusi in agarosio montaggio, lasciando la regione di body posteriori ad allungarsi e svilupparsi normalmente. Vi mostreremo come questo possa essere adattato per posizione verticale, capovolta e verticale luce fogli microscopia set-up. Anche se questo protocollo si concentra su embrioni per l'imaging per il corpo posteriori di montaggio, potrebbe facilmente essere adattato per l'imaging dal vivo di molteplici aspetti dello sviluppo zebrafish.
Introduzione
Posteriore allungamento corpo è un processo essenziale nello sviluppo embrionale da cui l'embrione si estende per formare una grande parte dell'asse corpo. Si tratta di un esempio di un complesso processo morfogenetico da cui comportamenti delle cellule multiple agire coordinatamente per generare la morfogenesi a livello dei singoli tessuti. Queste deformazioni tissutali differenziale quindi agiscono insieme per generare l'allungamento del corpo posteriore, a tutto il livello della struttura. Per capire come questi processi sono controllati e coordinati durante lo sviluppo, dobbiamo essere in grado di seguire questi processi a scale multiple (cioè a livello di molecole, cellule, le popolazioni di cellule e tessuti) e di mettere in relazione questo direttamente alla morfogenesi di tutta la struttura .
zebrafish embrioni sono ideali per l'imaging posteriore allungamento corpo come la trasparenza ottica e piccole dimensioni permette l'applicazione di immagini poco minimamente invasiva approcci adatta a live imaging. 1 Ciò è stato evidenziato da una serie di recenti pubblicazioni che hanno fatto luce sullo sviluppo del corpo posteriore a livello di molecole, 2 singole cellule, 3 e inter-tessuto comportamenti, 4 nonché a livello della popolazione cellulare e tutto l'organo. 5
tecniche di imaging avanzate come confocale, microscopia multi-fotone e piano selettivo illuminazione microscopia (SPIM) stanno permettendo la formazione immagine a lungo termine dei processi di sviluppo, con effetto di tossicità luce e fotometabolismo diminuito. tecniche robuste per il montaggio di campioni vivi sono necessari per raggiungere tre obiettivi: 1) sostegno sufficiente per mantenere campioni nell'orientamento corretto durante il trasferimento al microscopio e durante l'acquisizione, 2) sufficiente libertà di movimento del campione per consentire la conseguenza di la regione di corpo posteriore senza compromettere la sua normale develluppo, e infine 3) un certo grado di versatilità del metodo di montaggio per consentire imaging diverse immagini set-up.
Questo protocollo introduce una tecnica di montaggio per l'imaging lo sviluppo del zebrafish D. rerio. Questa tecnica comporta embrioni montaggio in modo che le regioni della testa e del sacco vitellino sono quasi interamente inclusi in agarosio, lasciando la regione di body posteriori ad allungarsi e svilupparsi normalmente. Come tale, è anche un metodo appropriato per imaging a lungo termine delle altre regioni del corpo di sviluppo come l'agarosio permette l'imaging mediante tecniche di imaging luce standard. Questo protocollo dimostra montaggio di embrioni in un orientamento laterale, anche se è possibile montare embrioni in orientamenti alterative. Sarà inoltre mostrerà come adattare il metodo per configurazioni microscopia ottica fogli verticali, invertiti e verticali.
Protocollo
1. preparazione di soluzioni e tirato Vetro ago
- Fare una soluzione 25x magazzino di Tricaine (3-amino acido benzoico etil estere, chiamato anche etil 3-aminobenzoate) a 4 mg / ml in 20 mM Tris pH 8.8 e portare questa soluzione è a pH 7. aliquota del 4 ml e conservare a -20 ° C.
NOTA: L'anestetico Tricaine agisce preferenzialmente sui canali del sodio voltaggio-dipendenti neurali bloccando così contrazioni muscolari e il movimento 6. - Effettuare una soluzione di lavoro di Tricaine ad una concentrazione finale di 0,17 mg / ml in terreno di embrione E3. 7
NOTA: Rendere il Tricaine soluzione di lavoro estemporaneamente come il pH di questa soluzione va alla deriva. - Sciogliere l'agarosio a basso punto di fusione ad una concentrazione finale di 1,5% in E3 medio embrione in un tubo da 50 ml riscaldando la soluzione in un forno a microonde. Lasciate che questa soluzione equilibrare a 42 - 45 ° C sia in un bagno d'acqua o da banco incubatore. Se la preparazione di piatti di grandi dimensioni per il verticaleluce fogli di imaging (fase 4), fanno un ulteriore 25 ml di 1% di fusione standard di agarosio nel medio embrione E3.
- Utilizzare vetro borosilicato con capillari filamento con dimensioni di diametro 1,20 millimetri, ID 0,69 millimetri, la lunghezza di 10 mm.
- Se capillari sono tirati dal tipo di riscaldamento-filamento ago estrattore descritto nella tabella di attrezzature e reagenti, utilizzare le seguenti impostazioni: Calore 600, Pull 120, velocità 50, Tempo 225, pressione 500. Con un paio di pinze taglienti, pausa l'ago appena passato il punto in cui si flette per creare un ago pulito e tagliente per orientare embrioni e rimuovendo l'eccesso di agarosio. Un micro-bisturi può anche essere usato per rimuovere l'eccesso di agarosio.
2. Integrazione di embrioni per la microscopia invertito o verticale
- Alza gli embrioni fino allo stadio appropriato in media embrione E3. 7
- In fase di richiesta, gli embrioni dechorionate con un paio di pinze forte sotto un binocolo dissezioneMicroscopio ting.
- Incubare gli embrioni dechorionated per almeno 5 minuti nella soluzione di lavoro Tricaine.
- Una volta che la soluzione di agarosio fuso è stata raffreddata a 45 ° C, utilizzare una pipetta Pasteur di vetro per trasferire l'embrione dechorionated direttamente nel tubo 50 ml con trasferimento minimo di mezzo E3.
- Rimuovere embrione insieme con circa 1 ml di mezzo di montaggio e aggiungere circa. 100 pl di mezzo di montaggio insieme con l'embrione al cerchio centrale di una capsula di Petri con fondo 35 mm, con micropozzetti 10 mm.
- Poiché il mezzo di montaggio è l'impostazione, spostare l'embrione al bordo del cerchio di agarosio con la coda rivolta verso l'esterno (Figura 1A). Utilizzare l'ago capillare per mantenere l'embrione con l'orientamento laterale desiderato fino a quando il gel è completamente impostata. Per un'immagine di sviluppo del corpo posteriore, fare attenzione a orientare l'embrione come laterale un orientamento il più possibile. Pertanto, mantenere l'embrione in questa posizione da attenti Rettifichets con l'ago capillare.
NOTA: embrioni multipli possono essere aggiunti al piatto di montaggio, a questo punto, se necessario. Se questo è il caso, trasferire il bassofondente agarosio nel piatto prima e aggiungere gli embrioni al centro della goccia di agarosio. Poi, spingere gli embrioni verso i bordi dell'anello vetro e orientare nella posizione desiderata. Fino a sei embrioni può essere montato in questo modo prima che il agarosio diventa solidificato.
3. La rimozione di un eccesso di agarosio intorno al corpo posteriore
NOTA: Questa sezione descrive la procedura con la quale agarosio viene rimosso dalla regione che circonda il corpo posteriore. Nel caso di allungamento del corpo posteriore, è importante garantire che la coda può crescere-out normalmente. Rimuovendo l'agarosio dopo l'embrione è stato completamente incluso da agarosio, l'embrione viene lasciata delimitata dalla regione della testa e circa la metà del sacco vitellino.
- Una volta che la goccia di agarosio ha fissato, inondare il petri diSH con la soluzione di lavoro Tricaine.
- Sotto un microscopio binoculare dissezione con una base a luce trasmessa, regolare la posizione dello specchio e l'angolo della luce incidente tale che la forte contrasto permette ai tagli nella agarosio per essere visto chiaramente attraverso l'operazione.
- Per eseguire taglio 1 (Figura 1), utilizzare l'ago capillare o micro-bisturi per tagliare la metà strada agarosio lungo il tuorlo, da una posizione immediatamente posteriore al campo cuore formatura alla posizione del somite 5 (5 ° somite anteriore).
- Avviare il taglio iniziale adiacente al cuore formatura come mostrato, e il modo completo attraverso l'agarosio al vetro.
- Tenere il capillare o micro-bisturi in profondità all'interno della agarosio, e lentamente ha visto su e giù mentre cominciando a fare un lungo taglio sopra l'embrione come mostrato Figura 1. Tagliare il più vicino per l'embrione possibile senza pungere l'embrione o il tuorlo.
- Successivamente, effettuare tagli 2 e 3 (Figura 1 ), Partendo dalla posizione contro l'embrione e con il taglio andando fino in fondo al vetro a fondo piatto. Rendere taglio 2 in modo che sia tangente ai primi 5 somiti, consentendo piena dorsalward dispiegamento del corpo posteriore. Rendere tagliare 3 a 90 ° con la superficie tuorlo e partendo dal Heartfield.
NOTA: Taglio agarosio finché il bordo del cerchio di vetro (come mostrato in figura 1) aiuti nel rimuovere il agarosio come blocco completo (passo 3.6). Tuttavia, questo non è necessario. - Partendo all'intersezione di tagli 1 e 3, fare un taglio lenta diagonale verso la fine del taglio 2 mentre lentamente sollevamento verso l'alto per rimuovere il quadrato agarosio che circonda il corpo posteriore.
Note: In alcuni casi, questo sarà rilasciato in un blocco e l'operazione viene completata in un colpo solo. In altri casi, potrebbero essere necessari diversi tentativi per dis-lodge tutto il agarosio che circonda l'embrione. - Con un paio di pinze taglienti, rimuovere il b sloggiatociocche di agarosio dal mezzo embrione. Per facilitare questo processo, spostare i pezzi agarosio al lato del piatto e utilizzare la parete della capsula di Petri da supporto sollevando i pezzi agarosio.
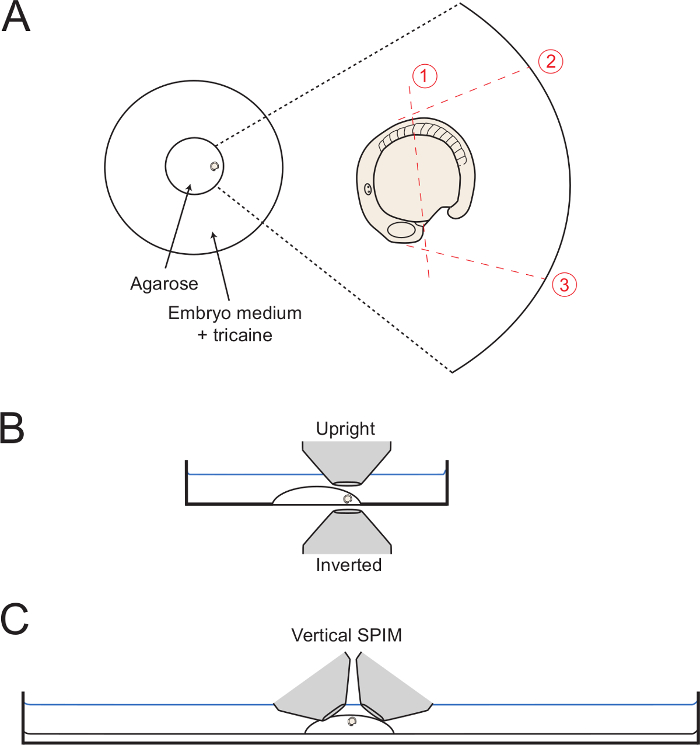
Figura 1: Schemi di montaggio set-up. (A) Il diagramma mostra la posizione dell'embrione montato all'interno dell'anello bicchiere centro di una piastra di Petri. Sulla destra è uno zoom di un embrione con ogni taglio successivo attraverso il circostante agarosio mostrata con linee rosse dottted. (B) Gli embrioni montato è diagrammed in vista laterale la visualizzazione della facilità di accesso per entrambi gli obiettivi invertiti e in posizione verticale. (C) Un digram simile che mostra come gli embrioni possono essere montati per immagini fogli luce verticale set-up. Si prega di click qui per vedere una versione più grande di questa figura.
- Se contrazioni muscolari non è completamente bloccato in quel punto, aggiungere gocce di Tricaine dalla soluzione madre di 4 mg / ml, pH 7.
4. Montaggio di embrioni per la Luce della scheda verticale Microscopia
NOTA: Questa è una variante del metodo sopra descritto, che consente l'accesso di obiettivi multipli per l'imaging di campioni da SPIM verticalmente orientati. L'idea alla base di questa variante è quella di togliere il campione leggermente superiore al fondo del piatto, per consentire un facile accesso delle due obiettivi di imaging.
- Prima del campione di montaggio, cappotto una capsula di Petri in plastica 100 mm con 1% agarosio in medium E3 ad un'altezza di 5 mm e lasciare solidificare.
- Mettere una goccia di 1 ml di basso punto di fusione agarosio al centro del piatto e lasciare solidificare.
- embrioni Incorpora in basso punto di fusione agarosio come nella sezione 2. Tuttavia, questa volta, rimuovere l'embrione dal tubo 50 mldi agarosio con una goccia più piccola di soluzione (0,5 ml) e collocarlo piccola goccia in cima al 1 ml cadere nel centro del piatto.
- Utilizzare l'ago capillare per posizionare l'embrione nel centro della piccola goccia e mantenere il corretto orientamento fino ad impostare gel.
- Inondare il piatto con soluzione di lavoro Tricaine e rimuovere l'eccesso di agarosio come nella sezione 3, ma senza tagliare attraverso il cuscino del 1% agarosio standard.
Risultati
Il protocollo descritto sopra dettagli una tecnica versatile per il montaggio di embrioni di zebrafish per l'imaging lasso di tempo a lungo termine. Un esempio di questo è mostrato in Figura 2A e animato / video Figura 1. Gli embrioni sono stati iniettati nella fase 1 cella con mRNA codificante la proteina fluorescente fotoconvertibile kikumeGR. Nella fase 15 somite sono stati montati come descritto sopra e ripreso per 12 ore su un microscopio confo...
Discussione
Questa tecnica di montaggio consente di embrioni da tenere ancora durante il trasferimento al microscopio e oltre esperimenti di imaging time-lapse a lungo termine volti a seguito posteriore allungamento del corpo a più scale di lunghezza. Inoltre, è versatile in quanto consente per l'esposizione su entrambi microscopia verticale e capovolto set-up, e un suggerimento è fatto per come questo può essere ulteriormente adattata per SPIM orientato verticalmente.
Un passo fondamentale in q...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35 mm Petri dish, 10 mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Riferimenti
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon