Method Article
小鼠小肠的混合原代培养拟肠激素分泌的研究和活细胞成像的肠内分泌细胞的供
摘要
这个协议描述混合鼠小肠细胞的分离和培养。这些一次肠培养使底层使用多种技术肠肽分泌信号转导途径的研究。
摘要
肠道是身体最大的内分泌器官,与沿着胃肠上皮的长度位于激素分泌的肠内分泌细胞。尽管他们的生理意义,内分泌细胞仅代表上皮细胞群的一小部分,在过去,它们的特征已经呈现从而对细胞系模型的依赖相当大的挑战。在这里,我们提供一种用于混合鼠小肠细胞的分离和培养的详细协议。这些原代培养物已被用于识别响应于数营养素和神经肽以及药理学试剂的刺激与肠肽分泌的抑制的基础的信号传导途径。此外,在利用转基因荧光记者小鼠的组合,我们已经证明,这些原代培养成为荧光标记的内分泌细胞的在中考的有力工具细胞外水平,使用诸如膜片钳和单细胞钙和cAMP-FRET成像。
引言
此方法的总的目标是分离和培养混合鼠肠细胞,使肠肽分泌和内分泌细胞的活细胞成像的研究。这个程序的早期版本被莱曼等人最初发表于2008年。 1并从此形成从我们的基团的进一步的出版物20的基础。对于这个手稿中,我们选择把重点放在小肠文化,因为他们更有挑战性的建立比结肠文化。
肠内分泌细胞分泌肠肽,包括胰高血糖素样肽1(GLP-1),葡萄糖依赖性促胰岛素肽(GIP),缩胆囊素(CCK)和肽YY(PYY)2的阵列。这些肠肽在组织协调餐后反应,如消化道中转,葡萄糖刺激的胰岛素释放和饱腹感的诱导增强的放缓重要的生理作用。 GLP-1模拟物一第二抑制其降解的药物,目前许可用于2型糖尿病的治疗和有刺激该肽3的内源性分泌的治疗潜力的持续评估。更好地理解肠内分泌生理学的和通过分泌要么刺激或抑制的机制,因此,极为重要的。
肠肽分泌可以使用多种体外和离体实验模型,各有优点和缺点进行研究(为一个综合最近的综述也涵盖使用体内模型的看到斯文森等人 4)。 离体技术,例如离体灌注肠5和尤斯灌流室6当前正在使用的探索响应于各种物质肠肽的分泌。这些方法的主要优点,如相比原代培养物,是肠内分泌细胞的直接环境保持基本完好,并重要的是,细胞的极性被保留。因此,有可能引起关于促分泌作用于6,其细胞表面的信息。然而,这些通常是低通量技术和衍生自它们的数据的质量在很大程度上依赖于肠组织的完整性和存活,这不可避免地随时间降低。
肠类器官,现在越来越多地被用作体外模型肠内分泌细胞的功能和发展7的研究。类器官,它可以从鼠和人体组织中得到,具有形成3D"隐窝样"维持在培养物中的细胞极性结构的益处。然而,类器官衍生的肠内分泌细胞还没有得到充分的表征,并且它们的相似性,以天然I CELLS仍然知之甚少。原代培养物具有作为一个步骤更接近生理的设置的优点,因为肠内分泌细胞不保持并在延长的时间段人工条件区分。
其已经用于肠肽分泌的评估的替代原代培养物的方法是大鼠胎儿肠细胞(FRICS)8的分离。但是,成人肠组织的培养已遇到了以下的成功和一些差异已经在FRICS 对成年鼠肠细胞( 例如,葡萄糖8)的响应性被观察到。
肠内分泌样细胞系( 例如的GLUTag,STC-1和NCI-H716)在传统上被用来直接VS进行区分。上肠内分泌细胞和解剖耦合刺激分泌的分子机制间接影响;看到Kuhre 等 。 9,用于肽的产生和分泌由"L细胞样"永生化细胞系。这一直是必要的,因为内分泌细胞,沿着胃肠道错落,构成略低于肠上皮细胞10和分选细胞的1%,在我们的手中,不要在文化生存1。细胞系留由于事实,他们是一个基本上均一的细胞群这有利于遗传操作,例如基因沉默的有用工具。因此,很容易调查不能药理针对性,在转基因小鼠不可蛋白质的作用。然而,细胞系并不总是原代细胞的有效模式。虽然有许多相似之处,从原代培养物已有时强调了通过在初级L细胞某些营养素相比的GLUTag细胞中激活的信号传导途径的差异的研究结果,例如( 例如 ,蛋白胨 11)。至关重要的是,在转基因的荧光报告小鼠组合中,原代培养物模型使在细胞内水平各个初级的肠内分泌细胞的详细检查。原代培养物中的荧光标记的L细胞已被用于我们的组补丁夹紧1,12研究,和单细胞钙11,13和环磷酸腺苷-FRET成像14周的研究中,已在肠内分泌领域得到显著进展生理。
以下协议用于执行分泌实验,使用24孔板或用于多达16对成像菜肴的准备进行了优化,从一个单一的成年小鼠的小肠的10厘米的部分。该协议可以通过增加的消化时间和共同被容易地修改为结肠细胞中的研究llagenase浓度。
研究方案
所有的动物过程由剑桥大学动物福利的大学和伦理审查机构批准,符合动物(科学规程)1986年法令修订规例(SI三千〇三十九分之二千〇一十二)。
1.事前准备
- 置于冰上基底膜基质的等分试样(BMM)(〜200μL)解冻。
注:BMM在室温下固化(RT)。 - 预暖50毫升无菌高葡萄糖的Dulbecco改良Eagle培养基(DMEM)(无添加物)和〜40毫升的无菌培养介质(高葡萄糖DMEM补充有10%胎牛血清(FBS),100U / mL青霉素和0.1毫克/毫升链霉素(P / S),并在37℃。2 2mM L-谷氨酰胺)中在水浴50mL离心管
- 预冷钙和磷酸盐缓冲盐水(PBS)含镁。
- 称出15毫克胶原酶(XI粗品),添加到50mL离心管中,并保持在冰上。
- 注意:胶原酶是有害的。它会导致皮肤刺激(H315)和严重眼刺激(H319)。如果吸入(H334)可能引起过敏或哮喘症状或呼吸困难。这可能会导致呼吸道刺激(H335)。使用适当的个人防护装备,避免灰尘生成,避免吸入粉尘。保证充分的通风。
2.组织收集
- 约20mL L-15介质加入到50mL离心管中,并将其放置在冰上。
- 安乐死小鼠通过颈脱位法,或其他认可的时间表1的方法。
注:肠组织通常由在C57BL6背景的小鼠获得。然而,其它遗传背景也被用于例如 129 / SvEv 15。成像实验需要使用荧光记者小鼠如 GLU金星1。组织是由两种性别的成年小鼠(2-6个月)获得。小鼠被安置在individuaLLY通风与水和常规食物随意获取笼。然而,实验来检验高脂饮食的影响,例如,在肠内分泌细胞功能16如果一个项目许可证的支持下进行。 - 解剖,轻轻取出小鼠肠(距离幽门开始直肠的),使用镊子和清扫剪刀。储存于L-15介质上冰,直到准备使用。
3.组织准备
- 放置肠组织中含有足够的PBS以覆盖组织在10cm培养皿中。采取10厘米期望的组织( 例如小肠上部,顶部10厘米,远端幽门)。
- 冲洗使用塑料巴斯德吸管和冷却PBS肠内容物。
- 使用镊子,微妙地握肠道段的一个端部和巴斯德移液管的尖端放置到它。冲洗用冷水PBS内容。从两端重复,直到魔女内容RITY已经被冲洗掉。转移到含有新鲜冷冻的PBS清洁培养皿。
- 使用镊子,取出脂肪组织及肠系膜,照顾同时不拉断肌肉层。
- 剥离的肌肉层脱落"像短袜"使用两组细镊子的解剖显微镜下。
注:此步骤不是必需的,但强烈建议。有去除肌肉层,这里所描述的一个替代方法。例如,肠道可以除去肌肉层的之前被纵向切开第一,。- 查找在组织的更近端的起点,那里有肌肉的可见瓣。轻轻扯远了肌肉层有少量周围肠道一路。
注意:为了避免肌肉层或肠上皮的撕裂,通过夹紧更大的表面面积,而不是采用t减少的张力细镊子的IPS。 - 夹紧肠和尽可能多的肌瓣尽可能的,轻轻拉开,并开始剥离从周围的肠肌肉层。为了避免撕裂两个肌肉层和上皮细胞,保留重新调整钳的位置,让他们紧靠在一起。以这种方式,从肠道段和废弃的整个长度除去肌肉层。
- 查找在组织的更近端的起点,那里有肌肉的可见瓣。轻轻扯远了肌肉层有少量周围肠道一路。
- 切肠开放纵向和与新鲜的冷PBS干净的培养皿中纷飞洗。如有必要,重复删除任何剩余食糜或粘液。
- 用外科手术刀刀片切碎组织以达到约1-2毫米2正方形和这些添加约20mL中使用巴氏吸管的50mL离心管中冷却的PBS中。为了避免组织片粘到吸移管,切断尖端和通过用PBS研磨湿吸液管。
- 轻轻摇动管中以进一步清洗所述组织片。允许组织沉降,并倾或对ipette掉大部分的PBS,并用新鲜PBS重复,直到PBS看起来清晰。
4. BBM包被的平板/餐具和消化介质的制备
注意:下面的步骤应在组织培养罩(具有保温步骤在37℃的水浴)来执行。
- 制备在冷却DMEM 2%BMM溶液(无添加)。工作时,保持在冰上的解决方案。为2%的溶液中,添加140μL解冻BMM至7毫升DMEM(足以制备单24孔板)。
- 加入250μL2%BMM溶液每孔(24孔板)或每玻璃底皿的成像。
- 在37℃下孵育包被的板/菜为至少30分钟的培养箱中以允许BMM的充分聚合。
- 该预热的50毫升的DMEM(无添加)添加到15毫克胶原酶(来自步骤1.2和1.4),以形成0.3 mg / mL的溶液和转化至溶解。
- 上CE完全溶解后,使用20毫升注射器,通过0.2μm无菌过滤器胶原酶溶液过滤到新的无菌的50mL离心管中。这个标签作为分解媒介。
5.组织消化
- 使用10毫升血清移液管除去从PBS组织片,并添加到含有冰冷的无菌DMEM(无添加物)的无菌的50mL离心管中,涡旋,然后除去DMEM。
注意:为避免组织粘附到血清移液管,通过研磨与所述组织接触之前,DMEM润湿它。 - "消化" 1和2:细胞碎片和单个细胞的去除
- 7毫升消化介质添加到组织片,并给所述管的涡流。
- 孵育在37℃的水浴中5分钟。
- 轻轻摇动(未旋动)的管为〜3秒。
- 允许组织沉降,弃去消化介质,预留小体积看在显微镜下。
注意:尤其是起步时,强烈建议检查在显微镜下的小体积的每个"消化"(〜30μL)来衡量的消化过程的进度。如果许多隐窝在这个阶段观察,晃动可能过于剧烈。对于什么样的不同的"消化"阶段通常看起来像代表图像,参见图1。 - 重复步骤5.2.-5.2.4(新鲜分解媒介)。
- "文摘" 3至5:收集隐窝片段的
- 7毫升消化介质添加到组织。
- 在37℃下孵育10分钟。
- 在培养过程中,摇匀每5分钟10-12秒。
注:摇动是更有力的比对摇动"消化" 1和2。
- 在培养过程中,摇匀每5分钟10-12秒。
- 允许未消化的组织,以在15毫升离心管中沉降并收集消化平台。如果组织被意外收集与介质一起,它平静下来,使用10毫升血清移液管将其取出并传输回至含有未消化的组织的50-mL离心管中。
- 离心机收集介质/上清液在RT在100×g下3分钟。
- 弃去上清液并通过温和研磨并预留重新悬浮在5预热毫升培养基中的细胞沉淀。
- 检查在显微镜下将细胞悬浮液的小体积(见从步骤5.2.4注)。
注:在理想情况下,隐窝片段开始出现与细胞碎片和单个细胞沿着"消化" 3。 "文摘" 4和5包含具有降低的细胞碎片隐窝片段的显著更大数量( 图1)。调整振动强度必要即如果组织不能消化和隐窝碎片没有出现,动摇更有力。 - 重复步骤5.3.1-5.3.6,直到5"消化"已完成或直到大部分的组织的已被消化(可能需要一个第 6摘要)。
- 一旦从"摘要" 3-5(或3-6)已被收集,离心所有上清液在RT下的消化上清液在100×g下3分钟。
- 用于分泌的实验中,从"摘要" 3-5(或3-6)之前合并离心上清液。
注意:需要较少的组织进行成像实验,因此选择该摘要上清液即是最清洁的(不存在细胞碎片和单个细胞的)隐窝片段的更大数量。这通常是"消化" 4或5。 - 弃上清,通过研磨,直至无团块可见轻轻重新悬浮沉淀。重悬在补充有10μMY-27632二盐酸盐预热培养基的颗粒(以防止失巢凋亡17)。使用5mL的用于分泌实验和2成像实验毫升培养基。
- 过滤通过100微米的过滤器的细胞悬浮液(以除去任何未消化的组织)。通过过滤器运行另外的2毫升预热培养基洗(总体积:7毫升和4mL用于分泌和成像,分别地)。
注:过滤不是必需的,然而,较大的组织碎片往往不附着于板/菜肴。
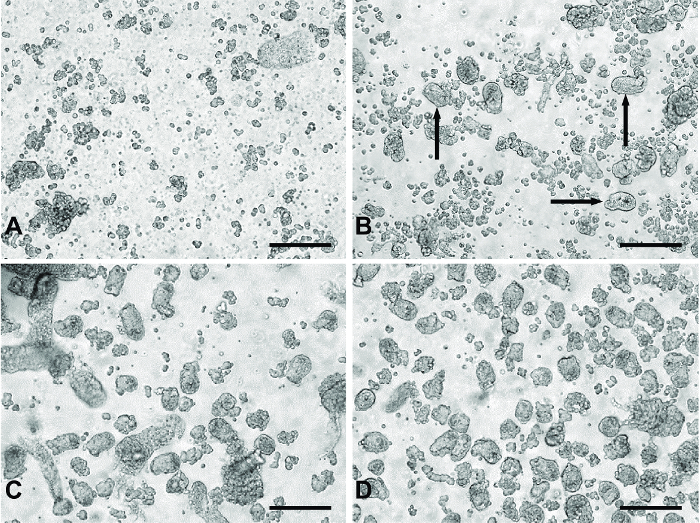
图1:从原发性小肠培养方法"消化"的代表性图像。 (A)从"摘要" 1和2主要含有单细胞和细胞碎片的典型材料。 (B)从"消化" 3.黑色箭头产品的例子表明出现在消化材料隐窝片段。 (C)典型的"消化" 4或5面板(D)表示汇集消化的材料从"消化" 3-5通过100μm过滤器以除去在(C)观察到的更大的不想要的组织碎片。所有的图像使用具有20倍的目标数字倒置显微镜拍摄。比例尺=100μm左右。 请点击此处查看该图的放大版本。
6.电镀肠培养物(富集隐窝细胞)
- 除去从板或菜肴过量BMM溶液,并加入每分泌250μL预温热培养基良好。
注:成像菜肴左无介质,从而进行到下一个步骤迅速,以防止盘干燥。 - 板250μL细胞悬浮液,每孔(24孔板)或每玻璃底皿中。
- 板,逐滴穿过井中的慢"之字形"运动。允许隐窝片段移动板,以TH之前沉降〜5分钟Ë孵化器。
注:这应该鼓励井内甚至隐窝/细胞的分布。
- 板,逐滴穿过井中的慢"之字形"运动。允许隐窝片段移动板,以TH之前沉降〜5分钟Ë孵化器。
- 孵育在37℃下板或菜肴过夜,5%CO 2。
注:A"修修补补"单层应该已经形成。对于以下三个洗涤培养物的代表性图像,参见图2A。 - "洪水"摄像菜肴每个培养皿2毫升预热的培养基。
注:多达〜72小时以下电镀这些菜将适合于成像。结肠文化通常持续时间较长,可达7天。还没有粘附的细胞可以通过一个洗涤步骤中除去。原代培养,现在已经准备好用于实验。
结果
采用串行消化步骤允许镀一个相对干净的准备隐窝碎片的集合实验。前两个消化从消化材料( 图1A)除去主要单细胞和细胞碎片。第三消化期间,隐窝片段出现在消化材料( 图1B)。消化4和5产率用更少的单电池( 图1C)隐窝片段更大数目。过滤从消化汇集的材料去除3-5大块未消化的组织,这可能是有害的培养,产生一个干净的隐窝制备的片段( 图1D)。
以下培养的18-24小时,原发性小肠细胞的单层被观察到( 图2A)。使用从转基因小鼠产生的培养物中特异性表达的卡cium荧光传感器,GCaMP3,高血糖素原启动子11的控制下,L细胞是易于识别和培养( 图2B)内散布。在原发性小肠培养物,化合物靶向对于g q -Ca 2+ i和cAMP的我依赖性途径刺激GLP-1的分泌(用于分泌实验方法见莱曼等人 1)。铃蟾肽(BBS,100纳米)和毛喉素和3-异丁基-1-甲基黄嘌呤(IBMX)的共同申请(F / I,各10μM)引发的相对GLP-1释放的2-和11倍,刺激基础,分别为( 图2C)。 GCaMP3的特定大号细胞表达允许鉴定和动员在个体L细胞钙的实时监测。既100nM的铃蟾肽(BBS)和30mM氯化钾(KCl)刺激的细胞内钙瞬时增加指示所述已知G 的q </子> -和初级L细胞( 图2D)电的耦合通路。
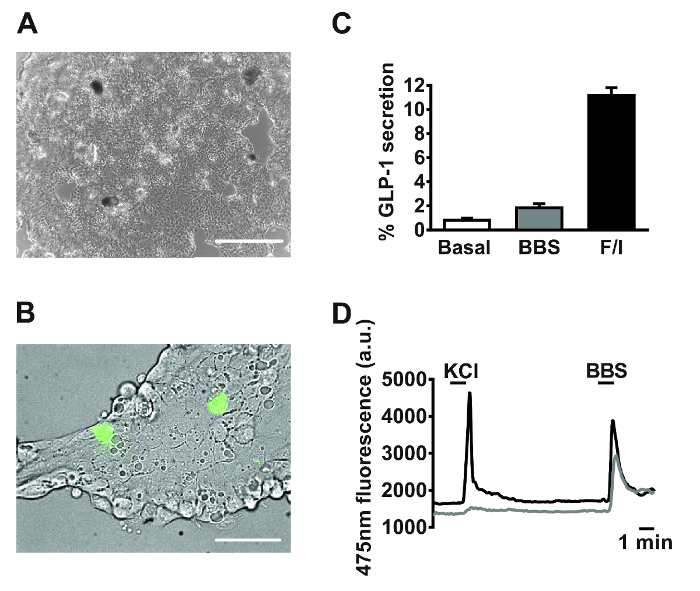
图2:从原发性小肠培养物的有代表性的数据。用于(A)的分泌和(B)成像实验混合原发性小肠培养物的实施例的图像发布24小时电镀。从24孔板截取(A)图像,使用具有4X物镜的数字倒置显微镜。比例尺=500μm左右。 (B)使用GLU-Cre重组X ROSA26 GCamP3小鼠L细胞中的视图(绿色细胞)的字段是由GCaMP3的荧光标识。比例尺条为50μm以下。 (C)GLP-1分泌在响应毛喉素/ 3-异丁基-1-甲基黄嘌呤(IBMX)测定蛙皮素(BBS,100纳米)和(F / I,各10μM)。计算百分比GLP-1分泌通过在上清液和细胞裂解测定GLP-1的水平。数据代表平均值±n = 3的每个条件的SEM。 (D)响应于氯化钾(KCl,30毫摩尔)和BBS(100 nM)的实时监控在(B)所概述的两个小区的GCaMP3荧光(反映细胞内钙)。使用具有40X油浸物镜的倒置荧光显微镜下进行单细胞成像。 GCaMP3在十分之四百七十五处激发,采用75瓦氙弧灯,并通过荧光成像软件控制的单色器。发射记录用的分色镜和一个510-560纳米带宽滤波器的高分辨率数字电荷耦合器件(CCD)相机。 请点击此处查看该图的放大版本。
讨论
这个协议描述混合鼠小肠细胞的分离和培养,以使肠肽分泌和标记的肠内分泌细胞的单细胞成像的研究。
为了增加小肠培养物获得成功的可能性,重要的是,该协议被尽可能迅速地进行(理想地,收获的组织的3小时内),并且所述组织保持在冰冷的培养基或前缓冲在消化过程中,限制细胞死亡。虽然它不是必需的,尤其对于结肠文化,切除小肠肌肉层的大力鼓励。小肠文化协议已经标准化,尽可能。然而,需要注意的是没有消化过程是相同的是非常重要的。有此协议期间多的步骤,其中可以在一天到一天的基础上引入例如肌肉去除程度的可变性,T的大小他"切碎"组织片,摇动的强度,特定批次胶原酶等的效力。因此,极为重要的检查每个不同的"消化"的等分试样,在显微镜下评估消化过程和裁缝摇动的进步和"消化"相应的数量。建议更多轻轻摇晃,开始用和,隐窝碎片不会从明显的"消化" 3日起,开始更用力摇晃。
根据我们的经验,内分泌细胞不增殖培养和小肠培养4天之内,通常丢失。尽管如此,这允许执行肠肽分泌实验充裕的时间来测试生理刺激和/或药理学试剂(典型地在2个小时内,18-24小时后镀进行)。之前的分泌实验需要过夜孵育实验也是可行的例如在预治疗与百日咳毒素15的情况。
这里介绍的原代培养技术是一种行之有效的方法,通过研究将其输出多年来产生的体积所证明的。原代培养物模型已被用于研究多种肠肽,包括GLP-1 1,GIP 18和PYY 19的分泌,响应于不同的营养物和非营养14,20刺激和抑制剂。另外,同样的技术已经成功地应用于人体肠道细胞21的培养物。通常,原代细胞培养方法的一个额外的实验模型如沿的组合。 离体或在体内能提供最洞察6。值得注意的是和其他方法相比,该技术具有IMportant应用超出肠肽释放的测量。我们已经证明,从转基因报告小鼠衍生的原发性小肠培养物是用于耦合到肠肽分泌细胞内信号通路的询问有力工具,分别使用例如钙和cAMP传感器,GCaMP3 11,13和Epac2camps 14日 ,以及电生理技术12。
如同所有的体外模型中,主肠培养具有某些固有的局限性,包括培养物中的上皮细胞极性的损失,以及血液供应和神经支配的损失。这是很难估计的肠内分泌细胞的功能,这些人工条件的潜在影响。然而,从原代培养物中获得的数据往往是在体内 setti平移NG(短链脂肪酸对GLP-1分泌15 例如影响)。
主要的肠道文化与许多潜在应用的通用技术。他们已经提供了重要的机械洞察肠肽分泌的调节。
披露声明
作者什么都没有透露。
致谢
GLP-1的免疫测定,由核心生化分析实验室的Addenbrooke医院进行。
这项工作,多年来,得到了威康信托基金会的支持(目前活跃的补助106262 / Z / 14 / Z和106263 / Z / 14 / Z)和医学研究理事会(MRC)(赠款MRC_MC_UU_12012 / 3和MRC_MC_UU_12012 / 5)。
材料
| Name | Company | Catalog Number | Comments |
| 24-well plates | Costar | 3524 | For secretion experiments |
| Bombesin | Sigma-Aldrich | B4272 | Positive control (calcium imaging experiment) |
| Centrifuge tubes, 15 mL, sterile | Greiner bio-one | 188261 | For tissue preperation/digestion |
| Centrifuge tubes, 50 mL, sterile | Corning | 430828 | For tissue preperation/ digestion |
| Collagenase XI (Crude) | Sigma-Aldrich | C9407 | For making up digestion medium |
| Dichroic mirror | Cairn Research | - | For imaging experiments |
| DMEM High glucose (4500 mg) | Sigma-Aldrich | D6546 | For dissolving matrigel (keep at 4 °C). For making up digestion medium, pre-warm to 37 °C. |
| Emission Filter (Bandwidth 510-560 nm) | Cairn Research | - | For imaging experiments |
| Foetal Bovine Serum | Sigma-Aldrich | F7524 | For making up culture medium |
| Forceps/Tweezers | Agar Scientific | AGT520 | For dissection/removal of intestine |
| Forskolin | Sigma-Aldrich | F6886 | Positive control (secretion experiment) |
| Glass-bottomed dishes (35 mm) | MatTek | P35G-0-14-C | For imaging experiments |
| High precision tweezer (110 mm) | IDEAL-TEK | 3480641 (5 SA) | For removing muscle layer |
| High resolution digital CCD camera | Hamamatsu | ORCA-ER | For imaging experiments |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I7018 | Positive control (secretion experiment) |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | For collecting tissue, keep on ice |
| L-glutamine | Sigma-Aldrich | G7513 | For making up culture medium |
| Matrigel | Corning | 354234 | Basement Membrane Matrix, for coating plates and dishes |
| MetaFluor | Molecular Devices (supplied by Cairn Research) | - | Fluorescence ratio imaging software |
| Mice (C57BL6) | Charles River Laboratories | C57BL/6J | Background mice used for breeding. Can also be used for secretion experiments |
| Mice (GLU-cre x ROSA26 GCaMP3) | in house | - | For calcium imaging and secretion experiments |
| Microscope (EVOS XL Core) | Thermo Fisher Scientific | AMEX1000 | For photomicrographs of cultures |
| Microscope | Olympus | IX71 | Inverted microscope with 40X oil objective used for imaging experiments |
| Monochromator | Cairn Research | - | For imaging experiments |
| Pasteur pipettes | Alpha Laboratories | LW4234 | For cleaning tissue |
| PBS containing Ca2+ and Mg2+ | Sigma-Aldrich | D8662 | For washing tissue, keep on ice |
| Penicillin & Streptomycin | Sigma-Aldrich | P0781 | For making up culture medium |
| Petri dishes (100 mm x 20 mm) | Corning | CLS430167 | For cleaning tissue and removing muscle layer |
| Potassium chloride | Fisher Scientific | P/4280/53 | Positive control (calcium imaging experiment) |
| Scissors | Agar Scientific | AGT554 | For dissection/removal of intestine |
| Sterile cell strainer 100 µm | Fisher Scientific | 22363549 | For filtering crypt cell suspension prior to plating |
| Surgical scalpel blade No.22 (sterile, stainless) | Swann Morton | 0308 | For dicing tissue |
| Syringe filters, Minisart NML (0.2 µm pore size) | Sartorius | 16534-K | For filter-sterilising collagenase solution (digestion medium) |
| Syringes, 20 mL, disposable, sterile, Luer slip | BD | 300613 | For filter-sterilising collagenase solution (digestion medium) |
| Xenon arc lamp 75W | Cairn Research | - | For imaging experiments |
| Y-27632 dihydrochloride | Tocris | 1254 | ROCK inhibitor, prepare 10 mM stock solution in sterile water (use 1:1,000 in final culture medium) |
参考文献
- Reimann, F., Habib, A. M., Tolhurst, G., Parker, H. E., Rogers, G. J., Gribble, F. M. Glucose sensing in L cells: A primary cell study. Cell Metab. 8, 532-539 (2008).
- Psichas, A., Reimann, F., Gribble, F. M. Gut chemosensing mechanisms. J Clin Invest. 125 (3), 908-917 (2015).
- Lovshin, J. A., Drucker, D. J. Incretin-based therapies for type 2 diabetes mellitus. Nat Rev Endocrinol. 5 (5), 262-269 (2009).
- Svendsen, B., Holst, J. J. Regulation of gut hormone secretion. Studies using isolated perfused intestines. Peptides. 77, 47-53 (2016).
- Kuhre, R. E., Frost, C. R., Svendsen, B., Holst, J. J. Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine. Diabetes. 64 (2), 370-382 (2015).
- Brighton, C. A., et al. Bile acids trigger GLP-1 release predominantly by accessing basolaterally located G protein-coupled bile acid receptors. Endocrinology. 156 (11), 3961-3970 (2015).
- Petersen, N., et al. Generation of L cells in mouse and human small intestine organoids. Diabetes. 63 (2), 410-420 (2014).
- Brubaker, P. L., Vranic, M. Fetal rat intestinal cells in monolayer culture: a new in vitro system to study the glucagon-like immunoreactive peptides. Endocrinology. 120 (5), 1976-1985 (1987).
- Kuhre, R. E., et al. Peptide production and secretion in GLUTag, NCI-H716, and STC-1 cells: a comparison to native L-cells. J Mol Endocrinol. 56 (3), 201-211 (2016).
- Gerbe, F., et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as new secretory cell type in the intestinal epithelium. J Cell Biol. 192 (5), 767-780 (2011).
- Pais, R., Gribble, F. M., Reimann, F. Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells. Peptides. 77, 9-15 (2016).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. J Physiol. 589 (Pt 5), 1081-1093 (2011).
- Emery, E. C., et al. Stimulation of GLP-1 secretion downstream of the ligand-gated ion channel TRPA1. Diabetes. 64 (4), 1202-1210 (2015).
- Psichas, A., Glass, L. L., Sharp, S. J., Reimann, F., Gribble, F. M. Galanin inhibits GLP-1 and GIP secretion via the GAL1 receptor in enteroendocrine L and K cells. Br J Pharmacol. 173 (5), 888-898 (2016).
- Tolhurst, G., et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via G-protein-coupled receptor FFAR2. Diabetes. 61 (2), 364-371 (2012).
- Richards, P., et al. High fat diet impairs the function of glucagon-like peptide-1 producing L-cells. Peptides. 77, 21-27 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol. 25 (6), 681-686 (2007).
- Parker, H. E., Habib, A. M., Rogers, G. J., Gribble, F. M., Reimann, F. Nutrient-dependent secretion of glucose-dependent insulinotropic polypeptide from primary murine K cells. Diabetologia. 52 (2), 289-298 (2009).
- Pais, R., Rievaj, J., Larraufie, P., Gribble, F. M., Reimann, F. Angiotensin II type 1 receptor-dependent GLP-1 and PYY secretion in mice and humans. Endocrinology. 157 (10), 3821-3831 (2016).
- Moss, C. E., et al. Somatostatin receptor 5 and cannabinoid receptor 1 activation inhibit secretion of glucose-dependent insulinotropic polypeptide from intestinal K cells in rodents. Diabetologia. 55 (11), 3094-3103 (2012).
- Habib, A. M., Richards, P., Rogers, G. J., Reimann, F., Gribble, F. M. Co-localisation and secretion of glucagon-like peptide 1 and peptide YY from primary cultured human L cells. Diabetologia. 56 (6), 1413-1416 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。