Method Article
Mixed colture primarie di murino tenue finalizzate allo studio di Gut secrezione dell'ormone e imaging cellulare dal vivo di celle enteroendocrine
In questo articolo
Riepilogo
Questo protocollo descrive l'isolamento e la coltura di piccole cellule intestinali murine misti. Queste colture primarie intestinali consentono la ricerca di vie di segnalazione sottostanti intestinale secrezione peptide utilizzando un numero di tecniche.
Abstract
L'intestino è l'organo più endocrino del corpo, con celle enteroendocrine GH secernenti situati lungo la lunghezza dell'epitelio gastrointestinale. Nonostante la loro importanza fisiologica, le cellule enteroendocrine rappresentano solo una piccola frazione della popolazione di cellule epiteliali e, in passato, la loro caratterizzazione ha presentato una notevole sfida con un conseguente affidamento su modelli della linea cellulare. Qui, forniamo un protocollo dettagliato per l'isolamento e la coltura di piccole cellule intestinali murine misti. Queste colture primarie sono state usate per identificare le vie di segnalazione sottostanti la stimolazione e inibizione della secrezione intestinale peptide in risposta ad un numero di sostanze nutritive e neuropeptidi nonché agenti farmacologici. Inoltre, in combinazione con l'uso di topi transgenici reporter fluorescente, abbiamo dimostrato che queste colture primarie diventano un potente strumento per l'esame delle cellule enteroendocrine fluorescenza-tag al dilivello tracellular, utilizzando metodi come serraggio cerotto e calcio cella singola e l'imaging cAMP-FRET.
Introduzione
L'obiettivo generale di questo metodo è quello di isolare e coltura mista cellule intestinali murine per consentire lo studio della secrezione intestinale peptide e imaging cellulare dal vivo di cellule enteroendocrine. Una prima versione di questa procedura è stato originariamente pubblicato nel 2008 da Reimann et al. 1 e da allora ha costituito la base di ulteriori 20 pubblicazioni dal nostro gruppo. Per questo manoscritto, abbiamo scelto di concentrarsi su piccoli culture intestinale in quanto sono più difficili da stabilire di culture del colon.
Cellule enteroendocrine secernono una serie di peptidi intestinali compresi glucagone-like peptide 1 (GLP-1), glucosio-dipendente insulinotropico peptide (GIP), colecistochinina (CCK) e peptide YY (PYY) 2. Questi peptidi intestinali hanno importanti ruoli fisiologici a orchestrare le risposte post-prandiali, come il rallentamento del budello di transito, potenziamento del rilascio di insulina glucosio-stimolata e l'induzione di sazietà. GLP-1 mimetici and farmaci che inibiscono la degradazione sono attualmente licenza per il trattamento del diabete di tipo 2 e non v'è costante valutazione del potenziale terapeutico di stimolare la secrezione endogena di questo peptide 3. Una migliore comprensione della fisiologia e enteroendocrine i meccanismi con cui secrezione è stimolata sia o inibita è, quindi, di importanza critica.
Gut secrezione peptide può essere studiata utilizzando diversi in vitro ed ex vivo modelli sperimentali, ciascuno con vantaggi e svantaggi (per una rassegna recente completa comprendente anche l'uso di modelli in vivo vedere Svendsen et al. 4). Ex vivo tecniche come l'intestino 5 e Camera di Ussing perfusi isolati 6 sono attualmente utilizzate per esplorare intestinale secrezione peptide in risposta a varie sostanze. Il principale vantaggio di questi metodi, comerispetto a colture primarie, è che l'ambiente immediato delle cellule enteroendocrine rimane in gran parte intatto e, soprattutto, la polarità delle cellule è conservato. Pertanto, è possibile ottenere informazioni riguardanti quale cella superficie un secretagogo agisce per 6. Tuttavia, queste sono in genere tecniche a basso throughput e la qualità dei dati da essi derivati si basa molto sulla integrità e la vitalità del tessuto intestinale, che declina inevitabilmente nel corso del tempo.
Organoidi intestinali sono ora sempre più utilizzati come modelli in vitro per lo studio della funzione delle cellule enteroendocrine e sviluppo 7. Organoidi, che possono derivare sia da topo e tessuti umani, hanno il vantaggio di formare strutture 3D 'cripta-simili' che mantengono la polarità delle cellule in coltura. Tuttavia, le cellule enteroendocrine organoide derivate devono ancora essere completamente caratterizzati e loro somiglianza L cel nativols rimane in gran parte sconosciuto. colture primarie hanno il vantaggio di essere un passo verso l'impostazione fisiologico, come cellule enteroendocrine non vengono mantenute e differenziate in condizioni artificiali per periodi di tempo prolungati.
Un metodo di coltura primario alternativo che è stato usato per la valutazione della secrezione intestinale peptide è l'isolamento delle cellule intestinali ratto fetale (FRICS) 8. Tuttavia, la coltura di tessuto intestinale adulta ha riscosso meno successo e alcune differenze sono state osservate nella sensibilità di FRICS vs cellule intestinali murine adulte (ad esempio glucosio 8).
Linee cellulari enteroendocrine-simile (es GLUTag, STC-1 e NCI-H716) sono stati tradizionalmente utilizzati per distinguere diretta vs. effetti indiretti sulle cellule enteroendocrine e per sezionare meccanismi molecolari alla base accoppiamento stimolo alla secrezione; vedi Kuhre et al . 9 per la produzione e la secrezione del peptide da linee cellulari immortalizzate 'alveolari L'. Questo è stato necessario in quanto le cellule enteroendocrine, sparsi lungo il tratto gastrointestinale, costituiscono poco meno dell'1% delle cellule epiteliali intestinali 10 e cellule ordinati, nelle nostre mani, non sopravvivere in cultura 1. Linee cellulari rimangono strumenti utili per il fatto che essi sono una popolazione cellulare molto omogeneo che è favorevole a manipolazioni genetiche come gene silenziamento. Di conseguenza, è facile per indagare il ruolo delle proteine che non possono essere mirati farmacologicamente, quando i topi transgenici non sono disponibili. Tuttavia, le linee cellulari non sono sempre validi modelli di pile. Mentre ci sono molte somiglianze, risultati di colture primarie sono talvolta differenze nelle vie di segnalazione attivate da alcune sostanze nutritive in cellule primarie L rispetto alle cellule GLUTag evidenziate, per esempio (es. Peptoni 11). Cruciale, in combinazione con i topi transgenici reporter fluorescente, il modello coltura primaria permette un esame particolareggiato delle singole celle enteroendocrine primario a livello intracellulare. Cellule L fluorescenti-tag all'interno colture primarie sono state usate dal nostro gruppo di patch di bloccaggio 1, 12 studi e unicellulare calcio 11, 13 e ciclico adenosina immagini monofosfato-FRET 14 studi, che hanno dato significativi progressi nel campo della enteroendocrine fisiologia.
Il seguente protocollo è ottimizzato per eseguire esperimenti secrezione, utilizzando una piastra a 24 pozzetti o per la preparazione di fino a 16 piatti di imaging, da una sezione 10 cm tenue da un singolo topo adulto. Il protocollo può essere facilmente modificato per lo studio delle cellule del colon aumentando tempi di digestione e coconcentrazione llagenase.
Protocollo
Tutte le procedure di animali sono stati approvati dalla University of Cambridge Animal Welfare ed etico organo di valutazione ed adeguato alle Animali (Procedure Scientifiche) Act del 1986 Emendamento regolamenti (SI 2012/3039).
1. Preparazione in anticipo
- Mettere un'aliquota di matrice di membrana basale (BMM) (~ 200 mL) sul ghiaccio a sciogliersi.
NOTA: Il BMM solidifica a temperatura ambiente (RT). - Preriscaldare 50 mL sterile ad alta glucosio Dulbecco Modified Eagle Medium (DMEM) (senza aggiunte) e ~ 40 mL cultura sterile media (DMEM high-glucosio supplementato con 10% siero fetale bovino (FBS), 100 U / mL di penicillina e 0,1 mg / mL di streptomicina (P / S), e 2 mM L-glutammina) in 50 mL provette da centrifuga in un bagno d'acqua a 37 ° C.
- Pre-freddo calcio e magnesio contenenti salina tamponata con fosfato (PBS).
- Pesare 15 mg di collagenasi (XI greggio), aggiungere un tubo da 50 ml centrifuga e tenerlo in ghiaccio.
- ATTENZIONE: Collagenasi è nocivo. Esso provoca irritazione della pelle (H315) e grave irritazione oculare (H319). Può provocare sintomi allergici o asmatici o difficoltà respiratorie se inalato (H334). Essa può causare irritazione respiratoria (H335). Utilizzare dispositivi di protezione adeguati, evitando la formazione di polvere e inalare polvere. Assicurare una adeguata ventilazione.
2. Tissue Collection
- Aggiungere 20 ml di L-15 di media ~ ad un tubo da 50 ml per centrifuga e posizionarlo sul ghiaccio.
- Eutanasia un topo per dislocazione cervicale, o altro metodo approvato pianificazione 1.
NOTA: intestinale tessuto è tipicamente ottenuto da topi su uno sfondo C57BL6. Tuttavia, altri sfondi genetici sono stati utilizzati anche per esempio 129 / SvEv 15. Esperimenti di imaging richiedono l'uso di topi indicatori fluorescenti es GLU-Venere 1. Il tessuto è ottenuto da topi adulti (2-6 mesi) di entrambi i sessi. I topi sono alloggiati in individuagabbie con ad libitum accesso all'acqua e chow regolare lly ventilato. Tuttavia, gli esperimenti per testare l'effetto di una dieta ricca di grassi, ad esempio, sulla funzione delle cellule enteroendocrine 16 può essere eseguita se supportato da una licenza del progetto. - Sezionare e rimuovere delicatamente intestino mouse (dal piloro dell'inizio della retto) con pinze e forbici dissezione. Conservarlo in media L-15 sul ghiaccio fino al momento dell'uso.
3. Preparazione del tessuto
- Posizionare tessuto intestinale in una capsula di Petri 10 centimetri contenente PBS sufficiente a coprire il tessuto. Prendere 10 cm di tessuto desiderato (es superiore dell'intestino tenue, primi 10 cm, distali al piloro).
- Lavare contenuto intestinale usando una pipetta Pasteur di plastica e rilassato PBS.
- Utilizzando pinze, delicatamente presa un'estremità del segmento intestinale e posizionare la punta di una pipetta Pasteur in esso. Lavare contenuti con refrigerata PBS. Ripetere da entrambe le estremità fino a quando il majorezza dei contenuti è stato stanato. Trasferimento in una capsula di Petri pulito contenente fresche, refrigerate PBS.
- Utilizzando pinze, rimuovere il tessuto adiposo e mesentere, avendo cura di non tirare fuori lo strato muscolare allo stesso tempo.
- Sbucciare il muscolo strato off "come un calzino" sotto un microscopio da dissezione utilizzando due set di pinza sottile.
NOTA: Questo passaggio non è essenziale, ma è altamente raccomandato. Ci sono modi alternativi di rimozione dello strato muscolare a quello descritto qui. Ad esempio, l'intestino può essere sezionato longitudinalmente prima, prima della rimozione dello strato muscolare.- Trovare un punto di partenza al termine più prossimale del tessuto in cui c'è un lembo visibile del muscolo. Delicatamente tirare via una piccola quantità di tessuto muscolare tutto intorno l'intestino.
NOTA: per evitare la lacerazione dello strato muscolare o l'epitelio intestinale, ridurre la forza di tensione serrando una superficie maggiore anziché utilizzare il tips delle belle pinze. - Bloccare l'intestino e tanto del lembo muscolo possibile estrarre lentamente a parte e iniziare staccava lo strato muscolare intorno l'intestino. Per evitare di strappare sia lo strato muscolare ed epitelio, mantenere reimpostato la posizione della pinza per tenerli ravvicinati. In questo modo, rimuovere lo strato muscolare della intera lunghezza del segmento intestinale e scarti.
- Trovare un punto di partenza al termine più prossimale del tessuto in cui c'è un lembo visibile del muscolo. Delicatamente tirare via una piccola quantità di tessuto muscolare tutto intorno l'intestino.
- Tagliare l'intestino aperta longitudinalmente e lavare agitando in un piatto pulito Petri con fresche refrigerate PBS. Ripetere, se necessario, per rimuovere ogni residuo di chimo o muco.
- Tessuto tritare con una lama di bisturi chirurgico per raggiungere piazze di ~ 1-2 mm 2 e aggiungere questi per ~ 20 mL raffreddato PBS in una provetta da centrifuga da 50 ml con una pipetta Pasteur. Per evitare pezzi di tessuto che attaccano alla pipetta, tagliare la punta e bagnare la pipetta triturando con PBS.
- Agitare delicatamente il tubo per lavare ulteriormente i pezzi di tessuto. Lasciare che il tessuto di stabilirsi e di versare o pipette fuori la maggior parte della PBS e ripetere con PBS fresco fino a quando la PBS sembra chiaro.
4. Preparazione di BBM-rivestito Piastra / Piatti e digestione Media
NOTA: Le seguenti operazioni devono essere eseguite in una cappa coltura tissutale (con fasi di incubazione a 37 ° C bagnomaria).
- Preparare una soluzione BMM 2% in DMEM freddo (senza aggiunte). Mentre si lavora, tenere la soluzione su ghiaccio. Per una soluzione al 2%, aggiungere 140 microlitri scongelato BMM a 7 ml DMEM (sufficiente per preparare una singola piastra da 24 pozzetti).
- Aggiungere 250 microlitri 2% soluzione BMM per pozzetto (24-pozzetti) o al bicchiere fondo piatto imaging.
- Incubare rivestiti piatti / piatti per almeno 30 minuti in un incubatore a 37 ° C per consentire un'adeguata polimerizzazione della BMM.
- Aggiungere il DMEM 50 mL pre-riscaldato (senza aggiunte) alla collagenasi 15 mg (da Piazza di 1.2 e 1.4) per formare una soluzione di 0,3 mg / ml e invertire a dissolversi.
- Soprace completamente sciolto, utilizzando una siringa da 20 ml, filtrata la soluzione di collagenasi attraverso un filtro sterile da 0,2 pm in una nuova provetta sterile 50 centrifuga. Etichettare questo come mezzo di digestione.
5. Tessuto Digestione
- Rimuovere i pezzi di tessuto dalla PBS usando una pipetta 10 ml sierologica e aggiungere un sterile provetta da centrifuga da 50 mL contenente DMEM sterile raffreddata (senza aggiunte), turbolenza e quindi rimuovere DMEM.
NOTA: per evitare tessuto attaccare alla pipetta sierologica, bagnò mediante triturazione con DMEM prima del contatto con il tessuto. - 'Digest' 1 e 2: rimozione di detriti cellulari e cellule singole
- Aggiungere 7 ml di medio digestione per i pezzi di tessuto e dare il tubo di un vortice.
- Incubare per 5 minuti in un bagno d'acqua a 37 ° C.
- Agitare delicatamente (non agitare) il tubo per ~ 3 s.
- Lasciare che il tessuto di stabilirsi ed eliminare il mezzo di digestione, riservando unpiccolo volume a guardare sotto il microscopio.
NOTA: Soprattutto quando si inizia, si consiglia vivamente di ispezionare un piccolo volume di ogni 'digerire' (~ 30 mL) sotto il microscopio per valutare lo stato di avanzamento del processo di digestione. Se molti cripte sono osservati in questa fase, l'agitazione può essere troppo vigorosa. Per le immagini rappresentative di ciò fasi diversa 'digest' tipicamente assomigliano, fare riferimento alla Figura 1. - Ripetere i punti 5.2.-5.2.4 (con media digestione fresco).
- 'Digest' 3-5: raccolta di frammenti cripta
- Aggiungere 7 ml di medio digestione al tessuto.
- Incubare per 10 minuti a 37 ° C.
- Durante l'incubazione, agitare ogni 5 minuti per 10-12 s.
NOTA: L'agitazione è più vigorosa rispetto al agitazione per 'digest' 1 e 2.
- Durante l'incubazione, agitare ogni 5 minuti per 10-12 s.
- Lasciare che il tessuto non digerito di stabilirsi e raccogliere il mezzo di digestione in una provetta 15 centrifuga. Seil tessuto viene raccolto accidentalmente e il mezzo, permettono di risolvere, rimuoverlo usando una pipetta sierologica 10 mL e le trasferisce di nuovo al tubo da centrifuga da 50 mL contenente il tessuto non digerito.
- Centrifuga raccolto medio / supernatante a RT per 3 min a 100 x g.
- Eliminare il supernatante e risospendere il pellet cellulare in 5 ml di terreno di coltura pre-riscaldato mediante triturazione dolce e messo da parte.
- Ispezionare un piccolo volume di sospensione cellulare al microscopio (vedi nota dal punto 5.2.4).
NOTA: Idealmente, frammenti cripta iniziano a comparire in 'digerire' 3 insieme a detriti cellulari e singole cellule. 'Digest' 4 e 5 contengono un numero significativamente maggiore di frammenti cripta con ridotta detriti cellulari (Figura 1). Regolare scuotendo intensità come necessità, ossia se il tessuto non è digerire e frammenti cripta non stanno comparendo, agitare più vigorosamente. - Ripetere passaggi 5.3.1-5.3.6 fino al 5 'digest' sono staticompletato o finché è stato digerito la maggior parte del tessuto (a 6 ° digest può essere richiesto).
- Una volta che tutti i supernatanti da 'digest' 3-5 (o 3-6) sono state raccolte, centrifugare la digerire sopranatanti a temperatura ambiente per 3 min a 100 x g.
- Per gli esperimenti di secrezione, combinare i surnatanti da 'digest' 3-5 (o 3-6) prima della centrifugazione.
NOTA: meno tessuto è necessaria per esperimenti di imaging, quindi scegliere il surnatante digest che è il più pulito (assenza di detriti cellulari e cellule singole) con il maggior numero di frammenti cripta. Questo è in genere 'digerire' 4 o 5. - Eliminare il supernatante e delicatamente risospendere il pellet triturando fino grumi sono visibili. Risospendere il precipitato in mezzo di coltura pre-riscaldato supplementato con 10 pM Y-27632 dicloridrato (per evitare anoikis 17). Utilizzare 5 mL per esperimenti di secrezione e 2 mL di terreno di coltura per esperimenti di imaging.
- Filtrosospensione cellulare attraverso un filtro da 100 micron (per rimuovere qualsiasi tessuto non digerito). Eseguire un ulteriore 2 ml di terreno di coltura pre-riscaldato attraverso il filtro di lavare (volume totale: 7 ml e 4 ml di secrezione e di imaging, rispettivamente).
NOTA: Il filtro non è essenziale, tuttavia, frammenti di tessuto grandi non tendono ad aderire alle piastre / stoviglie.
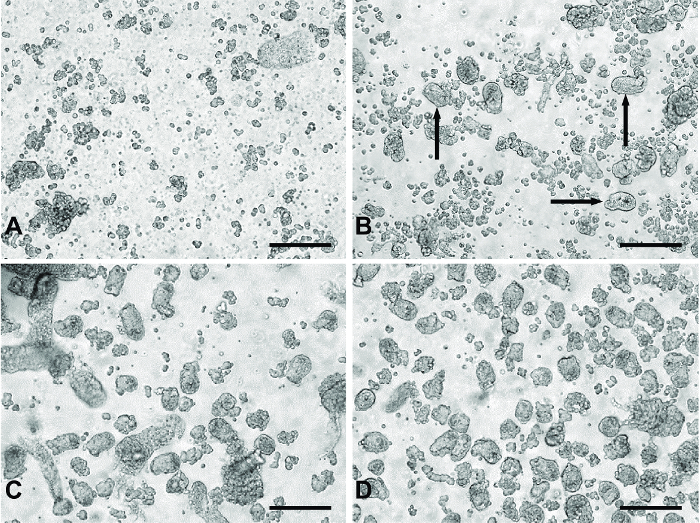
Figura 1: Immagini rappresentative di 'digest' dal piccolo metodo di coltura intestinale primitiva. (A) materiale tipica dalla 'digest' 1 e 2 contenente cellule principalmente singole e detriti cellulari. (B) Un esempio di prodotti di 'digerire' 3. Le frecce nere indicano frammenti cripta appaiono nel materiale digerire. (C) tipica di 'digerire' 4 o 5. Pannello (D) rappresenta pooled digerire materiale da'digest' 3-5 fatta passare attraverso un filtro 100 micron per rimuovere i frammenti di tessuto indesiderate grandi visto in (C). Tutte le immagini sono state scattate con un microscopio invertito digitale con un obiettivo 20X. Barre di scala = 100 um. Si prega di cliccare qui per vedere una versione più grande di questa figura.
6. Culture placcatura intestinali (arricchito da crypt cellule)
- Rimuovere la soluzione in eccesso dalla BMM piatto o piatti, e aggiungere 250 microlitri terreno di coltura pre-riscaldato per secrezione bene.
NOTA: Imaging piatti sono lasciati senza prodotto così procedere al passo successivo rapidamente per impedire il piatto si secchi. - Piastra 250 microlitri di sospensione cellulare per pozzetto (24-pozzetti) o per vetro piatto inferiore.
- Piastra goccia a goccia in un movimento lento 'zig-zag' tutto il bene. Consentire frammenti cripta di stabilirsi per ~ 5 minuti prima di passare la piastra a the incubatore.
NOTA: Questo dovrebbe incoraggiare una distribuzione uniforme delle cripte / cellule all'interno del pozzo.
- Piastra goccia a goccia in un movimento lento 'zig-zag' tutto il bene. Consentire frammenti cripta di stabilirsi per ~ 5 minuti prima di passare la piastra a the incubatore.
- Incubare la piastra o piatti notte a 37 ° C e 5% CO 2.
NOTA: un monostrato 'macchia di leopardo' avrebbe dovuto formata. Per un'immagine rappresentativa di culture seguenti tre lavaggi, vedere la Figura 2A. - 'inondazione' piatti di imaging con 2 mL di terreno di coltura pre-riscaldato a piatto.
NOTA: Questi piatti saranno adatti per l'imaging fino a ~ 72 ore dopo la placcatura. culture del colon in genere durano più a lungo, fino a 7 giorni. Le cellule che non hanno aderito possono essere rimossi da una fase di lavaggio. Colture primarie sono ora pronti per essere utilizzati per gli esperimenti.
Risultati
L'uso di mineralizzazione seriali permette la raccolta di una preparazione relativamente pulita di frammenti cripta da placcare per esperimenti. I primi due digest rimuovono le cellule principalmente singole e detriti cellulari dal materiale digerire (Figura 1A). Durante il terzo digest, frammenti cripta appaiono nel materiale digerito (Figura 1B). Digerisce 4 e 5 resa un maggior numero di frammenti cripta con meno cellule singole (Figura 1C). Filtrare il materiale raggruppata dei digest 3-5 rimuove grandi pezzi di tessuto non digerito, che possono essere dannosi per la coltura, producendo un pulito preparazione frammento cripta (Figura 1D).
Seguendo 18-24 ore di coltura, si osservano monostrati di piccole cellule intestinali primarie (Figura 2A). Utilizzando le culture generate da topi transgenici che esprimono in particolare il calsensore fluorescente Cium, GCaMP3, sotto il controllo del promotore proglucagon 11, cellule L sono facilmente identificabili e intervallati nella cultura (Figura 2B). Nelle piccole colture primarie intestinali, composti targeting G q -Ca 2+ i e cAMP i percorsi -dipendente stimolato la secrezione di GLP-1 (per metodologia esperimento secrezione vedi Reimann et al. 1). Bombesina (BBS, 100 nM) e co-applicazione di forskolina e 3-isobutil-1-metilxantina (IBMX) (F / I, 10 pM ciascuno) innescato una stimolazione 2 e 11 volte, di GLP-1 rispetto al rilascio basale, rispettivamente (Figura 2C). espressione cellula L specifica del GCaMP3 permette di individuare e monitoraggio in tempo reale di mobilitazione del calcio nelle singole cellule L. Sia 100 nM bombesin (BBS) e cloruro di potassio 30 mM (KCl) stimolati aumenti transitorie del calcio intracellulare indicativi della nota G q </ sub> - e percorsi elettrogeniche accoppiati in cellule primarie L (Figura 2D).
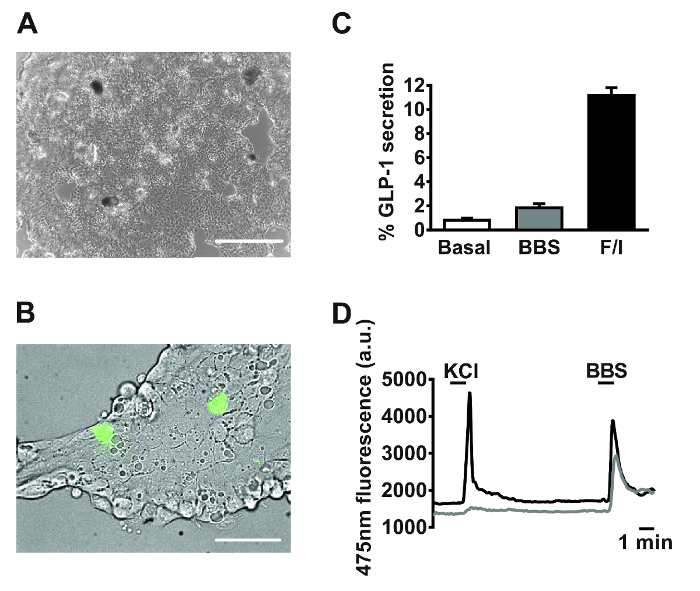
Figura 2: Dati rappresentativi derivanti da piccole colture primarie intestinali. Immagini di esempio di piccole colture primarie intestinali miste usate per (A) e la secrezione esperimenti di imaging (B) posta 24 h placcatura. (A) Immagine tratta da una piastra a 24 pozzetti, utilizzando un microscopio invertito digitale con un obiettivo 4X. Barra di scala = 500 micron. (B) Usando GLU-Cre x topi ROSA26 GCamP3, cellule L nel campo visivo (cellule verdi) sono stati identificati dalla fluorescenza di GCaMP3. bar scala rappresenta 50 um. (C) GLP-1 secrezione è stato misurato in risposta a bombesina (BBS, 100 nM) e forskolin / 3-isobutil-1-metilxantina (IBMX) (F / I, 10 pM ciascuno). Percentuale GLP-1 è stata calcolata secrezionemisurando i livelli di GLP-1 nei surnatanti e lisati cellulari. Dati rappresentano le medie ± SEM di n = 3 per ogni condizione. (D) GCaMP3 fluorescenza (riflettente calcio citosolico) delle due celle descritte in (B) monitorati in tempo reale in risposta al cloruro di potassio (KCl, 30 mM) e BBS (100 nM). Imaging singola cella è stata effettuata utilizzando un microscopio invertito a fluorescenza con un obiettivo ad immersione in olio 40X. GCaMP3 stato eccitato a 475/10 nm, utilizzando una lampada allo xeno ad arco 75 W ed un monocromatore controllato dal software di imaging di fluorescenza. Emissione è stato registrato con una fotocamera digitale ad alta risoluzione dispositivo ad accoppiamento di carica (CCD) usando uno specchio dicroico e un filtro a banda 510-560 nm. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
Questo protocollo descrive l'isolamento e la coltura di piccole cellule intestinali murine misti per consentire lo studio della secrezione intestinale peptide e di imaging singola cellula di cellule enteroendocrine etichettati.
Per aumentare la probabilità delle piccole colture intestinali avere successo, è importante che il protocollo avviene più rapidamente possibile (idealmente entro 3 h di raccolta del tessuto) e che il tessuto viene mantenuto in terreno ghiacciata o tampone prima per il processo di digestione, per limitare la morte cellulare. Mentre non è essenziale, soprattutto per culture colon, rimozione dello strato muscolare dall'intestino tenue è fortemente incoraggiata. Il piccolo protocollo cultura intestinale è stato standardizzato, per quanto possibile. Tuttavia, è importante notare che nessun processo di digestione è identico. Ci sono molti passi durante questo protocollo in cui la variabilità può essere introdotto in un giorno per giorno ad esempio, il grado di rimozione del muscolo, la dimensione delle tha 'macinato' pezzi di tessuto, la forza di scuotere, la potenza di un particolare lotto di collagenasi, ecc. È quindi di fondamentale importanza per ispezionare aliquote di ciascuno dei diversi 'digerisce' al microscopio per valutare l'avanzamento del processo di digestione e adattare lo scuotimento e il numero di 'digest' di conseguenza. Si consiglia di scuotere più delicatamente per cominciare e, se frammenti cripta non sono evidenti da 'digest' 3 in poi, per iniziare agitazione più vigorosamente.
Dalla nostra esperienza, le cellule enteroendocrine non proliferano nella cultura e di solito sono persi da piccole culture intestinali entro 4 giorni. Tuttavia, questo consente tempo sufficiente per effettuare esperimenti secrezione intestinale peptide (tipicamente effettuata in 2 h, 18-24 ore dopo placcatura) per testare stimoli fisiologici e / o agenti farmacologici. Esperimenti che richiedono una notte di incubazione prima dell'esperimento secrezione sono possibili anche esnel caso di pre-trattamento con la tossina della pertosse 15.
La tecnica di coltura primaria qui presentato è un metodo ben noto, come dimostra il volume dei risultati della ricerca ha prodotto nel corso degli anni. Il modello di coltura primaria è stata usata per studiare la secrezione di una varietà di peptidi intestinali, compreso GLP-1 1, 18 e GIP PYY 19, in risposta a diverse nutrienti e non nutrienti 14, 20 stimoli e inibitori. Inoltre, la stessa tecnica è stata applicata con successo alla coltura di cellule intestinali umane 21. Spesso, una combinazione del metodo colture primarie insieme ad un ulteriore modello sperimentale es. ex vivo o in vivo in grado di fornire la più intuizione 6. In particolare ed in contrasto con altri metodi, questa tecnica ha imapplicazioni portanti al di là della misura del rilascio intestinale peptide. Abbiamo dimostrato che le piccole colture intestinali primarie derivate da topi transgenici transgenici sono strumenti potenti per l'interrogazione dei segnali intracellulari accoppiati al budello secrezione peptide, usando per esempio il Ca 2+ e sensori cAMP, GCaMP3 11, 13 e Epac2camps 14, rispettivamente, nonché tecniche elettrofisiologiche 12.
Come con tutti i modelli in vitro, le colture primarie intestinali hanno certe limitazioni inerenti compresa la perdita di polarità delle cellule epiteliali in coltura, così come il mancato afflusso di sangue e innervazione. È difficile stimare gli impatti potenziali di queste condizioni artificiali sulla funzione cellulare enteroendocrine. Tuttavia, i dati ottenuti da colture primarie sono state spesso traslabile in vivo setting (ad esempio effetti degli acidi grassi a catena corta di GLP-1 secrezione 15).
Le colture primarie intestinali sono una tecnica versatile con molte applicazioni potenziali. Essi hanno già fornito importanti visione meccanicistica nella regolazione della secrezione intestinale peptide.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
GLP-1 immuno-test sono stati eseguiti dal Nucleo biochimica Laboratorio Analisi dell'Ospedale di Addenbrooke.
Questo lavoro ha, nel corso degli anni, è stato sostenuto dalla Wellcome Trust (attualmente sovvenzioni attivi 106262 / Z / 14 / Z e 106263 / Z / 14 / Z) e il Medical Research Council (MRC) (sovvenzioni MRC_MC_UU_12012 / 3 e MRC_MC_UU_12012 / 5).
Materiali
| Name | Company | Catalog Number | Comments |
| 24-well plates | Costar | 3524 | For secretion experiments |
| Bombesin | Sigma-Aldrich | B4272 | Positive control (calcium imaging experiment) |
| Centrifuge tubes, 15 mL, sterile | Greiner bio-one | 188261 | For tissue preperation/digestion |
| Centrifuge tubes, 50 mL, sterile | Corning | 430828 | For tissue preperation/ digestion |
| Collagenase XI (Crude) | Sigma-Aldrich | C9407 | For making up digestion medium |
| Dichroic mirror | Cairn Research | - | For imaging experiments |
| DMEM High glucose (4500 mg) | Sigma-Aldrich | D6546 | For dissolving matrigel (keep at 4 °C). For making up digestion medium, pre-warm to 37 °C. |
| Emission Filter (Bandwidth 510-560 nm) | Cairn Research | - | For imaging experiments |
| Foetal Bovine Serum | Sigma-Aldrich | F7524 | For making up culture medium |
| Forceps/Tweezers | Agar Scientific | AGT520 | For dissection/removal of intestine |
| Forskolin | Sigma-Aldrich | F6886 | Positive control (secretion experiment) |
| Glass-bottomed dishes (35 mm) | MatTek | P35G-0-14-C | For imaging experiments |
| High precision tweezer (110 mm) | IDEAL-TEK | 3480641 (5 SA) | For removing muscle layer |
| High resolution digital CCD camera | Hamamatsu | ORCA-ER | For imaging experiments |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I7018 | Positive control (secretion experiment) |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | For collecting tissue, keep on ice |
| L-glutamine | Sigma-Aldrich | G7513 | For making up culture medium |
| Matrigel | Corning | 354234 | Basement Membrane Matrix, for coating plates and dishes |
| MetaFluor | Molecular Devices (supplied by Cairn Research) | - | Fluorescence ratio imaging software |
| Mice (C57BL6) | Charles River Laboratories | C57BL/6J | Background mice used for breeding. Can also be used for secretion experiments |
| Mice (GLU-cre x ROSA26 GCaMP3) | in house | - | For calcium imaging and secretion experiments |
| Microscope (EVOS XL Core) | Thermo Fisher Scientific | AMEX1000 | For photomicrographs of cultures |
| Microscope | Olympus | IX71 | Inverted microscope with 40X oil objective used for imaging experiments |
| Monochromator | Cairn Research | - | For imaging experiments |
| Pasteur pipettes | Alpha Laboratories | LW4234 | For cleaning tissue |
| PBS containing Ca2+ and Mg2+ | Sigma-Aldrich | D8662 | For washing tissue, keep on ice |
| Penicillin & Streptomycin | Sigma-Aldrich | P0781 | For making up culture medium |
| Petri dishes (100 mm x 20 mm) | Corning | CLS430167 | For cleaning tissue and removing muscle layer |
| Potassium chloride | Fisher Scientific | P/4280/53 | Positive control (calcium imaging experiment) |
| Scissors | Agar Scientific | AGT554 | For dissection/removal of intestine |
| Sterile cell strainer 100 µm | Fisher Scientific | 22363549 | For filtering crypt cell suspension prior to plating |
| Surgical scalpel blade No.22 (sterile, stainless) | Swann Morton | 0308 | For dicing tissue |
| Syringe filters, Minisart NML (0.2 µm pore size) | Sartorius | 16534-K | For filter-sterilising collagenase solution (digestion medium) |
| Syringes, 20 mL, disposable, sterile, Luer slip | BD | 300613 | For filter-sterilising collagenase solution (digestion medium) |
| Xenon arc lamp 75W | Cairn Research | - | For imaging experiments |
| Y-27632 dihydrochloride | Tocris | 1254 | ROCK inhibitor, prepare 10 mM stock solution in sterile water (use 1:1,000 in final culture medium) |
Riferimenti
- Reimann, F., Habib, A. M., Tolhurst, G., Parker, H. E., Rogers, G. J., Gribble, F. M. Glucose sensing in L cells: A primary cell study. Cell Metab. 8, 532-539 (2008).
- Psichas, A., Reimann, F., Gribble, F. M. Gut chemosensing mechanisms. J Clin Invest. 125 (3), 908-917 (2015).
- Lovshin, J. A., Drucker, D. J. Incretin-based therapies for type 2 diabetes mellitus. Nat Rev Endocrinol. 5 (5), 262-269 (2009).
- Svendsen, B., Holst, J. J. Regulation of gut hormone secretion. Studies using isolated perfused intestines. Peptides. 77, 47-53 (2016).
- Kuhre, R. E., Frost, C. R., Svendsen, B., Holst, J. J. Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine. Diabetes. 64 (2), 370-382 (2015).
- Brighton, C. A., et al. Bile acids trigger GLP-1 release predominantly by accessing basolaterally located G protein-coupled bile acid receptors. Endocrinology. 156 (11), 3961-3970 (2015).
- Petersen, N., et al. Generation of L cells in mouse and human small intestine organoids. Diabetes. 63 (2), 410-420 (2014).
- Brubaker, P. L., Vranic, M. Fetal rat intestinal cells in monolayer culture: a new in vitro system to study the glucagon-like immunoreactive peptides. Endocrinology. 120 (5), 1976-1985 (1987).
- Kuhre, R. E., et al. Peptide production and secretion in GLUTag, NCI-H716, and STC-1 cells: a comparison to native L-cells. J Mol Endocrinol. 56 (3), 201-211 (2016).
- Gerbe, F., et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as new secretory cell type in the intestinal epithelium. J Cell Biol. 192 (5), 767-780 (2011).
- Pais, R., Gribble, F. M., Reimann, F. Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells. Peptides. 77, 9-15 (2016).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. J Physiol. 589 (Pt 5), 1081-1093 (2011).
- Emery, E. C., et al. Stimulation of GLP-1 secretion downstream of the ligand-gated ion channel TRPA1. Diabetes. 64 (4), 1202-1210 (2015).
- Psichas, A., Glass, L. L., Sharp, S. J., Reimann, F., Gribble, F. M. Galanin inhibits GLP-1 and GIP secretion via the GAL1 receptor in enteroendocrine L and K cells. Br J Pharmacol. 173 (5), 888-898 (2016).
- Tolhurst, G., et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via G-protein-coupled receptor FFAR2. Diabetes. 61 (2), 364-371 (2012).
- Richards, P., et al. High fat diet impairs the function of glucagon-like peptide-1 producing L-cells. Peptides. 77, 21-27 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol. 25 (6), 681-686 (2007).
- Parker, H. E., Habib, A. M., Rogers, G. J., Gribble, F. M., Reimann, F. Nutrient-dependent secretion of glucose-dependent insulinotropic polypeptide from primary murine K cells. Diabetologia. 52 (2), 289-298 (2009).
- Pais, R., Rievaj, J., Larraufie, P., Gribble, F. M., Reimann, F. Angiotensin II type 1 receptor-dependent GLP-1 and PYY secretion in mice and humans. Endocrinology. 157 (10), 3821-3831 (2016).
- Moss, C. E., et al. Somatostatin receptor 5 and cannabinoid receptor 1 activation inhibit secretion of glucose-dependent insulinotropic polypeptide from intestinal K cells in rodents. Diabetologia. 55 (11), 3094-3103 (2012).
- Habib, A. M., Richards, P., Rogers, G. J., Reimann, F., Gribble, F. M. Co-localisation and secretion of glucagon-like peptide 1 and peptide YY from primary cultured human L cells. Diabetologia. 56 (6), 1413-1416 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon