Method Article
장 내분비 세포의 굿 호르몬 분비의 연구 및 라이브 세포 이미징을위한 의도 된 쥐 소장의 혼합 차 문화
요약
이 프로토콜은 혼합 된 쥐의 소장 세포의 분리 및 문화에 대해 설명합니다. 이러한 기본 장 배양 기법들을 사용하여 장내 펩타이드 분비 하부 신호 전달 경로의 조사를 가능하게한다.
초록
창자는 위장 상피의 길이를 따라 위치한 호르몬을 분비하는 장 내분비 세포와 신체의 가장 큰 내분비 기관이다. 자신의 생리 학적 중요성에도 불구하고, 장 내분비 세포는 상피 세포 인구의 작은 부분을 대표하고 과거에, 그들의 특성은 세포주 모델에 의존의 결과로 상당한 도전을 선물했다. 여기, 우리는 혼합 된 쥐의 소장 세포의 분리 및 문화에 대한 자세한 프로토콜을 제공합니다. 이러한 차 배양 영양분과 신경 펩티드의 수에 응답뿐만 아니라 약리학 적 제제의 자극 및 장내 펩타이드 분비의 억제를 기초가 신호 경로를 식별하는데 사용되었다. 또한, 형질 전환 형광 기자 마우스의 사용과 함께, 우리는이 차 문화가에서의 찬란 - 태그 장 내분비 세포의 시험을위한 강력한 도구가 될 것을 증명하고있다이러한 패치 클램프 및 단일 셀 칼슘과 캠프 FRET 촬상 같은 방법을 사용하여 레벨 tracellular.
서문
이 방법의 전반적인 목표는 장내 펩타이드 분비와 장 내분비 세포의 라이브 세포 이미징 연구를 가능하게 격리하고 문화 혼합 된 쥐의 장 세포입니다. 이 절차의 초기 버전은 원래 차원의 시공 등의 알에 의해 2008 년에 출판되었다. 1 이후 우리 그룹으로부터 추가의 20 출판물의 기초를 형성하고있다. 이 원고를 들어, 우리는 그들이 결장 문화보다 확립하는 것이 더 어려운만큼 소장 문화에 집중하기로 결정했습니다.
장 내분비 세포는 글루카곤 유사 펩타이드 1 (GLP-1), 글루코스 - 의존성 (GIP) 펩티드 인슐린, 콜레시스토키닌 (CCK) 및 펩타이드 YY (PYY) 2를 포함한 장내 펩타이드 어레이를 분비한다. 이 장 펩타이드는 장내 교통, 포도당 자극 인슐린 분비와 포만감 유도의 증강의 둔화로 식후 응답을 조율 중요한 생리적 역할을합니다. GLP-1 유사체ND의 열화를 억제하는 약물은 현재 제 2 형 당뇨병의 치료를 위해 허가 된이 펩티드 3의 내인성 분비 자극의 치료 가능성을 지속적으로 평가가있다. 장 내분비 생리학의 이해 및 분비를 자극하거나 억제된다 중 하나되는 메커니즘은 매우 중요합니다, 따라서이다.
펩타이드 분비 시험 관내 및 생체 외 실험 모델 장단점 각각의 다양한 사용하여 조사 될 수 거트 (또한 생체 모델의 사용을 다루는 포괄적 최근 검토 SVENDSEN 외. (4) 참조). 예컨대 절연 관류 부위 Ussing 챔버 (5) 및 (6)와 같은 생체 외 기술은 현재 다양한 물질에 응답 장내 펩타이드 분비를 탐색하는 데 사용되고있다. 이 방법의 주요 장점, 등차 문화 비교, 장 내분비 세포의 즉각적인 환경이 대부분 그대로 남아 있고 중요한 것은, 세포의 극성이 보존된다는 점이다. 그러므로, 6 분비에 작용하는 세포 표면에 관한 정보를 유도 할 수있다. 그러나 이러한 일반적으로 낮은 처리량 기술하고 그들로부터 파생 된 데이터의 품질은 필연적으로 시간이 지남에 따라 감소 장 조직의 무결성과 생존 능력에 크게 의존하고있다.
장내 organoids는 이제 점점 장 내분비 세포의 기능 및 개발 (7)의 연구를 위해 체외 모델로 사용되고있다. 뮤린 및 인간 조직 모두로부터 유도 될 수 Organoids는 배양 세포의 극성을 유지 3D '토굴 형'구조를 형성하는 이점이있다. 그러나, 유사 장기 유래의 장 내분비 세포는 아직 완전히 특성화 될 필요 네이티브 L CEL의 그들의 유사성LS는 거의 알려져 있지 않다. 장 내분비 세포 유지하며 장시간 인공 조건에서 분화되지 않으므로 차 배양은 다가간 생리 설정하는되는 장점이있다.
장내 펩타이드 분비의 평가에 사용 된 또 다른 기본 배양법은 태아 래트 장 세포 (FRICs) (8)의 분리이다. 그러나, 성인 장 조직의 문화는 작은 성공을 만났다과 약간의 차이가 FRICs 대 성인 쥐의 장 세포 (예를 들어, 포도당 8)의 응답에서 관찰되었다.
장 내분비 같은 세포주 (예 GLUTag, STC-1 및 NCI-H716)는 전통적으로 대 직접 구별하기 위해 사용되어왔다. 간접적 인 효과 장 내분비 세포와 분비 자극을 연결하는 기본 분자 메커니즘을 해부; 참조 Kuhre 외 . 'L 세포 형 "불멸화 세포주 펩티드 생산과 분비 9. 이 위장관을 따라 흩어져 장 내분비 세포와 같은 필요가 있었다, 단지 장내 상피 세포 (10)와 정렬 된 세포의 1 % 미만, 우리 손에, 문화 1에서 생존하지 않습니다 구성한다. 셀 라인은 같은 유전자 침묵 등의 유전자 조작에 도움이 크게 균일 한 세포 집단이라는 사실 때문에 유용한 도구가 남아있다. 결과적으로, 트랜스 제닉 마우스를 사용할 수없는 경우, 약리학 적으로 타겟팅 할 수없는 단백질의 역할을 조사하기 쉽다. 그러나 세포주는 항상 일차 전지의 유효 모델이 아니다. 많은 유사점, 경우에 GLUTag 세포에 비해 차 L 세포에서 특정 영양소에 의해 활성화 된 신호 전달 경로의 차이를 강조 차 문화의 연구 결과가 있지만, 예를 들어 (예. 펩톤 11). 결정적으로, 형질 전환 형광 리포터 생쥐와 함께 일차 배양 모델은 세포 수준에서 개별 기본 장 내분비 세포의 상세한 검사를 가능하게한다. 차 배양 내의 형광 태그 L 세포 패치 칼슘 11, 13 및 환상 아데노신 모노 포스페이트-FRET 촬상 장 내분비 분야에서 상당한 발전을 수득 한 14 개 연구, 1, 12 개 연구 및 단일 셀을 클램핑 우리 그룹에서 사용 된 생리학.
다음 프로토콜은 하나의 성체 마우스의 소장 10cm의 부분에서, 분비 실험을 수행하는 24 웰 플레이트를 이용하여 또는 최대 16 개 촬상 음식의 준비를 위해 최적화된다. 이 프로토콜은 쉽게 소화 시간과 협력을 증가시켜 대장 세포의 연구를 위해 수정 될 수있다llagenase 농도.
프로토콜
모든 동물의 절차는 캠브리지 동물 복지의 대학과 윤리 심사 기관의 승인 (과학적인 절차) 법 1986 개정 규정 (SI 3,039분의 2,012)을 동물을 본했다.
1. 사전 준비
- 해동 얼음 기저막 매트릭스의 분취 량 (BMM) (~ 200 μL)를 놓는다.
참고 : BMM은 실온 (RT)에서 굳은. - 사전 따뜻한 50 ㎖ 멸균 높은 글루코스 둘 베코 변형 이글 중간 (DMEM) (NO 추가로) 및 ~ 10 % 태아 소 혈청 (FBS가 보충 된 40 mL의 멸균 배지 (고 글루코스 DMEM), 100 U / ㎖ 페니실린 및 0.1 ㎎ / ㎖ 스트렙토 마이신 (P / S), O 및 37 ℃에서 수욕에서 50 개 ㎖ 원심 분리 튜브에 2 mM의 L- 글루타민)
- 사전 냉각 칼슘과 마그네슘 함유 인산염 완충 식염수 (PBS)를.
- 15 mg의 콜라게나 제 (XI의 조)를 달아, 50 mL의 원심 분리 관에 추가하고 얼음에 보관.
- 주의 : 콜라게나 제는 유해한이다. 그것은 피부 자극 (H315)와 눈에 심한 자극 (H319)를 야기한다. (H334) 흡입시는 알레르기 성 반응, 천식 또는 호흡 곤란을 일으킬 수 있습니다. 그것은 호흡기 자극 (H335)를 일으킬 수 있습니다. 적절한 개인 보호 장비를 사용하여 분진 형성을 방지하고 분진을 흡입하지 마십시오. 적절한 환기를 확인합니다.
2. 조직 컬렉션
- 50 ML의 원심 분리기 튜브에 ~ 20 mL의 L-15 매체를 추가하고 얼음에 놓습니다.
- 자궁 전위, 또는 기타 승인 된 일정 한 방법으로 마우스를 안락사.
참고 : 창자 조직은 일반적으로 C57BL6 배경에 생쥐에서 얻을 수있다. 그러나 다른 유전 적 배경도 129 / SvEv 15 예를 들어, 사용되어왔다. 이미징 실험은 예를 들어, 형광 리포터 생쥐 사용 GLU 금성-1를 필요로한다. 조직은 남녀의 성인 마우스 (2~6개월)에서 얻을 수있다. 생쥐는 individua에 보관되어물과 일반 차우에 광고 임의로 액세스 할 수있는 새장을 에서야 환기. 프로젝트 라이센스에 의해 지원되는 경우, 실험 장 내분비 세포의 기능 (16)에, 예를 들어, 고지방 다이어트의 효과를 테스트하기 위해 수행 할 수 있습니다. - 해부 부드럽게 포셉 및 해부 가위를 사용하여 (직장 시작으로 유문부에서) 마우스 소장을 제거합니다. 사용할 준비가 될 때까지 얼음에 L-15 매체에 보관.
3. 티슈 제조
- 조직을 충당하기 위해 충분한 PBS를 포함하는 10cm 페트리 접시에 장 조직을 놓습니다. (유문 원위부 예 상부 소장 상부 10cm) 원하는 조직을 10cm.
- 플라스틱 파스퇴르 피펫 및 냉장 PBS를 사용하여 장 내용을 플래시합니다.
- 섬세 그립, 장 세그먼트의 한쪽 끝을 집게를 사용하고 그것으로 파스퇴르 피펫의 팁을 배치합니다. 냉장 PBS와 내용을 플래시합니다. majo 때까지 양쪽 끝에서 반복내용의 RITY는 플러시되고있다. 신선한 냉장 PBS를 포함하는 깨끗한 페트리 접시에 전송합니다.
- 집게를 사용하여 동시에 근육 층을 끌어하지 않도록주의하면서, 지방 조직 및 장간막을 제거합니다.
- 껍질은 근육이 미세 집게 두 세트를 사용하여 해부 현미경 "양말처럼"오프 층.
참고 :이 단계는 필수는 아니지만 것이 좋습니다. 여기에 설명 된 것과 근육 층을 제거하는 다른 방법이있다. 예를 들면, 소장 전에 근육 층의 제거, 세로 제 절개 될 수있다.- 근육의 볼 플랩이있는 경우 조직의 더 근위 끝에 출발점을 찾을 수 있습니다. 부드럽게 장 주변 모든 방법 근육 층의 작은 금액을 당깁니다.
주 : 근육층 또는 장내 상피의 찢어짐을 방지하기 위해 더 큰 표면적을 클램핑보다는 t를 사용하여 장력을 감소미세 집게의 IPS. - 소장 가능한 근육 플랩만큼 클램프, 부드럽게 떨어져 당겨 장 주변의 근육 층을 벗겨 시작합니다. 근육 층과 상피 모두가 찢어지지 않도록하기 위해, 그들을 가깝게 유지하기 위해 집게의 위치를 재조정 유지한다. 이러한 방식으로, 장 구간 및 폐기의 전체 길이에서 근육 층을 제거한다.
- 근육의 볼 플랩이있는 경우 조직의 더 근위 끝에 출발점을 찾을 수 있습니다. 부드럽게 장 주변 모든 방법 근육 층의 작은 금액을 당깁니다.
- 열린 세로 장을 잘라 신선한 냉장 PBS와 깨끗한 페트리 접시에 소용돌이로 씻는다. 필요한 경우 남아있는 유미 즙이나 점액을 제거하기 위해 반복합니다.
- 외과 용 메스 블레이드 말하다 조직 ~ 1-2 ㎜ × 2의 사각형을 달성하고 20 ml의 파스퇴르 피펫을 사용하여 50 mL의 원심 분리 튜브에 냉장 PBS ~ 이러한 추가한다. 피펫을 고수 조직 조각을 피하기 끝을 잘라 PBS로 분쇄하여하여 피펫을 젖은합니다.
- 부드럽게 상기 조직편을 세척 튜브를 흔들어. 조직이 정착 붓거나 P 허용PBS를의 대부분을 ipette하고 PBS 분명 모습이 될 때까지 신선한 PBS로 반복합니다.
BBM 코팅 플레이트 / 요리와 소화 중간 4. 준비
참고 : 다음 단계 (37 ℃ 수조에서 항온 처리 단계)와 조직 배양 후드에서 수행되어야한다.
- (아무 추가로) 냉장 DMEM에서 2 % BMM 솔루션을 준비합니다. 작업하는 동안, 얼음 솔루션을 유지한다. 2 % 용액의 경우, 추가 140 μL 7 mL의 DMEM (충분히 단일 24- 웰 플레이트를 제조)에 BMM 해동.
- 250 μL를 BMM 2 % 용액을 웰당 (24- 웰 플레이트) 또는 촬상 유리 바닥 접시 당 추가.
- BMM 적절한 중합 있도록 37 ℃의 배양기에서 적어도 30 분 동안 코팅 된 플레이트 / 접시 부화.
- 0.3 ㎎ / ㎖의 용액을 형성하고 용해 반전 (단계 1.2와 1.4)에서 15 mg의 콜라게나로 (NO 추가 제공) 50 ㎖의 미리 가온 DMEM 추가.
- 에CE는 완전히 20 ㎖ 주사기를 사용하여 용해하고, 새로운 멸균 50 ㎖ 원심 분리 튜브에 0.2 ㎛의 멸균 필터를 통해 콜라게나 제 용액을 필터. 소화 매체로이 레이블.
5. 조직 소화
- 10 ㎖의 혈청 피펫을 사용하여 PBS에서 조직 조각을 제거하고 멸균 된 50 mL의 원심 분리 (NO 추가로) 냉각 멸균 DMEM을 함유하는 튜브, 소용돌이에 추가 한 후 DMEM을 제거한다.
참고 : 혈청 학적 피펫을 고수 조직을 방지 조직과 접촉하기 전에 DMEM로 분쇄하여 젖은합니다. - "다이제스트"1, 2 : 세포 파편 및 단일 세포를 제거하여
- 조직의 조각 7 ML의 소화 매체를 추가하고 관에게 소용돌이를 제공합니다.
- 37 ℃ 수욕에서 5 분 동안 인큐베이션.
- 부드럽게 (소용돌이하지 않음) ~ 3 초 동안 튜브를 흔들.
- 을 예약, 조직이 소화 매체를 정착 폐기 할 수 있도록 허용작은 볼륨은 현미경으로 볼 수 있습니다.
참고 : 밖으로 시작할 때 특히,이 매우 소화 과정의 진행 상황을 측정하기 위해 현미경으로 각각 '소화'(~ 30 μL)의 작은 볼륨을 검사하는 것이 좋습니다. 많은 지하실은이 단계에서 관찰하는 경우, 흔들림도 활발한 할 수있다. 다른 '요약'단계는 일반적으로 어떻게 생겼는지의 대표 이미지의 경우 그림 1 참조. - (신선한 소화 매체와) 단계를 반복 5.2.-5.2.4.
- '다이제스트'3 ~ 5 : 토굴 조각의 컬렉션
- 조직에 7 ML의 소화 매체를 추가합니다.
- 37 ° C에서 10 분 동안 인큐베이션.
- 배양하는 동안, 10 ~ 12 초 동안 5 분마다 흔들어.
주 : 진동 더 격렬하다 진탕보다 '다이제스트'1, 2.
- 배양하는 동안, 10 ~ 12 초 동안 5 분마다 흔들어.
- 소화 조직을 15 mL의 원심 분리 튜브 내의 소화 매체가 정착 수집하도록 허용. 만약조직 실수 매체와 함께 그것이 해결 10 ㎖의 혈청 피펫을 사용하여 제거하고 소화 조직을 함유하는 50 mL의 원심 분리 튜브에 다시 전송할 수 수집된다.
- 원심 분리는 100 × g에서 3 분 동안 RT에서 매체 / 상등액을 모았다.
- 상층 액을 제거하고 부드럽게 분쇄하여 별도로하여 5 ㎖의 미리 가온 된 배지에서 세포 펠렛을 다시 일시.
- 현미경으로 세포 현탁액의 소량을 검사한다 (단계 5.2.4에서 참고 참조).
참고 : 이상적으로, 토굴 조각 세포 파편 및 단일 세포와 함께 3 '소화'를에 나타나기 시작. '다이제스트'4 및도 5는 감소 된 세포 파편과 토굴 단편 훨씬 더 많은 수를 포함하는 (도 1). 티슈는 소화되지 않고 토굴 단편보다 강하게 흔들어 표시되지 않는 경우, 즉 필요한 강도를 조정 진탕. - 단계를 반복 5.3.1-5.3.6 5까지 '소화'는 있었다완료 또는 조직의 대부분이 소화 될 때까지 (6 번째 다이제스트가 요구 될 수있다).
- 일단 '다이제스트'3-5 (또는 3-6) 수집 된 원심 모든 상청액 100 × g에서 3 분 동안 RT에서 상청액 다이제스트.
- 분비 실험은 '소화'3-5 (또는 3-6) 이전 원심에서 상층 액을 결합한다.
주 : 조직이 덜하므로 토굴 단편의 수가 많은 깨끗 (세포 파편과 단셀의 유무)은 다이제스트 상등액을 선택 촬상 실험이 필요하다. 이는 전형적으로 4 또는 5 '요약'. - 뜨는을 취소하고 부드럽게 더 덩어리가 보이지 않을 때까지 분쇄하여하여 펠렛을 다시 일시 중지합니다. 다시 일시 10 μM Y-27632 염산염 보충 된 예비 가온 된 배지에서 펠릿 (17 anoikis 방지). 분비 실험 및 이미징 실험 2ml의 배지 5 ㎖의 사용.
- 필터100 μm의 필터를 통해 세포 현탁액 (모든 소화 조직을 제거하기 위해). (: 각각 분비 이미징 7㎖를 4 mL의 총량)을 세척하기 위해 필터를 통해 예열 된 배양 배지의 또 2ml를 실행.
참고 : 필터링이 필수적인 것은 아니다, 그러나, 더 큰 조직 조각이 판 / 요리 준수하지 않는 경향이있다.
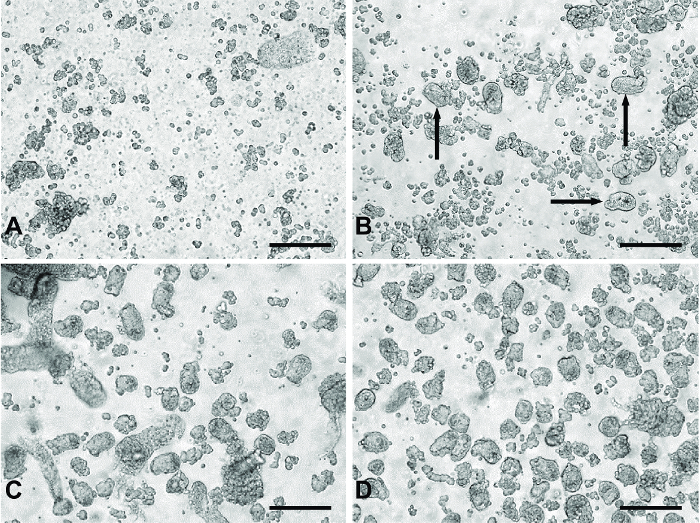
도 1 : 기본 소장 배양법에서 '다이제스트'의 대표적인 이미지. (A) '다이제스트'1과 2는 주로 단일 세포 및 세포 파편을 포함에서 전형적인 재료. (B) 흑색 화살표 3. '요약'에서 제품의 예는 소화 물질에 나타나는 토굴 단편을 나타낸다. 대표적인 (C)는 제 4 패널 (D)의 자료를 요약 풀링 나타내고 '요약''다이제스트'3-5 (C)에서 볼 수있는 큰 원치 않는 조직 파편을 제거하기 위해 100 ㎛의 필터를 통해 통과시켰다. 모든 이미지는 20 배 목표와 디지털 거꾸로 현미경을 사용하여 촬영되었다. 스케일 바는 100 ㎛, =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 도금 소장 배양 (크립트 세포 농축)
- 플레이트 접시에서 BMM 과잉 용액을 제거하고 웰 당 250 μL 분비 예열 배양 배지를 추가한다.
참고 : 이미징 요리는 매우 신속하게 다음 단계로 진행 마르지 요리를 방지하기 위해 매체 않고 남아 있습니다. - 플레이트 250 μL 세포 현탁액을 웰당 (24- 웰 플레이트) 또는 유리 바닥 접시 당.
- 플레이트 드롭 현명 잘 걸쳐 천천히 '지그재그'움직임이다. 토굴 단편 1~ 플레이트를 이동하기 전에 ~ 5 분 동안 정치 허용E 배양기.
참고 :이 잘 내 지하실 / 세포의 고른 분포를 장려해야한다.
- 플레이트 드롭 현명 잘 걸쳐 천천히 '지그재그'움직임이다. 토굴 단편 1~ 플레이트를 이동하기 전에 ~ 5 분 동안 정치 허용E 배양기.
- 플레이트 접시 밤새 37 ℃ 및 5 % CO 2 부화.
참고 : A '누덕 누덕 기운'단층을 형성해야합니다. 세 세척 다음 문화의 대표적인 이미지를 들어,도 2a 참조. - 접시 당 2ml의 사전 예열 배양액 '홍수'촬상 요리.
참고 : ~ 72 시간까지 도금을 다음과 같은 사항에 대해이 요리 이미지에 적합합니다. 대장 문화는 일반적으로 최대 7 일, 마지막으로 더 이상. 부착되지 않은 세포는 세척 공정에 의해 제거 될 수있다. 차 문화는 이제 실험에 사용 될 준비가 된 것입니다.
결과
직렬 분해 단계를 사용 토굴 단편 비교적 깨끗한 제조 컬렉션 실험에 도금 될 수있다. 처음 두 다이제스트가 소화 물질 (도 1a)에서 주로 단일 세포 및 세포 찌꺼기를 제거한다. 제 다이제스트 동안 토굴 단편 소화 재료 (도 1B)에 나타난다. 적은 단 전지 (도 1C)와 토굴 조각 (4, 5)의 수율보다 많은 소화. 3-5 클린 토굴 단편 준비 (도 1D)의 제조 배양에 해로울 수있다 소화 조직의 큰 조각을 제거한다 다이제스트로부터 풀링 된 물질을 여과하는 단계를 포함하는 방법.
18-24 시간 배양 이후, 주 소장 세포의 단층 (도 2A)를 관찰한다. 구체적으로는 칼을 나타내는 트랜스 제닉 마우스에서 생성 된 배양 물을 사용하여cium 형광 센서는 GCaMP3는 proglucagon 촉진제 (11)의 제어하에 L 세포는 쉽게 식별 배양 (도 2b) 내에 산재되어있다. 일차 배양 소장에서, 화합물은 G Q -CA 타겟팅 2+ I 캠프 내가 경로는 GLP-1의 분비를 자극 의존성 (분비 실험 방법론 차원의 시공 등. 1 참조). 봄베 신 (BBS, 100 ㎚) 및 포스 콜린, 3- 이소 부틸 -1- 메틸 크 (IBMX)의 공동 프로그램 (F / I는 10 μM 각각)에 GLP-1 방출 상대의 2-, 11 배, 자극을 촉발 기저 각각 (도 2C). GCaMP3의 구체적인 L 세포 발현의 식별 및 개별 L 세포에서 칼슘 동원의 실시간 모니터링을 허용한다. 모두 100 나노 봄베 신 (BBS), 30 mM의 염화칼륨 (KCl을)은 공지의 G Q 나타내는 세포 내 칼슘의 일시적 증가를 자극 </ 서브> - 기본 및 L 세포 (도 2D)에 결합 된 경로 electrogenic.
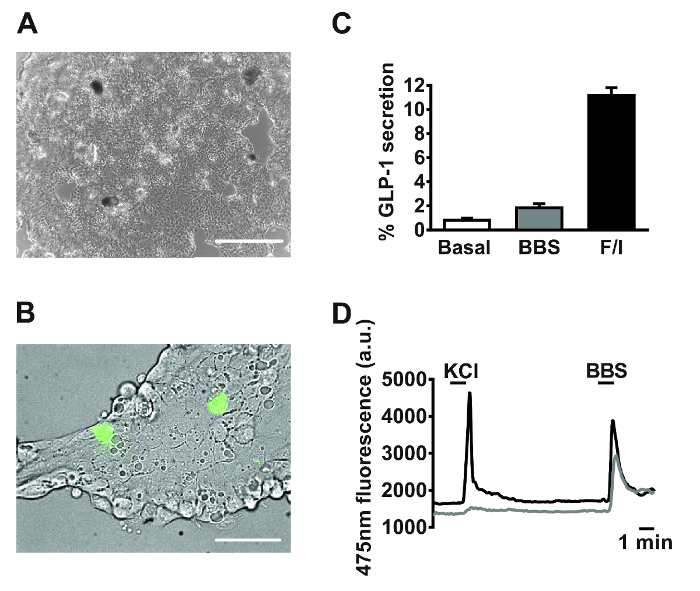
도 2 차 배양 소장 유래의 대표적인 데이터. (A) 분비 및 (B) 화상 실험에 사용되는 혼합 된 기본 소장 배양 예 화상을 24 시간 도금을 게시. (A)는 4 배속 영상 목적으로 디지털 도립 현미경을 이용하여 24 웰 플레이트에서 수행. 스케일 바 = 500㎛ 인. GLU-Cre 호텔 사용 (B)는 볼 (녹색 셀)의 필드 ROSA26 GCamP3 마우스, L 세포를 X는 GCaMP3의 형광에 의하여 확인되었다. 스케일 바는 50㎛의 나타낸다. (F / I, 각각 10 μM) (C) GLP-1 분비 (BBS, 100 나노 미터) 봄베 신에 응답하여 측정하고, 포스 콜린 / 3- 이소 부틸 -1- 메틸 크 (IBMX). 백분율 GLP-1 분비를 계산 하였다상청액 및 세포 용 해물에서 GLP-1 수준을 측정함으로써. 데이터는 각각의 조건에 대한 N = 3 ± SEM 수단을 나타낸다. (D), 염화칼륨 (KCl을 30 mM의) 및 BBS (100 ㎚)에 대응하여 실시간으로 모니터링 (B)에서 설명하는 두 개의 셀 (사이토 졸 칼슘 반사) GCaMP3 형광. 단일 세포 이미징은 40X 오일 침지 목적으로 반전 된 형광 현미경을 사용하여 수행 하였다. GCaMP3은 75 W 크세논 아크 램프 및 형광 이미징 소프트웨어에 의해 제어되는 단색화 장치를 사용 10분의 475 ㎚에 흥분했다. 방출은 다이크로 익 미러와 510-560 nm의 대역 필터를 이용하는 고해상도 디지털 전하 결합 소자 (CCD) 카메라로 기록 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 장내 펩타이드 분비 및 표시 장 내분비 세포의 단일 세포 이미징 연구를 가능하게 혼합 된 쥐의 소장 세포의 분리 및 문화에 대해 설명합니다.
작은 창자 배양에 성공되는 가능성을 증가시키기 위해, 상기 프로토콜은 (조직을 적출 3 시간 이내, 이상적으로는)로서 신속 가능한 실시되어 있고 티슈 빙냉 매체에 보존되어 있는지 또는 선행 버퍼 중요 소화 과정, 세포 죽음을 제한합니다. 그것은 특히 결장 문화에 대한이 아닌 필수이지만, 소장에서 근육 층의 제거를 강력히 권장합니다. 작은 창자 문화 프로토콜은 최대한 표준화하고있다. 그러나, 더 소화 과정이 동일 없다는 것을 주목하는 것이 중요하다. 변화는 근육 제거의 정도 예를 들어 일상적으로 도입 될 수이 프로토콜 동안 많은 단계는 t의 크기가 있습니다그 진동의 강도, 콜라겐 등의 특정 배치의 효능을 조직편을 '다진'. 그것은 소화 과정과 맞춤형 흔들림의 진행과 '소화'따라의 수를 평가하기 위해 현미경으로 '소화'서로 다른 각각의 분획을 검사하기 위해 매우 중요하므로입니다. 토굴의 조각에서 명확하지 않은 경우가로 시작하는 것이 더 부드럽게 흔들 권장하고 더 적극적으로 흔들어 시작, 이후 3 '소화'.
우리의 경험에서, 장 내분비 세포 배양 증식하지 않고 보통 사일 내에 소장 문화에서 손실됩니다. 그러나,이 장내 펩타이드 분비 실험을 수행 할 충분한 시간이 생리적 자극 및 / 또는 약리학 적 제제를 테스트하기 위해 (일반적으로 2 시간, 18-24 시간 후 도금 위에 행할) 수있다. 분비 실험 이전에 하룻밤 배양을 필요로하는 실험도 가능 예입니다백일해 독소 15 전처리의 경우이다.
그것은 지난 몇 년 동안 생산하고있다 연구 출력의 볼륨에 의해 입증 여기에 제시된 주 문화 기술은 잘 확립 된 방법이다. 초대 배양 모델은 다양한 영양소 및 비 영양 (14), (20 개)의 자극 및 억제에 응답하여, GLP-1, GIP 18 PYY (19)를 포함한 장내 펩타이드의 다양한 분비를 연구하기 위해 사용되었다. 또한, 동일한 기술이 성공적 인간 장 세포 (21)의 배양에 적용되었다. 종종, 추가 실험 모델의 예와 함께 차 세포 배양 방법의 조합. 생체 나 생체 내에서 가장 통찰력 (6)을 제공 할 수 있습니다. 특히 다른 방법과 달리,이 기술은 IM을 갖는다장내 펩타이드 자료의 측정을 넘어 portant 응용 프로그램. 우리는 각각 예를 들어 사용하는 칼슘 및 캠프 센서 GCaMP3 11, 13 Epac2camps 14, 트랜스 제닉 리포터 생쥐 유래의 기본 소장 배양 펩타이드 분비 직감 결합 세포 내 신호 전달 경로의 심문위한 강력한 툴이라는 것을 증명 뿐만 아니라, 전기 생리 학적 방법 (12).
모든 시험관 모델과 마찬가지로, 기본 장 문화는 문화의 상피 세포의 극성의 손실뿐만 아니라 혈액 공급과 신경 분포의 손실을 포함하여 특정 고유 한 한계가있다. 이 장 내분비 세포 기능에 이러한 인공 조건의 잠재적 영향을 평가하기는 어렵다. 그러나, 일차 배양에서 얻은 정보는 종종 생체 내에서 병진 setti왔다NG (GLP-1 분비 15 단쇄 지방산의 영향 예).
차 장 문화는 많은 잠재적 인 응용 프로그램과 다재 다능 한 기술이다. 그들은 이미 장내 펩타이드 분비의 조절에 중요한 기계론의 통찰력을 제공하고 있습니다.
공개
저자가 공개하는 게 없다.
감사의 말
GLP-1 면역 분석법 Addenbrooke 병원에서 코어 분석법 생물 실험실에서 수행 하였다.
이 작품은, 수년에 걸쳐, 웰컴 트러스트 (Wellcome Trust)에 의해 지원되었다 (현재 활성화 된 보조금 106262 / Z / 14 / Z 및 106,263 / Z / 14 / Z)과 의학 연구위원회 (MRC) (보조금 MRC_MC_UU_12012 / 3 및 MRC_MC_UU_12012 / 5).
자료
| Name | Company | Catalog Number | Comments |
| 24-well plates | Costar | 3524 | For secretion experiments |
| Bombesin | Sigma-Aldrich | B4272 | Positive control (calcium imaging experiment) |
| Centrifuge tubes, 15 mL, sterile | Greiner bio-one | 188261 | For tissue preperation/digestion |
| Centrifuge tubes, 50 mL, sterile | Corning | 430828 | For tissue preperation/ digestion |
| Collagenase XI (Crude) | Sigma-Aldrich | C9407 | For making up digestion medium |
| Dichroic mirror | Cairn Research | - | For imaging experiments |
| DMEM High glucose (4500 mg) | Sigma-Aldrich | D6546 | For dissolving matrigel (keep at 4 °C). For making up digestion medium, pre-warm to 37 °C. |
| Emission Filter (Bandwidth 510-560 nm) | Cairn Research | - | For imaging experiments |
| Foetal Bovine Serum | Sigma-Aldrich | F7524 | For making up culture medium |
| Forceps/Tweezers | Agar Scientific | AGT520 | For dissection/removal of intestine |
| Forskolin | Sigma-Aldrich | F6886 | Positive control (secretion experiment) |
| Glass-bottomed dishes (35 mm) | MatTek | P35G-0-14-C | For imaging experiments |
| High precision tweezer (110 mm) | IDEAL-TEK | 3480641 (5 SA) | For removing muscle layer |
| High resolution digital CCD camera | Hamamatsu | ORCA-ER | For imaging experiments |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I7018 | Positive control (secretion experiment) |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | For collecting tissue, keep on ice |
| L-glutamine | Sigma-Aldrich | G7513 | For making up culture medium |
| Matrigel | Corning | 354234 | Basement Membrane Matrix, for coating plates and dishes |
| MetaFluor | Molecular Devices (supplied by Cairn Research) | - | Fluorescence ratio imaging software |
| Mice (C57BL6) | Charles River Laboratories | C57BL/6J | Background mice used for breeding. Can also be used for secretion experiments |
| Mice (GLU-cre x ROSA26 GCaMP3) | in house | - | For calcium imaging and secretion experiments |
| Microscope (EVOS XL Core) | Thermo Fisher Scientific | AMEX1000 | For photomicrographs of cultures |
| Microscope | Olympus | IX71 | Inverted microscope with 40X oil objective used for imaging experiments |
| Monochromator | Cairn Research | - | For imaging experiments |
| Pasteur pipettes | Alpha Laboratories | LW4234 | For cleaning tissue |
| PBS containing Ca2+ and Mg2+ | Sigma-Aldrich | D8662 | For washing tissue, keep on ice |
| Penicillin & Streptomycin | Sigma-Aldrich | P0781 | For making up culture medium |
| Petri dishes (100 mm x 20 mm) | Corning | CLS430167 | For cleaning tissue and removing muscle layer |
| Potassium chloride | Fisher Scientific | P/4280/53 | Positive control (calcium imaging experiment) |
| Scissors | Agar Scientific | AGT554 | For dissection/removal of intestine |
| Sterile cell strainer 100 µm | Fisher Scientific | 22363549 | For filtering crypt cell suspension prior to plating |
| Surgical scalpel blade No.22 (sterile, stainless) | Swann Morton | 0308 | For dicing tissue |
| Syringe filters, Minisart NML (0.2 µm pore size) | Sartorius | 16534-K | For filter-sterilising collagenase solution (digestion medium) |
| Syringes, 20 mL, disposable, sterile, Luer slip | BD | 300613 | For filter-sterilising collagenase solution (digestion medium) |
| Xenon arc lamp 75W | Cairn Research | - | For imaging experiments |
| Y-27632 dihydrochloride | Tocris | 1254 | ROCK inhibitor, prepare 10 mM stock solution in sterile water (use 1:1,000 in final culture medium) |
참고문헌
- Reimann, F., Habib, A. M., Tolhurst, G., Parker, H. E., Rogers, G. J., Gribble, F. M. Glucose sensing in L cells: A primary cell study. Cell Metab. 8, 532-539 (2008).
- Psichas, A., Reimann, F., Gribble, F. M. Gut chemosensing mechanisms. J Clin Invest. 125 (3), 908-917 (2015).
- Lovshin, J. A., Drucker, D. J. Incretin-based therapies for type 2 diabetes mellitus. Nat Rev Endocrinol. 5 (5), 262-269 (2009).
- Svendsen, B., Holst, J. J. Regulation of gut hormone secretion. Studies using isolated perfused intestines. Peptides. 77, 47-53 (2016).
- Kuhre, R. E., Frost, C. R., Svendsen, B., Holst, J. J. Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine. Diabetes. 64 (2), 370-382 (2015).
- Brighton, C. A., et al. Bile acids trigger GLP-1 release predominantly by accessing basolaterally located G protein-coupled bile acid receptors. Endocrinology. 156 (11), 3961-3970 (2015).
- Petersen, N., et al. Generation of L cells in mouse and human small intestine organoids. Diabetes. 63 (2), 410-420 (2014).
- Brubaker, P. L., Vranic, M. Fetal rat intestinal cells in monolayer culture: a new in vitro system to study the glucagon-like immunoreactive peptides. Endocrinology. 120 (5), 1976-1985 (1987).
- Kuhre, R. E., et al. Peptide production and secretion in GLUTag, NCI-H716, and STC-1 cells: a comparison to native L-cells. J Mol Endocrinol. 56 (3), 201-211 (2016).
- Gerbe, F., et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as new secretory cell type in the intestinal epithelium. J Cell Biol. 192 (5), 767-780 (2011).
- Pais, R., Gribble, F. M., Reimann, F. Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells. Peptides. 77, 9-15 (2016).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. J Physiol. 589 (Pt 5), 1081-1093 (2011).
- Emery, E. C., et al. Stimulation of GLP-1 secretion downstream of the ligand-gated ion channel TRPA1. Diabetes. 64 (4), 1202-1210 (2015).
- Psichas, A., Glass, L. L., Sharp, S. J., Reimann, F., Gribble, F. M. Galanin inhibits GLP-1 and GIP secretion via the GAL1 receptor in enteroendocrine L and K cells. Br J Pharmacol. 173 (5), 888-898 (2016).
- Tolhurst, G., et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via G-protein-coupled receptor FFAR2. Diabetes. 61 (2), 364-371 (2012).
- Richards, P., et al. High fat diet impairs the function of glucagon-like peptide-1 producing L-cells. Peptides. 77, 21-27 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol. 25 (6), 681-686 (2007).
- Parker, H. E., Habib, A. M., Rogers, G. J., Gribble, F. M., Reimann, F. Nutrient-dependent secretion of glucose-dependent insulinotropic polypeptide from primary murine K cells. Diabetologia. 52 (2), 289-298 (2009).
- Pais, R., Rievaj, J., Larraufie, P., Gribble, F. M., Reimann, F. Angiotensin II type 1 receptor-dependent GLP-1 and PYY secretion in mice and humans. Endocrinology. 157 (10), 3821-3831 (2016).
- Moss, C. E., et al. Somatostatin receptor 5 and cannabinoid receptor 1 activation inhibit secretion of glucose-dependent insulinotropic polypeptide from intestinal K cells in rodents. Diabetologia. 55 (11), 3094-3103 (2012).
- Habib, A. M., Richards, P., Rogers, G. J., Reimann, F., Gribble, F. M. Co-localisation and secretion of glucagon-like peptide 1 and peptide YY from primary cultured human L cells. Diabetologia. 56 (6), 1413-1416 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유