Method Article
Mezcla de cultivos primarios de murino intestino delgado previstos para el Estudio de Gut Hormone secreción y Imágenes de células vivas de células enteroendocrinas
En este artículo
Resumen
Este protocolo describe el aislamiento y cultivo de células del intestino delgado murino mixtos. Estos cultivos primarios intestinales permiten la investigación de vías de señalización subyacentes secreción de péptido intestinal usando un número de técnicas.
Resumen
El intestino es el mayor órgano endocrino del cuerpo, con las células enteroendocrinas secretoras de hormonas situados a lo largo de la longitud del epitelio gastrointestinal. A pesar de su importancia fisiológica, las células enteroendocrinas representan sólo una pequeña fracción de la población de células epiteliales y en el pasado, su caracterización ha presentado un reto considerable que resulta en una dependencia de los modelos de línea celular. Aquí, proporcionamos un protocolo detallado para el aislamiento y cultivo de células del intestino delgado murino mixtos. Estos cultivos primarios se han utilizado para identificar las vías de señalización que subyacen a la estimulación y la inhibición de la secreción de péptido intestinal en respuesta a una serie de nutrientes y neuropéptidos, así como agentes farmacológicos. Además, en combinación con el uso de ratones transgénicos indicadores fluorescentes, hemos demostrado que estos cultivos primarios se convierten en una herramienta poderosa para el examen de las células enteroendocrinas fluorescentemente etiquetado en el ennivel intracelulares, utilizando métodos tales como fijación de parche y de calcio de una sola célula y formación de imágenes cAMP-FRET.
Introducción
El objetivo general de este método consiste en aislar y cultivar células intestinales mixta murinos para permitir el estudio de la secreción del péptido intestinal y imágenes de células vivas de las células neuroendocrinas. Una primera versión de este procedimiento se publicó originalmente en 2008 por Reimann et al. 1 y desde entonces ha formado la base de otras 20 publicaciones de nuestro grupo. Para este manuscrito, se optó por centrarse en pequeños cultivos intestinales, ya que son más difíciles de establecer que las culturas del colon.
Células enteroendocrinas secretan una gran variedad de péptidos intestinales incluyendo péptido similar al glucagón 1 (GLP-1), dependiente de la glucosa péptido insulinotrópico (GIP), colecistoquinina (CCK) y el péptido YY (PYY) 2. Estos péptidos intestinales tienen importantes papeles fisiológicos en la orquestación de las respuestas posprandial como la ralentización de tránsito intestinal, la potenciación de la liberación de insulina estimulada por la glucosa y la inducción de saciedad. GLP-1 miméticos unand fármacos que inhiben su degradación actualmente tienen licencia para el tratamiento de diabetes tipo 2 y hay evaluación continua del potencial terapéutico de la estimulación de la secreción endógena de este péptido 3. Una mejor comprensión de la fisiología enteroendocrina y los mecanismos por los que la secreción es ya sea estimulado o inhibido es, por lo tanto, de importancia crítica.
Gut secreción del péptido puede ser estudiada usando una variedad de in vitro y ex vivo modelos experimentales, cada uno con ventajas y desventajas (para una revisión integral reciente también cubre el uso de modelos in vivo ver Svendsen et al. 4). Técnicas ex vivo tales como el intestino 5 y cámaras de Ussing aislados y perfundidos 6 Actualmente se están utilizando para explorar la secreción de péptido intestinal en respuesta a varias sustancias. La principal ventaja de estos métodos, comoen comparación con los cultivos primarios, es que el entorno inmediato de las células enteroendocrinas permanece en gran parte intacta y de manera importante, se conserva la polaridad de las células. Por lo tanto, es posible obtener información con respecto a qué celda superficie un secretagogo está actuando en 6. Sin embargo, estos son típicamente técnicas de bajo rendimiento y la calidad de los datos derivados de ellos depende en gran medida de la integridad y viabilidad del tejido intestinal, lo que inevitablemente disminuirá con el tiempo.
Organoides intestinales ahora están siendo cada vez más utilizados como modelos in vitro para el estudio de la función celular enteroendocrina y desarrollo 7. Organoides, que pueden ser derivados de ambos murino y el tejido humano, tienen la ventaja de formar estructuras 'cripta-como' 3D que mantienen la polaridad celular en cultivo. Sin embargo, las células enteroendocrinas-organoides derivados tienen todavía que ser completamente caracterizados y su similitud con L cel nativols sigue siendo en gran parte desconocido. Los cultivos primarios tienen la ventaja de ser un paso más cerca de la configuración fisiológica, como células enteroendocrinas no se mantienen y se diferencian en condiciones artificiales para períodos prolongados de tiempo.
Un método de cultivo primario alternativo que ha sido empleado para la evaluación de la secreción de péptido intestinal es el aislamiento de las células intestinales de rata fetal (SCIIF) 8. Sin embargo, la cultura de tejido intestinal de adultos se ha reunido con menos éxito y se han observado algunas diferencias en la capacidad de respuesta de SCIIF vs células intestinales murinos adultos (por ejemplo, glucosa 8).
Líneas celulares Enteroendocrinas-como (por ejemplo GluTAG, STC-1 y NCI-H716) se han utilizado tradicionalmente para distinguir directo vs. efectos indirectos sobre las células enteroendocrinas y para diseccionar los mecanismos moleculares subyacentes de acoplamiento estímulo para la secreción; ver Kuhre et al . 9 para la producción de péptido y la secreción por las líneas celulares inmortalizadas 'similares a células L'. Esto ha sido necesario como células neuroendocrinas, dispersos a lo largo del tracto gastrointestinal, constituyen menos del 1% de las células epiteliales intestinales 10 y células clasificadas, en nuestras manos, no sobreviven en la cultura 1. Las líneas celulares se mantienen herramientas útiles debido al hecho de que son una población de células en gran medida homogénea que es propicio para manipulaciones genéticas tales como la silenciación del gen. En consecuencia, es fácil para investigar el papel de las proteínas que no se pueden orientar farmacológicamente, cuando los ratones transgénicos no están disponibles. Sin embargo, las líneas celulares no siempre son modelos válidos de células primarias. Si bien hay muchas similitudes, los resultados de los cultivos primarios en ocasiones han resaltados diferencias en las vías de señalización activadas por ciertos nutrientes en las células L primaria en comparación con células GluTAG, por ejemplo (por ejemplo. Peptonas 11). Fundamentalmente, en combinación con ratones transgénicos indicadores fluorescentes, el modelo de cultivo primario permite el examen detallado de células enteroendocrinas primarios individuales en el nivel intracelular. Células L etiquetados fluorescentemente en cultivos primarios se han utilizado por nuestro grupo para el parche de sujeción 1, 12 estudios, y de una sola célula de calcio 11, 13 y de formación de imágenes monofosfato-FRET de adenosina cíclico 14 estudios, que han dado avances significativos en el campo de enteroendocrina fisiología.
El siguiente protocolo se ha optimizado para la realización de experimentos de secreción, utilizando una placa de 24 pocillos o para la preparación de hasta 16 platos de formación de imágenes, a partir de una sección de 10 cm del intestino delgado a partir de un solo ratón adulto. El protocolo puede ser modificado fácilmente para el estudio de las células del colon mediante el aumento de los tiempos de digestión y coconcentración llagenase.
Protocolo
Todos los procedimientos con animales fueron aprobados por la Universidad de Cambridge y el Bienestar de los Animales de Revisión Ética cuerpo y se ajustaban a los Animales (Procedimientos Científicos) Act 1986 Modificación del Reglamento (SI 2012/3039).
1. Preparación de antemano
- Colocar una alícuota de matriz de membrana basal (BMM) (~ 200! L) en hielo para descongelar.
NOTA: El BMM se solidifica a temperatura ambiente (TA). - de Pre-caliente 50 ml Dulbecco estéril de alta glucosa medio Eagle modificado (DMEM) (sin adiciones) y ~ 40 ml de medio de cultivo estéril (DMEM de alta glucosa suplementado con 10% suero bovino fetal (FBS), 100 U / ml de penicilina y 0,1 mg / ml de estreptomicina (P / S), y 2 mM L-glutamina) en 50 tubos de centrífuga ml en un baño de agua a 37 ° C.
- calcio Pre-enfriamiento y tamponada con fosfato salino (PBS) que contiene magnesio.
- Pesar 15 mg de colagenasa (XI bruto), añadir a un tubo de centrífuga de 50 ml y mantenerlo en hielo.
- PRECAUCIÓN: La colagenasa es perjudicial. Esto causa irritación de la piel (H315) y la irritación ocular grave (H319). Puede provocar síntomas de alergia o asma o dificultades respiratorias si se inhala (H334). Puede causar irritación respiratoria (H335). Use equipo protector personal adecuado, evitar la formación de polvo y evitar la inhalación del polvo. Asegurar una ventilación adecuada.
2. Colección de Tejidos
- Añadir ~ 20 ml de medio L-15 a un tubo de centrífuga de 50 ml y colocarlo en hielo.
- La eutanasia a un ratón por dislocación cervical, u otro método de calendario aprobado 1.
NOTA: Intestinal tejido se obtiene típicamente a partir de ratones en un fondo C57BL6. Sin embargo, otros fondos genéticos también se han utilizado por ejemplo 129 / SvEv 15. Experimentos de imagen requieren el uso de ratones indicadores fluorescentes por ejemplo GLU-Venus 1. El tejido se obtiene a partir de ratones adultos (2-6 meses) de ambos sexos. Los ratones se alojaron en individuajaulas con acceso ad libitum a agua y pienso normal LLY-ventilado. Sin embargo, los experimentos para probar el efecto de una dieta alta en grasas, por ejemplo, en función de las células enteroendocrinas 16 puede llevarse a cabo si es compatible con una licencia de proyecto. - Diseccionar y eliminar suavemente intestino de ratón (de píloro para comenzar de recto) utilizando fórceps y tijeras de disección. Almacenarlo en medio L-15 en hielo hasta que esté listo para su uso.
3. Preparación del tejido
- Coloque el tejido intestinal en una placa de Petri de 10 cm que contiene suficiente PBS para cubrir el tejido. Tomar 10 cm de tejido deseado (por ejemplo, intestino delgado superior, los mejores 10 cm, distales al píloro).
- Enjuague contenido intestinal utilizando una pipeta Pasteur de plástico y enfriado PBS.
- El uso de pinzas, delicadamente agarre un extremo del segmento intestinal y coloque la punta de una pipeta Pasteur en ella. Enjuague contenidos con PBS enfriado. Repetir desde ambos extremos hasta que el majodad de los contenidos ha sido purgada. Transferencia a una placa de Petri que contiene limpio fresco refrigerado PBS.
- El uso de pinzas, extraer el tejido adiposo y el mesenterio, teniendo cuidado de no salga de la capa de músculo al mismo tiempo.
- Peel la capa muscular off "como un calcetín" bajo un microscopio de disección usando dos conjuntos de pinzas finas.
NOTA: Este paso no es esencial, pero es muy recomendable. Hay maneras alternativas de eliminación de la capa muscular a la descrita aquí. Por ejemplo, el intestino se puede cortar abierto longitudinalmente primero, antes de la eliminación de la capa muscular.- Encontrar un punto de partida en el extremo más proximal del tejido donde hay una aleta visible del músculo. Tire suavemente de distancia una pequeña cantidad de capa muscular todo el camino alrededor del intestino.
NOTA: Para evitar el desgarro de la capa muscular o el epitelio intestinal, reducen la fuerza de tensión por apriete una superficie más grande en lugar de utilizar la tips de las pinzas finas. - Sujetar el intestino y la mayor cantidad de colgajo de músculo como sea posible, tire suavemente aparte y empezar a despegar la capa muscular de todo el intestino. Para evitar que se rompa tanto la capa muscular y el epitelio, mantener el reajuste de la posición de los fórceps para mantenerlos juntos. De esta manera, eliminar la capa muscular de toda la longitud del segmento intestinal y descarte.
- Encontrar un punto de partida en el extremo más proximal del tejido donde hay una aleta visible del músculo. Tire suavemente de distancia una pequeña cantidad de capa muscular todo el camino alrededor del intestino.
- Cortar el intestino abierto longitudinalmente y lavado por agitación en una placa de Petri limpia, con fresco refrigerado PBS. Repetir si es necesario para eliminar cualquier quimo o moco restante.
- Tejido de carne con una hoja de bisturí quirúrgico para lograr cuadrados de ~ 1-2 mm 2 y añadir estos a ~ 20 ml PBS enfriado en un tubo de centrífuga de 50 ml utilizando una pipeta Pasteur. Para evitar piezas de tejido se pegan a la pipeta, cortar la punta y mojar la pipeta triturando con PBS.
- Agitar suavemente el tubo para lavar adicionalmente las piezas de tejido. Permitir que el tejido se asiente y vierta o pipette de la mayoría de la PBS y repetir con PBS fresco hasta que el PBS se ve claro.
4. Preparación de la placa / placas revestidas-BBM y la digestión Medium
NOTA: Los siguientes pasos deben realizarse en una campana de cultivo de tejido (con pasos de incubación en 37 ° C baño de agua).
- Preparar una solución de BMM 2% en DMEM enfriado (sin adiciones). Durante el trabajo, mantener la solución en hielo. Para una solución de 2%, añadir 140 l descongeló BMM a 7 ml de DMEM (suficiente para preparar una única placa de 24 pocillos).
- Añadir 250! L 2% de solución de BMM por pocillo (placa de 24 pocillos) o por vaso plato de formación de imágenes inferior.
- Incubar placas recubiertas / platos durante al menos 30 min en una incubadora a 37 ° C para permitir la polimerización adecuada de la BMM.
- Añadir la DMEM 50 ml pre-calentado (sin adiciones) a la colagenasa 15 mg (de los pasos 1.2 y 1.4) para formar una solución 0,3 mg / ml y se invierte para disolver.
- Ence completamente disuelto, utilizando una jeringa de 20 ml, se filtra la solución de colagenasa a través de un filtro estéril de 0,2 micras en una nueva estéril de 50 ml tubo de centrífuga. Etiquetar esto como el medio digestión.
La digestión 5. Tejido
- Retire las piezas de tejido de la PBS usando una pipeta serológica ml 10 y añadir a un tubo estéril de 50 ml de centrífuga que contiene DMEM estéril enfriada (sin adiciones), remolino y luego eliminar DMEM.
NOTA: Para evitar el tejido se pegue a la pipeta serológica, mojó por trituración con DMEM antes del contacto con el tejido. - 'Digest 1 y 2: Eliminación de residuos celulares y células individuales
- Añadir 7 medio digestión ml a las piezas de tejido y dar al tubo de un remolino.
- Incubar durante 5 min en un baño de agua a 37 ° C.
- Agitar suavemente (no agitar) el tubo durante ~ 3 s.
- Permitir que el tejido se asiente y desechar el medio de digestión, reservando unapequeño volumen para ser evaluada bajo el microscopio.
NOTA: Especialmente cuando se inicia, es muy recomendable para inspeccionar un pequeño volumen de cada 'digerir' (~ 30 l) bajo el microscopio para medir el progreso del proceso de la digestión. Si se observan muchas criptas en esta etapa, el temblor puede ser demasiado vigorosa. Para las imágenes representativas de los diferentes estadios lo 'digest' tienen la apariencia típica, consulte la Figura 1. - Repita los pasos 5.2.-5.2.4 (con medio fresco digestión).
- '' Las digestiones 3 a 5: La colección de fragmentos de las criptas
- Añadir 7 ml medio de digestión de los tejidos.
- Incubar durante 10 min a 37 ° C.
- Durante la incubación, agitar cada 5 minutos durante 10-12 s.
NOTA: El temblor es más vigoroso que el temblor de 'digiere' 1 y 2.
- Durante la incubación, agitar cada 5 minutos durante 10-12 s.
- Permitir que el tejido no digerido se asiente y recoger el medio de digestión en un tubo de centrífuga de 15 ml. Sitejido se recoge accidentalmente junto con el medio, deje que se asiente, quitar usando una pipeta serológica de 10 ml y transferir de nuevo al tubo de centrífuga de 50 ml que contiene el tejido no digerido.
- Centrifugar recogió el medio / sobrenadante a TA durante 3 min a 100 x g.
- Descartar el sobrenadante y volver a suspender el sedimento celular en 5 ml de medio de cultivo pre-calentado por trituración suave y dejar de lado.
- Inspeccionar un pequeño volumen de la suspensión celular bajo el microscopio (véase la Nota de la Etapa 5.2.4).
NOTA: Lo ideal es que los fragmentos de las criptas comienzan a aparecer en 'digerir' 3 junto con los restos celulares y células individuales. 'Digests' 4 y 5 contienen un número significativamente mayor de fragmentos de cripta con los restos celulares reducida (Figura 1). Ajuste agitación intensidad como necesario, es decir si el tejido no está digiriendo y fragmentos de las criptas no aparecen, agitar con más fuerza. - Repita los pasos 5.3.1-5.3.6 hasta 5 'digiere' han sidocompletado o hasta que la mayoría del tejido se ha digerido (a 6º de digestión puede ser necesaria).
- Una vez que todos los sobrenadantes de 'digiere' 3-5 (o 3-6) se han recogido, se centrifuga la sobrenadantes digieren a TA durante 3 min a 100 x g.
- Para los experimentos de secreción, se combinan los sobrenadantes de 'digiere' 3-5 (o 3-6) antes de la centrifugación.
NOTA: Se necesita menos tejido para experimentos de imagen, por lo tanto elegir el sobrenadante de digestión que es el más limpio (ausencia de restos de células y las células individuales) con el mayor número de fragmentos de las criptas. Esto es típicamente 'digerir' 4 o 5. - Descartar el sobrenadante y suavemente volver a suspender el sedimento por trituración hasta que no hay grumos son visibles. Vuelva a suspender el sedimento en medio de cultivo pre-calentado suplementado con 10 mM de dihidrocloruro de Y-27632 (para evitar la anoikis 17). Usar 5 ml para los experimentos de secreción y 2 ml de medio de cultivo para los experimentos de formación de imágenes.
- Filtrarsuspensión de células a través de un filtro de 100 mm (para eliminar cualquier tejido no digerido). Ejecutar un más 2 ml de medio de cultivo pre-calentado a través del filtro para lavar (volumen total: 7 ml y 4 ml para la secreción y formación de imágenes, respectivamente).
NOTA: El filtrado no es esencial, sin embargo, los fragmentos de tejido más grandes no tienden a adherirse a la placa / platos.
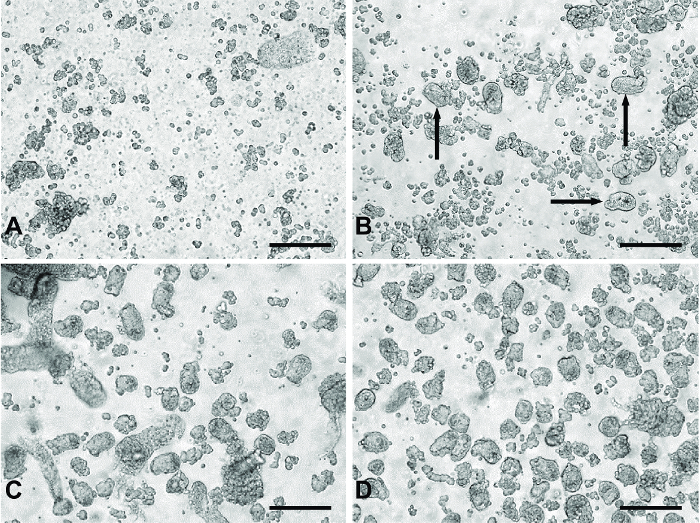
Figura 1: Imágenes representativas de 'digiere' de método de cultivo intestinal pequeña primario. (A) material típico de 'digiere' 1 y 2 que contiene principalmente células individuales y los restos celulares. (B) Un ejemplo de productos de 'digerir' 3. Las flechas negras indican fragmentos de las criptas que aparecen en el material de digerir. (C) típica de 'digerir' 4 o 5. Panel (D) representa agruparon digerir el material de'digiere' 3-5 pasa a través de un filtro de 100 micras para eliminar los fragmentos de tejido no deseados más grandes observados en (C). Todas las imágenes fueron tomadas usando un microscopio invertido digital con un objetivo 20X. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
6. culturas Chapado intestinal (enriquecidos para células de las criptas)
- Eliminar el exceso de solución de BMM de plato o platos, y añadir 250! L de medio de cultivo pre-calentado por la secreción también.
NOTA: Proyección de imagen platos se dejan sin medio así que vaya al siguiente paso con rapidez para evitar que el plato se sequen. - Plate 250! L de suspensión de células por pocillo (placa de 24 pocillos) o por vaso plato inferior.
- Plate gota a gota en un movimiento lento 'zig-zag' a través del pozo. Permitir a fragmentos de las criptas se asienten durante ~ 5 min antes de mover la placa a the incubadora.
NOTA: Este debe fomentar una distribución uniforme de las criptas / células dentro del pozo.
- Plate gota a gota en un movimiento lento 'zig-zag' a través del pozo. Permitir a fragmentos de las criptas se asienten durante ~ 5 min antes de mover la placa a the incubadora.
- Incubar la placa o platos durante la noche a 37 ° C y 5% de CO2.
NOTA: Una monocapa 'irregular' debería haber formado. Para una imagen representativa de las culturas Después de tres lavados, véase la Figura 2A. - platos de imagen 'inundación' con 2 ml de medio de cultivo pre-calentado por plato.
NOTA: Estos platos serán adecuadas para obtener imágenes de hasta ~ 72 h después de chapado. culturas colon suelen durar más tiempo, hasta 7 días. Las células que no se han adherido pueden ser eliminados por una etapa de lavado. Los cultivos primarios son ahora listo para ser utilizado para los experimentos.
Resultados
El uso de etapas de digestión de serie permite la obtención de una preparación relativamente limpia de fragmentos de las criptas a ser plateado para los experimentos. Los primeros dos digestiones de eliminar las células principalmente individuales y restos de células a partir del material de digestión (Figura 1A). Durante la tercera digestión, los fragmentos de las criptas aparecen en el material digerido (Figura 1B). Digiere 4 y 5 rendimiento de un mayor número de fragmentos de cripta con un menor número de células individuales (Figura 1C). Filtrar el material reunido de las digestiones 3-5 elimina grandes piezas de tejido no digerido, que pueden ser perjudiciales para el cultivo, la producción de una preparación fragmento cripta limpio (Figura 1D).
Después de 18-24 h de cultivo, se observaron monocapas de pequeñas células intestinales primarios (Figura 2A). Utilizando cultivos generados a partir de ratones transgénicos que expresan específicamente la calCIUM sensor fluorescente, GCaMP3, bajo el control del promotor de proglucagón 11, células L son fácilmente identificables y intercaladas dentro de la cultura (Figura 2B). En pequeñas culturas intestinal primaria, compuestos que dirigen el G q -Ca 2 + i y cAMP i dependiente de vías estimulan la secreción de GLP-1 (para la metodología experimento secreción ver Reimann et al. 1). Bombesina (BBS, 100 nM) y co-aplicación de forskolina y 3-isobutil-1-metilxantina (IBMX) (F / I, 10? M cada uno) desencadenaron una de 2 y 11 veces, la estimulación de GLP-1 de liberación relativa a basal, respectivamente (Figura 2C). la expresión en células L específico de GCaMP3 permite la identificación de y la supervisión en tiempo real de movilización de calcio en células L individuales. Tanto 100 nM bombesina (BBS) y cloruro de potasio 30 mM (KCl) estimularon aumentos transitorios de calcio intracelular indicativas de la G conocido q </ sub> - y las vías-electrógenos acoplados en células L primarios (Figura 2D).
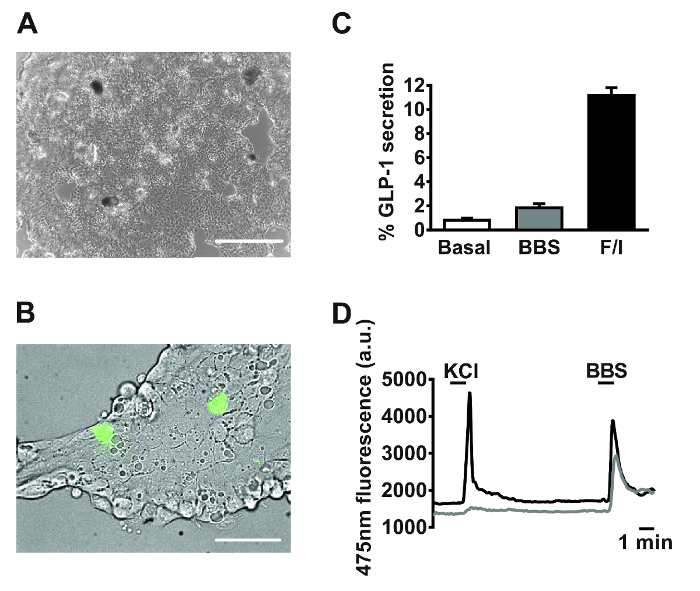
Figura 2: Los datos representativos derivados de pequeños cultivos intestinales primarios. Imágenes de ejemplo de pequeños cultivos intestinales primarias mixtas utilizadas para la secreción (A) y los experimentos de imagen (B) post 24 h de chapado. (A) Imagen tomada de una placa de 24 pocillos, utilizando un microscopio invertido digital con un objetivo 4X. Barra de escala = 500 m. (B) Uso de GLU-Cre x ratones ROSA26 GCamP3, células L en el campo de visión (células verdes) fueron identificadas por la fluorescencia de GCaMP3. La barra de escala representa 50! m. (C) la secreción de GLP-1 se midió en respuesta a la bombesina (BBS, 100 nM) y la forskolina / 3-isobutil-1-metilxantina (IBMX) (F / I, 10? M cada uno). Porcentaje GLP-1 secreción se calculómediante la medición de los niveles de GLP-1 en los sobrenadantes y los lisados celulares. Los datos representan las medias ± SEM de n = 3 para cada condición. (D) la fluorescencia GCaMP3 (reflejando calcio citosólico) de las dos células descritas en (B) monitorizados en tiempo real en respuesta a cloruro de potasio (KCl, 30 mM) y BBS (100 nM). formación de imágenes de células individuales se realizó utilizando un microscopio de fluorescencia invertida con un objetivo de inmersión en aceite 40X. GCaMP3 se excita a 475/10 nm, usando una lámpara de arco de xenón de 75 W y un monocromador controlado por software de imágenes de fluorescencia. La emisión se grabó con una cámara digital de alta resolución de dispositivo de carga acoplada (CCD) utilizando un espejo dicroico y un filtro de ancho de banda de 510-560 nm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe el aislamiento y cultivo de células del intestino delgado murino mixtos para permitir el estudio de la secreción de péptido intestinal y formación de imágenes de células individuales de células enteroendocrinas etiquetados.
Para aumentar la probabilidad de los pequeños cultivos intestinales tener éxito, es importante que el protocolo se lleva a cabo lo más rápidamente posible (idealmente, a menos de 3 h de cosechar el tejido) y que el tejido se mantiene en un medio enfriado con hielo o tampón antes con el proceso de la digestión, para limitar la muerte celular. Si bien no es esencial, especialmente para culturas del colon, se recomienda encarecidamente la eliminación de la capa muscular en el intestino delgado. El protocolo de cultivo del intestino delgado se ha normalizado tanto como sea posible. Sin embargo, es importante tener en cuenta que ningún proceso de digestión es idéntico. Hay muchos pasos durante este protocolo donde la variabilidad se puede introducir en una base de día a día por ejemplo, el grado de eliminación de músculo, el tamaño de tél 'picada' piezas de tejido, la fuerza de agitación, la potencia de un lote particular de colagenasa etc. Es por lo tanto, de suma importancia para inspeccionar alícuotas de cada uno de los diferentes 'digiere' bajo el microscopio para evaluar el progreso del proceso de digestión y adaptar la agitación y el número de consecuencia 'digiere'. Se recomienda agitar con más suavidad, para empezar y, en caso de restos de la cripta no son evidentes a partir de 'digerir' 3 en adelante, para empezar a temblar con más fuerza.
A partir de nuestra experiencia, las células neuroendocrinas no proliferan en cultivo y por lo general se pierden de pequeños cultivos intestinales dentro de 4 días. Sin embargo, esto permite el tiempo suficiente para llevar a cabo experimentos de secreción de péptido intestinal (típicamente lleva a cabo durante 2 h, 18-24 h después de la galvanoplastia) para probar estímulos fisiológicos y / o agentes farmacológicos. Los experimentos que requieren una incubación durante la noche antes del experimento secreción también son factibles por ejemplo,en el caso de pre-tratamiento con toxina pertussis 15.
La técnica de cultivo primario que se presenta aquí es un método bien establecido, como lo demuestra el volumen de producción de la investigación que se ha producido en los últimos años. El modelo de cultivo primario se ha utilizado para estudiar la secreción de una variedad de péptidos intestinales, incluyendo GLP-1 1, GIP 18 y PYY 19, en respuesta a diversa de nutrientes y no nutrientes 14, 20 estímulos e inhibidores. Además, la misma técnica se ha aplicado con éxito para el cultivo de células intestinales humanas 21. A menudo, una combinación del método de cultivo celular primario junto con un modelo experimental adicional, por ejemplo. ex vivo o in vivo pueden proporcionar la mayor penetración 6. En particular y en contraste con otros métodos, esta técnica tiene imaplicaciones portantes más allá de la medición de la liberación de péptido intestinal. Hemos demostrado que pequeños cultivos intestinales primarios derivados de reportero ratones transgénicos son herramientas poderosas para el interrogatorio de vías de señalización intracelular acoplados a destripar la secreción del péptido, usando por ejemplo los sensores de AMPc Ca 2 + y, GCaMP3 11, 13 y Epac2camps 14, respectivamente, así como técnicas electrofisiológicas 12.
Como con todos los modelos in vitro, los cultivos intestinales primarias tienen ciertas limitaciones inherentes, incluyendo la pérdida de la polaridad de las células epiteliales en cultivo, así como la pérdida de suministro de sangre y la inervación. Es difícil estimar el impacto potencial de estas condiciones artificiales en la función de las células enteroendocrinas. Sin embargo, los datos obtenidos a partir de cultivos primarios a menudo han sido traducible en el in vivo setting (por ejemplo, efectos de los ácidos grasos de cadena corta en GLP-1 secreción 15).
Los cultivos primarios intestinales son una técnica versátil con muchas aplicaciones potenciales. Ya han proporcionado una visión mecanicista importante en la regulación de la secreción del péptido intestinal.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
GLP-1 inmuno-ensayos se realizaron por el Laboratorio de Ensayo Core bioquímica en el Hospital de Addenbrooke.
Este trabajo, a lo largo de los años, ha apoyado por el Wellcome Trust (actualmente subvenciones activas 106262 / Z / 14 / Z y 106263 / Z / 14 / Z) y el Consejo de Investigación Médica (MRC) (subvenciones MRC_MC_UU_12012 / 3 y MRC_MC_UU_12012 / 5).
Materiales
| Name | Company | Catalog Number | Comments |
| 24-well plates | Costar | 3524 | For secretion experiments |
| Bombesin | Sigma-Aldrich | B4272 | Positive control (calcium imaging experiment) |
| Centrifuge tubes, 15 mL, sterile | Greiner bio-one | 188261 | For tissue preperation/digestion |
| Centrifuge tubes, 50 mL, sterile | Corning | 430828 | For tissue preperation/ digestion |
| Collagenase XI (Crude) | Sigma-Aldrich | C9407 | For making up digestion medium |
| Dichroic mirror | Cairn Research | - | For imaging experiments |
| DMEM High glucose (4500 mg) | Sigma-Aldrich | D6546 | For dissolving matrigel (keep at 4 °C). For making up digestion medium, pre-warm to 37 °C. |
| Emission Filter (Bandwidth 510-560 nm) | Cairn Research | - | For imaging experiments |
| Foetal Bovine Serum | Sigma-Aldrich | F7524 | For making up culture medium |
| Forceps/Tweezers | Agar Scientific | AGT520 | For dissection/removal of intestine |
| Forskolin | Sigma-Aldrich | F6886 | Positive control (secretion experiment) |
| Glass-bottomed dishes (35 mm) | MatTek | P35G-0-14-C | For imaging experiments |
| High precision tweezer (110 mm) | IDEAL-TEK | 3480641 (5 SA) | For removing muscle layer |
| High resolution digital CCD camera | Hamamatsu | ORCA-ER | For imaging experiments |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I7018 | Positive control (secretion experiment) |
| L-15 Medium (Leibovitz) | Sigma-Aldrich | L1518 | For collecting tissue, keep on ice |
| L-glutamine | Sigma-Aldrich | G7513 | For making up culture medium |
| Matrigel | Corning | 354234 | Basement Membrane Matrix, for coating plates and dishes |
| MetaFluor | Molecular Devices (supplied by Cairn Research) | - | Fluorescence ratio imaging software |
| Mice (C57BL6) | Charles River Laboratories | C57BL/6J | Background mice used for breeding. Can also be used for secretion experiments |
| Mice (GLU-cre x ROSA26 GCaMP3) | in house | - | For calcium imaging and secretion experiments |
| Microscope (EVOS XL Core) | Thermo Fisher Scientific | AMEX1000 | For photomicrographs of cultures |
| Microscope | Olympus | IX71 | Inverted microscope with 40X oil objective used for imaging experiments |
| Monochromator | Cairn Research | - | For imaging experiments |
| Pasteur pipettes | Alpha Laboratories | LW4234 | For cleaning tissue |
| PBS containing Ca2+ and Mg2+ | Sigma-Aldrich | D8662 | For washing tissue, keep on ice |
| Penicillin & Streptomycin | Sigma-Aldrich | P0781 | For making up culture medium |
| Petri dishes (100 mm x 20 mm) | Corning | CLS430167 | For cleaning tissue and removing muscle layer |
| Potassium chloride | Fisher Scientific | P/4280/53 | Positive control (calcium imaging experiment) |
| Scissors | Agar Scientific | AGT554 | For dissection/removal of intestine |
| Sterile cell strainer 100 µm | Fisher Scientific | 22363549 | For filtering crypt cell suspension prior to plating |
| Surgical scalpel blade No.22 (sterile, stainless) | Swann Morton | 0308 | For dicing tissue |
| Syringe filters, Minisart NML (0.2 µm pore size) | Sartorius | 16534-K | For filter-sterilising collagenase solution (digestion medium) |
| Syringes, 20 mL, disposable, sterile, Luer slip | BD | 300613 | For filter-sterilising collagenase solution (digestion medium) |
| Xenon arc lamp 75W | Cairn Research | - | For imaging experiments |
| Y-27632 dihydrochloride | Tocris | 1254 | ROCK inhibitor, prepare 10 mM stock solution in sterile water (use 1:1,000 in final culture medium) |
Referencias
- Reimann, F., Habib, A. M., Tolhurst, G., Parker, H. E., Rogers, G. J., Gribble, F. M. Glucose sensing in L cells: A primary cell study. Cell Metab. 8, 532-539 (2008).
- Psichas, A., Reimann, F., Gribble, F. M. Gut chemosensing mechanisms. J Clin Invest. 125 (3), 908-917 (2015).
- Lovshin, J. A., Drucker, D. J. Incretin-based therapies for type 2 diabetes mellitus. Nat Rev Endocrinol. 5 (5), 262-269 (2009).
- Svendsen, B., Holst, J. J. Regulation of gut hormone secretion. Studies using isolated perfused intestines. Peptides. 77, 47-53 (2016).
- Kuhre, R. E., Frost, C. R., Svendsen, B., Holst, J. J. Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine. Diabetes. 64 (2), 370-382 (2015).
- Brighton, C. A., et al. Bile acids trigger GLP-1 release predominantly by accessing basolaterally located G protein-coupled bile acid receptors. Endocrinology. 156 (11), 3961-3970 (2015).
- Petersen, N., et al. Generation of L cells in mouse and human small intestine organoids. Diabetes. 63 (2), 410-420 (2014).
- Brubaker, P. L., Vranic, M. Fetal rat intestinal cells in monolayer culture: a new in vitro system to study the glucagon-like immunoreactive peptides. Endocrinology. 120 (5), 1976-1985 (1987).
- Kuhre, R. E., et al. Peptide production and secretion in GLUTag, NCI-H716, and STC-1 cells: a comparison to native L-cells. J Mol Endocrinol. 56 (3), 201-211 (2016).
- Gerbe, F., et al. Distinct ATOH1 and Neurog3 requirements define tuft cells as new secretory cell type in the intestinal epithelium. J Cell Biol. 192 (5), 767-780 (2011).
- Pais, R., Gribble, F. M., Reimann, F. Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells. Peptides. 77, 9-15 (2016).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. J Physiol. 589 (Pt 5), 1081-1093 (2011).
- Emery, E. C., et al. Stimulation of GLP-1 secretion downstream of the ligand-gated ion channel TRPA1. Diabetes. 64 (4), 1202-1210 (2015).
- Psichas, A., Glass, L. L., Sharp, S. J., Reimann, F., Gribble, F. M. Galanin inhibits GLP-1 and GIP secretion via the GAL1 receptor in enteroendocrine L and K cells. Br J Pharmacol. 173 (5), 888-898 (2016).
- Tolhurst, G., et al. Short-chain fatty acids stimulate glucagon-like peptide-1 secretion via G-protein-coupled receptor FFAR2. Diabetes. 61 (2), 364-371 (2012).
- Richards, P., et al. High fat diet impairs the function of glucagon-like peptide-1 producing L-cells. Peptides. 77, 21-27 (2016).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol. 25 (6), 681-686 (2007).
- Parker, H. E., Habib, A. M., Rogers, G. J., Gribble, F. M., Reimann, F. Nutrient-dependent secretion of glucose-dependent insulinotropic polypeptide from primary murine K cells. Diabetologia. 52 (2), 289-298 (2009).
- Pais, R., Rievaj, J., Larraufie, P., Gribble, F. M., Reimann, F. Angiotensin II type 1 receptor-dependent GLP-1 and PYY secretion in mice and humans. Endocrinology. 157 (10), 3821-3831 (2016).
- Moss, C. E., et al. Somatostatin receptor 5 and cannabinoid receptor 1 activation inhibit secretion of glucose-dependent insulinotropic polypeptide from intestinal K cells in rodents. Diabetologia. 55 (11), 3094-3103 (2012).
- Habib, A. M., Richards, P., Rogers, G. J., Reimann, F., Gribble, F. M. Co-localisation and secretion of glucagon-like peptide 1 and peptide YY from primary cultured human L cells. Diabetologia. 56 (6), 1413-1416 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados