Method Article
使用CRISPR并发剂的小鼠小肠组织中多基因敲除的方案
摘要
该协议描述了将多个单个引导RNA克隆到一个引导RNA并行载体中的步骤,其特别用于使用CRISPR / Cas9技术创建多基因敲除。肠组织中双重敲除的产生显示为该方法的可能应用。
摘要
CRISPR / Cas9技术大大提高了理解基因功能必不可少的功能丧失功能研究的可行性和速度。在高等真核生物中,旁系同源基因可以通过补偿基因的损失来掩盖潜在的表型,从而限制了依靠单基因敲除的遗传研究可以获得的信息。我们已经开发了一种用于引导RNA(gRNA)并联体的新型快速克隆方法,以便在小鼠小肠组织中进行单次转染后产生多基因敲除。我们的策略允许通过与退火的gRNA寡核苷酸和预先设计的逆转录病毒载体进行单一的金门改组反应,将多达四个单独的gRNA并入单个载体。这允许同时敲除多达四种不同的基因,或者通过多种gRNA靶向一种基因后提高的敲除效率。在这个协议中,我们详细说明如何有效克隆多个gRNA到逆转录病毒CRISPR连锁载体中,以及如何在肠组织中实现高效电穿孔。例如,我们显示同时敲除Wnt信号通路(Axin1 / 2和Rnf43 / Znrf3)负调节因子的两对基因,使得肠组织对抵抗关键生长因子有抵抗力。
引言
反向遗传学方法是广泛使用的一种调查基因功能的方法。特别是功能丧失研究,其中基因的破坏导致表型改变,在构建我们对生物过程的理解方面发挥关键作用。 CRISPR / Cas9方法代表了基因组工程技术的最新进展,并彻底改变了目前在细胞和生物体中的遗传学实践。 Cas9是RNA引导的内切核酸酶,其结合与gRNA互补的特异性DNA序列并产生双链断裂(DSB)。该DSB招募DNA修复机器,在不存在用于同源重组的DNA模板的情况下,将通过易错非同源末端连接重新连接切割的DNA链,从而导致核苷酸的插入或缺失,造成移码突变1 。
CRISPR / Cas9 appr的极大的简便性和多功能性oach,使它成为旨在解开未知的基因功能2,3基因组范围内的淘汰赛屏幕一个极具吸引力的工具。然而,如果存在具有冗余功能的多个旁系同源物,单基因敲除方法的使用有限。因此,消融单一基因可能不足以确定该基因的功能,给予可能由旁系同源物补偿导致很少或没有表型改变4 。因此,重要的是通过递送靶向不同旁系同源基因的多个gRNA载体来并行敲除旁系同源物,以克服遗传补偿的影响。
延长使用CRISPR / Cas9到旁系同源基因敲除,我们最近开发了一种快速,一步克隆方法克隆多达四个预退火gRNAs成一个单一的逆转录病毒载体5。这个骨干,名为CRISPR-concatemer,是基于在含有重复gRNA表达盒的MSCV逆转录病毒质粒上。每个盒含有IIS类型限制酶Bbs I的两个倒置识别位点,其可以在具有匹配突出端的退火的gRNA寡核苷酸中使用金管改组反应在单管6中不可逆地替代。该克隆方法由消化和连接的重复循环组成,允许通过利用Bbs I产生的不同突出序列同时装配多个DNA片段。该酶的唯一性是例如在其识别之外进行不对称切割的能力序列;因此,每个盒可以具有与Bbs I核心位点侧翼的定制突出端不同的序列,并且以这种方式,每个gRNA可以克隆在连接体载体的特定位置和取向上。
作为原则的证明,我们展示了这一策略的使用小鼠肠组织通过一轮电穿孔同时破坏Wnt途径的两对旁系同源负调节因子5 。
在过去的几年中,基于使用金门洗牌7,以实现各种模型系统中,如人细胞系8, 图9,斑马鱼10和大肠杆菌的多基因敲除构建多个gRNA表达载体许多其他组织已经开发类似的策略11 。在它们的方案中,首先将gRNA克隆到单独的中间载体中,然后组装成一个最终产物。相比之下,我们的CRISPR连锁策略的主要优点是单个Bbs I洗牌,克隆步骤的便利。像其他gRNA连锁蛋白一样,我们的方法可以同时敲除多达四个不同基因或增加的CRISPR敲除效率后,一个或两个基因与多个gRNA的靶向( 图1 )。
在本协议中,我们详细描述了从gRNA设计到金门反应以及成功克隆确认的CRISPR连锁向量生成的每个步骤。我们还提供了一种高效的方案,用于通过电穿孔和随后的生长因子取出实验将CRISPR连结体转染入小鼠小肠组织。
研究方案
1. CRISPR连锁向量的gRNA设计
注意:本节的目的是解释如何选择最佳的定位策略,以及如何设计包含CRISPR连锁向量特定突出端的gRNA。
- 使用选择的CRISPR gRNA设计工具设计针对感兴趣基因的gRNA。参见" 材料表"一个例子。
注意:当靶向一对旁系同源基因时,尽管可以为每个基因设计一个gRNA,但是建议每个基因设计两个gRNA以增加实现双重敲除的机会( 图1 )。 - 通过使用限制性测绘工具确保gRNA不含有Bbs I识别位点(参见" 材料表" )。
- 向每个寡核苷酸添加特异性CRISPR连锁向量突出端,如表1所示。
表1:CRISPR连续向量的每个盒的突出。
2.将gRNA克隆入CRISPR并列载体
- 寡核苷酸的磷酸化和退火
注意:此步骤说明了如何o为每个gRNA寡核苷酸退火顶部和底部链,以及如何在单个反应中磷酸化其末端。- 根据下面的说明准备反应混合物,以使寡核苷酸磷酸化并在冰上退火顶部和底部。
注意:所有寡聚体可以合并成一个反应;例如,在4个gRNA连接体载体的情况下,将8个寡核苷酸汇集在一起。 - 对于3个连续体,使用3.0μLgRNA顶链(每个gRNA为1.0μL;10μM,1μL/ gRNA),3.0μLgRNA底部链(每个gRNA为1.0μL;10μM,1μL/ gRNA),2.0μLT4 DNA连接酶缓冲液(10x),1.0μLT4 PNK,加入总量为20.0μL的H 2 O。
- 通过移液混合,并在热循环仪中运行,使用以下设置:37℃30分钟,95℃5分钟,以0.3℃/ min降温至25℃,保持在4℃。
- 根据下面的说明准备反应混合物,以使寡核苷酸磷酸化并在冰上退火顶部和底部。
- Bbs我洗牌反应
注意:在本节中,将预退火的gRNA寡核苷酸通过消化和连接的交替循环在一个步骤中并入到并入载体的适当位置。- 在DNase /不含RNA酶的水中稀释反应混合物1:100,以产生3和4个gRNA连接体载体。
注意:当克隆2 gRNA-多联体则不需要此步骤。 - 按照下面的说明,在冰上装配Bbs I洗牌反应。包含只包含向量的负控制。
- 使用100ng CRISPR连接载体,10.0μL寡聚混合物,1.0μL含BSA限制酶缓冲液(10x),1.0μLDTT(10mM),1.0μLATP(10mM), 1.0μLBbs I,1.0μLT7连接酶,和H 2 O,总体积为20.0μL。
- 通过移液混合,并使用以下设置在热循环仪中运行:运行50个循环用于克隆3和4个gRNA并列物质, 25个循环2 gRNA-多联体,无论是在37℃下5分钟,21℃保持5分钟, 保持在 37℃15分钟,然后4℃永远。
- 在DNase /不含RNA酶的水中稀释反应混合物1:100,以产生3和4个gRNA连接体载体。
- 外切核酸酶处理
注意:强烈推荐此步骤,因为它通过去除线性化DNA的任何痕迹来提高克隆的效率。- 用DNA外切核酸酶处理Bbs I改组反应( 参见表材料 )如下。
- 取上一步(2.2.3)11.0μL连接混合物,加入1.5μL外切核酸酶缓冲液(10x),1.5μLATP(10 mM),1.0μLDNA核酸外切酶,并用水提取总体积至15.0μL。在37℃下孵育30分钟,然后在70℃下孵育30分钟。
注意:此步骤除去混合物中任何残留的线性化DNA,因此提高了克隆效率。 - 使用2μL反应混合物进行化学反应帐篷大肠杆菌热休克12 。
注意:或者,反应可在-20°C下储存长达一周。
- 限制性消化
注意:此步骤的目的是通过限制性消化来评估克隆程序的成功。- 为了证实在CRISPR连接载体中存在gRNA插入片段,用接种环选择4-8个细菌菌落,在37℃的轨道振荡器中将每个克隆在4mL LB培养基中培养过夜。根据制造商的说明书使用质粒微量制备试剂盒提取DNA(参见材料表 )。
- 通过在细菌培养箱中将其在37℃下孵育3小时,将10μLEcoR I + 5U Bgl II的DNA与10μL的反应物进行消化。包括与对应的原始载体的单独的反应混合物作为大小比较的阳性对照。
注意:This将确认是否存在所有的并发剂,因为这两种限制性内切酶将消除整体并存。这些是每个连接体的预期大小:2个gRNA连接体(800bp),3个gRNA连接体(1.2kbp)和4个gRNA连接体(1.6kbp)。 - 在1%琼脂糖凝胶上在90V下进行约20分钟的消化反应。
- 使用紫外线透照仪可视化凝胶。通过确保其带状图案与原始向量之一相匹配,并通过使用DNA梯子来确定每个片段具有预期大小,从而识别具有正确插入大小的克隆。
- 在细菌培养箱中将选定的克隆与5U Bbs I在37℃下消化3小时。包括与相应的原始载体作为对照的单独的反应混合物。
注意:这个额外的消化步骤是确认gRNA已被克隆到正确的位置,因此所有Bbs I识别位点都已经丢失。 - 运行消化反应1%琼脂糖凝胶在90V下约20分钟。仅考虑由Bbs I切割的载体,因为它们只含有gRNA。
- 载体测序
注意:该步骤的目的是通过限制性消化分析证实在鉴定为正确的那些载体中存在gRNA序列。- 使用以下引物,通过Sanger测序13确认阳性连接载体:
前进:TCAAGCCCTTTGTACACCCTAAG(用于检查第一个gRNA盒)
Linker1_Forward:GACTACAAGGACGACGATGACAA(用于检查第二个gRNA盒)
Linker2_Reverse:GGCGTAGTCGGGCACGTCGTAGGGGT(用于检查第二个gRNA盒)
Linker2_Forward:ACCCCTACGACGTGCCCGACTACGCC(用于检查第三个gRNA盒)
Linker3_Reverse:TCCTCCTCTGAGATCAGCTTCTGCAT(用于检查第三个gRNA盒)
反向:AGGTGGCGCGAAGGGGCCACCAAAG(用于检查最后一个gRNA卡带) - 通过在测序读数中搜索其序列来检查所有gRNA的存在。
- 使用以下引物,通过Sanger测序13确认阳性连接载体:
3.通过电穿孔转染肠组织
注意:请注意,本程序基于Fujii 等人发布的方案。在2015年,适应小鼠小肠有机体培养14 。
- 预电
注意:本节介绍如何通过从培养基中除去所有抗生素和条件培养基,在电穿孔前准备小鼠肠组织。这将防止电穿孔中可能的毒性作用。- 在转染的第0天,以1:2的比例分解有机体。
注意:根据以前建立的方案15可以通过进行隐窝分离来获得肠组织培养物。请参阅表2所有媒体组成。- 当分裂有机体进行电穿孔时,每转染一个48孔板至少6孔。
- 在20μL基底基质滴中种植有机物,并在37℃,5%CO 2的湿润培养箱(如前所述15 )中在WENR + Nic培养基(Wnt + EGF + Noggin + R-斯朋丹+烟酰胺)中生长, 。
- 在第2天,用不含抗生素的250μLEN(EGF + Noggin)+ CHIR99021(Glycogen Synthase Kinase-3抑制剂)+ Y-27632(ROCK抑制剂))代替WENR + Nic来更换培养基( 参见表2 )。
注意:在所有步骤中,添加到48孔板的每个孔中的培养基的量为250μL。 - 在第3天,将有机介质更换为EN + CHIR99021 + Y-27632 + 1.25%v / v二甲基亚砜(DMSO),无抗生素。
- 在转染的第0天,以1:2的比例分解有机体。
- 细胞的制备
注意:这里我们描述如何通过机械和化学解离将组织细胞分裂成小细胞簇。这些步骤对于程序的成功至关重要。- 在第4天,使用1毫升移液器尖端破坏基底矩阵圆顶,并将组织转移到1.5 mL管中。将48孔板的四口井的池内容物装入管中。
- 通过P200移液管上下移动约200次,将组织细胞机械性地破碎成小碎片。在室温下离心,以600×g离心5分钟。
- 取出培养基,并将沉淀重悬于1 mL细胞培养级重组蛋白酶(见表格)。在37℃下孵育最多5分钟,然后在倒置光学显微镜下用4x物镜检查50μL的样品滴。
注意:10-15个细胞群是可取的,因为这样可以增加电穿孔后的细胞存活。 - 将细胞悬浮液转移到低结合的15 mL管中并停止通过加入9 mL无抗生素的基础培养基解离( 见表2 )。在室温下离心,以600×g离心5分钟,然后弃去上清液,并将沉淀重悬于1mL还原血清培养基中(参见材料表 )。
- 用Bürker室计数细胞数,每个电穿孔反应使用至少1×10 5个细胞。将9 mL还原血清培养基加入到15 mL管中,并在室温下离心3 min,浓度为400 x g。
- 电
注意:以下部分提供有关如何进行电穿孔并使组织回收的说明。- 取出所有的上清液,并将沉淀重新悬浮在电穿孔溶液中(参见材料表 )。向细胞悬浮液中加入总量为10μg的DNA,并加入电穿孔溶液至终体积为100μL,并保持细胞DN在冰上混合。以1:1的比例将CRISPR-连接体载体与Cas9表达质粒( 例如 Addgene#41815)组合使用。
注意:添加的DNA的总体积应小于或等于总反应体积的10%。 - 包括含有GFP质粒的单独转染混合物以评估转染效率( 例如 pCMV-GFP,Addgene#11153或任何通用的GFP表达质粒)。
- 将细胞DNA混合物加入到电穿孔试管中,并将其置于电穿孔器室中。通过按电动机上的适当按钮测量阻抗,并确保其为0.030-0.055Ω。按照表3所示的设置进行电穿孔。
注意:如果阻抗值超出允许范围,请调整反应杯中的溶液体积。 - 加入400μL电穿孔缓冲液+ Y-27632给比色杯,然后将其全部转移到1.5 mL管中。 Incuba在室温下静置30分钟以使细胞恢复,随后在400×g室温下旋转3分钟。
- 取出上清液,将沉淀物重新悬浮于20μL/孔的基底层。在48孔板中种子约1×10 4至1×10 5个细胞/孔,并加入EN + CHIR99021 + Y-27632 + 1.25%v / v DMSO培养基。在37°C孵育。
- 在第5天,将培养基更换为EN + CHIR99021 + Y-27632,并通过观察GFP表达来检测转染效率( 图2 )。 2天后,保持有机体在37°C,并刷新EN + CHIR99021 + Y-27632培养基。
- 在第9天,将培养基更换为WENR + Nic + Y-27632,并在37℃下孵育。
注意:Y-27632可在7-10天后(16-19日)取出。
- 取出所有的上清液,并将沉淀重新悬浮在电穿孔溶液中(参见材料表 )。向细胞悬浮液中加入总量为10μg的DNA,并加入电穿孔溶液至终体积为100μL,并保持细胞DN在冰上混合。以1:1的比例将CRISPR-连接体载体与Cas9表达质粒( 例如 Addgene#41815)组合使用。
| 打浆脉冲 | 转移脉冲 | |
| 电压 | 175V | 20V |
| 脉冲长度 | 5毫秒 | 50毫秒 |
| 脉冲间隔 | 50毫秒 | 50毫秒 |
| 脉冲数 | 2 | 五 |
| 衰减率 | 10% | 40% |
| 极性 | + | +/- |
表3:电穿孔设置。
生长因子提取
注意:这里举例说明如何在敲除肠组织中Wnt通路的负调节因子时进行生长因子抽取实验。
- 10-14天电穿孔,按照上述步骤(3.2.1〜3.2.2),在48孔板中以1:3比例分解有机物。
- 将组织沉淀重悬于20μL基底膜基质中,使其在37℃固化10分钟。然后,覆盖250μL生长因子剥夺培养基( 如 EN),以检测目标基因的敲除是否已经达到5 。
- 分裂生长因子剥夺的条件下类器官最少2 - 3通道以看到在野生型野生型(WT)对照类器官和突变类器官5,15之间存活的差异。
注意:野生型有机体不应该能够在生长因子剥夺的培养基中存活两代,而突变体系应该能够生长。
结果
为了确认连接体载体中正确数目的gRNA插入物的存在,用所有gRNA表达盒侧翼的酶( EcoR I + Bgl II)进行限制性消化(每个盒大小为〜400bp, 图1 )。例如,当产生4个gRNA-连接体载体时,琼脂糖凝胶中较低条带的预期大小约为1.6Kbp;任何低于此值的条带表示不是所有4个gRNA盒都插入载体( 图2A )。此外,始终建议检查所有Bbs I识别位点是否丢失,并且酶不剪切载体( 图2B )。
一旦确定了构建体,可以通过电穿孔将其输送到小鼠肠组织,以达到最佳l转染效率水平(高达70%),如GFP控制( 图3 )所示。
最后,为了功能测试这种策略的效率,将转染Cas9的肠组织和针对Axin1 / 2和Rnf43 / Znrf3的连接酶载体在EN(R-spondin取出)和EN + IWP2(R-spondin和Wnt提取,IWP2 :豪猪抑制剂,2.5μM)培养基至少3代( 图4 )。虽然未转染的WT组织因子在两种情况下死亡,但由于Wnt通路的下游激活,Axin1 / 2敲除组织存活在两者中。此外,Rnf43 / Znrf3突变体的有机体在不存在R-spondin的情况下存活,但在IWP2的存在下不能存活,这导致激活途径的Wnt的耗尽。总而言之,这些观察结果表明,通过产生t可以消除这些旁系对对他期望有机体表型。这些结果的详细信息已发表在" 发育生物学" 5 。
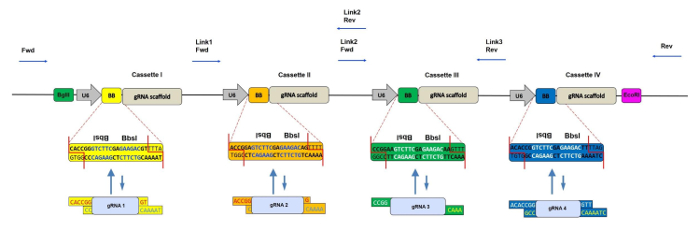
图1:具有4个磁带盒的CRISPR连接器的示意图。将4个gRNA连接载体与每个含有U6启动子的400bp盒,两个反向重复的Bbs I位点(也称为BB)和gRNA支架依次组合。在混洗反应期间, Bbs I位点被具有匹配突出端的gRNA片段替代,因此丢失。用于检查正确插入gRNA寡核苷酸的测序引物的结合位点用蓝色箭头表示。 Fwd =正向引物,Rev =反向引物,Link 1/2/3 =接头片段1/2/3。 请坐舔这里查看这个数字的较大版本。

图2:协调者载体的代表性消化模式。 ( A )用EcoR I和Bgl II双重消化3和4个gRNA连接体载体。正确的消化模式用绿色标记标记,而只有1或2个gRNA插入的载体用红十字标记。泳道1显示用作阳性对照(用"+")表示的4gRNA-并连者亲本载体的消化;类似地,泳道5显示用"+"标记的3gRNA-并连者亲本载体的消化。 ( B )用Bbs I进行消化,显示未消化的连字向量的正确大小(由绿色蜱表示)。使用已丢失Bbs I位点的含gRNA的并连体载体的消化作为阳性对照d用"+"标记。 请点击此处查看此图的较大版本。
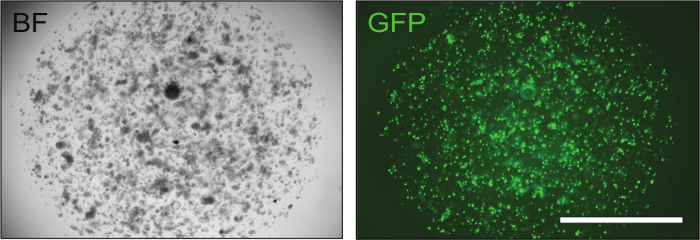
图3:成功电穿孔肠组织的代表性图像。转染GFP质粒有助于评估转染效率。电穿孔后大约24小时,含有少量细胞的有机体已经可见,如果电穿孔程序成功,其中70%显示绿色荧光。 BF =亮场,GFP =绿色荧光蛋白。刻度棒=2,000μm。 请点击此处查看此图的较大版本。
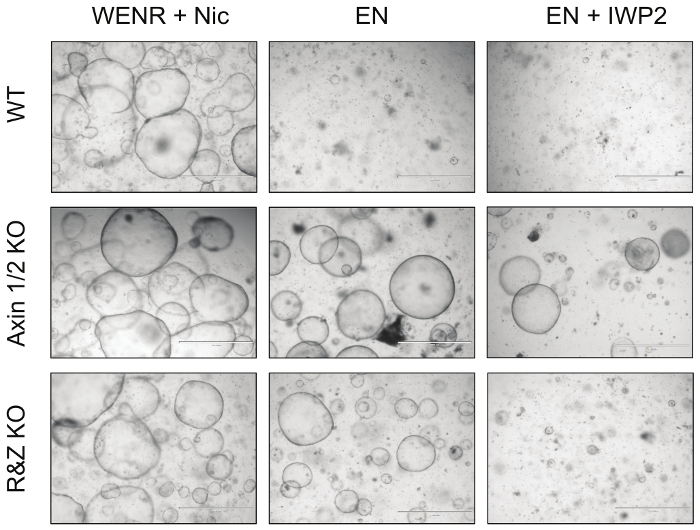
图4:突变肠组织的代表性图像。敲除Wnt途径Axin1和Rnf43的负调控因子及其旁系同源物,使肠组织对抗生长因子的剥夺。特别是,Axin1 / 2敲除有机体(Axin1 / 2 KO)可以在不存在R-spondin(EN:EGF + Noggin)和Wnt(EN + IWP2:EN +豪猪抑制剂)的情况下生长,而Rnf43 / Znrf3突变体组织(R&Z KO)只能在没有R-spondin(EN)的情况下生存。相比之下,WT组织细胞只能在对照培养条件下存活,WENR + Nic(Wnt + EGF + Noggin + R-spondin +烟酰胺)。刻度棒=1,000μm。 请点击此处查看此图的较大版本。
| 基础培养基 | 注释 | |
| 在4℃下储存4周 | ||
| 细胞培养基 | 500 mL | 见材料表 |
| L-谷氨酰胺100x | 5 mL | |
| 缓冲剂1 M | 5 mL | 见材料表 |
| 青霉素链霉素100x | 5 mL | |
| WENR + Nic(Wnt + EGF + Noggin + R-螺旋蛋白+烟酰胺) | ||
| 在4°C储存2周 | ||
| 基础培养基 | 最多50 mL | |
| 神经元细胞无血清补充(50x) | 1 mL | 见马表terials |
| 神经元细胞无血清补充物(100x) | 500μL | 见材料表 |
| 正乙酰半胱氨酸(500mM) | 125μL | |
| 小鼠EGF(100μg/ mL) | 25μL | |
| 小鼠Noggin(100μg/ mL) | 50μL | |
| R-Spondin条件培养基 | 5 mL | |
| Wnt3a条件培养基 | 25 mL | |
| 烟酰胺(1M) | 250μL | |
| EN + CHIR + Y-27632(EGF + Noggin + CHIR + Y-27632) | ||
| 在4°C储存2周 | ||
| 基础培养基不含青霉素链霉素 | 最多20 mL | |
| 神经元细胞无血清补充(50x) | 400μL | 见材料表 |
| 神经元细胞无血清补充物(100x) | 200μL | 见材料表 |
| 正乙酰半胱氨酸(500mM) | 50μL | |
| 小鼠EGF(100μg/ mL) | 10μL | |
| 小鼠Noggin(100μg/ mL) | 20μL | |
| Y-27632(10μM) | 20μL | |
| CHIR99021(8μM) | 10μL | |
| EN(EGF + Noggin) | ||
| 在4℃下储存4周 | ||
| 基础培养基 | 最多50 mL | |
| 神经元细胞无血清补充(50x) | 1 mL | 见材料表 |
| 神经元细胞无血清补充物(100x) | 500μL | 见材料表 |
| 正乙酰半胱氨酸(500mM) | 125μL | |
| 小鼠EGF(100μg/ mL) | 25μL | |
| 小鼠Noggin(100μg/ mL) | 50μL |
表2:有机体介质组成。
讨论
在本协议中,我们详细介绍了产生CRISPR并发剂所需的所有步骤,并将CRISPR-concatemers应用于小肠肠组织,以同时敲除多个基因。如前所述,该策略具有速度快,效率高,成本效益好等优点。
为了顺利执行整个程序,需要考虑几个关键方面。首先,所有gRNA寡核苷酸都必须正确退火和磷酸化,因为它们代表了本身非常有效的Bbs I克隆反应的起始材料。其次,当电穿孔有机体时,每种条件使用的细胞越多,转染效率的最大可能越高。此外,重要的是,细胞解离后,小细胞簇比单细胞占优势。
然而,可能会遇到技术问题尝试克隆或转染第一次时,在gRNA克隆的问题的情况下,建议仔细检查gRNA寡核苷酸序列,如果正确,选择额外的细菌菌落进行限制性消化筛选。如果转染效率和细胞活力低于电穿孔后,建议每个条件使用更多细胞重复该方案,并将细胞解离时间缩短至3分钟。
虽然CRISPR联合器的生成相对便宜且容易,但是在组织细胞中进行更大规模的遗传筛选不是,因为规模受到与器官培养相关的成本和劳动密集型的限制。在这种情况下值得一提的是,CRISPR并联方法也与细胞系如HEK293和小鼠胚胎干细胞相容。
不管细胞系统,这个的另一个潜在的缺点当瞄准同时敲除三个或四个不同基因时,可能会遇到策略。例如,每个gRNA将具有不同的靶向效率,并且同时击中所有基因的变化可以相对较低;出于这个原因,建议使用连接体系引导不止一种gRNA反对相同的基因。
同样基于金门洗牌替代战略已经提出,多年来产生多重gRNA载体7,8。然而,在我们的方法中,可以在单次克隆中将多个gRNA直接组装到单个逆转录病毒载体中,这使得其适合于产生靶向旁系同源物的gRNA文库。
我们的CRISPR并行器建立在MSCV逆转录病毒载体骨架中。因此,可以使用含gRNA并连反转录病毒的逆转录病毒产生过表达的稳定细胞系ress gRNAs。当与Cas9诱导系统结合使用时,可以使用我们的系统进行诱导型旁系同源基因敲除。
总之,在这里我们将介绍如何在一个步骤中将多达四种不同的gRNA克隆到相同的载体中,以及如何以高转染效率将这一策略应用于有机培养。此外,我们提供有用的建议,以最大限度地提高整个程序成功的机会。
披露声明
作者没有什么可以披露的。作者没有宣布任何利益冲突。
致谢
我们感谢Christopher Hindley对稿件的批判性阅读。 AM由Wntsapp(Marie Curie ITN),AA-R支持。由医学研究理事会(MRC)和BK.K.支持。和RM由Wellcome Trust和Royal Society [101241 / Z / 13 / Z]的Henry Dale奖学金支持,并通过惠康信托基金和MRC向Wellcome Trust - MRC剑桥干细胞研究所提供的核心资助获得支持。
材料
| Name | Company | Catalog Number | Comments |
| Optimized CRISPR Design Tool | Feng Zhang group | CRISPR gRNA design tool; http://crispr.mit.edu/ | |
| Webcutter 2.0 | restriction mapping tool; http://rna.lundberg.gu.se/cutter2/ | ||
| T4 PNK (Polynucleotide Kinase) | New England Biolabs | M0201L | |
| T4 DNA ligase buffer | New England Biolabs | M0202S | |
| T7 DNA Ligase | New England Biolabs | M0318L | |
| DTT (dithiothreitol) | Promega | P1171 | |
| ATP (adenosine triphosphate) | New England Biolabs | P0756S | |
| FastDigest BbsI (BpiI) | Thermo Fisher | FD1014 | |
| Tango buffer (BSA-containing restriction enzyme buffer) | Thermo Fisher | BY5 | |
| BglII | New England Biolabs | R0144 | |
| EcoRI | New England Biolabs | R0101 | |
| Plasmid-safe exonuclease | Cambio | E3101K | |
| Thermal cycler | Applied biosystems | 4359659 | |
| 10G competent E. coli bacteria | Cambridge Bioscience | 60108-1 | |
| Plasmid mini kit | Qiagen | 12125 | |
| Table top microcentrifuge | Eppendorf | UY-02580-01 | |
| Inoculating loops | Microspec | PLS5 | |
| Bacteria incubator | Sanyo | MIR-262 | |
| Luria-Bertani broth (LB) | Sigma-Aldrich | L3522 | |
| Agarose | Sigma-Aldrich | A4718 | |
| Agarose gel electrophoresis apparatus | Bioneer | A-7020 | |
| Advanced DMEM/F12(cell culture medium) | Invitrogen | 12634-034 | |
| Glutamax (L-Glutamine) 100x | Invitrogen | 35050-068 | |
| HEPES 1 M (buffering agent) | Invitrogen | 15630-056 | |
| Penicillin-streptomycin 100x | Invitrogen | 15140-122 | |
| B27 supplement (Neuronal cell serum-free supplement) 50x | Invitrogen | 17504-044 | |
| N2 supplement (Neuronal cell serum-free supplement) 100x | Invitrogen | 17502-048 | |
| n-Acetylcysteine 500 mM | Sigma-Aldrich | A9165-5G | |
| Mouse EGF 500 µg/mL | Invitrogen Biosource | PMG8043 | |
| Mouse Noggin 100 µg/mL | Peprotech | 250-38 | |
| Nicotinamide 1 M | Sigma | N0636 | |
| R-Spondin conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Wnt conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Y-27632 10 µM | Sigma-Aldrich | Y0503-1MG | |
| Standard BD Matrigel matrix | BD Biosciences | 356231 | |
| 48-well Plate | Greiner Bio One | 677980 | |
| CHIR99021 | Sigma-Aldrich | A3734-1MG | |
| IWP-2 | Cell Guidance Systems | SM39-10 | |
| TrypLE (recombinant protease) | Invitrogen | 12605-010 | |
| Opti-MEM (reduced serum medium ) | Life technologies | 51985-034 | |
| Electroporation Cuvettes 2mm gap | NepaGene | EC-002S | |
| Low binding 15 mL tubes | Sigma-Aldrich | CLS430791 | |
| Bürker’s chamber | Sigma-Aldrich | BR719520-1EA | |
| NEPA21 Super Electroporator | NepaGene | contact supplier | |
| Protein LoBind tubes low binding | Thermo Fisher | 10708704 | |
| BTXpress electroporation buffer | Harvard Apparatus | 45-0805 | |
| DMSO (Dimethyl sulfoxide) | AppliChem | A3672 |
参考文献
- Mali, P., et al. RNA-Guided Human Genome Engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Koike-Yusa, H., Li, Y., Tan, E. -. P., Velasco-Herrera, M. D. C., Yusa, K. Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nat Biotech. 32 (3), 267-273 (2014).
- Bassett, A. R., Kong, L., Liu, J. L. A Genome-Wide CRISPR Library for High-Throughput Genetic Screening in Drosophila Cells. J Genet Genomics. 42 (6), 301-309 (2015).
- Diss, G., Ascencio, D., DeLuna, A., Landry, C. R. Molecular mechanisms of paralogous compensation and the robustness of cellular networks. J Exp Zool B Mol Dev Evol. 322 (7), 488-499 (2014).
- Andersson-Rolf, A., Merenda, A., Mustata, R. C., Li, T., Dietmann, S., Koo, B. -. K. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 1-7 (2016).
- Ran, F. A., Hsu, P. P. D., Wright, J., Agarwala, V., Scott, D., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: A one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS ONE. 4 (5), (2009).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Sci Rep. 4 (5), 5400 (2014).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), 1-11 (2014).
- Yin, L., et al. Multiplex Conditional Mutagenesis Using Transgenic Expression of Cas9 and sgRNAs. Genetics. 200 (2), 431-441 (2015).
- Cress, B. F., Toparlak, O. D., et al. CRISPathBrick: Modular Combinatorial Assembly of Type II-A CRISPR Arrays for dCas9-Mediated Multiplex Transcriptional Repression in E. coli. ACS Synth Biol. 4 (9), 987-1000 (2015).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Zimmermann, J., Voss, H., Schwager, C., Stegemann, J., Ansorge, W. Automated Sanger dideoxy sequencing reaction protocol. FEBS Letters. 233 (2), 432-436 (1988).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nat. Protoc. 10 (10), 1474-1485 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. -. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。