Method Article
Un protocollo per il knockout dei geni multipli nei piccoli organoidi intestinali del mouse usando un concatemer CRISPR
In questo articolo
Riepilogo
Questo protocollo descrive i passaggi per la clonazione di singoli RNA guidati singoli in un unico concetto di RNA concatenatore di guida, che è di particolare utilità nella creazione di knockouts multi-gene usando la tecnologia CRISPR / Cas9. La generazione di doppie bocce in organoidi intestinali viene mostrata come possibile applicazione di questo metodo.
Abstract
La tecnologia CRISPR / Cas9 ha notevolmente migliorato la fattibilità e la velocità degli studi di perdita di funzioni, essenziali per la comprensione della funzione genica. Nei eucarioti più alti, i geni paralogici possono mascherare un fenotipo potenziale compensando la perdita di un gene, limitando così le informazioni che possono essere ottenute dagli studi genetici basati su singoli colpi di gene. Abbiamo sviluppato un metodo di clonazione rapido e rapido per concatenanti RNA guida (gRNA) al fine di creare knockouts multi-gene a seguito di un singolo ciclo di trasfezione in organoidi intestinali piccoli del mouse. La nostra strategia consente la concatemerizzazione di fino a quattro gRNA individuali in un singolo vettore eseguendo una singola reazione di shuffling Golden Gate con oligosi gRNA annealed e un vettore retrovirale pre-progettato. Ciò consente l'eliminazione simultanea di fino a quattro geni diversi, o un aumento dell'efficienza di eliminazione dei risultati dopo il targeting di un gene da più gRNAs. In questo protocollo, mostriamo in dettaglioCome clonare in modo efficiente più gRNAs nel retrovirale CRISPR-concatemer vettoriale e come ottenere elettroporazione altamente efficiente negli organoidi intestinali. Ad esempio, mostriamo che l'eliminazione simultanea di due coppie di geni che codificano i regolatori negativi del percorso di segnalazione Wnt (Axin1 / 2 e Rnf43 / Znrf3) rende gli organoidi intestinali resistenti al ritiro dei principali fattori di crescita.
Introduzione
L'approccio alla genetica inversa è un metodo ampiamente utilizzato per indagare la funzione di un gene. In particolare, studi di perdita di funzioni, in cui la rottura di un gene causa alterazioni fenotipiche, svolgono un ruolo fondamentale nella costruzione della nostra comprensione dei processi biologici. Il metodo CRISPR / Cas9 rappresenta il più recente progresso nella tecnologia di ingegneria genomica e ha rivoluzionato l'attuale pratica della genetica in cellule e organismi. Cas9 è una endonucleasi guidata da RNA che si lega a una sequenza specifica del DNA complementare al gRNA e genera una rottura a doppio filamento (DSB). Questo DSB recluta macchinari di riparazione del DNA che, in assenza di un template di DNA per la ricombinazione omologa, ricollegano il filo di DNA tagliato mediante unione terminale non omologale soggetta a errori, che può quindi provocare inserzioni o delezioni di nucleotidi Causando mutazioni frameshift 1 .
La grande facilità e versatilità della CRISPR / Cas9 apprOach lo ha reso uno strumento estremamente attraente per le schermate di knockout su scala genomica mirate a scoprire le funzioni genetiche ignote 2 , 3 . Tuttavia, i metodi di eliminazione dei singoli genomi sono di uso limitato se esistono più paraloghi con funzioni ridondanti. Così, ablare un singolo gene potrebbe non essere sufficiente a determinare la funzione di quel gene dato la possibilità di compensazione da parte di paralogie, con conseguente scarsa o nessuna alterazione fenotipica 4 . È quindi importante eliminare paralogie in parallelo fornendo più vettori di gRNA che mirano ai diversi geni paralogici per superare l'influenza della compensazione genetica.
Per estendere l'uso di CRISPR / Cas9 a un knockout genico paralogo, abbiamo recentemente sviluppato un metodo di clonazione rapido e univoco per clonare fino a quattro gRNA pre-annealed in un unico vettore retrovirale 5 . La base, denominata CRISPR-concatemer, è basataSu un plasmide retrovirale MSCV contenenti cassette di espressione gRNA ripetitive. Ogni cassetta contiene due siti di riconoscimento invertiti dell'organismo di restrizione tipo IIS Bbs I, che può essere rimpiazzato in modo irreversibile da un oligo gRNA ricotto con sovrapposizioni corrispondenti utilizzando una reazione di shuffling Golden Gate in un singolo tubo 6 . Questo metodo di clonazione consiste in cicli ripetitivi di digestione e di legatura che consentono l'assemblaggio simultaneo di più frammenti di DNA sfruttando le diverse sequenze di sovrapposizione generate da Bbs I. L'unicità di questo enzima è ad esempio la capacità di eseguire tagli asimmetrici al di fuori del suo riconoscimento sequenza; Quindi, ogni cassetta può avere una sequenza diversa con sovrapposizioni personalizzate che fiancheggia il sito centrale di Bbs I e in questo modo ciascun gRNA può essere clonato in una specifica posizione e orientamento del vettore concatemer.
Come prova del principio, abbiamo dimostrato l'uso di questa strategia inOrganoidi intestinali del mouse distruggendo contemporaneamente due coppie di regolatori negativi paralogici del percorso Wnt da un ciclo di elettroporazione 5 .
Negli ultimi anni molti altri gruppi hanno sviluppato strategie simili basate su più vettori di espressione di gRNA costruiti utilizzando Golden Shuffling 7 per ottenere il knockout multi-gene in vari sistemi di modelli, come linee cellulari umane 8 , 9 , zebrafish 10 e Escherichia coli 11 . Nei loro protocolli, i gRNA vengono prima clonati in singoli vettori intermedi e poi assemblati in un unico prodotto finale. Al contrario, il vantaggio principale della nostra strategia CRISPR-concatemer è la comodità di un singolo Bbs I shuffling, passo di clonazione. Come altri concatenanti di gRNA, il nostro metodo rende possibile la simultanea eliminazione di fino a quattroDiversi geni o un aumento dell'efficienza di eliminazione di CRISPR dopo il targeting di uno o due geni con più gRNAs ( Figura 1 ).
In questo protocollo, descriviamo in dettaglio ogni passo nella generazione di vettori CRISPR-concatemer, dal design gRNA alla reazione Golden Gate e alla conferma di una clonazione di successo. Inoltre forniamo un protocollo altamente efficace per la transfezione di concatenatori CRISPR in piccoli organoidi intestinali del mouse mediante elettroporazione e successivi esperimenti di ritiro del fattore di crescita.
Protocollo
1. Progettazione di gRNA per il vettore CRISPR-concatemer
Nota: Lo scopo di questa sezione è spiegare come optare per la strategia di targeting migliore e come progettare gRNA contenenti specifiche sovrapposizioni per il vettore CRISPR concatemer.
- Progettare gRNA contro i geni di interesse utilizzando uno strumento di progettazione CRISPR gRNA di scelta. Vedere la tabella dei materiali per un esempio.
NOTA: quando si punta a una coppia di geni paralogici, anche se è possibile progettare un gRNA per gene, è consigliabile progettare due gRNA per gene per aumentare le possibilità di ottenere un doppio knockout ( Figura 1 ). - Assicurarsi che i gRNAs non contengano il sito di riconoscimento di Bbs I utilizzando uno strumento di mappatura di restrizione (vedere la tabella dei materiali per un esempio).
- Aggiungere specifiche sovrapposizioni di vettori CRISPR-concatemer ad ogni oligo, come mostrato nella Tabella 1 .
Tabella 1: Sovrapposizioni per ogni cassetta del CRISPR-concatemer Vector.
2. Clonazione di gRNAs nel CRISPR-concatemer Vector
- La fosforilazione e l'annealing degli oligosi
NOTA: Questo passaggio illustra come tO filamenti superiori e inferiori per ogni oligo di gRNA e come fosforilizzare le loro estremità in una sola reazione.- Preparare la miscela di reazione per fosforilare gli oligosi e ricoprire i fili superiori e inferiori sul ghiaccio, seguendo le istruzioni riportate di seguito.
NOTA: Tutti gli oligosi possono essere raggruppati in una sola reazione; Ad esempio, nel caso di un vettore di concatemer di 4 gRNA, pool insieme 8 oligos. - Per 3 concatenanti, utilizzare 3,0 μL di gRNA top strand (1,0 μL da ciascun gRNA, 10 μM, 1 μL / gRNA), 3,0 μL di strato di fondo gRNA (1,0 μL da ogni gRNA, 10 μM, 1 μL / gRNA), 2,0 μl T4 DNA ligase buffer (10 volte), 1,0 μl T4 PNK e aggiungere H 2 O fino al volume totale di 20,0 μL.
- Mescolare bene pipettando e farlo eseguire in un termociclatore utilizzando le seguenti impostazioni: 37 ° C per 30 minuti, 95 ° C per 5 minuti, rampa fino a 25 ° C a 0,3 ° C / min, tenere a 4 ° C.
- Preparare la miscela di reazione per fosforilare gli oligosi e ricoprire i fili superiori e inferiori sul ghiaccio, seguendo le istruzioni riportate di seguito.
- Bbs Mi commuovo la reazione
NOTA: In questa sezione, gli oligosi gRNA pre-annealed sono incorporati nella posizione appropriata del vettore concatemer in un solo passaggio alternando cicli di digestione e legatura.- Diluire la miscela di reazione 1: 100 in acqua liberata da DNase / RNase per generare 3 e 4 gRNA-concatemer vectors.
NOTA: durante la clonazione di 2 concatenanti di gRNA questo passaggio non è necessario. - Montare la reazione di Bbs I shuffling sul ghiaccio, secondo le istruzioni riportate di seguito. Includi un controllo negativo che contiene solo il vettore.
- Utilizzare 100 ng di vettore CRISPR-concatemer, 10,0 μL di oligo, 1,0 μl di tampone enzimatico restrittivo contenente BSA (10 volte), 1,0 μl DTT (10 mM), 1,0 μl ATP (10 mM), 1,0 μl Bbs I, 1,0 μl T7 ligasi , E H 2 O fino al volume totale di 20,0 μL.
- Mescolare bene pipettando ed eseguire questo in un termociclatore utilizzando le seguenti impostazioni: Eseguire 50 cicli per la clonazione di 3 e 4 concatenanti gRNA e 25 cicli per 2 concatenanti gRNA, entrambi a 37 ° C per 5 min, 21 ° C per 5 min, tenerlo a 37 ° C per 15 minuti, poi 4 ° C per sempre.
- Diluire la miscela di reazione 1: 100 in acqua liberata da DNase / RNase per generare 3 e 4 gRNA-concatemer vectors.
- Trattamento esonuclease
NOTA: Questo passo è altamente raccomandato in quanto aumenta l'efficienza della clonazione eliminando eventuali tracce di DNA linearizzato.- Trattare la reazione di Bbs I che si mescola con un'esonucleasi del DNA (vedere tabella dei materiali ) come segue.
- Prendere 11,0 μL di lega di legatura dalla fase precedente (2.2.3), aggiungere 1,5 μL di tampone di esonuclease (10 volte), 1,5 μl di ATP (10 mM), 1,0 μL di esonucleasi del DNA e portare il volume totale a 15,0 μL con acqua. Incubare a 37 ° C per 30 min poi 70 ° C per 30 min.
NOTA: Questo passaggio elimina qualsiasi DNA linearizzato residuo nella miscela e quindi aumenta l'efficienza di clonazione. - Utilizzare 2 μL della miscela di reazione per la trasformazione in chimicaTenero batteri E. coli da shock termico 12 .
NOTA: In alternativa, la reazione può essere conservata fino a una settimana a -20 ° C.
- La digestione della restrizione
NOTA: Lo scopo di questa fase è valutare il successo della procedura di clonazione mediante la digestione di restrizione.- Per confermare la presenza di inserti di gRNA nel vettore CRISPR-concatemer, raccogliere 4 - 8 colonie batteriche con un ciclo di inoculazione, crescere ogni clone in 4 ml di mezzo LB per una notte a 37 ° C in un agitatore orbitale. Estrarre il DNA utilizzando un kit di miniprep plasmide secondo le istruzioni del produttore (vedi tabella dei materiali ).
- Digestare ~ 200 ng di DNA con 10 U EcoR I + 5 U Bgl II in una reazione di 10 μl incubandandola a 37 ° C per 3 ore in un incubatore di batteri. Includere una miscela di reazione separata con il corrispondente vettore originale come un controllo positivo per il confronto delle dimensioni.
NOTA: ThiS confermerà se tutti i concatenanti sono presenti, poiché questi due enzimi di restrizione escluderanno i concatenatori interi. Queste sono le dimensioni previste per ciascun concatenatore: 2 gRNA-concatemer (800 bp), 3 gRNA-concatemer (1,2 kbp) e 4 gRNA-concatemer (1,6 kbp). - Effettuare reazioni di digestione su un agarosio 1% a 90 V per circa 20 min.
- Visualizzare il gel con un transilluminatore UV. Identificare i cloni con una dimensione corretta dell'inserto assicurandosi che il loro pattern di banda corrisponda a quello del vettore originale e che ogni frammento abbia le dimensioni previste utilizzando una scala del DNA.
- Digestare i cloni selezionati con 5 U Bbs I a 37 ° C per 3 ore in un incubatore di batteri. Includere un mix di reazione separato con il corrispondente vettore originale come un controllo.
NOTA: Questa ulteriore fase di digestione è quella di confermare che i gRNA sono stati clonati nella posizione giusta e di conseguenza tutti i siti di riconoscimento di Bbs I sono stati persi. - Eseguire le reazioni di digestioneUn 1% di agarosio a 90 V per circa 20 min. Consideriamo corretti solo i vettori che non sono tagliati da Bbs I in quanto contengono solo gRNAs.
- Sequenziamento vettoriale
NOTA: Lo scopo di questa fase è quello di confermare la presenza di sequenze di gRNA in quei vettori identificati come corretti dall'analisi della digestione di restrizione.- Confermare i vettori concatemer positivi da sequenziamento di Sanger 13 utilizzando i seguenti primer:
In avanti: TCAAGCCCTTTGTACACCCTAAG (per il controllo della prima cassetta di gRNA)
Linker1_Forward: GACTACAAGGACGACGATGACAA (per il controllo della seconda cassetta gRNA)
Linker2_Reverse: GGCGTAGTCGGGCACGTCGTAGGGGT (per il controllo della seconda cassetta di gRNA)
Linker2_Forward: ACCCCTACGACGTGCCCGACTACGCC (per il controllo della terza cassetta di gRNA)
Linker3_Reverse: TCCTCCTCTGAGATCAGCTTCTGCAT (per il controllo della terza cassetta di gRNA)
Reverse: AGGTGGCGCGAAGGGGCCACCAAAG (per il controllo dell'ultimo gRNAcassetta) - Controllare la presenza di tutti i gRNA cercando le loro sequenze nelle letture di sequenza.
- Confermare i vettori concatemer positivi da sequenziamento di Sanger 13 utilizzando i seguenti primer:
3. Trasfezione di organoidi intestinali mediante elettroporazione
NOTA: Si prega di notare che questa procedura si basa sul protocollo pubblicato da Fujii et al . Nel 2015, con adattamento per le piccole organizzazioni organiche intestinali del topo 14 .
- Pre-elettroporazione
NOTA: Questa sezione descrive come preparare gli organoidi intestinali del mouse prima dell'elettroporazione rimuovendo tutti gli antibiotici ei supporti condizionati dal loro mezzo di coltura. Ciò impedirà possibili effetti tossici durante l'elettroporazione.- Al giorno 0 della procedura di trasfusione, dividere gli organoidi in un rapporto 1: 2.
NOTA: Le colture organoide intestinali possono essere ottenute eseguendo l'isolamento cripta secondo protocolli precedentemente stabiliti 15 . Per favore riferisci a Tabella 2 per tutte le composizioni mediatiche.- Quando si dividono gli organoidi per l'elettroporazione, sementi almeno 6 pozzetti di una piastra a 48 pozzetti per transfezione.
- Seme gli organoidi in gocce di matrici di 20 μL e le coltivano in un mezzo WENR + Nic (Wnt + EGF + Noggin + R-spondin + Nicotinamide) a 37 ° C, 5% CO 2 in un incubatore umidificato (come descritto in precedenza 15 ) .
- Il giorno 2, sostituire WENR + Nic con 250 μL di EN (EGF + Noggin) + CHIR99021 (inibitore della sintetasi di glicogeno-sintasi) + Y-27632 (inibitore di ROCK), senza antibiotici (vedere tabella 2 ).
NOTA: in tutti i passaggi la quantità di mezzo aggiunto ad ogni pozzetto di una piastra a 48 pozzetti è di 250 μL. - Il giorno 3, modificare il mezzo organoidico a EN + CHIR99021 + Y-27632 + 1,25% v / v Dimetil sulfossido (DMSO), senza antibiotici.
- Al giorno 0 della procedura di trasfusione, dividere gli organoidi in un rapporto 1: 2.
- Preparazione delle cellule
NOTA:Qui descriviamo come frammentare organoidi nei cluster di piccole cellule mediante dissociazione meccanica e chimica. Questi passaggi sono fondamentali per il successo della procedura.- Il giorno 4, interrompere le cupole della matrice di basamento utilizzando una punta pipetta da 1 ml e trasferire organoidi in un tubo da 1,5 mL. Contenuto della piscina di quattro pozzetti di una piastra da 48 pozzetti in un tubo.
- Interrompe meccanicamente gli organoidi in piccoli frammenti pipettando su e giù con una pipetta P200 circa 200 volte. Centrifugare a temperatura ambiente, 5 min a 600 x g.
- Rimuovere il mezzo e risospendere il pellet in 1 mL di una proteasi ricombinante a coltura cellulare (vedi tabella dei materiali). Incubare a 37 ° C per un massimo di 5 minuti e quindi controllare una goccia di campione di 50 μl sotto un microscopio leggero invertito con un obiettivo 4x.
NOTA: I cluster di 10-15 cellule sono desiderabili, in quanto ciò aumenta la sopravvivenza cellulare dopo l'elettroporazione. - Trasferire la sospensione cellulare in un tubo da 15 mL a basso tenore e arrestare laDissociazione aggiungendo 9 mL di mezzo basale senza antibiotici (vedi tabella 2 ). Centrifugare a temperatura ambiente, 5 min a 600 xg, quindi scartare il surnatante e risospendere il pellet in 1 ml di mezzo di siero ridotto (vedi tabella dei materiali ).
- Contare il numero di cellule con una camera di Bürker e utilizzare un minimo di 1 x 10 5 cellule per reazione di elettroporazione. Aggiungere 9 mL di media sierica ridotta al tubo da 15 mL e centrifugare a temperatura ambiente, 3 min a 400 x g.
- elettroporazione
NOTA: Le seguenti sezioni forniscono istruzioni su come eseguire l'elettroporazione e per rendere gli organoidi recuperati in seguito.- Rimuovere tutto il supernatante e risospendere il pellet in una soluzione di elettroporazione (vedere tabella dei materiali ). Aggiungere una somma totale di 10 μg di DNA alla sospensione cellulare e aggiungere una soluzione di elettroporazione ad un volume finale di 100 μl e mantenere la DN-cellulaUna miscela sul ghiaccio. Utilizzare vettori CRISPR-concatamer in combinazione con un plasmide di espressione Cas9 ( ad es. Addgene # 41815) in un rapporto 1: 1.
NOTA: Il volume totale del DNA aggiunto deve essere inferiore o pari al 10% del volume totale di reazione. - Includere un miscuglio di transfezione separato contenente un plasmide GFP per valutare l'efficacia della trasfezione ( p.es. pCMV-GFP, Addgene # 11153, o qualsiasi generico plasmide GFP-esprimente).
- Aggiungere la miscela cellulare-DNA alla cuvetta dell'elettroporazione e posizionarla nella camera di elettroporatore. Misurare l'impedenza premendo il pulsante appropriato sull'elettroporatore e verificare che sia 0,030-0,055 Ω. Eseguire l'elettroporazione in base alle impostazioni riportate nella Tabella 3 .
NOTA: Se il valore dell'impedenza scende al di fuori dell'intervallo consentito, regolare il volume della soluzione nella cuvetta. - Aggiungere 400 μl di tampone di elettroporazione + Y-27632 alla cuvetta e quindi trasferire tutto in un tubo da 1,5 mL. incubaA temperatura ambiente per 30 minuti per consentire alle cellule di recuperare e successivamente spinarle a temperatura ambiente per 3 min a 400 x g.
- Rimuovere il surnatante e risospendere il pellet in 20 μL / pozzetto della matrice del basamento. Seme circa 1 x 10 4 a 1 x 10 5 cellule per pozzetto in una piastra a 48 pozzetti e aggiungere EN + CHIR99021 + Y-27632 + 1,25% v / v DMSO medium. Incubare a 37 ° C.
- Al giorno 5, cambiare il mezzo su EN + CHIR99021 + Y-27632 e controllare l'efficienza della trasfezione osservando l'espressione GFP ( Figura 2 ). Tenere gli organoidi a 37 ° C e aggiornare EN + CHIR99021 + Y-27632 dopo 2 giorni.
- Il giorno 9, cambiare il mezzo a WENR + Nic + Y-27632 e incubare a 37 ° C.
NOTA: Y-27632 può essere rimosso dopo 7-10 giorni (il giorno 16-19).
- Rimuovere tutto il supernatante e risospendere il pellet in una soluzione di elettroporazione (vedere tabella dei materiali ). Aggiungere una somma totale di 10 μg di DNA alla sospensione cellulare e aggiungere una soluzione di elettroporazione ad un volume finale di 100 μl e mantenere la DN-cellulaUna miscela sul ghiaccio. Utilizzare vettori CRISPR-concatamer in combinazione con un plasmide di espressione Cas9 ( ad es. Addgene # 41815) in un rapporto 1: 1.
| Pulse di poring | Impulso di trasferimento | |
| Voltaggio | 175V | 20V |
| Lunghezza impulsi | 5 msec | 50msec |
| Intervallo di impulso | 50msec | 50msec |
| Numero di impulsi | 2 | 5 |
| Tasso di decadimento | 10% | 40% |
| Polarità | + | +/- |
Tabella 3: Impostazioni di elettroporazione.
4. Rilascio del fattore di crescita
Nota: qui è esemplificato come condurre un esperimento di ritiro del fattore di crescita quando elimini regolatori negativi del percorso Wnt in organoidi intestinali.
- 10-14 giorni afteR, dividono gli organoidi in un rapporto 1: 3 in una piastra a 48 pozzetti seguendo le fasi sopra menzionate (3.2.1 - 3.2.2).
- Resuspendere il pellet organoide in 20 μL di matrice di membrana basale e lasciarlo solidificare a 37 ° C per 10 min. Quindi, sovrapporre 250 μL di mezzo di crescita privo di fattori di crescita ( ad es. EN) per verificare se è stata raggiunta l'eliminazione dei geni bersaglio 5 .
- Distribuire gli organoidi in condizioni di fattore di crescita estraneo per un minimo di 2 - 3 passaggi per vedere una differenza di sopravvivenza tra organoidi di controllo wildtype (WT) e organoidi mutanti 5 , 15 .
NOTA: Gli organoidi del tipo Wildtype non dovrebbero sopravvivere in mezzo a due fattori, mentre le linee mutanti dovrebbero essere in grado di crescere.
Risultati
Per confermare la presenza del numero corretto di inserti gRNA nel vettore concatemer, la digestione di restrizione viene eseguita con enzimi ( EcoR I + Bgl II) che fiancheggiano tutte le cassette esprimenti gRNA (ogni dimensione del cassetto è ~ 400 bp, figura 1 ). Ad esempio, quando si genera un vettore 4 gRNA-concatemer, la dimensione prevista della banda inferiore nel gel agarosio è di circa 1,6 Kbp; Qualsiasi banda inferiore a questa indica che non tutte le 4 cassette gRNA sono inserite nel vettore ( Figura 2A ). Inoltre, è sempre consigliabile verificare che tutti i siti di riconoscimento di Bbs I siano persi e che l'enzima non taglia il vettore ( Figura 2B ).
Una volta confermati i costrutti, possono essere consegnati agli organoidi intestinali del mouse mediante elettroporazione per ottenere ottimi risultatiL livelli di efficienza di trasfezione (fino al 70%), come mostrato dal controllo GFP ( Figura 3 ).
Infine, per testare funzionalmente l'efficacia di questa strategia, organoidi intestinali trasfettati con Cas9 e vettori concatemer contro Axin1 / 2 e Rnf43 / Znrf3 sono stati coltivati in EN (R-spondin withdrawal) e EN + IWP2 (R-spondin e Wnt withdrawal, IWP2 : Inibitore di Porcupine, 2,5 μM) per un minimo di 3 passaggi ( Figura 4 ). Mentre gli organoidi WT non transfettati sono morti in entrambe le condizioni, gli organoidi knockout Axin1 / 2 sono sopravvissuti sia in seguito all'attivazione a valle del percorso Wnt; Inoltre, gli organoidi mutanti di Rnf43 / Znrf3 sopravvivono in assenza di R-spondina ma non sopravvivono in presenza di IWP2, che provocano l'esaurimento del Wnt che attiva il percorso. Considerati insieme, queste osservazioni dimostrano che la cancellazione di queste coppie di paralogie è possibile generando tSi aspettava il fenotipo dell'organoide. I dettagli di questi risultati sono stati pubblicati in Developmental Biology 5 .
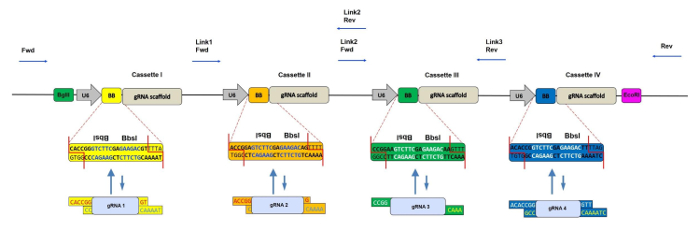
Figura 1: Rappresentazione schematica del CRISPR-concatemer con 4 cassette. Schema del 4 gRNA-concatemer vettore con ogni cassetta da 400 bp contenente un promotore U6, due siti Bbs I ripetuti invertiti (indicati anche come BB) e scaffold gRNA in questo ordine. Durante la reazione di mutamento, i siti di Bbs I sono sostituiti da frammenti di gRNA con sovrapposizioni corrispondenti e conseguentemente persi. I siti di rilegatura dei primer sequenziali per controllare l'inserimento corretto di oligomi gRNA sono mostrati dalle frecce blu. Fwd = primer avanti, Rev = primer inverso, Link 1/2/3 = regioni linker 1/2/3. CLeccate qui per vedere una versione più grande di questa figura.

Figura 2: Rappresentativi schemi di digestione dei concatemer vettori. ( A ) Doppia digestione di 3 e 4 gRNA-concatemer vettori con EcoR I e Bgl II. Il modello di digestione corretto è contrassegnato da un segno verde, mentre i vettori con solo 1 o 2 inserzioni di gRNA sono contrassegnati da una croce rossa. La corsia 1 mostra la digestione di un vettore genitori 4 gRNA-concatemer utilizzato come controllo positivo (contrassegnato da "+"); Allo stesso modo, la corsia 5 mostra la digestione di un vettore genitori 3 gRNA-concatemer, contrassegnato da "+". ( B ) Digestione con Bbs I, che mostra la giusta dimensione dei vettori di concatemer non indesiderati (indicati dalle zecche verdi). La digestione di un vettore concatemer contenente gRNA che ha perso i siti di Bbs I viene utilizzato come un controllo positivoD è contrassegnato da "+". Clicca qui per visualizzare una versione più grande di questa figura.
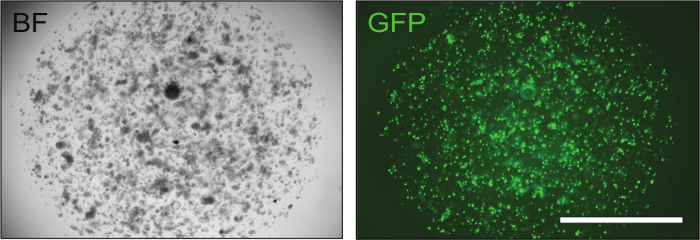
Figura 3: Immagine rappresentativa degli organoidi intestinali con successo elettroporazione. La trasfezione di un plasmide di GFP è strumentale per valutare l'efficacia della trasfezione. Circa 24 ore dopo l'elettroporazione, sono già visibili organoidi contenenti un piccolo numero di cellule e, se la procedura di elettroporazione ha avuto successo, fino al 70% di loro mostra la fluorescenza verde. BF = campo luminoso, GFP = proteina fluorescente verde. Barra di scala = 2.000 μm. Clicca qui per visualizzare una versione più grande di questa figura.
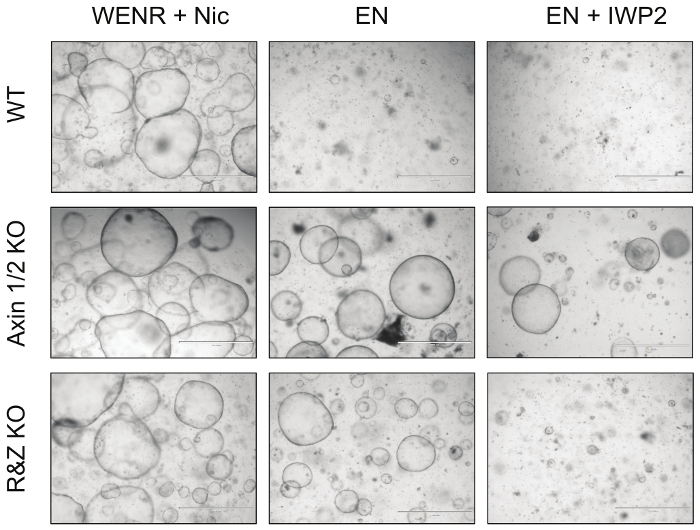
Figura 4: Immagini rappresentative degli organiidi intestinali mutanti. La rottura dei regolatori negativi del percorso Wnt Axin1 e Rnf43, insieme ai loro paraloghi, rende i organoidi intestinali resistenti alla deprivazione del fattore di crescita. In particolare, gli organoidi di Axin1 / 2 (Axin1 / 2 KO) possono crescere in assenza di R-spondin (EN: EGF + Noggin) e Wnt (EN + IWP2: EN + Porcupine inibitore), mentre gli organoidi mutanti Rnf43 / Znrf3 (R & Z KO) può sopravvivere solo in assenza di R-spondin (EN). Al contrario, gli organoidi WT possono sopravvivere solo nella condizione di coltura di controllo, WENR + Nic (Wnt + EGF + Noggin + R-spondin + Nicotinamide). Barre di scala = 1000 μm. Clicca qui per visualizzare una versione più grande di questa figura.
| Medio basale | Commenti | |
| Conservare a 4 ° C per 4 settimane | ||
| Mezzo di coltura cellulare | 500 mL | Vedere la tabella dei materiali |
| L-Glutamina 100x | 5 mL | |
| Agente di tamponamento 1 M | 5 mL | Vedere la tabella dei materiali |
| Penicillina Streptomicina 100x | 5 mL | |
| WENR + Nic (Wnt + EGF + Noggin + R-spondina + Nicotinamide) | ||
| Conservare a 4 ° C per 2 settimane | ||
| Medio basale | Fino a 50 ml | |
| Supplemento senza serum della cellula neuronale (50x) | 1 ml | Vedi tabella di materiali |
| Integratore senza cellule neuronali (100x) | 500 μL | Vedere la tabella dei materiali |
| N-Acetilcisteina (500 mM) | 125 μL | |
| Mouse EGF (100 μg / mL) | 25 μL | |
| Mouse Noggin (100 μg / mL) | 50 μL | |
| R-Spondin condizionato mezzo | 5 mL | |
| Wnt3a condizionato mezzo | 25 mL | |
| Nicotinamide (1 M) | 250 μL | |
| EN + CHIR + Y-27632 (EGF + Noggin + CHIR + Y-27632) | ||
| Conservare a 4 ° C per 2 settimane | ||
| Medio basale senza penicillina Streptomicina | Fino a 20 ml | |
| Supplemento senza serum della cellula neuronale (50x) | 400 μL | Vedere la tabella dei materiali |
| Integratore senza cellule neuronali (100x) | 200 μL | Vedere la tabella dei materiali |
| N-Acetilcisteina (500 mM) | 50 μL | |
| Mouse EGF (100 μg / mL) | 10 μL | |
| Mouse Noggin (100 μg / mL) | 20 μl | |
| Y-27632 (10 μM) | 20 μl | |
| CHIR99021 (8 μM) | 10 μL | |
| EN (EGF + Noggin) | ||
| Conservare a 4 ° C per 4 settimane | ||
| Medio basale | Fino a 50 ml | |
| Supplemento senza serum della cellula neuronale (50x) | 1 mL | Vedi tabella dei materiali |
| Integratore senza cellule neuronali (100x) | 500 μL | Vedi tabella dei materiali |
| N-Acetilcisteina (500 mM) | 125 μL | |
| Mouse EGF (100 μg / mL) | 25 μL | |
| Mouse Noggin (100 μg / mL) | 50 μL |
Tabella 2: Composizione di organi medi.
Discussione
In questo protocollo, abbiamo dettagliato tutti i passaggi necessari per generare concateneri CRISPR e applicare i concatenatori CRISPR negli organoidi intestinali del mouse allo scopo di eliminare contemporaneamente più geni. Come già accennato, questa strategia ha diversi vantaggi, come la sua velocità, l'alta efficienza e l'efficacia dei costi.
Per eseguire con successo l'intera procedura, ci sono alcuni aspetti critici da considerare. In primo luogo, è essenziale che tutti gli oligomi di gRNA siano adeguatamente ricottati e fosforilati, in quanto rappresentano il materiale di partenza per la reazione clonazione di Bbs I che in sé è molto efficace. In secondo luogo, quando l'elettroporazione degli organoidi, più le cellule utilizzate per condizione, maggiore è la massima efficienza di trasfezione possibile. Inoltre, è anche importante che dopo la dissociazione cellulare, i cluster di piccole cellule predominano su singole cellule.
Tuttavia, è possibile incontrare problemi tecniciQuando tentano la clonazione o la trasfezione per la prima volta; Nel caso di problemi durante la clonazione di gRNA, si consiglia di verificare la sequenza oligo gRNA e, se corretto, selezionare ulteriori colonie batteriche per la screening della digestione di restrizione. Se l'efficienza di transfection e la vitalità cellulare sono basse post-elettroporazione, allora è consigliabile ripetere il protocollo utilizzando più cellule per condizione e ridurre il tempo della dissociazione cellulare a 3 min.
Sebbene la generazione di CRISPR-concatemers sia relativamente poco costosa e facile, l'esecuzione di schermi genetici di dimensioni maggiori in organoidi non è perché la scala è limitata dai costi associati alla cultura dell'organoide e dalla sua intensità di lavoro. Vale la pena menzionare in questo caso che il metodo CRISPR-concatemer è anche compatibile con linee cellulari, come HEK293 e cellule staminali embrionali del mouse.
Indipendentemente dal sistema cellulare, un altro potenziale inconveniente di questo sSi può incontrare quando si punta alla simultanea eliminazione di tre o quattro geni differenti. Ad esempio, ogni gRNA avrà un'efficienza di targeting diversa e le modifiche di colpire tutti i geni allo stesso tempo possono essere relativamente basse; Per questo motivo è consigliabile impiegare il sistema concatemer per indirizzare più di un gRNA contro lo stesso gene.
Nel corso degli anni sono state proposte strategie alternative, basate sul Golden Shuffling, per generare vettori gRNA multiplex 7 , 8 . Tuttavia, nel nostro metodo è possibile assemblare direttamente più gRNAs in un singolo vettore retrovirale in un singolo ciclo di clonazione, che lo rende adatto per generare librerie di gRNA a destinare i paraloghi.
Il nostro CRISPR-concatemer è costruito nel backbone vettoriale retrovirale MSCV. Pertanto, il retrovirus contenente concatemer di gRNA può essere utilizzato per generare linee cellulari stabili che sovraesperienzaGRNA di ress. In combinazione con un sistema Cas9-indicibile, è possibile eseguire indizibili uscite paralogiche usando il nostro sistema.
In sintesi, qui descriviamo come clonare fino a quattro gRNA differenti nello stesso vettore in un solo passo e come applicare questa strategia alla cultura organica con un'elevata efficienza di trasfezione. Inoltre forniamo suggerimenti utili per massimizzare le probabilità di successo durante tutta la procedura.
Divulgazioni
Gli autori non hanno nulla da rivelare. Gli autori non hanno dichiarato alcun conflitto di interessi.
Riconoscimenti
Ringraziamo Christopher Hindley per la lettura critica del manoscritto. AM è supportato da Wntsapp (Marie Curie ITN), AA-R. È sostenuta dal Consiglio di Ricerca Medica (MRC) e BK.K. E RM sono sostenuti da una Sir Henry Dale Fellowship della Wellcome Trust e dalla Royal Society [101241 / Z / 13 / Z] e ricevono il sostegno attraverso una borsa di studio del Wellcome Trust e MRC alla Wellcome Trust - MRC Cambridge Stem Cell Institute .
Materiali
| Name | Company | Catalog Number | Comments |
| Optimized CRISPR Design Tool | Feng Zhang group | CRISPR gRNA design tool; http://crispr.mit.edu/ | |
| Webcutter 2.0 | restriction mapping tool; http://rna.lundberg.gu.se/cutter2/ | ||
| T4 PNK (Polynucleotide Kinase) | New England Biolabs | M0201L | |
| T4 DNA ligase buffer | New England Biolabs | M0202S | |
| T7 DNA Ligase | New England Biolabs | M0318L | |
| DTT (dithiothreitol) | Promega | P1171 | |
| ATP (adenosine triphosphate) | New England Biolabs | P0756S | |
| FastDigest BbsI (BpiI) | Thermo Fisher | FD1014 | |
| Tango buffer (BSA-containing restriction enzyme buffer) | Thermo Fisher | BY5 | |
| BglII | New England Biolabs | R0144 | |
| EcoRI | New England Biolabs | R0101 | |
| Plasmid-safe exonuclease | Cambio | E3101K | |
| Thermal cycler | Applied biosystems | 4359659 | |
| 10G competent E. coli bacteria | Cambridge Bioscience | 60108-1 | |
| Plasmid mini kit | Qiagen | 12125 | |
| Table top microcentrifuge | Eppendorf | UY-02580-01 | |
| Inoculating loops | Microspec | PLS5 | |
| Bacteria incubator | Sanyo | MIR-262 | |
| Luria-Bertani broth (LB) | Sigma-Aldrich | L3522 | |
| Agarose | Sigma-Aldrich | A4718 | |
| Agarose gel electrophoresis apparatus | Bioneer | A-7020 | |
| Advanced DMEM/F12(cell culture medium) | Invitrogen | 12634-034 | |
| Glutamax (L-Glutamine) 100x | Invitrogen | 35050-068 | |
| HEPES 1 M (buffering agent) | Invitrogen | 15630-056 | |
| Penicillin-streptomycin 100x | Invitrogen | 15140-122 | |
| B27 supplement (Neuronal cell serum-free supplement) 50x | Invitrogen | 17504-044 | |
| N2 supplement (Neuronal cell serum-free supplement) 100x | Invitrogen | 17502-048 | |
| n-Acetylcysteine 500 mM | Sigma-Aldrich | A9165-5G | |
| Mouse EGF 500 µg/mL | Invitrogen Biosource | PMG8043 | |
| Mouse Noggin 100 µg/mL | Peprotech | 250-38 | |
| Nicotinamide 1 M | Sigma | N0636 | |
| R-Spondin conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Wnt conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Y-27632 10 µM | Sigma-Aldrich | Y0503-1MG | |
| Standard BD Matrigel matrix | BD Biosciences | 356231 | |
| 48-well Plate | Greiner Bio One | 677980 | |
| CHIR99021 | Sigma-Aldrich | A3734-1MG | |
| IWP-2 | Cell Guidance Systems | SM39-10 | |
| TrypLE (recombinant protease) | Invitrogen | 12605-010 | |
| Opti-MEM (reduced serum medium ) | Life technologies | 51985-034 | |
| Electroporation Cuvettes 2mm gap | NepaGene | EC-002S | |
| Low binding 15 mL tubes | Sigma-Aldrich | CLS430791 | |
| Bürker’s chamber | Sigma-Aldrich | BR719520-1EA | |
| NEPA21 Super Electroporator | NepaGene | contact supplier | |
| Protein LoBind tubes low binding | Thermo Fisher | 10708704 | |
| BTXpress electroporation buffer | Harvard Apparatus | 45-0805 | |
| DMSO (Dimethyl sulfoxide) | AppliChem | A3672 |
Riferimenti
- Mali, P., et al. RNA-Guided Human Genome Engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Koike-Yusa, H., Li, Y., Tan, E. -. P., Velasco-Herrera, M. D. C., Yusa, K. Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nat Biotech. 32 (3), 267-273 (2014).
- Bassett, A. R., Kong, L., Liu, J. L. A Genome-Wide CRISPR Library for High-Throughput Genetic Screening in Drosophila Cells. J Genet Genomics. 42 (6), 301-309 (2015).
- Diss, G., Ascencio, D., DeLuna, A., Landry, C. R. Molecular mechanisms of paralogous compensation and the robustness of cellular networks. J Exp Zool B Mol Dev Evol. 322 (7), 488-499 (2014).
- Andersson-Rolf, A., Merenda, A., Mustata, R. C., Li, T., Dietmann, S., Koo, B. -. K. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 1-7 (2016).
- Ran, F. A., Hsu, P. P. D., Wright, J., Agarwala, V., Scott, D., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: A one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS ONE. 4 (5), (2009).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Sci Rep. 4 (5), 5400 (2014).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), 1-11 (2014).
- Yin, L., et al. Multiplex Conditional Mutagenesis Using Transgenic Expression of Cas9 and sgRNAs. Genetics. 200 (2), 431-441 (2015).
- Cress, B. F., Toparlak, O. D., et al. CRISPathBrick: Modular Combinatorial Assembly of Type II-A CRISPR Arrays for dCas9-Mediated Multiplex Transcriptional Repression in E. coli. ACS Synth Biol. 4 (9), 987-1000 (2015).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Zimmermann, J., Voss, H., Schwager, C., Stegemann, J., Ansorge, W. Automated Sanger dideoxy sequencing reaction protocol. FEBS Letters. 233 (2), 432-436 (1988).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nat. Protoc. 10 (10), 1474-1485 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. -. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon