Method Article
Un protocolo para múltiples genes Knockout en ratón Intestinal Organoids utilizando un CRISPR-concatemer
En este artículo
Resumen
Este protocolo describe los pasos para la clonación de múltiples ARN guía único en un guía de ARN concatemer vector, que es de uso particular en la creación de múltiples gen knockouts utilizando CRISPR / Cas9 tecnología. La generación de knockouts dobles en organoides intestinales se muestra como una posible aplicación de este método.
Resumen
La tecnología CRISPR / Cas9 ha mejorado en gran medida la viabilidad y velocidad de los estudios de pérdida de función que son esenciales para comprender la función del gen. En los eucariotas superiores, los genes paralogous pueden enmascarar un fenotipo potencial mediante la compensación de la pérdida de un gen, limitando así la información que se puede obtener de los estudios genéticos que dependen de knockouts único gen. Hemos desarrollado un nuevo y rápido método de clonación para guiar ARN (gRNA) concatemers con el fin de crear múltiples gen knockouts después de una sola ronda de transfección en ratón de intestino delgado organoides. Nuestra estrategia permite la concatemerización de hasta cuatro gRNAs individuales en un único vector mediante la realización de una única puerta Golden Gate de reacción con oligos recocido gRNA y un vector retroviral pre-diseñado. Esto permite la eliminación simultánea de hasta cuatro genes diferentes, o una mayor eficiencia knockout después de la orientación de un gen por múltiples gRNAs. En este protocolo, mostramos en detalleCómo clonar de forma eficaz múltiples gRNAs en el vector CRATR-CRATRAT retroviral y cómo lograr electroporación altamente eficiente en organoides intestinales. A modo de ejemplo, se muestra que la eliminación simultánea de dos pares de genes que codifican los reguladores negativos de la vía de señalización Wnt (Axin1 / 2 y Rnf43 / Znrf3) hace que los organoides intestinales resistentes a la retirada de factores clave de crecimiento.
Introducción
El enfoque genético inverso es un método ampliamente utilizado para investigar la función de un gen. En particular, los estudios de pérdida de función, en los que la alteración de un gen causa alteraciones fenotípicas, desempeñan un papel clave en la construcción de nuestra comprensión de los procesos biológicos. El método CRISPR / Cas9 representa el avance más reciente en la tecnología de ingeniería del genoma y ha revolucionado la práctica actual de la genética en células y organismos. Cas9 es una endonucleasa guiada por ARN que se une a una secuencia de ADN específica complementaria al ARNg y genera una rotura de doble hebra (DSB). Este DSB recluta maquinaria de reparación de ADN que, en ausencia de una plantilla de ADN para la recombinación homóloga, volverá a ligar la cadena de ADN cortada a través de uniones finales no homólogas propensas a error, lo que puede dar lugar a inserciones o deleciones de nucleótidos, Causando mutaciones de frameshift 1 .
La gran facilidad y versatilidad del CRISPR / Cas9 apprOach ha hecho que sea una herramienta muy atractiva para las pantallas de knockout de escala genómica dirigida a desentrañar las funciones de genes desconocidos 2 , 3 . Sin embargo, los enfoques de knockout de gen único son de uso limitado si existen múltiples paralogues con funciones redundantes. Por lo tanto, la ablación de un solo gen podría no ser suficiente para determinar la función de ese gen dado compensación posible por paralogues resultando en poca o ninguna alteración fenotípica [ 4] . Por lo tanto, es importante eliminar los paralogues en paralelo mediante la entrega de múltiples gRNA vectores dirigidos a los diferentes genes paralogous con el fin de superar la influencia de la compensación genética.
Para extender el uso de CRISPR / Cas9 a knockout de genes paralogous, hemos desarrollado recientemente un método de clonación rápido, de un solo paso para clonar hasta cuatro gRNA pre-hibridación en un solo vector retroviral [ 5] . La columna vertebral, denominada CRISPR-concatemer, se basa enEn un plásmido retroviral MSCV que contiene casetes de expresión de gRNA repetitivos. Cada casete contiene dos sitios de reconocimiento invertidos de la enzima de restricción Bbs I del Tipo IIS, los cuales pueden ser reemplazados irreversiblemente por un oligo de gRNA recocido con salientes coincidentes usando una reacción de barajadura Golden Gate en un solo tubo 6 . Este método de clonación consiste en ciclos repetitivos de digestión y ligadura que permiten el ensamblaje simultáneo de múltiples fragmentos de ADN explotando las diferentes secuencias de saliente generadas por Bbs I. La singularidad de esta enzima es, por ejemplo, la capacidad de realizar cortes asimétricos fuera de su reconocimiento secuencia; Por lo tanto, cada casete puede tener una secuencia diferente con voladizos personalizados que flanquean sitio central Bbs I y de esta manera, cada gRNA se pueden clonar en una posición específica y la orientación del vector concatemer.
Como prueba de principio, hemos demostrado el uso de esta estrategia enRatón organoides intestinales por la interrupción simultánea de dos pares de paralogous reguladores negativos de la Wnt vía por una ronda de electroporación [ 5] .
Durante los últimos años, muchos otros grupos han desarrollado estrategias similares basadas en múltiples vectores de expresión de gRNA construidos usando la barajadura de Golden Gate 7 para lograr knockout de múltiples genes en varios sistemas modelo, tales como líneas de células humanas 8 , 9 , pez cebra 10 y Escherichia coli 11 . En sus protocolos, los gRNAs se clonan primero en vectores intermedios individuales y luego se ensamblan juntos en un producto final. Por el contrario, la ventaja principal de nuestra estrategia de CRISPR-concatemer es la conveniencia de un solo Bbs I que barajan, paso de la clonación. Al igual que otros concatémicos de gRNA, nuestro método hace posible o bien la eliminación simultánea de hasta cuatroDiferentes genes o un aumento de CRISPR knockout eficiencia después de la orientación de uno o dos genes con múltiples gRNAs ( Figura 1 ].
En este protocolo, describimos en detalle cada paso en la generación de CRISPR-concatemer vectores, desde el diseño de gRNA a la Golden Gate reacción y la confirmación de éxito de la clonación. También proporcionamos un protocolo altamente eficiente para la transfección de CRISPR-concatemers en ratón de organoides de intestino delgado por electroporación y posterior factor de crecimiento de los experimentos de retirada.
Protocolo
1. Diseño de gRNA para el CRISPR-concatemer Vector
Nota: El objetivo de esta sección es explicar cómo optar por la mejor estrategia de orientación y cómo diseñar gRNAs que contengan salientes específicos para el vector CRISPR-concatemer.
- Diseñar gRNAs contra los genes de interés utilizando un CRISPR gRNA herramienta de diseño de elección. Vea la Tabla de Materiales para un ejemplo.
NOTA: Al dirigir un par de genes paralogous, aunque es posible diseñar un gRNA por gen, es aconsejable diseñar dos gRNAs por gen para aumentar las posibilidades de lograr un doble knockout ( Figura 1 ). - Asegúrese de que los gRNA no contengan el sitio de reconocimiento de Bbs I utilizando una herramienta de asignación de restricciones (consulte la Tabla de materiales para ver un ejemplo).
- Añadir específicos CRISPR-concatemer vector saltos a cada oligo, como se muestra en la Tabla 1 .
Tabla 1: Voladizos para cada casete del vector CRISPR-concatemer.
2. Clonación de gRNAs en el CRISPR-concatemer Vector
- Fosforilación y recocido de oligos
NOTA: Este paso ilustra cómo tO recolectar los hilos superiores e inferiores para cada oligo de gRNA y cómo fosforilar sus extremos en una sola reacción.- Preparar la mezcla de reacción para fosforilar los oligos y recocer las hebras superior e inferior sobre hielo, siguiendo las instrucciones a continuación.
NOTA: Todos los oligos se pueden agrupar en una reacción; Por ejemplo, en el caso de un vector de 4 gRNA-concatemer, unen juntos 8 oligos. - Para 3 concatemers, utilizar 3,0 μL de cadena superior de gRNA (1,0 μL de cada ARNg, 10 μM, 1 μL / ARNg), 3,0 μL de cadena de ARNg de fondo (1,0 μL de cada ARNg, 10 μM, 1 μL / ARNg), 2,0 μL de T4 DNA ligase buffer (10x), 1,0 μ l T4 PNK, y añadir H 2 O hasta el volumen total de 20,0 μ l.
- Mezclar bien pipeteando y hacer funcionar este en un termociclador usando los siguientes ajustes: 37 ° C durante 30 min, 95 ° C durante 5 min, rampa hasta 25 ° C a 0,3 ° C / min, mantenga a 4 ° C.
- Preparar la mezcla de reacción para fosforilar los oligos y recocer las hebras superior e inferior sobre hielo, siguiendo las instrucciones a continuación.
- Reacción de barrido de Bbs I
NOTA: En esta sección, los oligos de gRNA pre-recocido se incorporan en la posición apropiada del vector concatemer en una etapa alternando ciclos de digestión y ligación.- Diluir la mezcla de reacción 1: 100 en agua libre de DNasa / RNasa para generar 3 y 4 vectores de concatenador de gRNA.
NOTA: Cuando se clona 2 gRNA-concatemers este paso no es necesario. - Ensamble la reacción de barrido Bbs I en hielo, siguiendo las instrucciones a continuación. Incluir un control negativo que sólo contiene el vector.
- Utilice 100 ng de vector CRISPR-concatemer, 10,0 l mezcla de oligo, 1,0 l de BSA-tampón que contiene la enzima de restricción (10x), 1,0 l de DTT (10 mM), 1,0 l ATP (10 mM), 1,0 l Bbs I, 1,0 l T7 ligasa , Y H $ ₂ $ O hasta un volumen total de 20,0 μl.
- Mezclar bien pipeteando y ejecutar esto en un termociclador utilizando los siguientes ajustes: Ejecutar 50 ciclos para la clonación de 3 y 4 gRNA-concatemers y 25 ciclos para 2 concatenadores de gRNA, tanto a 37 ° C durante 5 min, 21 ° C durante 5 min, mantenga a 37 ° C durante 15 min, luego 4 ° C para siempre.
- Diluir la mezcla de reacción 1: 100 en agua libre de DNasa / RNasa para generar 3 y 4 vectores de concatenador de gRNA.
- Tratamiento con exonucleasa
NOTA: Este paso es muy recomendable ya que aumenta la eficiencia de la clonación al eliminar cualquier rastro de ADN linealizado.- Tratar la reacción de barrido de Bbs I con una exonucleasa de ADN (véase la Tabla de Materiales ) como sigue.
- Tomar 11,0 μL de mezcla de ligación del paso anterior (2.2.3), agregar 1,5 μl de tampón de exonucleasa (10x), 1,5 μl de ATP (10 mM), 1,0 μl de exonucleasa de ADN y aumentar el volumen total a 15,0 μl con agua. Incubar a 37 ° C durante 30 min seguido de 70 ° C durante 30 min.
NOTA: Este paso elimina cualquier ADN lineal residual en la mezcla y aumenta así la eficacia de la clonación. - Utilizar 2 μl de la mezcla de reacción para la transformación enBacterias E. coli tienda por el choque térmico 12 .
NOTA: Alternativamente, la reacción se puede almacenar durante hasta una semana a -20 ° C.
- Digestión de restricción
NOTA: El objetivo de este paso es evaluar por digestión de restricción el éxito del procedimiento de clonación.- Para confirmar la presencia de insertos de gRNA en el vector CRATP-concatemer, recoger 4 a 8 colonias bacterianas con un bucle de inoculación, cultivar cada clon en 4 ml de medio LB durante la noche a 37ºC en un agitador orbital. Extraer el ADN utilizando un kit de miniprep de plásmido de acuerdo con las instrucciones del fabricante (ver Tabla de Materiales ).
- Digerir ~ 200 ng de ADN con 10 U EcoR I + 5 U Bgl II en una reacción de 10 μL incubándolo a 37 ° C durante 3 h en un incubador de bacterias. Incluir una mezcla de reacción separada con el vector original correspondiente como un control positivo para la comparación de tamaños.
NOTA: EsteS confirmará si están presentes todos los concatémeros, ya que estas dos enzimas de restricción excluirán concatemeros enteros. Estos son los tamaños esperados para cada concatemer: 2 gRNA-concatemer (800 pb), 3 gRNA-concatemer (1,2 kbp) y 4 gRNA-concatemer (1,6 kbp). - Realizar reacciones de digestión en un gel de agarosa al 1% a 90 V durante aproximadamente 20 min.
- Visualice el gel usando un transiluminador UV. Identificar los clones con tamaño de inserto correcto asegurando que su patrón de banda coincida con el del vector original y que cada fragmento tenga el tamaño esperado usando una escala de ADN.
- Digerir los clones seleccionados con 5 U Bbs I a 37 ° C durante 3 h en un incubador de bacterias. Incluir una mezcla de reacción separada con el vector original correspondiente como control.
NOTA: Este paso de digestión adicional es para confirmar que los gRNAs se han clonado en la posición correcta y consecuentemente se han perdido todos los sitios de reconocimiento de Bbs I. - Ejecutar reacciones de digestión enUn gel de agarosa al 1% a 90 V durante aproximadamente 20 min. Considerar como correcto sólo los vectores que no son cortados por Bbs I, ya que sólo contienen gRNAs.
- Secuenciación vectorial
NOTA: El objetivo de este paso es confirmar la presencia de secuencias de gRNA en aquellos vectores identificados como correctos por análisis de digestión de restricción.- Confirme los vectores concatémeros positivos por secuenciación Sanger 13 utilizando los siguientes cebadores:
Reenviar: TCAAGCCCTTTGTACACCCTAAG (para comprobar el primer casete de gRNA)
Linker1_Forward: GACTACAAGGACGACGATGACAA (para comprobar el segundo casete de gRNA)
Linker2_Reverse: GGCGTAGTCGGGCACGTCGTAGGGGT (para comprobar la segunda casilla de gRNA)
Linker2_Forward: ACCCCTACGACGTGCCCGACTACGCC (para comprobar la tercera casete de gRNA)
Linker3_Reverse: TCCTCCTCTGAGATCAGCTTCTGCAT (para comprobar el tercer casete de gRNA)
Reverso: AGGTGGCGCGAAGGGGCCACCAAAG (para comprobar el último gRNAcasete) - Compruebe la presencia de todos los gRNA mediante la búsqueda de sus secuencias en la secuencia de lecturas.
- Confirme los vectores concatémeros positivos por secuenciación Sanger 13 utilizando los siguientes cebadores:
3. Transfección de Organoides Intestinales por Electroporación
NOTA: Tenga en cuenta que este procedimiento se basa en el protocolo publicado por Fujii et al . En 2015, con adaptación para los cultivos de organoides de intestino delgado de ratón 14 .
- Pre-electroporación
NOTA: Esta sección describe cómo preparar los organoides intestinales del ratón antes de la electroporación eliminando todos los antibióticos y medios acondicionados de su medio de cultivo. Esto evitará posibles efectos tóxicos durante la electroporación.- El día 0 del procedimiento de transfección, dividió los organoides en una proporción de 1: 2.
NOTA: Los cultivos organoides intestinales se pueden obtener realizando el aislamiento de la cripta de acuerdo con los protocolos previamente establecidos 15 . Por favor refiérase a Tabla 2 para todas las composiciones de medios.- Al dividir los organoides para la electroporación, sembrar un mínimo de 6 pocillos de una placa de 48 pocillos por transfección.
- Sembrar los organoides en 20 μL de gotas de la matriz del sótano y cultivarlas en medio WENR + Nic (Wnt + EGF + Noggin + R-espondina + Nicotinamida) a 37 ° C, 5% CO 2 en una incubadora humidificada (como se ha descrito anteriormente 15 ) .
- En el día 2, se cambia el medio sustituyendo WENR + Nic por 250 μl de EN (EGF + Noggin) + CHIR99021 (inhibidor de Glucógeno sintasa quinasa-3) + Y-27632 (inhibidor de ROCK), sin antibióticos (ver Tabla 2 ).
NOTA: En todos los pasos, la cantidad de medio añadido a cada pocillo de una placa de 48 pocillos es de 250 μl. - El día 3, se cambia el medio organoide a EN + CHIR99021 + Y-27632 + 1,25% v / v Dimethyl sulfoxide (DMSO), sin antibióticos.
- El día 0 del procedimiento de transfección, dividió los organoides en una proporción de 1: 2.
- Preparación de las células
NOTA:Aquí se describe cómo fragmentar organoides en pequeños grupos de células por disociación mecánica y química. Estos pasos son críticos para el éxito del procedimiento.- El día 4, romper las cúpulas de la matriz del sótano utilizando una punta de pipeta de 1 ml y transferir organoides a un tubo de 1,5 ml. Piscina contenido de cuatro pozos de una placa de 48 pozos en un tubo.
- Romper mecánicamente los organoides en pequeños fragmentos pipeteando hacia arriba y hacia abajo con una pipeta P200 aproximadamente 200 veces. Centrifugar a temperatura ambiente, 5 min a 600 x g.
- Se retira el medio y se resuspende el sedimento en 1 ml de una proteasa recombinante de grado de cultivo celular (véase tabla de materiales). Incubar a 37 ° C durante un máximo de 5 min y luego comprobar una gota de 50 μ l de la muestra bajo un microscopio de luz invertida con un objetivo 4x.
NOTA: Los grupos de 10 - 15 células son deseables, ya que esto aumenta la supervivencia celular después de la electroporación. - Transferir la suspensión celular a un tubo de 15 ml de baja unión y detener laDisociación añadiendo 9 ml de medio basal sin antibióticos (ver Tabla 2 ). Centrifugar a temperatura ambiente, 5 min a 600 xg, luego desechar el sobrenadante y resuspender el gránulo en 1 mL de medio de suero reducido (ver Tabla de Materiales ).
- Contar el número de células con una cámara de Bürker y utilizar un mínimo de 1 x 10 5 células por reacción de electroporación. Añadir 9 ml de medio de suero reducido al tubo de 15 ml y centrifugar a temperatura ambiente, 3 min a 400 x g.
- Electroporación
NOTA: Las siguientes secciones proporcionan instrucciones sobre cómo realizar la electroporación y hacer que los organoides se recuperen después.- Retirar todo el sobrenadante y resuspender el gránulo en una solución de electroporación (ver Tabla de Materiales ). Se añade una cantidad total de 10 μg de ADN a la suspensión celular y se añade la solución de electroporación hasta un volumen final de 100 μl y se mantiene la célula DNUna mezcla sobre hielo. Utilizar vectores CRATR-concatamer en combinación con un plásmido de expresión Cas9 ( por ejemplo, Addgene # 41815) en una relación 1: 1.
NOTA: El volumen total del ADN añadido debe ser menor o igual al 10% del volumen total de la reacción. - Incluya una mezcla de transfección separada que contenga un plásmido GFP para evaluar la eficacia de la transfección ( por ejemplo, pCMV-GFP, Addgene # 11153, o cualquier plásmido genérico que expresa GFP).
- Añadir la mezcla de células-ADN a la cubeta de electroporación y colocarlo en la cámara del electroporador. Mida la impedancia presionando el botón apropiado en el electroporador y asegúrese de que es 0.030-0.055 Ω. Realizar la electroporación de acuerdo con los ajustes mostrados en la Tabla 3 .
NOTA: Si el valor de la impedancia cae fuera del rango permitido, ajuste el volumen de la solución en la cubeta. - Añadir 400 μl de tampón de electroporación + Y-27632 a la cubeta y luego transferir todo a un tubo de 1,5 ml. IncubaTe a temperatura ambiente durante 30 minutos para permitir que las células se recuperen y posteriormente centrifugas a temperatura ambiente durante 3 min a 400 x g.
- Se retira el sobrenadante y se resuspende el sedimento en 20 μl / pocillo de la matriz del sótano. Sembrar aproximadamente 1 x 10 4 a 1 x 10 5 células por pocillo en una placa de 48 pocillos y añadir EN + CHIR99021 + Y-27632 + 1,25% v / v de medio DMSO. Incubar a 37 ° C.
- El día 5, cambie el medio a EN + CHIR99021 + Y-27632, y compruebe la eficacia de transfección observando la expresión de GFP ( Figura 2 ). Mantener los organoides a 37 ° C y actualizar EN + CHIR99021 + Y-27632 medio después de 2 días.
- El día 9, se cambia el medio a WENR + Nic + Y-27632 e incuba a 37 ° C.
NOTA: Y-27632 se puede eliminar después de 7-10 días (en el día 16-19).
- Retirar todo el sobrenadante y resuspender el gránulo en una solución de electroporación (ver Tabla de Materiales ). Se añade una cantidad total de 10 μg de ADN a la suspensión celular y se añade la solución de electroporación hasta un volumen final de 100 μl y se mantiene la célula DNUna mezcla sobre hielo. Utilizar vectores CRATR-concatamer en combinación con un plásmido de expresión Cas9 ( por ejemplo, Addgene # 41815) en una relación 1: 1.
| Pulso poroso | Pulso de transferencia | |
| voltaje | 175V | 20V |
| Longitud de pulso | 5 mseg | 50msec |
| Intervalo de pulso | 50msec | 50msec |
| Número de pulsos | 2 | 5 |
| Tasa de descomposición | 10% | 40% |
| Polaridad | + | +/- |
Tabla 3: Configuración de electroporación.
4. Retiro del Factor de Crecimiento
Nota: Aquí se ejemplifica cómo llevar a cabo un experimento de retirada del factor de crecimiento cuando se eliminan los reguladores negativos de la vía Wnt en los organoides intestinales.
- 10-14 días despuésR de electroporación, dividir los organoides en una proporción de 1: 3 en una placa de 48 pocillos siguiendo los pasos mencionados anteriormente (3.2.1 - 3.2.2).
- Resuspender el sedimento organoid en 20 μL de la matriz de la membrana basal y dejar que se solidifique a 37 ° C durante 10 min. A continuación, se superponen 250 μ l de medio privado de factor de crecimiento ( por ejemplo, EN) para probar si knockout de los genes objetivo se ha logrado [ 5] .
- Dividir los organoides bajo condiciones de factor de crecimiento privado de un mínimo de 2 - 3 pasajes para ver una diferencia en la supervivencia entre tipo salvaje de tipo salvaje (WT) organoids control y organoids mutantes [ 5 , 15] .
NOTA: Los organoides de tipo salvaje no deben ser capaces de sobrevivir en medio privado de factor de crecimiento durante dos pasadas, mientras que las líneas mutantes deben ser capaces de crecer.
Resultados
Con el fin de confirmar la presencia del número correcto de insertos de gRNA en el vector concatemer, la digestión de restricción se realiza con enzimas ( EcoR I + Bgl II) flanqueando todos los cassettes que expresan gRNA (cada tamaño de casete es ~ 400 pb, Figura 1 ). Por ejemplo, al generar un vector de 4 gARN-concatemer, el tamaño esperado de la banda inferior en el gel de agarosa es de aproximadamente 1,6 Kbp; Cualquier banda inferior indica que no todas las 4 casillas de gRNA se insertan en el vector ( Figura 2A ). Además, siempre se recomienda comprobar que todos los sitios de reconocimiento Bbs I se pierden y la enzima no corta el vector ( Figura 2B ).
Una vez que los constructos han sido confirmados, pueden ser entregados a organoides intestinales de ratón por electroporación para lograr optimaL niveles de eficiencia de transfección (hasta el 70%), como se muestra por el control GFP ( Figura 3 ].
Por último, para ensayar la eficacia de esta estrategia, se cultivaron organoides intestinales transfectados con Cas9 y vectores concatemer contra Axin1 / 2 y Rnf43 / Znrf3 en EN (retirada de R-espondina) y EN + IWP2 (R-spondina y retiro de Wnt, IWP2 : Inhibidor de puercoespín, 2,5 μM) para un mínimo de 3 pasajes ( Figura 4 ). Mientras que los organoides WT no transfectados murieron bajo ambas condiciones, los organoides knockout Axin1 / 2 sobrevivieron en ambos debido a la activación aguas abajo de la vía Wnt; Además, los organoides mutantes Rnf43 / Znrf3 sobreviven en ausencia de R-espondina pero no pueden sobrevivir en presencia de IWP2, lo que provoca la depleción del Wnt que activa la vía. En conjunto, estas observaciones demuestran que el knockout de estos pares de paralogues es posible generando tEsperaba un fenotipo organoide. Los detalles de estos resultados se han publicado en Developmental Biology 5 .
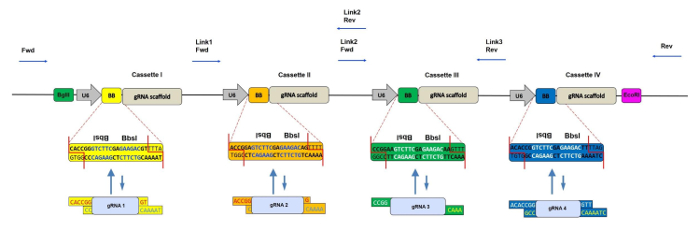
Figura 1: Representación esquemática del CRISPR-concatemer con 4 Cassettes. Esquema del vector de 4 gARN-concatemer con cada casete de 400 pb que contiene un promotor U6, dos sitios Bbs I repetidos invertidos (también indicado como BB) y andamiaje de gRNA en este orden. Durante la reacción de barajado, los sitios Bbs I son reemplazados por fragmentos de gRNA con salientes coincidentes y consecuentemente perdidos. Los sitios de unión de los cebadores de secuenciación para comprobar la inserción correcta de los oligos de gRNA se muestran mediante las flechas azules. Fwd = cebador directo, Rev = cebador inverso, Enlace 1/2/3 = regiones de unión 1/2/3. Por favor CLame aquí para ver una versión más grande de esta figura.

Figura 2: Patrones de digestión representativos de vectores concaténicos. ( A ) Doble digestión de 3 y 4 vectores de concatenador de gRNA con EcoR I y Bgl II. El patrón de digestión correcto está marcado por una garrapata verde, mientras que los vectores con sólo 1 o 2 inserciones de gRNA están marcados con una cruz roja. El carril 1 muestra la digestión de un vector parental de 4 gRNA-concatemer usado como control positivo (marcado con "+"); De manera similar, el carril 5 muestra la digestión de un vector parental de 3 gRNA-concatemer, marcado con "+". ( B ) Digestión con Bbs I, mostrando el tamaño correcto de los vectores concatemer no digeridos (indicados por las garrapatas verdes). La digestión de un vector concatemer que contiene gRNA que ha perdido sitios Bbs I se utiliza como un control positivo yD está marcado con "+". Haga clic aquí para ver una versión más grande de esta figura.
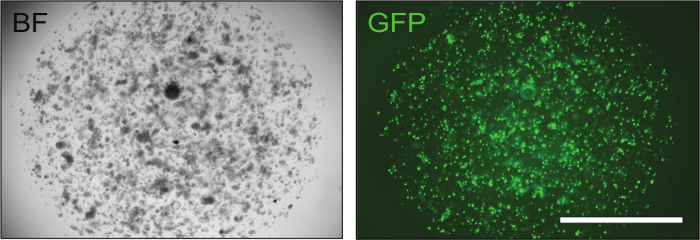
Figura 3: Imagen representativa de los organoides intestinales electroporados con éxito. La transfección de un plásmido GFP es instrumental para evaluar la eficacia de la transfección. Aproximadamente 24 h después de la electroporación, los organoides que contienen un pequeño número de células son ya visibles y, si el procedimiento de electroporación fue exitoso, hasta el 70% de ellos muestra fluorescencia verde. BF = campo brillante, GFP = proteína fluorescente verde. Barra de escala = 2.000 μm. Haga clic aquí para ver una versión más grande de esta figura.
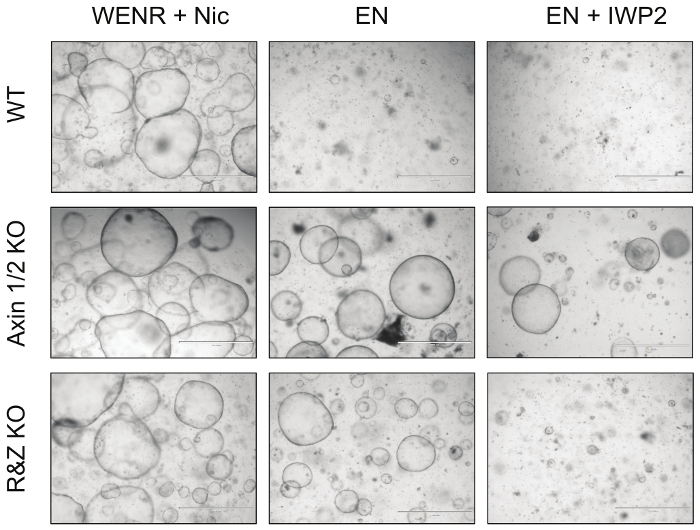
Figura 4: Imágenes representativas de Organoides Intestinales Mutantes. Knockout de los reguladores negativos de la vía Wnt Axin1 y Rnf43, junto con sus paralogues, hace que los organoides intestinales resistentes a la privación del factor de crecimiento. En particular, los organoides knockout Axin1 / 2 (Axin1 / 2 KO) pueden crecer en ausencia de R-spondina (EN: EGF + Noggin) y Wnt (EN + IWP2: EN + Inhibidor de Porcupine), mientras que Rnf43 / Znrf3 mutante organoides (R & Z KO) sólo puede sobrevivir en ausencia de R-espondina (EN). Por el contrario, los organoides de WT sólo pueden sobrevivir en la condición de cultivo de control, WENR + Nic (Wnt + EGF + Noggin + R-espondina + nicotinamida). Barras de escala = 1.000 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Medio basal | Comentarios | |
| Almacenar a 4 ° C durante 4 semanas | ||
| Medio de cultivo celular | 500 ml | Ver tabla de materiales |
| L-Glutamina 100x | 5 ml | |
| Agente tampón 1 M | 5 ml | Ver tabla de materiales |
| Penicilina Streptomycin 100x | 5 ml | |
| WENR + Nic (Wnt + EGF + Noggin + R - espondina + Nicotinamida) | ||
| Almacenar a 4 ° C durante 2 semanas | ||
| Medio basal | Hasta 50 ml | |
| Suplemento de células neuronales sin suero (50x) | 1 ml | Ver tabla de maTeriales |
| Suplemento de células neuronales sin suero (100x) | 500 μl | Ver tabla de materiales |
| N - acetilcisteína (500 mM) | 125 μL | |
| EGF de ratón (100 mu g / ml) | 25 μL | |
| Ratón Noggin (100 mu g / ml) | 50 μl | |
| Medio condicionado R-Spondin | 5 ml | |
| Wnt3a medio acondicionado | 25 ml | |
| Nicotinamida (1 M) | 250 μl | |
| EN + CHIR + Y - 27632 (EGF + Noggin + CHIR + Y - 27632) | ||
| Almacenar a 4 ° C durante 2 semanas | ||
| Basal medio sin penicilina Estreptomicina | Hasta 20 ml | |
| Suplemento de células neuronales sin suero (50x) | 400 μl | Ver tabla de materiales |
| Suplemento de células neuronales sin suero (100x) | 200 μl | Ver tabla de materiales |
| N - acetilcisteína (500 mM) | 50 μl | |
| EGF de ratón (100 mu g / ml) | 10 μl | |
| Ratón Noggin (100 mu g / ml) | 20 μL | |
| Y - 27632 (10 mu M) | 20 μL | |
| CHIR99021 (8 mu M) | 10 μl | |
| EN (EGF + Noggin) | ||
| Almacenar a 4 ° C durante 4 semanas | ||
| Medio basal | Hasta 50 ml | |
| Suplemento de células neuronales sin suero (50x) | 1 ml | Ver Tabla de materiales |
| Suplemento de células neuronales sin suero (100x) | 500 μl | Ver Tabla de materiales |
| N - acetilcisteína (500 mM) | 125 μL | |
| EGF de ratón (100 mu g / ml) | 25 μL | |
| Ratón Noggin (100 mu g / ml) | 50 μl |
Tabla 2: Composición de los medios organóides.
Discusión
En este protocolo, detallamos todos los pasos necesarios para generar CRISPR-concatemers y aplicar CRISPR-concatemers en ratón organoids intestinal con el fin de eliminar simultáneamente múltiples genes. Como se señaló anteriormente, esta estrategia tiene varias ventajas, como su velocidad, alta eficiencia y rentabilidad.
Con el fin de llevar a cabo con éxito todo el procedimiento, hay algunos aspectos críticos a considerar. En primer lugar, es esencial que todos los oligos de gRNA estén debidamente recocidos y fosforilados, ya que representan el material de partida para la reacción de clonación de Bbs I que en sí mismo es muy eficiente. En segundo lugar, cuando se electroporan organoides, cuanto más células se usan por condición, mayor es la eficacia de transfección máxima posible. Además, también es importante que después de la disociación celular, los grupos de células pequeñas predominen sobre las células individuales.
Sin embargo, es posible encontrar problemas técnicosCuando se intenta la clonación o la transfección por primera vez; En el caso de problemas durante la clonación de gRNA, se recomienda revisar la secuencia oligo de gRNA y, si es correcto, seleccionar colonias bacterianas adicionales para el cribado de digestión de restricción. Si la eficacia de la transfección y la viabilidad celular son bajas después de la electroporación, entonces es aconsejable repetir el protocolo usando más células por condición y reduciendo el tiempo de disociación celular a 3 min.
Aunque la generación de concatenadores CRISPR es relativamente barata y fácil, la realización de pantallas genéticas a gran escala en organoides no lo es, ya que la escala está limitada por los costos asociados con el cultivo de organoides y por su naturaleza de mano de obra intensiva. Cabe mencionar en este caso que el método CRISPR-concatemer es también compatible con líneas celulares, tales como HEK293 y células madre embrionarias de ratón.
Independientemente del sistema celular, otro posible inconveniente de este sTrategy se puede encontrar cuando se apunta a la eliminación simultánea de tres o cuatro genes diferentes. Por ejemplo, cada gRNA tendrá una eficacia de focalización diferente y los cambios de golpear todos los genes al mismo tiempo pueden ser relativamente bajos; Por esta razón, es aconsejable emplear el sistema concatemer para dirigir más de un gRNA contra el mismo gen.
Alternativas estrategias basadas en Golden Gate barajar se han propuesto a lo largo de los años para generar multiplex gRNA vectores [ 7 , 8] . Sin embargo, en nuestro método es posible ensamblar directamente múltiples ARNg en un solo vector retrovírico en una sola ronda de clonación, lo que hace que sea adecuado para generar bibliotecas de ARNg para diana de paralogues.
Nuestro CRISPR-concatemer se construye en la columna vertebral del vector retroviral MSCV. Por lo tanto, el retrovirus que contiene concatémero de gRNA puede usarse para generar líneas celulares estables que sobreexpirenRes gRNAs. Cuando se combina con un sistema inducible con Cas9, se pueden realizar knockouts de parálisis inducibles utilizando nuestro sistema.
En resumen, aquí se describe cómo clonar hasta cuatro diferentes gRNAs en el mismo vector en un solo paso y cómo aplicar esta estrategia a un cultivo organoid con una alta eficiencia de transfección. Además, proporcionamos sugerencias útiles para maximizar las posibilidades de éxito durante todo el procedimiento.
Divulgaciones
Los autores no tienen nada que revelar. Los autores no han declarado ningún conflicto de intereses.
Agradecimientos
Damos las gracias a Christopher Hindley por la lectura crítica del manuscrito. AM es apoyado por Wntsapp (Marie Curie ITN), AA-R. Es apoyado por el Consejo de Investigación Médica (MRC), y BK.K. Y RM son apoyados por una beca Sir Henry Dale del Wellcome Trust y la Royal Society [101241 / Z / 13 / Z] y reciben apoyo a través de una donación central del Wellcome Trust y MRC al Wellcome Trust - MRC Cambridge Stem Cell Institute .
Materiales
| Name | Company | Catalog Number | Comments |
| Optimized CRISPR Design Tool | Feng Zhang group | CRISPR gRNA design tool; http://crispr.mit.edu/ | |
| Webcutter 2.0 | restriction mapping tool; http://rna.lundberg.gu.se/cutter2/ | ||
| T4 PNK (Polynucleotide Kinase) | New England Biolabs | M0201L | |
| T4 DNA ligase buffer | New England Biolabs | M0202S | |
| T7 DNA Ligase | New England Biolabs | M0318L | |
| DTT (dithiothreitol) | Promega | P1171 | |
| ATP (adenosine triphosphate) | New England Biolabs | P0756S | |
| FastDigest BbsI (BpiI) | Thermo Fisher | FD1014 | |
| Tango buffer (BSA-containing restriction enzyme buffer) | Thermo Fisher | BY5 | |
| BglII | New England Biolabs | R0144 | |
| EcoRI | New England Biolabs | R0101 | |
| Plasmid-safe exonuclease | Cambio | E3101K | |
| Thermal cycler | Applied biosystems | 4359659 | |
| 10G competent E. coli bacteria | Cambridge Bioscience | 60108-1 | |
| Plasmid mini kit | Qiagen | 12125 | |
| Table top microcentrifuge | Eppendorf | UY-02580-01 | |
| Inoculating loops | Microspec | PLS5 | |
| Bacteria incubator | Sanyo | MIR-262 | |
| Luria-Bertani broth (LB) | Sigma-Aldrich | L3522 | |
| Agarose | Sigma-Aldrich | A4718 | |
| Agarose gel electrophoresis apparatus | Bioneer | A-7020 | |
| Advanced DMEM/F12(cell culture medium) | Invitrogen | 12634-034 | |
| Glutamax (L-Glutamine) 100x | Invitrogen | 35050-068 | |
| HEPES 1 M (buffering agent) | Invitrogen | 15630-056 | |
| Penicillin-streptomycin 100x | Invitrogen | 15140-122 | |
| B27 supplement (Neuronal cell serum-free supplement) 50x | Invitrogen | 17504-044 | |
| N2 supplement (Neuronal cell serum-free supplement) 100x | Invitrogen | 17502-048 | |
| n-Acetylcysteine 500 mM | Sigma-Aldrich | A9165-5G | |
| Mouse EGF 500 µg/mL | Invitrogen Biosource | PMG8043 | |
| Mouse Noggin 100 µg/mL | Peprotech | 250-38 | |
| Nicotinamide 1 M | Sigma | N0636 | |
| R-Spondin conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Wnt conditioned medium | n.a. | n.a. | Produced in house from HEK293 cells, for details see Sato and Clevers 2013 |
| Y-27632 10 µM | Sigma-Aldrich | Y0503-1MG | |
| Standard BD Matrigel matrix | BD Biosciences | 356231 | |
| 48-well Plate | Greiner Bio One | 677980 | |
| CHIR99021 | Sigma-Aldrich | A3734-1MG | |
| IWP-2 | Cell Guidance Systems | SM39-10 | |
| TrypLE (recombinant protease) | Invitrogen | 12605-010 | |
| Opti-MEM (reduced serum medium ) | Life technologies | 51985-034 | |
| Electroporation Cuvettes 2mm gap | NepaGene | EC-002S | |
| Low binding 15 mL tubes | Sigma-Aldrich | CLS430791 | |
| Bürker’s chamber | Sigma-Aldrich | BR719520-1EA | |
| NEPA21 Super Electroporator | NepaGene | contact supplier | |
| Protein LoBind tubes low binding | Thermo Fisher | 10708704 | |
| BTXpress electroporation buffer | Harvard Apparatus | 45-0805 | |
| DMSO (Dimethyl sulfoxide) | AppliChem | A3672 |
Referencias
- Mali, P., et al. RNA-Guided Human Genome Engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Koike-Yusa, H., Li, Y., Tan, E. -. P., Velasco-Herrera, M. D. C., Yusa, K. Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library. Nat Biotech. 32 (3), 267-273 (2014).
- Bassett, A. R., Kong, L., Liu, J. L. A Genome-Wide CRISPR Library for High-Throughput Genetic Screening in Drosophila Cells. J Genet Genomics. 42 (6), 301-309 (2015).
- Diss, G., Ascencio, D., DeLuna, A., Landry, C. R. Molecular mechanisms of paralogous compensation and the robustness of cellular networks. J Exp Zool B Mol Dev Evol. 322 (7), 488-499 (2014).
- Andersson-Rolf, A., Merenda, A., Mustata, R. C., Li, T., Dietmann, S., Koo, B. -. K. Simultaneous paralogue knockout using a CRISPR-concatemer in mouse small intestinal organoids. Dev Biol. 420 (2), 1-7 (2016).
- Ran, F. A., Hsu, P. P. D., Wright, J., Agarwala, V., Scott, D., Zhang, F. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: A one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS ONE. 4 (5), (2009).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Sci Rep. 4 (5), 5400 (2014).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), 1-11 (2014).
- Yin, L., et al. Multiplex Conditional Mutagenesis Using Transgenic Expression of Cas9 and sgRNAs. Genetics. 200 (2), 431-441 (2015).
- Cress, B. F., Toparlak, O. D., et al. CRISPathBrick: Modular Combinatorial Assembly of Type II-A CRISPR Arrays for dCas9-Mediated Multiplex Transcriptional Repression in E. coli. ACS Synth Biol. 4 (9), 987-1000 (2015).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. J Vis Exp. (6), e253 (2007).
- Zimmermann, J., Voss, H., Schwager, C., Stegemann, J., Ansorge, W. Automated Sanger dideoxy sequencing reaction protocol. FEBS Letters. 233 (2), 432-436 (1988).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nat. Protoc. 10 (10), 1474-1485 (2015).
- Andersson-Rolf, A., Fink, J., Mustata, R. C., Koo, B. -. K. A video protocol of retroviral infection in primary intestinal organoid culture. J Vis Exp. (90), e51765 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados