需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从巨 Unilamellar 泡中提取膜纳米管
* 这些作者具有相同的贡献
摘要
许多蛋白质在细胞感觉和导致膜曲度。我们描述了一种从脂泡中提取膜纳米管的方法, 以研究蛋白质或任何曲率-活性分子与弯曲膜的相互作用体外。
摘要
细胞膜的重塑是许多细胞现象的一个组成部分, 如吞、贩运、丝状的形成、等。许多不同的蛋白质与弯曲的细胞膜相关联, 因为它们能够感知或诱发膜的曲率。通常, 这些过程涉及大量的蛋白质使它们过于复杂, 无法定量地在细胞中进行研究。我们描述了一个协议, 重建一个弯曲的膜在体外, 模仿一个弯曲的细胞结构, 如吞颈部。一个巨大的 unilamellar 囊 (老爹) 被用作细胞膜的模型, 其内部压力和表面张力受微吸入控制。使用光镊对老大施加点拉力, 就会产生高曲率的纳米管连接到平坦的膜上。该方法传统用于测定脂质膜的基本力学性能, 如弯曲刚度。近年来, 它已经扩展到研究蛋白质与膜曲率的相互作用以及它们对膜的形状和力学的影响方式。结合微、显微注射、光镊和共聚焦显微镜的系统可以同时测量膜的曲率、膜张力和蛋白质的表面密度。从这些测量中可以推断出蛋白质-膜系统的许多重要的力学和形态学特性。此外, 我们还制定了一个在生理盐浓度存在下创建 GUVs 的协议, 以及从标记蛋白和脂类的荧光强度中定量化膜上蛋白质的表面密度的方法。
引言
许多细胞过程, 如吞, 贩运, 形成丝状, 感染,等, 伴随着细胞膜形状的戏剧性变化1,2。在细胞中, 许多蛋白质通过结合细胞膜和改变它们的形状来参与这些过程。最值得注意的例子是 Bin/Amphiphysin/Rvs (bar) 蛋白质家族的成员, 其中包含一个特征的本质曲线的酒吧域3,4,5,6,7。通常情况下, 它们通过将 BAR 域粘贴到表面上与膜进行交互, 并且在许多情形下, 还将亲螺旋插入双层中。条形域的形状、大小和电荷与亲螺旋的数量一起决定: (1) 膜曲率的方向 (即, 它们是否会诱发内陷或突起), 以及 (2) 膜的大小曲率5,8。注意, 这里的正曲率被定义为弯曲膜的凸面,即, 对相互作用粒子的凸出, 反之则为负。此外, 对 BAR 蛋白的定量研究表明, 它们对细胞膜的影响取决于一组物理参数: 蛋白质的表面密度、膜张力和膜的形状 (平面与管状的vs球形形状)7。根据这些参数, BAR 蛋白质可以: (1) 作为膜曲率传感器, (2) 弯曲膜, 或 (3) 诱导膜断7。
由于细胞内膜重塑所涉及的成分数量之多, 研究这些现象的定量方面, 如吞,在体内是极具挑战性的。体外在细胞中模拟弯曲膜的最小成分的重组提供了一种机制, 以获得对膜弯曲蛋白如何操作的机械理解。本文介绍了一种使用微、共焦显微镜和光镊在体外重建膜纳米管的协议。该方法可用于定量地研究蛋白质、脂质或小分子与弯曲膜的相互作用。脂质 GUVs 被用作细胞膜的模型, 其曲率与相互作用的膜弯曲分子的大小相比是微不足道的。他们使用的 electroformation 方法9 , 其中的泡是通过水合脂质膜, 并肿胀成 GUVs 在交流电流 (AC)10。最常见的基板上的 GUVs 是生长的是半导电板镀铟锡氧化物 (ITO) 或铂电线 (Pt 线)11。在这项工作中, GUVs 是在 Pt 线上生长的, 因为这种方法在缓冲12中显示出在使 GUVs 存在的情况下, 比替代品更有效。虽然这里描述了 electroformation 协议以充分的细节来重现它, 但我们将读者介绍给以前的文章, 其中的类似和其他制作 GUVs 的方法已经详细描述了13,14。在我们的手中, electroformation 在 Pt 线上成功地产生了 GUVs 混合的合成脂质或从天然脂提取物的缓冲含有〜100毫米氯化钠。此外, 也有可能在生长过程中封装 GUVs 内的蛋白质。图 1A中显示了一个示例 electroformation 室;它包括两个〜10厘米长的 Pt 线插入到一个持有聚四氟乙烯 (PTFE), 可以密封在双方的玻璃片〜 1-2 厘米分开 (图 1A)。

图 1: 实验设置.(A) electroformation 室, 连接在 Pt 线上的电连接器。(B) 左: 实验系统显示显微镜, 实验室以上的目标和两个 micropipettes (左, 右) 连接到动和插入实验室的管拉和蛋白质注射.右: 实验室的一个接近的看法登上了在目标之上显示志向和射入 micropipettes 插入。(C) 注射器装有一个薄薄的分配器插入到微在其后端。底部是微内的饮水机的关闭视图, 蓝色虚线勾勒出微。该系统用于填充微与酪蛋白钝化的玻璃表面, 也可以在需要时回填充矿物油。(D) 一种用于吸µL 蛋白质溶液数量的系统。针连接到注射器和油管连接到注射微。微提示是仔细浸入蛋白溶液和吸气, 以填补微提示。微, 然后返回充满矿物油使用的系统显示在面板 C.请点击这里查看这个数字的更大版本.
一个薄膜纳米管, 范围从7纳米到几百纳米, 可以从一个外部力量从一个老大拉。该方法最初设计用于测量细胞膜和囊泡的弹性特性, 如弯曲刚度15,16。在最近的工作中, 该方法被扩展, 以研究蛋白质与弯曲膜的相互作用, microinjecting 的蛋白质在被拉扯的纳米管附近7,17。其他的方法已经开发的研究膜弯曲蛋白。在一种方法中, 蛋白质是用不同大小的脂质体被拴在钝化表面上孵育的。共焦显微镜是用来测量蛋白质结合作为一个功能的脂质体直径, 这可以指示曲率诱导排序18,19。在另一种方法中, 在微吸气的老爹附近注射蛋白质来测量他们自发诱发小管的能力20,21。本协议中描述的方法非常适合于研究吞中涉及的膜弯曲蛋白, 其中大多数蛋白质通常会遇到与含货物膜套连接的预制膜管。底层平板等离子膜。此外, 在这种方法中, 与栓小脂质体的测定不同, 薄膜纳米管一直与膜连接;因此, 它是在机械平衡与老大, 一个情况下, 预计在体内。因此, 基础膜物理学的应用, 我们可以推断出一个过剩的机械性能从我们的测量22,23,24。
为了充分实现这种方法, 必要的设备包括共聚焦显微镜、光镊和一个或两个 micropipettes 连接到水箱 (图 1B)。通过组合所有三, 可以同时测量膜张力、膜曲率、蛋白质的表面密度和管力25。微的愿望是必不可少的, 它是很容易构造的插入一个玻璃微到一个持有人连接到一个水箱, 其中, 通过静水压压力, 控制吸入压力26。微和持有人是由一个微控制, 理想情况下, 在一个方向的压电驱动器的精密运动。为了拉动纳米管, microaspirated 的老大被短暂地粘在微米级的珠子上, 然后拉走了制造纳米管。在这个实现中, 磁珠由光镊持有, 它可以通过遵循已发布的协议27来构造。虽然以精确的力测量为代价, 但可以用不同的方式免除光镊和拉纳米管。如果它是太具挑战性的建立一个光阱或如果力量测量不是必要的, 例如, 如果你简单地想要检查蛋白质的偏爱为弯曲的膜, 管子可以被拉扯用珠吸气在第二微28的尖端。也可以使用引力力29或流30、31来拉动管道。此外, 共焦显微镜也不是必要的;然而, 它是比较可取的, 以测量蛋白质的表面密度。它还允许测量管中的脂质的荧光强度的纳米管半径, 从而独立于膜力和张力。从荧光推断管半径是特别重要的, 如果这些数量之间的关系偏离建立良好的方程, 由于存在膜黏附的蛋白质25。重要的是, 人们不能同时省略光阱和共焦显微镜, 因为它不可能测量管曲率。
本协议所述方法用于研究纳米管上各种外周膜蛋白的曲率诱导排序, 主要来自于 BAR 系列25、32、33、34.研究还表明, 锥形型跨膜钾通道 KvAP 在弯曲纳米管上的富集方式与棒蛋白35相同。通过优化 GUVs 内蛋白质的封装方法, 研究了负曲率蛋白质的相互作用, 以及36。此外, 该方法已被用来阐明蛋白质支架的形成25,37和研究的机制, 膜断的任何线张力38, 蛋白质动力39, 或由酒吧蛋白质40,41。除了蛋白质, 小分子或离子也能诱发曲率。利用这种方法, 钙离子被证明在无盐条件下诱发正曲率42。有趣的是, 它还表明, 脂质可以接受曲率排序, 虽然只有在分层点43,44附近的组合。总之, 这一方法可以被研究者们所用, 他们有兴趣研究整体膜组件 (例如, 如、脂质或跨膜蛋白) 或外周结合分子 (内外 GUVs) 与圆柱形的弯曲膜, 从机械和定量角度。它也适用于那些有兴趣测量膜本身的机械性能22,23,45。
研究方案
1. Electroformation 在 Pt 线上制备 GUVs
- 清洁 electroformation 室 (参见简介和图 1A) 和带有有机溶剂 (如乙醇或丙酮) 的 Pt 线, 以洗去脂质和水冲洗掉盐。
注意: 我们建议用乙醇浸泡过的组织彻底清除残留物, 然后在丙酮、乙醇、水中 sonicating, 每次5分钟。 - 在氯仿中, 在1毫克/毫升的时候, 准备一个期望的脂质组合。该混合物应包含〜0.05% 摩尔分数的脂质共轭生物素 (例如, 12-硬脂酸-sn-磷脂-3-乙醇-N-biotinyl (乙二醇)-2000)) 和〜0.5% 摩尔分数的脂共轭与荧光 (例如, BODIPY-TR-C5-ceramide)。
注意: 根据我们的经验, 在高收率下生产 GUVs 是很困难的, 含有超过30% 的带电脂类。
注意: 应在化学罩内处理氯仿, 佩戴合适的手套。 - 在 electroformation 室中插入一对 Pt 线。将脂质混合到铂丝上, 滴入2-3 毫米 (总〜4µL 的混合物)。
- 在室温下, 在真空下烘干电线30-60 分钟。
- 用硅脂粘附在腔室上的片, 以密封室的底部。用含有 nacl、蔗糖和缓冲剂的缓冲溶液填充腔室 (例如, 70 毫米氯化钠, 100 毫米蔗糖, 和10毫米三, pH 7.4)。这个介质将在实验中的 GUVs 内。这是必要的渗透的这种培养基匹配的渗透实验介质在10%。用蔗糖调节渗透。将蛋白质添加到溶液中, 如果目标是将它们封装在 GUVs。
注意: 缓冲区中的各种盐和糖会影响膜的弯曲刚度和自发曲率24,42,46,47。 - 用硅脂粘片, 确保室内的最小空气, 以密封房间的顶部。在500赫兹和280毫伏的 Pt 线上应用正弦交流电流。
注意: 生长时间和温度必须根据脂肪成分和蛋白质的敏感性而优化。当使用天然脂质提取物, 也当在 GUVs 中封装蛋白质, 最好的产量是通过生长 GUVs 在4° c 过夜。在缺乏蛋白质和合成脂质组合时, 室温下的 2 h 的生长是足够的。
2. 实验室和 Micropipettes 的制备
- 要准备 micropipettes, 用吸管拉拔玻璃毛细管。建议使用玻璃毛细管, 其内部和外部半径分别为0.7 毫米和1毫米。然后, 通过使用 microforge 细化微的尖端, 使其内径为 5–7 µm。如果在实验中注入蛋白质或其他分子, 请拉另一微, 并将其尖端细化为 8-15 µm 的内径。
- 通过将两个矩形显微镜片放置在一个金属底座上, 如图 1所示, 构造一个实验室。片应该由 ~ 1 毫米分开。腔室应该有沿长边的开口 (参见图 1)。开放的两侧应适合微的尖端, 其中的尖端应达到至少在会议厅的中心。
- 准备实验缓冲区, 其渗透不应与用于增长 GUVs 的缓冲区的大小相差10% 以上。用葡萄糖调节渗透。一个实验缓冲区的例子, 用于研究 endophilin 与纳米管的相互作用是100毫米氯化钠, 40 毫米葡萄糖, 缓冲与三至 pH 值7.4。蔗糖内外的结合确保: (a) 充分的相对比, 观察 GUVs 与明亮的现场显微镜, 和 (b) 较高的密度内的 GUVs, 使他们定居在底部的会议厅。根据实验要求调整盐浓度。
注: 除了影响膜的力学性能, 根据我们的经验, 高糖浓度 (> 300 mM) 对建立亲和-生物素键有负面影响, 需要拉纳米管。此外, 过少的盐会抑制亲和生物素键, 而浓度过高则会影响蛋白质膜的相互作用。在蛋白质封装的情况下, 使用非常高的盐浓度在外部缓冲 (如, > 200 毫米氯化钠) 可以用来作为一个技巧, 分离的蛋白质从外部传单36。有必要对一系列的盐浓度进行实验, 以找到感兴趣分子的最佳结合条件。 -
30-60 分钟前收集 GUVs 为实验, 钝化的玻璃表面, 填补了实验室和吸入微5毫克/毫升溶液的高度纯β酪蛋白 (例如, 溶解在实验缓冲区)。β-酪蛋白在玻璃表面创造一个保护层, 防止 GUVs 太强烈地黏附, 这将导致他们爆裂。用β-酪蛋白孵育30-60 分钟。
注: 微内不应有气泡, 这会影响细胞膜张力的控制。- 要建立一个饮水机填充 micropipettes, 打破注射器针接近塑料连接器和胶水到它薄薄的二氧化硅毛细管 (如那些用于液相色谱) (图 1C)。
- 在孵化期间与β酪蛋白, 登上房间在显微镜和中心它在目标之上。通过沿长边的开口插入吸入微的尖端, 并将针尖置于显微镜物镜之上。调整水箱的水位, 使吸入压力接近于零 (在显微镜下可以看到的是不应该有大量的流入或流出的吸管)。
-
在实验过程中, 当蛋白质或其他分子被注射时, 将注射微与所需的分子溶于实验缓冲液中, 在选择的浓度下, 在微内安装微, 并插入实验室的另一侧。
- 要使用最小量的蛋白质, 只用吸入的蛋白质填充微尖端。为了做到这一点, 用塑料导管将针头的一端包裹在注射器上。将油管插入注射微的背部。
- 非常小心地将微的尖端浸入蛋白质溶液中, 并吸入它来填满微的尖端。
注意: 这个简单的设置显示在图 1D中, 在我们的经验中, 它允许从少量的蛋白质溶液中µL。 - 用矿物油将注射微的其余部分回填, 以防止蛋白质溶液和水箱中的水混合 (使用图 1C中的设置)。
- 注意不要将气泡引入注射吸管, 因为它会导致不稳定的注射压力。另外, 如果蛋白质数量是充足的, 填装与蛋白质的微与填装与β酪蛋白相同的方式, 在步骤2.4 中描述。调整水箱水位, 以尽量减少注射吸管中的吸入压力。
注: 在纳米管附近注入的分子或离子的浓度会由于稀释而降低, 并且可以通过测量荧光强度的降低来估计, 这是从吸管出口42的距离的函数。然而, 更重要的是要知道被注射分子的双层束缚密度, 可以精确测量 (参见4节)。
- 用β-酪蛋白孵育后, 从腔内取出溶液, 用实验缓冲器冲洗几次。填充实验缓冲区。
- 停止 electroformation 的 GUVs 和收集他们直接从 Pt 线。在实验室中添加一些µL 的老爹解决方案。只使用刚准备好的 GUVs。
- 在实验室中加入一些µL 的亲和珠, 以最终浓度的珠子在室内, 在 0.1 x 10−3 % (w/v) 或更少。聚苯乙烯珠〜3µm 的直径建议 (聚苯乙烯珠在水中有一个近最佳的折射率对比, 关于最大的梯度力, 关于在光阱中的散射力)。在实验的基础上, 可以调整珠的浓度: 极低的浓度使得很难在室内找到它们, 而过高的浓度则会导致多个珠子落入光镊的风险。
3. 从老大身上拉出薄膜纳米管
- 让 GUVs 和珠子沉淀到房间的底部。通过让小的实验缓冲蒸发, 使 GUVs 的收缩, 约15分钟的 GUVs 是必不可少的产生一些过剩的面积, 可以吸气与微。GUVs 应明显波动 (即, 出现软盘) 在光显微镜下。如果他们出现紧张, 允许更多的蒸发时间。
注: 渗透的变化率取决于蒸发面面积、温度、等, 并应密切监测。从理论上来说, 渗透的差异可以通过调节蔗糖/葡萄糖浓度来确定, 但是, 应注意不要引起渗透性休克。 - 找到一个软盘老大, 然后把它吸进吸管。吸入舌的长度 (在吸管内膜的部分) 应等于或大于吸管半径的理论分析适用15,16,22,23 (图 2)。尝试几个 GUVs。如果没有一个 GUVs 可以吸气产生足够长的舌头, 再等几分钟。如果 GUVs 足够软盘, 请继续执行下一步。
- 用矿物油封住燃烧室, 防止缓冲液的进一步蒸发。这样做, 仔细移油沿实验室的开放边缘。
- 要设置吸入压力的零位, 首先, 在腔内寻找一颗珠子, 并将吸入吸管出口放在靠近珠子的位置。调整水箱的高度, 使珠子既不吸入, 也不被吸入吸管吹走。虽然矿物油防止蒸发, 因此进一步的压力变化在会议厅内, 零的愿望压力之前测量每个老大。
- 找到一个老大移动的微的焦点 (保持从表面上, 它可能会被拉出的吸管由剪切应力时, 商会移动)。
- 仔细地在房间里走动, 寻找一颗珠子。突然的动作会弹出老大用光学镊子把它困在离房间底部20µm 的距离内。确保该地区的利益是干净的, 没有其他的珠子或膜的视线。任何掉在光镊以外的磁珠都会扰乱测量。
- 使老大回到焦点, 并远离珠子与微与光陷阱对齐 (图 2)。
- 记录的运动的珠子为1-2 分钟测量平衡位置 (需要的力量测量)。
- 尽量减少微内的压力, 避免失去老爹, 从而降低膜张力。小心地将老大与珠子接触一秒钟, 建立亲和生物素键, 然后轻轻地拉回创建纳米管。对或远离珠子的运动, 最好是用压电执行器来最小地扰乱光镊中的珠子。
注: 如果纳米管不形成, 它可能是由于亲和涂层的珠, 不充分的化脂质在老爹, 不足的盐浓度或过多的葡萄糖浓度在实验缓冲区, 或膜老大的张力太高了48。 - 增加吸入压力, 以便重现吸舌。将管子对准吸入吸管的轴, 最大聚焦在管子上 (图 2)。
- 确保老大赤道和管的焦点。记录珠的运动与明亮的领域显微镜几分钟 (在这里, 相机采集速度是 30 Hz)。将水箱的高度 ( h) 记录为零位。采取一些系统的共焦图像 (图 2)。
- 重复上一步, 在不同的吸入压力下, 隐性膜张力。典型的张力范围是0.015–0.2 锰/米, 与一步大小约0.02 锰/米。
- 如果在系统附近注射蛋白质或分子, 使注射微靠近纳米管, 确保光阱中的珠子不被扰动。轻轻地注射在大约 1-2 Pa. 的压力
-
在蛋白质结合有平衡 (被注射的蛋白质的荧光强度在膜保持恒定在老爹) 之后, 重复步明智的测量和与光秃的膜 (步骤3.11 和 3.12)。
注: 由于测量是在持续加压的情况下在老爹附近注射蛋白质, 蛋白质的体积浓度在老大附近大致保持不变;因此, 在测量过程中蛋白质的解吸应该是微不足道的。- 另外, 在进行试管牵引实验之前, 可以将 GUVs 与蛋白质一起孵化, 以确保蛋白质的浓度恒定。考虑到在管上和在老大上的蛋白质的相对膜分数被测量, 蛋白质的传递方式不影响曲率排序计算 (见4节)。
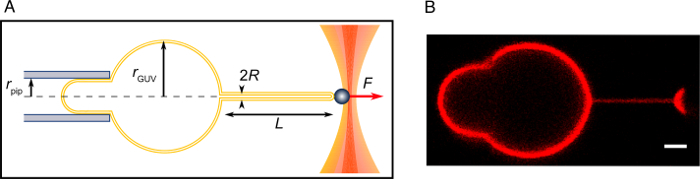
图 2: 拔管实验.(A) 实验的示意图。(B) 在本协议中描述的被拉管的共焦图像。缩放栏 = 2 µm.请单击此处查看此图的较大版本.
4. 测量和数据分析
- 薄膜张力测量
- 在恒定的吸入压力下计算每一步的静水压:
p = pgh
其中, p是水密度, g引力加速度, 以及h从步骤3.11 的水箱的高度。 - 从共焦图像中, 测量老大的半径, r老大, 以及吸入吸管的半径, rpip (图 2)。
- 计算膜张力, σ, 使用拉普拉斯方程49:
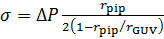
- 在恒定的吸入压力下计算每一步的静水压:
- 测量膜力
- 通过使用几种校准方法之一27来确定光学镊子的刚度, k。在此设置中, 使用粘性拖动方法27测量k 。
- 计算的平衡位置的珠子,一0, 作为一个平均从测量前拉动管 (步骤 3.8)。
- 对于每一个恒定的张力测量, 计算平衡膜力, F, 从胡克定律:
F = k(a a0)
其中, a是在该测量过程中, 珠子的平均位置。
- 测量管半径
- 在裸膜的情况下 (没有添加膜弯曲分子), 计算管半径, R, 从力为:
R = F/(4πσ)
(引用22,23)。 - 为了测量管半径在膜弯曲分子和独立的步骤 4.3.1, 首先, 记录的脂肪荧光强度沿管长度, I浴缸, 并沿老爹轮廓, I老爹。测量的平均荧光强度的荧光在或绑定到膜作为平均强度沿最亮线的管或老大轮廓。选择一个矩形框, 其中包含一个水平部分的老大轮廓或管, 并计算每一个水平线的荧光强度的总和在框中。
- 按水平线 (即、框宽) 的像素数除以每个总和。请注意, 在选定的框中, 不应该有其他的膜存在。得到了所选箱体长度的荧光强度剖面。
- 减去背景强度后, 取最亮线的平均像素荧光强度。管半径是线性相关的荧光沿管的轮廓和老大的比例为:
R = K浴缸i浴缸/i老大
其中K浴盆是一个校准因子25。
注: 此方法可用于测量 10–80 nm 范围内的管半径 (当管窄到足以在一个共焦的素体宽度下), 并在 80 nm 和更高的范围有较大的不确定性。测量的灵敏度取决于设置。
- 通过在步骤4.3.1 和4.3.2 上执行独立的半径测量来确定K浴盆, 使用不脂质进行简单的膜组合。这种简单的膜组成确保半径和力具有简单的关系, 在步骤4.3.1。重复实验几次, 并绘制 R, 从力 (步骤 4.3.1) 与I浴缸/i4.3.2 (步进) 推导出。从 fit 计算K浴缸。在此设置中, K浴缸= 200 ± 50 nm 使用鸡蛋 l-α-磷脂酰胆碱 (蛋-PC) 膜和荧光脂的萤光最小依赖于极化25。
注意: K浴盆必须针对不同的目标进行测量, 因为它们具有不同的共焦体素体积。脂质荧光不应与注射的蛋白质/分子相互作用。在这里推荐的荧光脂, BODIPY TR 神经酰胺, 预计不会有任何与蛋白质的相互作用。这个假设被证实与以前研究酒吧和 I 酒吧领域25,36,37, 这表明, 在高蛋白质表面覆盖, 管半径是固定的蛋白质, 无论老大的紧张气氛如果蛋白质与脂荧光相互作用, 荧光的损耗或富集将在不同的高蛋白质表面分数的试管中观察到。
- 在裸膜的情况下 (没有添加膜弯曲分子), 计算管半径, R, 从力为:
- 蛋白质表面密度的测定
- 使用简单的不脂质 (例如, 蛋-PC) 来制备脂质混合, 并辅以大约五种不同的荧光脂的摩尔分数 (与用于标记蛋白质的染料的波长相同,例如,BODIPY-FLC5-hexadecanoyl-phosphatidylcholine (hpc *) 为例如, Alexa488-labeled 蛋白质) 在范围: Xhpc * = 0.01–1%。用 ITO 板上的 electroformation 制备 GUVs 100 mM 蔗糖 (按照前一出版物13的步骤 1)。
- 收集 GUVs 和转移到实验室钝化与β酪蛋白。使用例如, 为实验溶液提供 100 mM 葡萄糖。等几分钟让 GUVs 安顿下来
- 以共焦荧光图像的 GUVs 和记录的平均荧光强度沿老爹轮廓作为一个功能的摩尔分数的荧光脂 (见步骤 4.3.2)。对于每个成分, 计算荧光脂的面积密度, φHPC*。例如, 假设每个脂肪的面积是 0.7 nm2, φHPC* = 1.43 x 106 xHPC *每张传单。剧情 hpc * 荧光强度在老大, 我hpc *, 老爹, vs φhpc*。Fit 给出校准常数, A, 由φhpc* = AIhpc *, 老爹。A取决于显微镜设置, 例如激光功率和探测器灵敏度 (即, 增益), 因此记录A用于各种常用显微镜设置 (参见图 3中的示例)。
- 准备几个解决方案的 HPC * 溶解于洗涤剂,例如, 十二烷基硫酸钠 (SDS), 在不同浓度的范围从〜1到10-50 µM. 各溶液在体积中的荧光强度记录及强度斜率的计算相对集中 (图 3)。重复测量与荧光将被共轭到蛋白质在一个相似的集中范围 (参见例子与 Alexa488 在图 3)。这种测量是需要的, 以联系的荧光强度的蛋白质标签和脂质标签, IA488,bulk /我HPC *, 散装, 因为他们不一定会发出相同的方式在相同的散装浓度。
- 使用 fluorospectrometer 测量每个蛋白质分子的荧光数。例如, 对于 Alexa488, 可以使用以下关系计算每种蛋白质的 Alexa488 分子的数量, nA488:
nA488 = (a494/ε488)/(a280 -0.11494)/ε波特)
其中A494和280分别为每单位长度的吸光度值 (494 nm 和 280 nm), ε a488和ε波特是 Alexa488 的分子吸收系数,蛋白质, 分别。 - 根据下面的公式计算在老大、φ波特、老爹中蛋白质的表面密度:
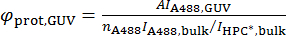
注意蛋白质的聚合状态。例如, bar 蛋白 dimerize, 因此, 如果使用单体形式的消光系数, 则计算的密度将是每个区域的条形单体。

图 3: 蛋白质表面密度校准的示例.测量的是 HPC * 脂质荧光强度在散装 (左) 和在 GUVs (中心)。此外, 测量的是 Alexa488 (绑定到 BAR 域) 的本体荧光强度 (右)。荧光强度随浓度线性缩放。测量显示的是特定的检测增益和激光功率输出。基于引用37的数据生成的图形。请单击此处查看此图的较大版本.
结果
管拉试验可以提供有关膜的重要机械信息。在没有蛋白质或其他分子与膜曲率耦合的情况下, 膜力和管半径可以与膜张力有关, 将卡纳姆-海尔哈密顿方程应用于从老大50,51 中拉出的管
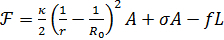 (公式 1)
(公式 1)
讨论
从 GUVs 拉管的方法给膜蛋白系统提供了丰富的信息, 因为它不仅是测量膜的基本力学性能的手段, 而且有助于揭示蛋白质与膜的耦合曲率.正如介绍中所讨论的, 还有其他技术来测量膜弯曲蛋白的影响, 要么通过将亚微米脂质体与钝化表面相连的蛋白质孵化18,19 , 要么通过观察微吸入 GUVs 后小管自发形成的研究20,21
披露声明
作者没有什么可透露的。
致谢
作者感谢 Benoit Sorre, 达米安 Cuvelier, 皮埃尔 Nassoy, 弗朗索瓦 Quemeneur 和吉尔 Toombes 在该组中建立纳米管方法的重要贡献。莱集团属于 CNRS 财团 CellTiss、Labex CelTisPhyBio (ANR-11-LABX0038) 和巴黎科学文学 (ANR-10-IDEX-0001-02)。EMBO 由长期研究金 (ALTF 1527-2014) 和居里夫人行动 (H2020-MSCA-IF-2014, 项目膜-ezrin-肌动蛋白) 资助。多发性硬化症是西蒙斯研究员协会的初级研究员。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
参考文献
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。