Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Потянув нанотрубок мембраны из гигантских однослойных везикул
* Эти авторы внесли равный вклад
В этой статье
Резюме
Многие белки в ячейке смысла и побудить мембраны кривизны. Мы описываем метод тянуть нанотрубок мембраны из липидов пузырьки для изучения взаимодействия белков или любой кривизны активные молекулы с изогнутой мембраны в пробирке.
Аннотация
Реорганизация клеточной мембраны является неотъемлемой частью многих клеточных явлений, таких как эндоцитоза, людьми, формирование filopodia, и т.д. Многие различные белки связывают с изогнутой мембраны из-за их способности смысл или побудить мембраны кривизны. Как правило эти процессы включают в себя множество белков, что делает их слишком сложными для изучения количественно в ячейке. Мы описываем протокол для воссоздания изогнутые мембраны в пробирке, подражая изогнутые сотовой структуры, например endocytic шею. Гигантский однослойных везикул (GUV) используется как модель клеточной мембраны, внутреннее давление и поверхностное натяжение которого контролируются с микропипеткой аспирации. Применение точки тяговое усилие на GUV, используя Оптический пинцет создает нанотрубки высокой кривизны, подключенных к плоской мембраны. Этот метод традиционно используется для измерения основных механических свойств липидов мембран, таких как жесткость на изгиб. В последние годы она была расширена для изучения взаимодействия белков с мембраны кривизны и то, как они влияют на форму и механики мембран. Система, сочетая микроманипуляции, микроинъекции, Оптический пинцет и confocal микроскопии позволяет измерение кривизны мембраны, мембраны напряженности и поверхностная плотность белков, одновременно. Из этих измерений может быть выведено много важных механические и Морфологические свойства белка мембранные системы. Кроме того мы выложить протокол о создании GUVs присутствии физиологические концентрации соли и метод количественного определения поверхностная плотность белка на мембране от интенсивности флуоресценции помечены белков и липидов.
Введение
Многих клеточных процессах, таких как эндоцитоза, торговля, образование filopodia, инфекции, и т.п., сопровождаются драматические изменения в форме клеточной мембраны1,2. В ячейке количество белков, участвовать в этих процессах путем привязки к мембране и изменяя их форму. Наиболее яркими примерами являются членами семьи протеина Bin/Amphiphysin/Rvs (бар), содержащий характеристику неразрывно изогнутый бар домена3,4,5,6,7. Как правило они взаимодействуют с мембраной путем присоединения домена бар на поверхность и, во многих случаях, также неглубоко Вставка амфифильными спиралей в бислой. Форма, размер и заряд бар домена вместе с количество спиралей амфифильными определяет: (1) направление мембранных кривизны (т.е., ли они будут побуждать кариолеммы или выступы) и (2) масштаб мембраны кривизны5,8. Здесь следует отметить, положительной кривизны определяется как выпуклой стороне изогнутые мембраны, т.е., выпуклость к взаимодействующих частиц и отрицательные иначе. Кроме того, количественные исследования бар белки показали, что их влияние на мембране зависит от набора физических параметров: поверхностная плотность белков, напряжение мембраны и мембраны формы (плоский против трубчатых против сферических 7форма). В зависимости от этих параметров бар белков может: (1) выступать в качестве датчиков мембраны кривизны, (2) согните мембраны или (3) побуждать мембраны scission7.
Из-за огромного числа компонентов, вовлеченных в мембраны реорганизация в ячейке, изучая количественные аспекты явления, такие как эндоцитоза в естественных условиях является чрезвычайно сложной задачей. В vitro воссоздание минимальным компонентов, подражая изогнутые мембраны в ячейке предоставляет средства механистического понимания как мембрана изгибая белков работают. Эта статья описывает протокол для воссоздания мембраны нанотрубок в пробирке с помощью микроманипуляции, конфокальная микроскопия и Оптический пинцет. Этот подход может использоваться для изучения, количественным способом, как белки, липиды или малые молекулы взаимодействуют с изогнутой мембраны. Липидные GUVs используются в качестве модели клеточной мембраны, чьи кривизны является незначительным по сравнению с размером взаимодействующих молекул, изгибая мембраны. Они были подготовлены с помощью метода electroformation9 , в котором везикулы образуются увлажняющий липидной пленки и опухоль в GUVs под переменный ток (AC)10. Наиболее распространенными субстратов, на которых выращиваются GUVs являются либо полупроводящей плиты, покрытые Индий оксид олова (ITO) или провода платины (Pt провода)11. В этой работе GUVs выращивается на Pt провода, как было показано, что этот метод работать гораздо лучше, чем альтернатива в принятии GUVs в присутствии солей в буфер12. Хотя протокол electroformation здесь описан достаточно подробно, чтобы воспроизвести его, мы отсылаем читателя к предыдущей статьи, в которых подобные и другие методы изготовления GUVs были описаны в деталях13,14. В наших руках electroformation на Pt провода успешно принесло GUVs из смеси синтетических липидов или от природных липидов экстрактов в буфер, содержащий ~ 100 мм NaCl. Кроме того было также можно инкапсулировать белков внутри GUVs во время роста. Камеру electroformation пример показан на рисунке 1A; Она состоит из двух ~ 10-cm долго Pt проводов вставляются в держатель из политетрафторэтилена (ПТФЭ), которые могут быть закрыты с обеих сторон стекла coverslips ~ 1-2 см друг от друга (рис. 1A).

Рисунок 1: экспериментальная установка. (A) GUV electroformation камера с электрическими разъемами, придает Pt провода. (B) слева: экспериментальная система, показаны в Микроскоп, экспериментальной камеры выше цели и двух micropipettes (левый и правый) придает микроманипуляторов и вставляется в экспериментальной камеры для трубки потянув и белка инъекции. Справа: в увеличенном экспериментальной камеры смонтированы выше цели показаны советы стремление и инъекций micropipettes вставлены. (C) A шприц с тонкой распылитель, вставляется в микропипеткой на его задней части. В нижней является в увеличенном колонки внутри микропипеткой с изложением микропипеткой синей пунктирной линией. Эта система используется для заполнения микропипеткой с казеином пассивации поверхности стекла, а также обратно заливки с минеральным маслом при необходимости. (D) A система, используемая для аспирационная количествах мкл раствора белка. Игла подключен шприц и трубопровод, который подключен к микропипеткой инъекций. Кончик микропипеткой тщательно погружен в раствор белка и наддува так чтобы заполнить микропипеткой кончик. Микропипеткой затем обратно заполнены с минеральным маслом, с использованием системы, отображаемые в панели C. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Нанотрубки мембраны, начиная в радиусе 7 Нм до нескольких сотен Нм, могут быть выведены из GUV внешней силой. Этот метод был первоначально предназначен для измерения упругих свойств клеточных мембран и везикулы, таких как изгиб жесткость15,16. В последних работах метод был продлен для изучения взаимодействия белков с изогнутой мембраны, microinjecting белки вблизи вытащил нанотрубок7,17. Другие методы были разработаны для изучения мембраны изгибая белков. В одном методе белки инкубируют с по-разному размера липосомы, привязанный к пассивированы поверхности. Конфокальная микроскопия используется для измерения связывания белков как функция липосом диаметра, который может указывать кривизны индуцированной сортировки19,18,. В другом методе белки вводят вблизи микро безнаддувных GUV измерить их способность спонтанно побудить трубочки20,21. Метод, описанный в настоящем Протоколе однозначно подходит для изучения мембраны изгибая белков, участвующих в эндоцитоза, где большинство белков, как правило, встречаются преформированных мембраны нанотрубок, соединяющий груза содержащих мембраны invagination с лежащие в основе плоской плазматической мембраны. Кроме того в этом методе, в отличие от в assay с привязи малых липосомы, мембраны нанотрубок постоянно подключен к мембраны; Таким образом это в Механическое равновесие с GUV, ситуация ожидается в естественных условиях. Следовательно физику фундаментальных мембраны относится и множество механических свойств можно заключить из нашего измерения по22,23,24.
Для полной реализации этого метода необходимое оборудование включает в себя Конфокальный микроскоп оптический пинцет и один или два micropipettes, подключенных к резервуар для воды (рис. 1B). Объединив все три, это позволяет одновременно измерять напряжение мембраны, мембраны кривизны, поверхностная плотность белков и трубки силу25. Микропипеткой стремление имеет важное значение, и он легко построен, вставив микропипеткой стекла в держатель, подключенных к резервуар с водой, которая, через гидростатическое давление, контролирует давление стремление26. Микропипеткой и держатель находятся под контролем микроманипулятор и, в идеале, в одном направлении пьезо привода для точности движения. Чтобы вытащить нанотрубки, microaspirated GUV кратко застрял микронных размеров бисера затем вытащил прочь создание нанотрубки. В этой реализации шарик проводится Оптический пинцет, которая может быть построена, следуя опубликованный протокол27. Это позволяет обойтись Оптический пинцет и тянуть нанотрубок различными способами, хотя за счет измерения точные силы. Если это слишком сложно построить оптические ловушки или измерения силы не существенно, такие как если один просто хочет проверить предпочтение белков изогнутые мембраны, трубка может быть вытащил с использованием бисера, наддува на кончике второй микропипеткой28. Это также можно тянуть труб с использованием гравитационных сил29 или потока30,31. Кроме того конфокальная микроскопия важно не либо; Однако желательно так чтобы измерить плотность поверхности белков. Она также позволяет, измерения нанотрубок радиуса от интенсивности флуоресценции липидов в трубки, таким образом независимо от силы мембраны и напряженности. Подразумеваемых радиус трубы от флуоресценции особенно важно, если отношения между этими количествами отклоняется от устоявшихся уравнений вследствие наличия придерживается мембранных белков25. Важно отметить, что нельзя обойтись оптические ловушки и confocal микроскопии, как это не будет возможно измерить кривизны трубы.
Метод, как описано в настоящем протоколе был использован для изучения кривизны индуцированной сортировки различных периферийных мембранных белков на нанотрубках, главным образом те из бар семьи25,,3233,34 . Было также показано, что конически форме калия трансмембранный канал, который KvAP обогащено на изогнутые нанотрубок таким же образом как бар белки35. Путем оптимизации метода инкапсуляции белков внутри GUVs, как хорошо36недавно исследовано взаимодействия белков с отрицательной кривизны. Кроме того этот метод был использован для выяснения формирования белков подмостей25,37 и изучить механизм мембраны scission либо линии напряженности38, белок Динамин39, или бар белки40,41. Помимо белков малых молекул или ионов может также вызвать кривизны. С помощью этого метода, ионов кальция показали побудить положительной кривизны под соль свободные условия42. Интересно, что также было показано, что липиды могут пройти кривизны сортировки, хотя только для композиций, которые вблизи demixing пункт43,44. В целом этот метод может использоваться исследователями заинтересованы в расследовании как либо интегральный мембранный компонентов (например, липидов или трансмембранные белки) или периферийно привязки молекул (либо внутри или вне GUVs) взаимодействуют с цилиндрически изогнутые мембраны, от механических и количественной точек зрения. Он также предназначен для тех, кто заинтересован в измерения механических свойств мембраны себя22,23,45.
протокол
1. Подготовка GUVs, Electroformation на Pt провода
- Electroformation отсек (см. Введение и рис. 1A) и Pt провода с органического растворителя, например этанол или ацетон, чтобы смыть липиды и с водой смыть соли.
Примечание: Мы рекомендуем тщательно вытирая остатков с этанола, пропитанной ткани, затем sonicating в ацетон, этанола, то вода, каждый на 5 мин. - Подготовка смесь липидов желаемого липидного состава на 1 мг/мл в хлороформе. Смесь должна содержать ~ молярная доля 0,05% липидов, конъюгированных с биотин (например, 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) и ~ 0,5% молярная доля липидов, конъюгированных с Флюорофор ( например, BODIPY-TR-C5-Церамид).
Примечание: В нашем опыте, было трудно производить GUVs в высокой доходности, содержащие более чем на 30% взимается липиды.
Предупреждение: Хлороформ должны обрабатываться внутри химические вытяжки, соответствующие перчатки. - Вставьте пару Pt провода в electroformation камере. Депозит в смесь липидов на Pt провода в капли, разделенных ~ 2-3 мм (всего ~ 4 мкл смеси).
- Сухие провода под вакуумом для 30 – 60 мин при комнатной температуре.
- Печать в нижней части камеры, соблюдая coverslip палаты с помощью силиконовой смазкой. Заполните камеры с буфферезированный раствор, содержащий NaCl, сахароза и буферизации агента (например, 70 мм NaCl, сахароза 100 мм и 10 мм трис, рН 7,4). Эта среда будет внутри GUVs в эксперименте. Важно, что осмолярности этой среды соответствуют осмолярности экспериментальной среды в течение ~ 10%. Использование сахарозы для регулировки осмолярности. Добавьте белки в решение на желаемой концентрации, если цель заключается в том, чтобы инкапсулировать их в GUVs.
Предупреждение: Различные соли и сахара в буфере может повлиять на изгиб жесткость и спонтанное кривизны мембраны-24,-42,-46,-47. - Печать в верхней части камеры, соблюдая coverslip силиконовой смазкой, обеспечение минимального воздуха внутри камеры. Применить синус переменного тока через Pt провода на 500 Гц и 280 МВ.
Примечание: Время роста и температуры должны быть оптимизированы в зависимости от состава липидного и чувствительности белка. При использовании экстрактов натуральных липидов, а также при инкапсуляции белков в GUVs, лучшие урожайность была достигнута путем выращивания GUVs на 4 ° C на ночь. В отсутствие белков и для синтетических липидной композиции, рост при комнатной температуре для ~ 2 h было достаточно.
2. Подготовка экспериментальной камеры и Micropipettes
- Чтобы подготовить micropipettes, вытяните стеклянный капилляр с помощью пипетки съемник. Предлагается использовать стеклянный капилляр с внутренний и внешний радиусы, соответственно, 0,7 мм и 1 мм. Затем, уточнить кончик микропипеткой, таким образом, чтобы его внутренний диаметр 5–7 мкм, с помощью microforge. Если в эксперименте будет вставлен белков и других молекул, тянуть другой микропипеткой и уточнить его кончик, чтобы внутренний диаметр 8–15 мкм.
- Постройте экспериментальный камеры, поставив два прямоугольных микроскопии coverslips на базе металлических, как показано на рисунке 1. Coverslips должны быть разделены ~ 1 мм. Камеры должны иметь отверстия по краям длинный (см. Рисунок 1). Открытые стороны должны соответствовать кончик микропипеткой где наконечник должен достичь по крайней мере в центре камеры.
- Подготовьте экспериментальный буфера, чьи осмолярности не должен отличаться более чем на 10% из буфера, используемого для расти GUVs. Отрегулируйте осмолярности с глюкозой. Пример экспериментальный буфера, который был использован в изучении взаимодействия endophilin с нанотрубок составляет 100 мм NaCl, глюкоза 40 мм, буфер с трис для рН 7,4. Сочетание сахарозы внутри / глюкозы вне гарантирует: a достаточная Фазовый контраст соблюдать GUVs с яркой области микроскопии и (b) выше плотность внутри GUVs, которая заставляет их поселиться в нижней части камеры. Отрегулируйте концентрации соли, основанные на экспериментальных требование.
Примечание: в дополнение к затрагивающим механических свойств мембраны, наш опыт показывает, высокий глюкозы (> 300 мм) негативно сказывается на создание облигаций стрептавидина биотин, необходимых для извлечения нанотрубки. Кроме того слишком мало соли подавляет стрептавидина биотин облигаций, в то время, как это слишком высокой по концентрации экраны взаимодействий протеин мембраны. В случае белка инкапсуляции, используя очень высокая концентрация соли в внешний буфере (например, > 200 мм NaCl) может использоваться как трюк, чтобы отделить белки от внешних листовка36. Это необходимо экспериментировать с диапазоном концентрации соли, чтобы найти оптимальный привязки условий молекулы интерес. -
30-60 мин до сбора GUVs для эксперимента, пассивации поверхности стекла, заполнив экспериментальной камеры и микропипеткой аспирации с 5 мг/мл раствора высоки чисто β-казеина (например, растворенного в экспериментальной буфера). Β-казеина создает защитный слой на поверхности стекла, предотвращая GUVs присоединиться слишком сильно, что приведет к их лопнуть. Проинкубируйте с β-казеина за 30-60 мин.
Примечание: Там должно быть никаких пузырей внутри микропипеткой, что будет мешать контролировать натяжение мембраны.- Чтобы построить диспенсером для заполнения micropipettes, сломать иглу шприца рядом пластиковый разъем и клей в нее тонкий кремния капиллярные (например те, которые используются для жидкостной хроматографии) (рис. 1 c).
- Во время инкубации с β-казеина монтировать камеры на микроскопе и его центр выше цели. Вставьте наконечник микропипеткой аспирации путем открытия вдоль длинного края и довести кончик выше цели Микроскоп. Отрегулируйте уровень воды бак, так что давление стремление близок к нулю (там должно быть без тяжелых потока или из пипетки, которые можно увидеть под микроскопом).
-
В случае, если во время эксперимента будет вводиться белков и других молекул, заполните микропипеткой инъекции с желаемой молекулы растворяют в экспериментальной буфера в концентрации выбора, смонтировать микропипеткой внутри микроманипулятор, и Вставьте через противоположной стороне экспериментальной камеры.
- Чтобы использовать минимальное количество белков, заполните только кончик микропипеткой белка путем аспирации. Чтобы сделать это, оберните конец иглы, придает шприца с пластиковых труб. Вставьте трубки в задней части микропипеткой инъекции.
- Очень тщательно погрузите кончик микропипеткой в раствор белка и его заполнить кончик микропипеткой аспирационная.
Примечание: Эта простая установка показано в рисунке 1 d и, по нашему опыту, он позволяет аспирационных от всего несколько мкл раствора белка. - Засыпки остальной части инъекций микропипеткой с минеральным маслом для предотвращения смешивания раствора белка и воду из резервуара для воды (с помощью установки в Рисунок 1 c).
- Заботиться не ввести пузырьков воздуха в пипетку инъекций, как он будет стимулировать давление впрыска нестабильной. В качестве альтернативы если достаточное количество белка, залейте микропипеткой белки так же, как начинка с β-казеина как описано в шаге 2.4. Отрегулируйте уровень воды бак для сведения к минимуму стремление давление в пипетку инъекций.
Примечание: Концентрация вводят молекулы или Ион возле нанотрубке собирается быть ниже вследствие разбавления и она может быть оценена путем измерения уменьшение интенсивности флуоресценции как функция расстояния от пипетки выхода42. Однако более важно знать плотность бислой привязкой вводят молекула, которая может быть точно измерена (см. раздел 4).
- После инкубации с β-казеина удалите решение из камеры и промыть экспериментальной буфер несколько раз. Заполните с экспериментальной буфера.
- Остановить electroformation GUVs и собирать их непосредственно от Pt провода. Добавьте несколько мкл раствора GUV экспериментальной камеры. Используйте только свежеприготовленные GUVs.
- Мкл несколько стрептавидина покрытием бусы для экспериментальной камеры до конечной концентрации бисера в зале около 0.1 x 10−3% (w/v) или меньше. Рекомендуется использовать шарики полистироля ~ 3 мкм в диаметре (шарики полистироля в воде у рядом оптимальный показатель преломления контраст отношении максимизации градиента силу в отношении силы рассеяния в оптические ловушки). Бусина концентрации может быть скорректирована на основании эксперимента: очень низкой концентрации делает его трудно найти их в камере, и слишком высокая концентрация рискует несколько бусинок, впадая в Оптический пинцет.
3. потянув нанотрубки мембраны из GUV
- Пусть GUVs и бусины оседают на дно камеры. Выкачать GUVs, позволяя немного экспериментальной буфера испаряются, для примерно ~ 15 мин, выкачивая GUVs важно производить некоторые избыточные область, которая может быть придыхательным с микропипеткой. Следует явно волнистым gUVs (т.е., появляются дискеты) в световой микроскоп. Если они появляются напряженной, позволяют больше времени испарения.
Примечание: Скорость изменений осмолярности зависит от площади испаряющей поверхности, температуры и т.д.и следует тщательно контролировать. В принципе осмолярность разница может составлять от начала, регулируя сахарозы/глюкозы, однако следует позаботиться не побудить осмотическим шоком. - Найти флоппи GUV и аспирационная в пипетку. Длина стремление язык (частью мембрана внутри пипеткой) должна быть равна или больше, чем радиус пипетку для теоретического анализа быть применимым15,16,22,23 ( Рисунок 2). Попробуйте несколько GUVs. Если ни один из GUVs может быть придыхательным производить достаточно длинный язык, подождите несколько минут. Если GUVs достаточно гибких, переходите к следующему шагу.
- Печать в камеру с минеральным маслом, чтобы предотвратить дальнейшее испарение буфера. Сделать это, тщательно закупорить нефти вдоль края открытого экспериментальной камеры.
- Чтобы задать нулевое положение стремление давления, во-первых, искать шарик в камере и положение выхода пипеткой стремление вблизи шарик. Отрегулируйте высоту резервуар для воды, таким образом, чтобы шарик не всасывается не сдувается стремление пипеткой. Хотя минеральное масло предотвращает испарение и поэтому дальнейшие изменения давления в камере, нулевой стремление давление перед началом измерения каждого GUV.
- Найти GUV и удалить его. Переместите микропипеткой вверх и не в фокусе (чтобы держать GUV от поверхности, где она может быть вытащил из пипетки, касательное напряжение при перемещении камеры).
- Посмотрите на шарик, тщательно перемещая вокруг камеры. Внезапный переход можно извлечь GUV. Ловушка с Оптический пинцет на расстоянии ~ 20 мкм от нижней палаты. Убедитесь, что регион интерес чистой, без других бусы или мембраны в прицел. Что-нибудь влюбиться в Оптический пинцет помимо шарик будет нарушать измерения.
- Верните GUV в фокус и от шарика с микропипеткой, в соответствие с оптической ловушки (рис. 2).
- Запись движения шарика для 1 – 2 мин для измерения положения равновесия (требуется для измерения силы).
- Уменьшить давление внутри микропипеткой насколько это возможно без потери GUV так, чтобы уменьшить напряжение мембраны. Тщательно довести GUV контакт с шарик для вокруг второй, налаживание связей стрептавидина биотин, затем осторожно потяните назад, создавая нанотрубки. Движения GUV к или от шарика в идеале должно быть сделано с пьезо привода сорвать минимально шарик в Оптический пинцет.
Примечание: Если нанотрубки не образуют, это может быть из-за плохой стрептавидина покрытие бисера, недостаточное количество биотинилированным липидов в GUV, недостаточная концентрация соли или чрезмерной концентрации глюкозы в экспериментальной буфер, или мембраны напряженность в GUV является слишком высокой48. - Увеличение давления стремление так, чтобы воссоздать стремление язык. Совместите трубки лежат в оси стремление пипетки и максимально сосредоточиться на трубе (рис. 2).
- Убедитесь, что GUV экватора и метро находятся в фокусе. Запись движения шарика с яркой области микроскопии за несколько минут (скорость приобретения камеры здесь, 30 Гц). Рекорд высоты, h, резервуар для воды в отношении нулевой позиции. Возьмите несколько конфокальный образы системы (рис. 2).
- Повторите предыдущий шаг при давлениях, разных аспирации, неявно мембраны напряженности. Типичный напряжение составляет 0,015 – 0,2 мН/м, с шагом размером около 0.02 МН/м.
- Если инъекции белки или молекул вблизи системы, принести инъекции микропипеткой вблизи нанотрубок, убедившись, что шарик в оптической ловушке не возмущенных. Осторожно вводить при давлении около 1 – 2 Pa.
-
После связывания белков достижение равновесного уровня (интенсивность флуоресценции вводят белка на мембране остается неизменной на GUV), повторите поэтапный измерений с голой мембраны (шаги 3.11 и 3.12).
Примечание: Поскольку измерения выполняются во время инъекции белки вблизи GUV при постоянном давлении, Массовая концентрация белка остается примерно неизменной вблизи GUV; Таким образом десорбции белка должно быть незначительным во время измерения.- Кроме того возможна инкубировать GUVs вместе с белками перед выполнением трубки потянув эксперименты для обеспечения постоянной белка массовой концентрации. Учитывая, что измеряется относительная мембраны фракция белков на трубе и на GUV, путь белков доставляются не влияет на расчет кривизны Сортировка (см. раздел 4).
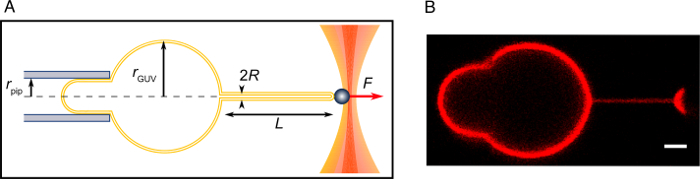
Рисунок 2: трубка потянув эксперимент. (A) схема эксперимента. (B) конфокальное изображение вытащил трубки, как описано в настоящем Протоколе. Шкалы бар = 2 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
4. измерение и анализ данных
- Измеряя напряжение мембраны
- Рассчитайте гидростатического давления для каждого шага при давлении постоянное стремление:
ΔP = pgh
где р — плотность воды, ускорение свободного падения g и h высота резервуара для воды из шага 3.11. - Конфокальный изображений Измерьте радиус GUV, rGUVи радиус стремление пипетку, rПМС (рис. 2).
- Вычислите напряженность мембраны, σ, используя уравнение Лапласа49:
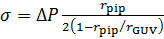
- Рассчитайте гидростатического давления для каждого шага при давлении постоянное стремление:
- Измерение силы мембраны
- Определите жесткость Оптический пинцет, k, используя один из нескольких методов калибровки27. В этой установки измеряют с помощью метода вязкой перетащить27 k .
- Вычислите положение равновесия шарика, 0,как в среднем от измерения перед вытягивать трубки (шаг 3,8).
- Для каждого измерения постоянного напряжения расчета равновесия мембраны силы F, от Гука закона:
F = k( - 0)
где — средняя позиция из бисера во время этого измерения.
- Измерительные трубки радиус
- В случае голой мембраны (не добавлен мембраны изгибая молекул) Вычислите радиус трубы, R, от сил, как:
R = F/(4πσ)
(ссылки2322,). - Чтобы измерить радиус трубы присутствии мембраны изгибая молекул и независимо от шага 4.3.1, во-первых, записывайте интенсивности флуоресценции липидов вдоль длины трубки, яваннойи вдоль контура GUV, яGUV. Измерьте интенсивность средняя флуоресценции Флюорофор в или прыгните к мембране как средней интенсивности вдоль линии ярких трубку или GUV контура. Выберите прямоугольник, содержащий горизонтальные секции GUV контура или трубки и вычислить сумму интенсивности флуоресценции каждой горизонтальной линии в поле.
- Разделите каждую сумму на количество пикселей горизонтальной линии (т.е., ширина окна). Обратите внимание, что в выбранном поле, должно быть без других настоящей мембраны. Получено профиль интенсивности флуоресценции по длине выбранного поля.
- После вычета интенсивность фона, принять интенсивности флуоресценции средняя пикселей от ярких линии. Радиус трубы линейно связана с отношение флуоресценции вдоль контура трубки и GUV как:
R = KВаннаяванной/яGUV
где KВанна — коэффициент калибровки25.
Примечание: Этот метод может использоваться для измерения радиуса трубы в диапазоне 10 – 80 Нм (когда трубка находится достаточно узкими, чтобы лежать в пределах одной ширины конфокальный voxel) и с несколько большей неопределенности в 80 Нм и выше диапазона. Чувствительность измерения зависит от установки.
- Определите KВанна , выполняя независимых радиус измерений в шагах 4.3.1 и 4.3.2 на простой мембраны композицию с помощью незаряженных липиды. Такой простой мембраны состав гарантирует, что радиус и силы имеют простые отношения в шаге 4.3.1. Повторить эксперимент несколько раз и участок R, вывели из состава сил (шаг 4.3.1) против яванной/яGUV (шаг 4.3.2). Вычислите KВанна из fit. В этой установки,Ванна K= 200 ± 50 Нм, используя яйцо L-α-фосфатидилхолин (яйцо PC) мембраны и флуоресцентные липидов, чьи флуоресценции минимально зависит от поляризации25.
Примечание: KВанна должна быть измерена для различных целей, из-за их различных конфокальный voxel томов. Липидные Флюорофор не должны взаимодействовать с вводят белков/молекул. Флуоресцентный липидов, рекомендовал здесь, Церамид BODIPY TR, ожидается не имеют какие-либо взаимодействия с белками. Это предположение было подтверждено с предыдущих исследований бар и бар-домены25,36,37, которые показали, что на поверхности покрытия высоким содержанием белка, радиус трубы фиксируется белки, вне зависимости от напряженность в GUV. Если белки взаимодействуют с Флюорофор липидов, истощение или обогащения Флюорофор будет наблюдаться в трубе на поверхности различных высоким белковых фракций.
- В случае голой мембраны (не добавлен мембраны изгибая молекул) Вычислите радиус трубы, R, от сил, как:
- Измерение поверхностной плотности белков
- Подготовка смеси липидов, используя простой незаряженных липидов (например, яйцо PC) дополнены около пяти различных моль фракций флуоресцентный липидов (Всего же волны как краситель, используемый для обозначения белка, например, BODIPY-FLC5-hexadecanoyl-phosphatidylcholine (HPC *) для например, белок Alexa488-меченых) в диапазоне: XHPC * = 0,01 – 1%. Подготовьте GUVs в 100 мм сахарозы, electroformation на Ито пластины (выполните шаг 1 предыдущей публикации13).
- Сбор GUVs и передаче экспериментальной камеры, пассивированная с β-казеина. Использование, например, 100 мм глюкозы для экспериментальной решения. Подождите несколько минут для GUVs урегулировать.
- Конфокальный флуоресценции изображения GUVs и рекорд интенсивности флуоресценции средняя вдоль GUV контуры по как функция Мольная доля флуоресцентные липидов (см. шаг 4.3.2). Для каждой композиции, вычислить плотность области флуоресцентные липидов, φHPC*. Например, в предположении, что площадь на липидной 0,7 Нм2, φHPC* 1.43 x 10 =6 XHPC * за листовку. Участок HPC * интенсивности флуоресценции в GUV,HPC *, GUV, по сравнению с φHPC*. Fit дает калибровки константа, А, учитывая φHPC* = AIHPC *, GUV. A зависит от параметров микроскопии, такие, как мощность лазера и чувствительность детектора (то есть, прибыль), поэтому запись A различных часто используемых параметров микроскопии (см. пример на рис. 3).
- Подготовьте несколько решений HPC * растворяют в моющих средств, например, лаурилсульфат натрия (SDS), в различных концентрациях в диапазоне от ~ 1-10-50 мкм. запись интенсивности флуоресценции каждого решения навалом и рассчитать уклон интенсивности концентрация по сравнению с (рис. 3). Повторите измерения с Флюорофор, который будет конъюгированных белка в диапазоне аналогичные концентрации (см. пример с Alexa488 на рис. 3). Это измерение требуется соотнести интенсивности флуоресценции белков этикетки и этикетки липидов, яA488, основная / яHPC *, россыпью, как они могут не выделяют обязательно таким же образом, в такой же концентрации оптом.
- Измерьте количество флуорофоров в молекулу белка, с помощью fluorospectrometer. Например в случае Alexa488, количество молекул Alexa488 за белка, nA488, можно вычислить с помощью следующие отношения:
n A488 = (A494/εA488) / ((А280 - 0.11В494) / εprot)
где A494 и A280 являются значения поглощения на единицу длины в 494 Нм и 280 Нм, соответственно, и εA488 и εprot являются коэффициенты молекулярной абсорбции Alexa488 и белка, соответственно. - Рассчитать плотность поверхности белка на GUV, φprot, GUV, по следующей формуле:
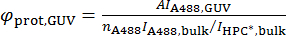
Имейте в виду состояние полимеризации белка. Например, Бар белки dimerize, поэтому рассчитанные плотность будет что бар мономера в области, если используется коэффициент вымирания односегментную форму.

Рисунок 3: пример калибровки поверхностная плотность белка. Измерения являются HPC * липидов флуоресценции интенсивность навалом (слева) и в GUVs (в центре). Измеряется также интенсивность флуоресценции массовых Alexa488 (связан с доменом бар) (справа). Интенсивность флуоресценции масштабируется линейно с концентрацией. Измерения показаны для обнаружения конкретные выгоды и лазерные Выходная мощность. Участки сгенерированный на основе данных из ссылки37. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Трубка потянув эксперимент могут дать жизненно механические информацию о мембраны. В отсутствие белков и других молекул, которые силы пара с мембраной кривизны, мембраны и радиус трубы могут быть связаны с мембраной напряженности путем применения Канхем-Хелфрих Гами...
Обсуждение
Метод потянув трубы с GUVs дает богатую информацию о системе мембрана белка, как это не только средство для измерения основных механических свойств мембраны, но он помогает пролить свет на связи между белками и мембраны кривизны. Как указывалось во введении, другие методы существуют для ?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы благодарят Benoit Sorre, Дамьен Кувелье, Пьер Nassoy, Франсуа Quemeneur и Gil Toombes за их важный вклад установить метод нанотрубок в группе. П.б. Группа принадлежит консорциуму CNRS CellTiss, Labex CelTisPhyBio (АНР-11-LABX0038) и Париж наук и литературы (АНР-10-IDEX-0001-02). F. C. Tsai финансировался EMBO долгосрочных стипендий (ALTF 1527-2014) и Мари Кюри действия (H2020-МСКА-если-2014, проект мембраны Эзрин миозина). М.с. – младший научный Симонс общества стипендиатов.
Материалы
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
Ссылки
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены