Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tirando de nanotubos de membrana de las vesículas unilaminar gigante
* Estos autores han contribuido por igual
En este artículo
Resumen
Muchas proteínas en la célula de sensación e inducen curvatura de la membrana. Se describe un método para nanotubos de membrana de las vesículas de lípidos para el estudio de la interacción de proteínas o cualquier molécula activa de curvatura con membranas curvo in vitro.
Resumen
La remodelación de la membrana celular es una parte integral de muchos fenómenos celulares, como la endocitosis, trata de personas, la formación de filopodios, etcetera. Muchas proteínas diferentes se asocian con membranas curvadas debido a su capacidad para sentir o inducir la curvatura de la membrana. Por lo general, estos procesos implican una multitud de proteínas haciéndolos demasiado complejo para estudiar cuantitativamente en la célula. Se describe un protocolo para la reconstitución de una membrana curvada en vitro, imitando una estructura celular curva, como el cuello endocítico. Una vesícula unilaminar gigante (GUV) se utiliza como un modelo de una membrana celular, cuya presión interna y tensión superficial son controlado con la aspiración de la micropipeta. Aplicación de una fuerza de tracción de punto en el GUV usando pinzas ópticas crea un nanotubo de alta curvatura conectado a una membrana plana. Este método se ha utilizado tradicionalmente para medir las propiedades mecánicas fundamentales de las membranas de lípidos, como la rigidez de flexión. En los últimos años se ha ampliado para estudiar cómo las proteínas interactúan con la curvatura de la membrana y la forma en que afectan la forma y la mecánica de las membranas. Un sistema que combina la micromanipulación, microinyección, pinza óptica y microscopía confocal permite medición de la curvatura de la membrana, membrana tensión y la densidad superficial de las proteínas, al mismo tiempo. De estas mediciones, se pueden deducir muchas propiedades mecánicas y morfológicas importantes sistema de proteínas de la membrana. Además, nos pone a un protocolo de creación 2.fino en presencia de concentraciones fisiológicas de sal y un método de cuantificación de la densidad superficial de las proteínas en la membrana de intensidades de fluorescencia de etiquetado proteínas y lípidos.
Introducción
Muchos procesos celulares, tales como endocitosis, trata de personas, la formación de filopodios, infección, etc., se acompañan de un cambio drástico en la forma de las membranas celulares1,2. En la célula, una serie de proteínas participa en estos procesos por Unión a la membrana y alterar su forma. Los ejemplos más notables son los miembros de la familia de proteínas Amphiphysin/Bin/Rvs (BAR), que contiene una característica intrínsecamente curvada barra dominio3,4,5,6,7. Por lo general, interactúan con la membrana adhiriendo el dominio de la barra a la superficie y, en muchos casos, también con insertar anfipáticos hélices en la bicapa. La forma, tamaño y carga del dominio de barra con el número de hélices anfipáticos determina: (1) la dirección de la curvatura de la membrana (es decir, si inducen invaginaciones o salientes) y (2) la magnitud de la membrana curvatura de5,8. De la nota, aquí curvatura positiva se define como el lado convexo de la membrana curvada, es decir, el bombeo hacia las partículas interactuantes y negativo lo contrario. Por otra parte, los estudios cuantitativos de barra proteínas revelaron que su efecto sobre la membrana depende de un conjunto de parámetros físicos: densidad de proteínas, la tensión de la membrana y forma de membrana (plano versus tubular versus esférica de la superficie forma)7. Dependiendo de estos parámetros de la barra las proteínas puede: (1) actuar como sensores de la curvatura de la membrana (2) las membranas de la curva y (3) induzca de la escisión de la membrana7.
Debido al número de componentes implicados en la remodelación de la membrana en la célula, estudia los aspectos cuantitativos de los fenómenos, tales como endocitosis, en vivo es extremadamente difícil. In vitro de la reconstitución de componentes mínimos que mímico el curvado de las membranas en la célula proporciona medios para lograr una comprensión mecanicista de proteínas de membrana-curvar como operar. Este artículo describe un protocolo para la reconstitución de una membrana nanotubos en vitro con micromanipulación, microscopía confocal y pinzas ópticas. El enfoque puede utilizarse para estudiar, en forma cuantitativa, como proteínas, lípidos o pequeñas moléculas interactuan con membranas curvadas. 2.fino de lípidos se utiliza como modelos de una membrana celular, cuya curvatura es despreciable en comparación con el tamaño de moléculas de membrana curva interacción. Son preparados utilizando el método de electroformation9 en que las vesículas se forman por hidratante una película lipídica y la hinchazón en 2.fino debajo de una corriente alterna (CA)10. Sustratos más comunes que se cultiva 2.fino son ambos semi-conductivas placas recubiertas con óxido de estaño indio (ITO) o cables de platino (Pt-cables)11. En este trabajo, 2.fino crecen en alambres de Pt como este método se ha demostrado que funciona mucho mejor que la alternativa en la fabricación de 2.fino en presencia de sales en el buffer12. Aunque el protocolo electroformation se describe aquí en detalle suficiente para reproducirlo, nos referimos al lector a los artículos anteriores en el que se han descrito similares y otros métodos de hacer 2.fino en detalle13,14. En nuestras manos, electroformation en alambres de Pt ha con éxito dado a 2.fino de una mezcla de lípidos sintéticos o de lípidos naturales extractos en un tampón que contiene ~ 100 mM NaCl. Además, también era posible encapsular proteínas dentro 2.fino durante el crecimiento. Una cámara de electroformation de ejemplo se muestra en la figura 1A; se compone de dos Pt-cables ~ 10 cm de largo insertados en un soporte de politetrafluoroetileno (PTFE) que se puede sellar por ambos lados con vidrio cubreobjetos cm ~ 1-2 apart (figura 1A).

Figura 1: montaje Experimental. (A) la electroformation GUV cámara con conectores eléctricos conectados a los cables de la pinta. Izquierda (B): el sistema experimental que muestra el microscopio, la cámara experimental sobre el objetivo y dos Micropipetas (izquierdos y derecho) conectado a los micromanipuladores e introduce en la cámara experimental para tirar del tubo y la proteína inyección. Derecha: una vista cercana de la cámara experimental montado sobre el objetivo que muestra los extremos de la aspiración y las Micropipetas de inyección insertados. (C) A la jeringa equipada con un distribuidor delgado insertado en una micropipeta en su extremo posterior. El fondo es una vista cercana de la cubeta dentro de la micropipeta con la línea de puntos azul que la micropipeta. Este sistema se utiliza para llenar la micropipeta con caseína a apaciguar la superficie de vidrio y también para llenar con aceite mineral cuando sea necesario. (D) A sistema usado para aspirar cantidades μl de la solución de proteína. La aguja está conectada a una jeringa y tubo que está conectado con la micropipeta de inyección. La punta de la micropipeta es inmerso en la solución de proteína y aspira así para llenar la punta de la micropipeta. La micropipeta es entonces volver llenos de aceite mineral con el sistema se muestra en el panel C. haga clic aquí para ver una versión más grande de esta figura.
Un nanotubo de membrana, que se extienden en un radio de 7 nm a varios cientos nm, se puede tirar de un GUV por una fuerza externa. Este método fue inicialmente diseñado para medir las propiedades elásticas de las membranas celulares y de las vesículas, como la flexión rigidez15,16. En obras más recientes, el método se amplió para estudiar la interacción de proteínas con membranas curvadas por microinjecting las proteínas cerca el nanotubo tirado7,17. Otros métodos han sido desarrollados para el estudio de las proteínas de membrana curva. En uno de los métodos, las proteínas se incuban con liposomas de diferentes tamaños anclados a una superficie pasivada. La microscopia confocal se utiliza para medir la Unión a proteínas en función del diámetro de liposomas, que puede indicar curvatura inducida clasificación18,19. En otro método, se inyectan proteínas cerca un GUV micro aspirado para medir su capacidad de inducir espontáneamente túbulos20,21. El método descrito en el presente Protocolo está especialmente preparado para estudiar la curvatura de la membrana proteínas implicadas en la endocitosis, donde la mayoría de las proteínas normalmente con nanotubos de membrana preformada conectando la invaginación de la membrana que contiene la carga con el membrana de plasma plana subyacente. Además, en este método, a diferencia de en el ensayo con liposomas pequeño atados, los nanotubos de membrana está continuamente conectado a la membrana; por lo tanto, está en equilibrio mecánico con el GUV, una situación esperada en vivo. Por lo tanto, se aplica la física de la membrana fundamental y podemos inferir una plétora de propiedades mecánicas de nuestras medidas22,23,24.
Para una plena aplicación de este método, el equipo necesario incluye un microscopio confocal, pinzas ópticas y una o dos Micropipetas conectadas a un tanque de agua (figura 1B). Combinando los tres, es posible medir la tensión de la membrana, membrana curvatura, densidad superficial de las proteínas, y simultáneamente tubo fuerza de25. Aspiración de la micropipeta es esencial y fácilmente se construye insertando una micropipeta de vidrio en un soporte conectado a un tanque de agua, que, a través de la presión hidrostática, controla la presión de aspiración26. La micropipeta y el soporte son controlados por un micromanipulador e, idealmente, en una dirección por un actuador piezoeléctrico para el movimiento de precisión. Para tirar un nanotubo, en microaspirated GUV brevemente se pega a un micrón de tamaño grano entonces tiró lejos creando un nanotubo. En esta implementación, el grano se lleva a cabo por pinzas ópticas, que pueden construirse siguiendo un protocolo publicado27. Es posible obtener de las pinzas ópticas y nanotubos de tirar de diferentes formas, aunque a costa de medidas de fuerza precisa. Si es demasiado difícil para construir una trampa óptica o si las medidas de fuerza son no esenciales, tales como si uno simplemente quiere ver la preferencia de las proteínas de membranas curvadas, se puede tirar un tubo usando un grano aspirado en la punta de una segunda micropipeta28. También es posible tirar los tubos utilizando fuerza gravitacional29 o30,31de flujo. Además, la microscopia confocal no es esencial sin embargo, es preferido por lo tanto para medir la densidad superficial de las proteínas. También permite medir el radio de nanotubo de intensidad de fluorescencia de los lípidos en el tubo, por lo tanto independientemente de la fuerza de la membrana y la tensión. Inferencia radio tubo de fluorescencia es particularmente importante si la relación entre estas cantidades se desvía de las ecuaciones bien establecidas debido a la presencia de proteínas de membrana adherida25. Lo importante, uno no puede dispensar de la trampa óptica y microscopia confocal, ya que no será posible medir la curvatura del tubo.
El método descripto en este protocolo se ha utilizado para estudiar la curvatura inducida por clasificación de diversas proteínas de membrana periférica en nanotubos, sobre todo los de la barra familiar25,32,33,34 . También fue demostrado que el canal de potasio transmembrana formados cónicamente en que kvap se enriquece curva nanotubos de la misma manera como la barra de proteínas35. Optimizando el método para encapsular proteínas dentro 2.fino, la interacción de proteínas con curvatura negativa ha sido recientemente investigada bien36. Además, este método ha sido utilizado para dilucidar la formación de proteína andamios25,37 y estudiar el mecanismo de la escisión de la membrana por cada línea tensión38, proteína Dinamina39, o por la barra de proteínas40,41. Además de proteínas, moléculas pequeñas o iones también pueden inducir la curvatura. Usando este método, los iones de calcio mostraron inducen curvatura positiva bajo condiciones libres de sal42. Curiosamente, también se ha demostrado que los lípidos pueden sufrir curvatura clasificación, aunque sólo para las composiciones que están cerca de un punto demixing43,44. En suma, el método puede ser utilizado por investigadores interesados en la investigación de cómo cualquiera de los dos componentes de la membrana integral (por ejemplo, los lípidos o las proteínas transmembranales) o periféricamente vinculante moléculas (ya sea dentro o fuera de 2.fino) interactuar con membranas cilíndrico curvadas, desde el punto de vista mecánico y cuantitativo. También está diseñado para aquellos interesados en la medición de las propiedades mecánicas de la membrana sí mismo22,23,45.
Protocolo
1. preparación de 2.fino por Electroformation en los cables de la pinta
- Limpiar la cámara de electroformation (ver Introducción y figura 1A) y Pt-alambres con un disolvente orgánico como etanol o acetona para eliminar los lípidos y con agua para lavar las sales.
Nota: Le sugerimos fondo enjugando el residuo con tejido impregnado de etanol entonces sonicando en acetona, etanol, agua, cada 5 minutos. - Preparar una mezcla de lípidos de una composición de lípidos deseada en 1 mg/mL en cloroformo. La mezcla debe contener ~ 0,05% fracción molar de un lípido conjugado con biotina (p. ej., 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000]) y ~ 0.5% de fracción molar de un lípidos conjugados con un fluoróforo ( por ejemplo, BODIPY-TR-C5-ceramida).
Nota: En nuestra experiencia, es difícil producir 2.fino al alto rendimiento que contiene más del 30% cargado de lípidos.
PRECAUCIÓN: Cloroformo debe ser manipulado dentro de una campana química con guantes apropiados. - Inserte un par de alambres de Pt en la cámara de electroformation. Depositar la mezcla de lípidos en los cables de la pinta en gotas separadas por ~ 2-3 mm (total ~ 4 μL de la mezcla).
- Secar los cables bajo vacío durante 30 – 60 min a temperatura ambiente.
- La parte inferior de la cámara del sello adhiriendo el cubreobjetos sobre la cámara con grasa de silicona. Llene la cámara con una solución tamponada que contiene NaCl, sacarosa y un neutralizante (p. ej., 70 mM NaCl, sacarosa 100 mM y 10 mM Tris, pH 7.4). Este medio estará dentro la 2.fino en el experimento. Es esencial que la osmolaridad del medio coinciden con la osmolaridad del medio experimental dentro de ~ 10%. Uso de sacarosa para regular la osmolaridad. Añadir proteínas a la solución a una concentración deseada si el objetivo es encapsular en la 2.fino.
PRECAUCIÓN: Diferentes sales y azúcares en el búfer pueden afectar a la rigidez de flexión y la curvatura espontánea de membranas24,42,46,47. - Selle la parte superior de la cámara adhiriendo un cubreobjetos con grasa de silicona garantiza aire dentro de la cámara. Aplicar una corriente sinusoidal AC a través de los alambres de Pt en 500 Hz y 280 mV.
Nota: El tiempo de crecimiento y la temperatura deben ser optimizados dependiendo de la composición de lípidos y la sensibilidad de la proteína. Al usar extractos de lípidos naturales y también cuando encapsular proteínas en 2.fino, el mejor rendimiento se logró crecimiento 2.fino a 4 ° C durante la noche. En ausencia de proteínas y para las composiciones de lípidos sintéticos, crecimiento a temperatura ambiente durante ~ 2 h era suficiente.
2. preparación de la cámara Experimental y las Micropipetas
- Para preparar micropipetas, tire un capilar de vidrio utilizando un extractor de la pipeta. Se sugiere utilizar un capilar de vidrio con radios internos y externos, respectivamente, 0,7 mm y 1 mm. Luego, afinar la punta de la micropipeta para que su diámetro interno es 5–7 μm, usando un microforge. Si se inyecta proteínas u otras moléculas en el experimento, tire otra micropipeta y refinar su extremidad para un diámetro interno de 8 μm 15–.
- Construir una cámara experimental colocando dos cubreobjetos microscopio rectangular sobre una base metálica como se muestra en la figura 1. El cubreobjetos deben estar separadas por ~ 1 mm. La cámara debe tener aberturas a lo largo de los bordes laterales (ver figura 1). Los lados abiertos deben encajar la punta de la micropipeta en la punta debe alcanzar al menos el centro de la cámara.
- Preparar el tampón experimental cuya osmolaridad no debe diferir en más del 10% del buffer utilizado para crecer a 2.fino. Ajuste de la osmolaridad con glucosa. Un ejemplo de un búfer de experimental que se utilizó en el estudio de la interacción de endophilin con nanotubos es 100 mM NaCl, glucosa 40 mM, tamponada con Tris pH 7.4. Una combinación de sacarosa dentro / fuera la glucosa asegura: contraste de fase (a) suficiente para observar 2.fino con microscopía de campo brillante y (b) mayor densidad dentro de la 2.fino que les lleva a instalarse en la parte inferior de la cámara. Ajustar la concentración de sal basado en el requisito experimental.
Nota: Además de afectar las propiedades mecánicas de la membrana, en nuestra experiencia, la concentración de glucosa alta (> 300 mM) afecta negativamente a la creación de bonos de estreptavidina-biotina, necesaria para tirar de un nanotubo. Además, muy poca sal inhibe bonos de estreptavidina-biotina, mientras que demasiado de una concentración pantallas las interacciones membrana-proteína. En el caso de encapsulación de proteínas, con muy alta concentración de sal en el buffer externo (p. ej., > 200 mM NaCl) puede ser utilizado como un truco para separar las proteínas de la hoja exterior36. Es necesario experimentar con una gama de concentraciones de sal para encontrar las condiciones de Unión óptima de la molécula de interés. -
30-60 min antes de recoger 2.fino para el experimento, apacigua las superficies de vidrio rellenando la cámara experimental y la micropipeta de aspiración con una solución de 5 mg/mL de una β-caseína altamente pura (p. ej., disuelto en el tampón de experimental). Β-caseína crea una capa protectora en las superficies de vidrio, evitando 2.fino para adherirse muy fuertemente, que pueda causar que exploten. Incubar con la β-caseína durante 30 – 60 min.
Nota: Debe haber ningunas burbujas dentro de la micropipeta que pueda interferir con el control de tensión de la membrana.- Para construir un dispensador para el llenado de micropipetas, romper una aguja de jeringa cerca del conector de plástico y pegamento en él un capilar de sílice fina (como los utilizados para la cromatografía líquida) (figura 1).
- Durante la incubación con β-caseína, Monte la cámara en el microscopio y centrarla sobre el objetivo. Inserte la punta de la micropipeta de aspiración a través de la abertura en el borde largo y llevar la punta sobre el objetivo del microscopio. Ajuste el nivel del tanque de agua para que la presión de aspiración es cercano a cero (no debe ser flujo pesado dentro o fuera de la pipeta, que puede verse bajo el microscopio).
-
En el caso de las proteínas u otras moléculas se inyecta durante el experimento, relleno la micropipeta de inyección con la molécula deseada disuelto en el tampón de experimental a una concentración de elección, montar la micropipeta dentro de un micromanipulador, y Inserte el lado opuesto de la cámara experimental.
- Para usar una cantidad mínima de proteínas, llene sólo la punta de la micropipeta con la proteína por la aspiración. Para ello, envuelva el extremo de una aguja conectada a una jeringa con un tubo de plástico. Inserte el tubo en la parte posterior de la micropipeta de inyección.
- Cuidadosamente sumerja la punta de la micropipeta en la solución de la proteína y aspirar para llenar la punta de la micropipeta.
Nota: Esta configuración simple se muestra en la figura 1 y, en nuestra experiencia, permite la aspiración desde tan poco como unos pocos μl de la solución de proteína. - Rellene el resto de la micropipeta de inyección con aceite mineral para evitar la mezcla de la solución de la proteína y el agua del tanque de agua (mediante la configuración en la figura 1).
- Tenga cuidado de no para introducir burbujas de aire en la pipeta de inyección, como inducirá la presión de inyección inestable. Alternativamente, si la cantidad de proteína es suficiente, llene la micropipeta con las proteínas de la misma manera como relleno de β-caseína como se describe en el paso 2.4. Ajustar el nivel de tanque de agua para minimizar la presión de aspiración en la pipeta de inyección.
Nota: La concentración de la molécula inyectada o ion cerca el nanotubo va a ser menor debido a la dilución y se puede estimar midiendo la disminución de la intensidad de fluorescencia en función de la distancia de la pipeta de salida42. Es sin embargo más importante saber la densidad bicapa-limite de la molécula inyectada, que puede ser medida exactamente (véase capítulo 4).
- Tras la incubación con β-caseína, retire la solución de la cámara y enjuague con el tampón de experimental varias veces. Llene con el tampón de experimental.
- Deje de electroformation de 2.fino y recoger directamente de los cables de la pinta. Añada unos pocos μl de la solución GUV a la cámara experimental. Use sólo las preparan a 2.fino.
- Añadir unos μl de perlas recubiertas de estreptavidina en la cámara experimental para una concentración final de cuentas en la cámara en torno a 0.1 x 10−3% (w/v) o menos. Se recomiendan los granos del poliestireno ~ 3 μm de diámetro (granos del poliestireno en agua tienen un contraste de índice de refracción casi óptima en cuanto a maximizar el gradiente de fuerza con respecto a la fuerza de dispersión en la trampa óptica). La concentración de grano puede ser ajustada en base a la experiencia: una concentración muy baja hace que sea difícil encontrar en la cámara, y una concentración demasiado alta corre el riesgo de múltiples granos de caer en las pinzas ópticas.
3. tirando un nanotubos de membrana de un GUV
- Deje que al 2.fino y colocan los granos en la parte inferior de la cámara. Desinflar el 2.fino dejando un poco del búfer experimental se evaporan, para aproximadamente ~ 15 minutos desinflando el 2.fino es esencial para producir algún exceso área que puede ser aspirado con la micropipeta. 2.fino debe visiblemente undulate (es decir, aparece floppy) bajo el microscopio óptico. Si aparecen tensas, permiten más tiempo de evaporación.
Nota: La tasa de cambio de osmolaridad depende de la superficie de evaporación, temperatura, etc.y debe vigilarse estrechamente. En principio, la diferencia de osmolaridad podría de inicio mediante el ajuste de la concentración de sacarosa/glucosa, sin embargo, debe tener cuidado de no para inducir un choque osmótico. - Busque a un disquete GUV y Aspire con la pipeta. La longitud de la lengüeta de aspiración (la parte de la membrana dentro de la pipeta) debe ser igual o mayor que el radio de la pipeta para el análisis teórico a ser aplicable15,16,22,(23 Figura 2). Pruebe a varios 2.fino. Si ninguno de lo 2.fino puede aspirarse para producir una lengua bastante larga, esperar unos minutos más. Si 2.fino es bastante flojo, proceder al siguiente paso.
- Sellar la cámara con aceite mineral, para evitar la evaporación del búfer. Hacerlo mediante pipeteo cuidadosamente el aceite a lo largo de los bordes abiertos de la cámara experimental.
- Para ajustar la posición cero de la presión de aspiración, en primer lugar, buscar una gota en la cámara y coloque la salida de la pipeta de aspiración cerca del talón. Ajuste la altura del tanque de agua para que el grano es aspirado ni flipado por la pipeta de aspiración. Aunque el aceite mineral evita la evaporación y por lo tanto, más cambios de presión dentro de la cámara, la presión de aspiración a cero antes de medir a cada GUV.
- Encontrar a un GUV y aspirar a lo. La micropipeta se mueven hacia arriba y fuera de foco (para mantener al GUV lejos de la superficie donde se puede sacar de la pipeta por esfuerzo cortante cuando la cámara se mueve).
- Busque una tira moviendo cuidadosamente alrededor de la cámara. Movimientos bruscos pueden expulsar al GUV. Trampa con pinzas ópticas a distancia ~ 20 μm de la parte inferior del compartimiento. Asegúrese de que la región de interés es limpieza sin otros granos o membranas a la vista. Nada caer en la pinza óptica que no sea el grano, se interrumpirán la medida.
- Traer al GUV en foco y lejos el grano con la micropipeta con la trampa óptica (figura 2).
- Registrar el movimiento de la cuenta de 1-2 minutos medir la posición de equilibrio (necesaria para las medidas de fuerza).
- Reducir la presión dentro de la micropipeta tanto como sea posible sin perder el GUV para disminuir la tensión de la membrana. Llevar cuidadosamente el GUV en contacto con el grano de alrededor de un segundo, estableciendo vínculos de estreptavidina-biotina, luego tire suavemente de nuevo creando un nanotubo. El movimiento de GUV hacia o lejos del talón debe realizarse idealmente con un actuador piezoeléctrico perturbar mínimamente el grano de las pinzas ópticas.
Nota: Si no forman el nanotubo, podría ser debido a la pobre estreptavidina capa del grano, insuficiente cantidad de lípidos biotinilado en GUV, concentración insuficiente de sal o excesiva concentración de glucosa en el búfer de experimental, o en la membrana tensión en el GUV es demasiado alto48. - Aumentar la presión de aspiración para recrear la lengua de aspiración. Alinee el tubo a la mentira en el eje de la pipeta de aspiración y máximo enfoque en el tubo (figura 2).
- Asegúrese de que el Ecuador GUV y el tubo están en foco. Registrar el movimiento del grano con microscopía de campo brillante durante unos minutos (aquí, la velocidad de la cámara es de 30 Hz). Registrar la altura, h, del tanque de agua con respecto a la posición cero. Tomar unas imágenes de confocales del sistema (figura 2).
- Repita el paso anterior a presiones de aspiración diferentes, implícitamente las tensiones de membrana. Rango de tensión típica es de 0.015 – 0,2 mN/m, con un tamaño de paso de aproximadamente 0.02 mN/m.
- Si inyecta proteínas o moléculas cerca del sistema, trae la micropipeta de inyección cerca de los nanotubos, asegurándose de que el grano de la trampa óptica no es perturbado. Inyectar suavemente a una presión de alrededor de 1 – 2 PA.
-
Después de la Unión a proteínas ha equilibrado (la intensidad de fluorescencia de la proteína inyectada en la membrana permanece constante en el GUV), repita las mediciones paso a paso como con la membrana desnuda (pasos 3.11 y 3.12).
Nota: Puesto que las mediciones son realizadas al mismo tiempo inyectar proteínas cerca el GUV a presión constante, la concentración de la mayor parte de la proteína sigue siendo más o menos inalterada cerca GUV; así, desorción de proteína debe ser despreciable durante la medición.- Alternativamente, es posible incubar a 2.fino junto con las proteínas antes de realizar experimentos de tirar por el tubo para asegurar una concentración de proteína constante a granel. Dado que se mide la fracción de membrana relativa de proteínas en el tubo y el GUV, el camino se entregan proteínas no influye en el cálculo de curvatura de clasificación (véase capítulo 4).
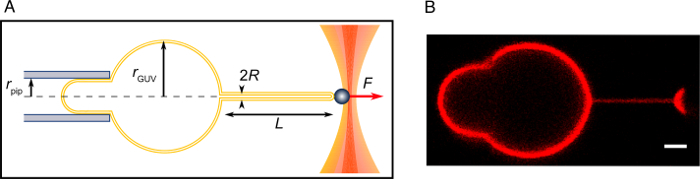
Figura 2: experimento de tirar tubo. (A) esquema del experimento. (B) una imagen confocal de un tubo tirado como se describe en este protocolo. Barra de escala = 2 μm. haga clic aquí para ver una versión más grande de esta figura.
4. mediciones y análisis de datos
- Medición de tensión de la membrana
- Calcular la presión hidrostática para cada paso a presión de aspiración constante:
ΔP = pgh
donde p es la densidad del agua, g aceleración de la gravedad y h la altura del tanque de agua de paso 3.11. - De imágenes confocales, medir el radio de GUV, rGUVy el radio de la pipeta de aspiración, rpip (figura 2).
- Calcular la tensión de la membrana, σ, utilizando la ecuación de Laplace49:
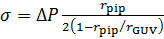
- Calcular la presión hidrostática para cada paso a presión de aspiración constante:
- Medir la fuerza de la membrana
- Determinar la rigidez de las pinzas ópticas, k, utilizando uno de varios métodos de calibración27. En esta configuración, medir k usando el método de arrastre viscoso27.
- Calcular la posición de equilibrio del grano, un0, como un promedio de una medición antes de retirar el tubo (paso 3.8).
- Para cada medición de tensión constante, calcular la fuerza de la membrana de equilibrio, F, de la ley de Hooke:
F = k(a - 0)
donde a es la posición media del grano durante esa medida.
- Medición radio de tubo
- En el caso de una membrana desnuda (sin moléculas de membrana curva agregadas), calcular el radio del tubo, R, de la fuerza como:
R = F/(4πσ)
(referencias de22,23). - Para medir el radio del tubo en presencia de moléculas de membrana curva e independientemente de paso 4.3.1, en primer lugar, registrar la intensidad de fluorescencia de lípidos a lo largo de la longitud del tubo, tinay a lo largo del contorno GUV, GUV. Medir la intensidad de fluorescencia media de un fluoróforo en o enlazado a la membrana como una intensidad media a lo largo de la línea más brillante de un tubo o un contorno GUV. Seleccione una caja rectangular que contiene una sección horizontal del contorno GUV o el tubo y calcular la suma de las intensidades de fluorescencia de cada línea horizontal en el cuadro.
- Dividir cada suma por el número de píxeles de la línea horizontal (es decir, el ancho de la caja). Tenga en cuenta que en el cuadro seleccionado, no debe ser membranas presentes. Se obtiene el perfil de intensidad de fluorescencia a lo largo de la longitud de la caja seleccionada.
- Después de restar la intensidad del fondo, tomar la intensidad de fluorescencia media pixel de la línea más brillante. El radio del tubo está relacionada linealmente con el cociente de la fluorescencia a lo largo del contorno del tubo y el GUV como:
R = Ktinatina/GUV
donde Ktina es un factor de calibración25.
Nota: Este método se puede utilizar para medir el radio del tubo en el rango de 10 a 80 nm (cuando el tubo se estrecha a la mentira dentro de una anchura de voxel confocal) y con una incertidumbre un poco mayor en los 80 nm y superior gama. La sensibilidad de la medición depende de la configuración.
- Determinar Ktina realizando mediciones de radio independiente en pasos 4.3.1 y 4.3.2 en una composición de membrana simple usando lípidos sin cargar. Tal composición de membrana simple garantiza que la radio y la fuerza de la relación simple de paso 4.3.1. Repetir el experimento varias veces y parcela R, deducido de la fuerza (criterio 4.3.1) versus tina/GUV (paso 4.3.2). Calcular Ktina de la fit. En esta configuración, Ktina = 200 ± 50 nm usando huevo membrana L-α-fosfatidilcolina (huevo-PC) y un lípidos fluorescentes cuya fluorescencia depende minimamente de polarización25.
Nota: Se medirá Ktina para diferentes objetivos, debido a sus volúmenes de diferentes voxel confocal. El fluoróforo de lípidos no debe interactuar con las moléculas de proteínas/inyectadas. Los lípidos fluorescentes BODIPY TR ceramida, se recomienda aquí, no se espera que las interacciones con las proteínas. Esta suposición se confirmó con estudios anteriores de la barra y -BAR dominios25,36,37, que han demostrado que en cobertura de superficie de alto valor proteico, el radio del tubo se fija por las proteínas, independientemente de la tensión en el GUV. Si las proteínas interactúan con el fluoróforo de lípidos, un agotamiento o enriquecimiento del fluoróforo se observará en el tubo en fracciones de superficie variada alta en proteínas.
- En el caso de una membrana desnuda (sin moléculas de membrana curva agregadas), calcular el radio del tubo, R, de la fuerza como:
- Medición de la densidad superficial de las proteínas
- Preparar mezclas de lípidos mediante un simple lípido sin cargos (por ejemplo, huevo-PC) con cerca de cinco fracciones distintas topo de un lípidos fluorescentes (de la misma longitud de onda como el tinte que utilizó para etiquetar la proteína, por ejemplo, Bodipy-FLC5-hexadecanoyl-phosphatidylcholine (HPC *) para p. ej., la proteína marcada Alexa488) en el intervalo: XHPC * = 0.01 – 1%. Preparar a 2.fino en sacarosa 100 mM electroformation en ITO placas (siga el paso 1 de una anterior publicación13).
- Recoger a 2.fino y traslado a una cámara experimental apaciguada con la β-caseína. Uso p. ej., 100 mM de glucosa de la solución experimental. Espere unos minutos para 2.fino resolver.
- Imágenes de fluorescencia confocal de 2.fino y registrar la intensidad de fluorescencia media a lo largo del GUV contornos en función de la fracción de lípidos fluorescentes (ver paso 4.3.2). Para cada composición, calcular el área de densidad de los lípidos fluorescentes, φHPC*. Por ejemplo, al asumir que el área por lípido es 0,7 nm2, φHPC* = 1,43 x 106 XHPC * por folleto. Trama de HPC * intensidad de fluorescencia en el GUV,HPC *, GUV, versus φHPC*. Ajuste da la constante de calibración, A, dada por φHPC* = AIHPC *, GUV. A depende de la configuración de microscopía, tales como la potencia del láser y la sensibilidad del detector (es decir, ganancia), por lo tanto grabar A para varios de uso general configuración de microscopía (ver ejemplo en figura 3).
- Preparar varias soluciones de HPC * disuelto detergente, por ejemplo, sodio dodecil sulfato (SDS), a diferentes concentraciones en un rango de ~ 1 a 10-50 μm. registrar la intensidad de fluorescencia de cada solución a granel y calcular la pendiente de la intensidad versus concentración (figura 3). Repita la medición con el fluoróforo que va conjugado con la proteína en un rango de concentración similares (ver el ejemplo con Alexa488 en la figura 3). Esta medida es necesaria para relacionar las intensidades de fluorescencia de la etiqueta de la proteína y la etiqueta de lípidos, A488, bulto / HPC *, bulto, como no puede emitir necesariamente de la misma manera en la misma concentración a granel.
- Medir el número de fluoróforos por molécula de proteína con un fluorospectrometer. Por ejemplo, para el caso de Alexa488, el número de moléculas Alexa488 por proteína, nA488, puede calcularse utilizando a la siguiente relación:
n A488 = (A494/εA488) / ((A280 - 0.11A494) / εprot)
donde A494 y A280 son los valores de absorbancia por unidad de longitud a 494 nm y 280 nm, respectivamente, y εA488 y εprot son los coeficientes de absorción molecular de Alexa488 y la proteína, respectivamente. - Calcular la densidad superficial de la proteína en el GUV, φprot, GUV, según la siguiente fórmula:
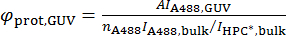
Tenga en cuenta el estado de polimerización de la proteína. Por ejemplo, la barra proteínas dimerizan, por lo tanto la densidad calculada será el monómero de BAR por la zona si se utiliza el coeficiente de extinción de la forma monomérica.

Figura 3: ejemplo de calibración de densidad superficial de la proteína. Medidos son la HPC * lípidos intensidad de fluorescencia a granel (izquierda) y en 2.fino (centro). También, mide son la intensidad de fluorescencia a granel de Alexa488 (con destino a un dominio de la barra) (derecha). Intensidad de fluorescencia escala linealmente con la concentración. Medidas que aparecen son para beneficio de la detección específica y potencia del laser. Diagramas generados en base a datos de referencia37. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El experimento de tirar tubo puede dar información vital mecánica sobre la membrana. En la ausencia de proteínas u otras moléculas que la fuerza de la pareja con la curvatura de la membrana, la membrana y radio del tubo puede tener relación con la tensión de membrana aplicando el hamiltoniano Canham-Helfrich ecuación a un tubo tiró de un GUV50,51
Discusión
El método de tirar tubos de 2.fino proporciona rica información sobre el sistema de la proteína de la membrana, no sólo los medios para medir las propiedades mecánicas fundamentales de la membrana, pero ayuda a arrojar luz sobre el acoplamiento entre las proteínas y membrana curvatura. Como comentamos en la introducción, existen otras técnicas para medir los efectos de las proteínas de membrana curva, incubando las proteínas con liposomas de sub-micron anclados a una superficie pasivada18
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a Benoit Sorre, Damien Cuvelier, Pierre Nassoy, François Quemeneur y Gil Toombes por sus contribuciones esenciales para establecer el método de nanotubos en el grupo. El grupo de P.B. pertenece al consorcio CNRS CellTiss, el Labex CelTisPhyBio (ANR-11-LABX0038) y a las Ciencias de París et Lettres (ANR-10-IDEX-0001-02). C. F. Tsai fue financiado por los EMBO compañerismo a largo plazo (ALTF 1527-2014) y las acciones Marie Curie (H2020-MSCA-IF-2014, proyecto membrana-ezrin-actina). M.S. es un Junior Fellow de la sociedad de becarios de Simons.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,2-Dioleoyl-sn-glycero-3-phosphatidylcholine (DOPC) | Avanti | 850375 | Example lipid used in data for Figure 3 |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[biotinyl(polyethyleneglycol)-2000] [DSPE-PEG(2000)-biotin] | Avanti | 880129 | biotinylated lipid |
| BODIPY-TR-C5-ceramide | Molecular Probes (ThermoFisher) | D7540 | fluorescent lipid |
| BODIPY- FLC5-hexadecanoyl phosphatidylcholine (HPC*) | Molecular Probes (ThermoFisher) | fluorescent lipid for protein density calibration | |
| egg L-α-phosphatidylcholine (eggPC) | Avanti | 840051 | used for calibrating the tube radius constant |
| β-casein from bovine milk (>99%) | Sigma Aldrich | C6905 | used for passivating the micropipette and the experimental chamber |
| Sucrose | Sigma Aldrich | S7903 | |
| D(+) glucose | Sigma Aldrich | G7021 | |
| NaCl | Sigma Aldrich | S7653 | |
| Tris | Sigma Aldrich | 10708976001 | |
| osmometer | Loser | n/a | |
| Pt-wires, 0.5 mm diameter, 99.99% pure | Goodfellow USA | PT005139 | used for GUV electroformation |
| function generator | n/a | used to create current for GUV electroformation | |
| putty sealant | Vitrex (from CML France) | CRIT 140013 | used to seal the electroformation chamber |
| bath sonicator | n/a | useful to clean the electroformation chamber, but not crucial | |
| Nikon TE2000 inverted microscope, eC1 confocal system (Nikon), with two laser lines (λ = 488 nm and 543 nm); optical tweezers induced by a 5 W ytterbium fiber continuous wave laser (λ > 1070 nm; IPG GmBH Germany) | an example of a confocal microscopy system equipped with optical tweezers | ||
| micromanipulators | n/a | ||
| borosilicate capillaries (with internal and external radii of 0.78 mm and 1 mm, respectively) | Harvard apparatus | 30-0036 | |
| micropipette puller | Sutter Instrument | P-2100 | |
| microforge | Narishige | MF-800 | |
| piezoelectric actuator | Physik Instrumente | n/a | |
| polystyrene streptavidin coated beads (diameter 3.2 µm) | Spherotech | SVP-30-5 |
Referencias
- McMahon, H. T., Gallop, J. L. Membrane curvature and mechanisms of dynamic cell membrane remodelling. Nature. 438 (7068), 590-596 (2005).
- Johannes, L., Wunder, C., Bassereau, P. Bending "on the rocks"--a cocktail of biophysical modules to build endocytic pathways. Cold Spring Harb Perspect Biol. 6 (1), (2014).
- Dawson, J. C., Legg, J. A., Machesky, L. M. Bar domain proteins: a role in tubulation, scission and actin assembly in clathrin-mediated endocytosis. Trends Cell Biol. 16 (10), 493-498 (2006).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends Biochem Sci. 37 (12), 526-533 (2012).
- Qualmann, B., Koch, D., Kessels, M. M. Let's go bananas: revisiting the endocytic BAR code. EMBO J. 30 (17), 3501-3515 (2011).
- Rao, Y., Haucke, V. Membrane shaping by the Bin/amphiphysin/Rvs (BAR) domain protein superfamily. Cell Mol Life Sci. 68 (24), 3983-3993 (2011).
- Simunovic, M., Voth, G. A., Callan-Jones, A., Bassereau, P. When Physics Takes Over: BAR Proteins and Membrane Curvature. Trends Cell Biol. 25 (12), 780-792 (2015).
- Safari, F., Suetsugu, S. The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases. Membranes (Basel). 2 (1), 91-117 (2012).
- Angelova, M. I., Soléau, S., Méléard, P., Faucon, F., Bothorel, P., Helm, C., Lösche, M., Möhwald, H. . Progress in Colloid and Polymer Science Vol. 89: Trends in Colloid and Interface Science VI. 89, 127-131 (1992).
- Meleard, P., Bagatolli, L. A., Pott, T. Giant unilamellar vesicle electroformation from lipid mixtures to native membranes under physiological conditions. Methods Enzymol. 465, 161-176 (2009).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Mathivet, L., Cribier, S., Devaux, P. F. Shape change and physical properties of giant phospholipid vesicles prepared in the presence of an AC electric field. Biophys J. 70 (3), 1112-1121 (1996).
- Collins, M. D., Gordon, S. E. Giant liposome preparation for imaging and patch-clamp electrophysiology. J Vis Exp. (76), (2013).
- Garten, M., Aimon, S., Bassereau, P., Toombes, G. E. Reconstitution of a transmembrane protein, the voltage-gated ion channel, KvAP, into giant unilamellar vesicles for microscopy and patch clamp studies. J Vis Exp. (95), e52281 (2015).
- Hochmuth, R. M., Evans, E. A. Extensional flow of erythrocyte membrane from cell body to elastic tether. I. Analysis. Biophys J. 39 (1), 71-81 (1982).
- Hochmuth, R. M., Wiles, H. C., Evans, E. A., McCown, J. T. Extensional flow of erythrocyte membrane from cell body to elastic tether. II. Experiment. Biophys J. 39 (1), 83-89 (1982).
- Bassereau, P., Sorre, B., Levy, A. Bending lipid membranes: experiments after W. Helfrich's model. Adv Colloid Interface Sci. 208, 47-57 (2014).
- Hatzakis, N. S., et al. How curved membranes recruit amphipathic helices and protein anchoring motifs. Nature chemical biology. 5 (11), 835-841 (2009).
- Bhatia, V. K., et al. Amphipathic motifs in BAR domains are essential for membrane curvature sensing. EMBO J. 28 (21), 3303-3314 (2009).
- Shi, Z., Baumgart, T. Membrane tension and peripheral protein density mediate membrane shape transitions. Nat Commun. 6, 5974 (2015).
- Chen, Z., Shi, Z., Baumgart, T. Regulation of membrane-shape transitions induced by I-BAR domains. Biophys J. 109 (2), 298-307 (2015).
- Cuvelier, D., Derenyi, I., Bassereau, P., Nassoy, P. Coalescence of membrane tethers: experiments, theory, and applications. Biophys J. 88 (4), 2714-2726 (2005).
- Derenyi, I., Julicher, F., Prost, J. Formation and interaction of membrane tubes. Phys Rev Lett. 88 (23), 238101 (2002).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Adv Colloid Interface Sci. 208, 225-234 (2014).
- Sorre, B., et al. Nature of curvature coupling of amphiphysin with membranes depends on its bound density. Proc Natl Acad Sci U S A. 109 (1), 173-178 (2012).
- Evans, E., Rawicz, W. Entropy-driven tension and bending elasticity in condensed-fluid membranes. Phys Rev Lett. 64 (17), 2094-2097 (1990).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nat Methods. 5 (6), 491-505 (2008).
- Capraro, B. R., Yoon, Y., Cho, W., Baumgart, T. Curvature sensing by the epsin N-terminal homology domain measured on cylindrical lipid membrane tethers. J Am Chem Soc. 132 (4), 1200-1201 (2010).
- Bo, L., Waugh, R. E. Determination of bilayer membrane bending stiffness by tether formation from giant, thin-walled vesicles. Biophys J. 55 (3), 509-517 (1989).
- Rossier, O., et al. Giant Vesicles under Flows: Extrusion and Retraction of Tubes. Langmuir. 19 (3), 575-584 (2003).
- Borghi, N., Rossier, O., Brochard-Wyart, F. Hydrodynamic extrusion of tubes from giant vesicles. EPL (Europhysics Letters). 64 (6), 837 (2003).
- Zhu, C., Das, S. L., Baumgart, T. Nonlinear sorting, curvature generation, and crowding of endophilin N-BAR on tubular membranes. Biophys J. 102 (8), 1837-1845 (2012).
- Ramesh, P., et al. FBAR syndapin 1 recognizes and stabilizes highly curved tubular membranes in a concentration dependent manner. Sci Rep. 3, 1565 (2013).
- Knorr, R. L., et al. Membrane morphology is actively transformed by covalent binding of the protein Atg8 to PE-lipids. PLoS One. 9 (12), e115357 (2014).
- Aimon, S., et al. Membrane shape modulates transmembrane protein distribution. Dev Cell. 28 (2), 212-218 (2014).
- Prévost, C., et al. IRSp53 senses negative membrane curvature and phase separates along membrane tubules. Nat Commun. , (2015).
- Simunovic, M., et al. How curvature-generating proteins build scaffolds on membrane nanotubes. Proc Natl Acad Sci U S A. 113 (40), 11226-11231 (2016).
- Allain, J. M., Storm, C., Roux, A., Ben Amar, M., Joanny, J. F. Fission of a multiphase membrane tube. Phys Rev Lett. 93 (15), 158104 (2004).
- Morlot, S., et al. Membrane shape at the edge of the dynamin helix sets location and duration of the fission reaction. Cell. 151 (3), 619-629 (2012).
- Renard, H. F., et al. Endophilin-A2 functions in membrane scission in clathrin-independent endocytosis. Nature. 517 (7535), 493-496 (2015).
- Simunovic, M., et al. Friction Mediates Scission of Tubular Membranes Scaffolded by BAR Proteins. Cell. 170 (1), 172-184 (2017).
- Simunovic, M., Lee, K. Y., Bassereau, P. Celebrating Soft Matter's 10th anniversary: screening of the calcium-induced spontaneous curvature of lipid membranes. Soft Matter. 11 (25), 5030-5036 (2015).
- Sorre, B., et al. Curvature-driven lipid sorting needs proximity to a demixing point and is aided by proteins. Proc Natl Acad Sci U S A. 106 (14), 5622-5626 (2009).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proc Natl Acad Sci U S A. 107 (16), 7208-7213 (2010).
- Dasgupta, R., Dimova, R. Inward and outward membrane tubes pulled from giant vesicles. Journal of Physics D: Applied Physics. 47 (28), 282001 (2014).
- Vitkova, V., Genova, J., Mitov, M. D., Bivas, I. Sugars in the aqueous phase change the mechanical properties of lipid mono- and bilayers. Molecular Crystals and Liquid Crystals. 449, 95-106 (2006).
- Bouvrais, H. . Mechanical properties of giant vesicle membranes investigated by flickering technique. , (2011).
- Koster, G., Cacciuto, A., Derenyi, I., Frenkel, D., Dogterom, M. Force barriers for membrane tube formation. Phys Rev Lett. 94 (6), 068101 (2005).
- Kwok, R., Evans, E. Thermoelasticity of large lecithin bilayer vesicles. Biophys J. 35 (3), 637-652 (1981).
- Helfrich, W. Elastic properties of lipid bilayers: theory and possible experiments. Z Naturforsch C. 28 (11), 693-703 (1973).
- Canham, P. B. The minimum energy of bending as a possible explanation of the biconcave shape of the human red blood cell. J Theor Biol. 26 (1), 61-81 (1970).
- Marcerou, J. P., Prost, J., Gruler, H. Elastic Model of Protein-Protein Interaction. Nuovo Cimento Della Societa Italiana Di Fisica D-Condensed Matter Atomic Molecular and Chemical Physics Fluids Plasmas Biophysics. 3 (1), 204-210 (1984).
- Leibler, S. Curvature Instability in Membranes. J Phys-Paris. 47 (3), 507-516 (1986).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados