Method Article
连续切片电子断层扫描显示的 3D果蝇间接飞行肌的线粒体超微结构研究
摘要
在本协议中, 我们展示了在果蝇间接飞行肌肉中应用的序列切片电子断层扫描来阐明线粒体结构。
摘要
线粒体是细胞的动力, 产生 ATP, 脂质和代谢物, 以及调节钙稳态和细胞死亡。独特的嵴丰富的双膜超微结构的这个细胞是优雅的安排, 以执行多种功能的划分生物分子。线粒体超微结构与各种功能密切相关;然而, 这些结构-函数关系的细微细节才刚刚开始被描述。在这里, 我们展示了在果蝇间接飞行肌肉中应用的序列切片电子断层扫描来阐明线粒体结构。串联电子断层扫描可用于研究三维的任何细胞结构。
引言
电子显微镜是一个有价值的工具, 研究的结构上下文的亚细胞组装和设备, 执行蜂窝过程。方法已经开发, 以保持组织或细胞的超微结构, 无论是通过化学固定醛或高压冷冻 (HPF) 后, 冷冻置换 (FS)1,2。嵌入的标本块, 然后可以切片, 染色, 并观察用透射电子显微镜 (TEM)。HPF 标本也可以在低温条件下处理, 如冷冻切片或聚焦离子束 (纤维蛋白原) 铣削, 并通过低温 EM3,4观察。
虽然薄片 EM 提供了丰富的形态学洞察力, 结果2D 图像只能揭示特定截面的超微结构。在3D 体积中组织超微结构的方法仍然模糊不清。为了使三维的细胞超微结构可视化, 在获得了一系列倾斜图像并将其投影到生成层析重建5 (图 1) 的情况下, 开发了一种电子断层扫描方法。双倾斜系列可通过旋转样品90°并获得第二倾斜系列来收集。这将减少因取样角度有限而导致的缺少楔形工件, 并提高图的分辨率。
在这里, 我们描述了用于研究果蝇间接飞行肌 (IFM)6、7、8、9的连续切片电子断层扫描的应用。.为了获得覆盖整个线粒体 (大约2.5 µm 厚) 的3D 重建, 序列切片从果蝇IFM 组织块获得。每个部分的断层使用自动数据收集软件单独收集。层析重建和串行断层与 IMOD 包, 以获得重建体积的整个线粒体。通过3D 软件对加入的断层进行了分析。对线粒体嵴的密度进行了细分, 产生了一个在三维度中揭示组织的分割模型。
研究方案
1. 使用振动叶片切片的切片果蝇组织
- 麻醉果蝇在冰上, 将每只苍蝇浸泡在1毫升的4% 低熔点琼脂糖的磷酸盐缓冲液中。允许琼脂糖凝固在冰上。通常, 4-6 只苍蝇被处理。
- 使用振动刀片切片的部分琼脂糖凝胶嵌入果蝇到切片100µm 厚度和浸泡在定影液中含有2.5% 戊二醛在0.1 米磷酸缓冲液。
注: Vibratome 切片是首选, 因为组织结构保持更完整的比其他方法。另外, 解剖镊子可用于解剖 IFM 的固定液中含有2.5% 戊二醛在0.1 米磷酸缓冲液。
2. 用高压冷冻和冷冻置换 (HPF/FS) 法制备 EM 试样
- 在磷酸盐缓冲液的3滴 (150 µL) 中洗涤组织切片, 其次是2滴 (100 µL) 的磷酸盐缓冲液和 20% BSA。然后在金载体中放置部分, HPF 填充有缓冲液和 20% BSA。
- 根据用户手册将载有携带者的样品装入高压冷藏箱。
- 冷冻后, 在液氮下释放托架, 并将其转移到冷冻替代装置, 冷却到-140 ° c。
- 执行表 1中所示的冻结替代协议, FS 鸡尾酒含有2% 戊二醛、2% 锇氧化和0.1% 铀丙酮乙酸酯。
- 小心地从携带针的载体上取出标本, 并在室温下将试样嵌入树脂中。聚合树脂在65° c 为16小时。
注意: 应修改 FS 协议以准备其他类型的示例。HPF/FS 是保存超微结构和减少细胞含量损失的首选。- 或者, 应用化学固定协议。用2.5% 戊二醛固定标本过夜, 用缓冲器冲洗, 然后用1% 锇氧化 2 h. 洗涤和脱水与上升的乙醇浓度, 然后渗透和嵌入在 Spurr 的树脂在65° c 聚合前16h
3. 制备电子断层扫描标本的系列切片
- 修剪标本块, 露出所需的块面, 其中含有组织。
- 预处理金颗粒 (直径 10 nm) 与 1% BSA, 30 分钟洗涤和悬浮在 PBS 缓冲区中的金粒子。覆盖在铜槽网格上涂上碳膜的金颗粒, 以创建基准标记。
- 在透射电镜下检查, 以获得足够的基准标记 (至少 5-10 标记) 在层析成像的视野。
- 切割串行部分, 200-250 nm 的厚度, 使用 ultramicrotome。
- 在插槽网格上使用一个完美的环形截面来收集串行部分。
- 染色的部分与雷诺的铅柠檬酸10分钟。
- 在剖面顶部覆盖第二层的基准金粒子。
4. 收集双倾斜电子断层扫描
- 将网格加载到双轴层析成像支架上, 并插入到 200 kV 的透射电子显微镜中。
- 将显微镜对准 eucentric 焦点。
- 设置自动数据收集软件。调整和对齐电子束在多尺度成像设置。有关操作详细信息, 请参阅用户手册10 (图 2)。
- 获取相机黑暗和明亮的参考在一个空白的区域没有碳膜下的断层扫描收集设置。
- 在低放大率下收集栅格地图集。选择序列切片上的线粒体作为断层扫描收集的目标。
- 获取一个倾斜系列, 从-60 °到 + 60 °, 每个目标的轴上2递增。
注意: 倾斜角度将被机械约束的标本持有人的设计。支架将在高倾角下阻挡光束。 - 要收集第二个倾斜系列, 请旋转试样托架90°。获得一个新的地图集。选择相应的位置, 并获取每个目标轴-b 上的倾斜系列。
注: 其他软件包 (如 SerialEM 和 Xplore3D) 可用于自动数据收集。
5. 使用软件重构3D 断层和分段子卷
- 使用 IMOD 软件11重构双轴倾斜图像的断层。
- 有关操作细节, 请参阅用户手册。
- 将单个倾斜级数与黄金基准标记的位置对齐。通过后向投影方法或由轴 a 和轴 B 的同时迭代重建技术 (SIRT) 方法 (图 3) 重新构造断层。
- 结合轴 a 和轴 B 的断层, 生成 double-tilt 图, 减少缺少楔形工件。
- 联合 double-tilt 断层的序列部分, 以获得覆盖整个线粒体体积的重建。通过 IMOD 程序对串行段之间的间隙进行建模。
- 将连接的断层和纸盒修剪为所需的卷分割大小。
- 使用3D 软件分析连接的串行断层。
- 有关操作细节, 请参阅用户手册。
- 用高斯滤镜 (或其他所需方法) 过滤断层, 以改善特征对比度, 降低背景密度。
- 对线粒体的超微结构进行人工或自动分割。
- 显示细分模型以允许在3D 中进行检查。
- 使用3D 中可用的工具生成影片。
结果
应用序列切片电子断层扫描技术分析线粒体嵴的结构特征, 反映其能量状态和衰老。我们发现,果蝇IFM 的线粒体在 3D (图 4)7中形成一个集成的嵴和矩阵网络。此外, 突变蝇与线粒体 DNA 复制缺陷和加速衰老表型积累线粒体, 其中包含洋葱状旋转核心 (图 5)7的分部。
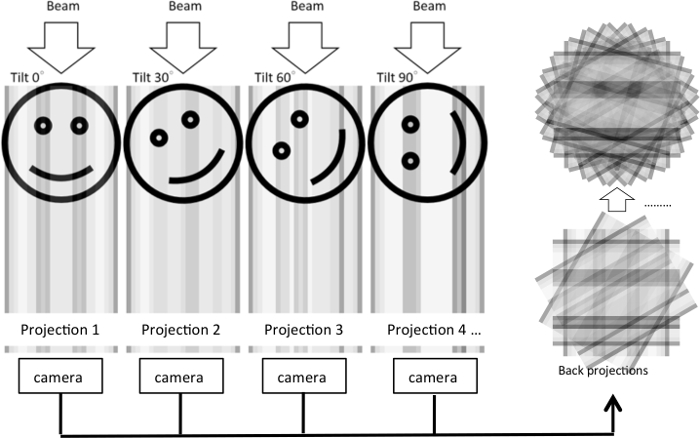
图 1: 从倾斜级数中重建电子断层的图示.在实验中, 当物体倾斜到不同程度时, 电子束通过3D 物体传递。对于每个倾斜条件, 将生成一个2D 投影并用照相机捕获。然后将2D 投影投影到基于中心切片定理的3D 对象重建中。在插图中, 对于在不同倾角下投射到单个尺寸中的原始2D 图像, 将显示相同的过程。然后使用1D 投影重建2D 图像。请单击此处查看此图的较大版本.
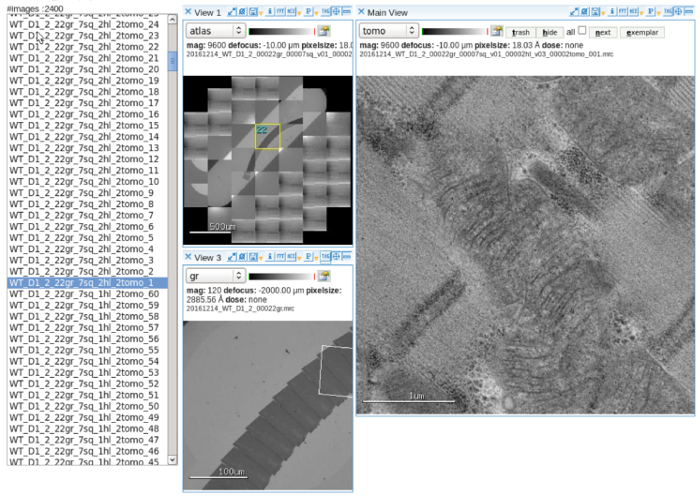
图 2: 自动数据收集一个图像查看器显示的软件显示的地图集的一个槽网包含串行部分, 多尺度目标的线粒体和获得倾斜图像。缩放栏 = 500 µm (左上面板), 100 µm (左下面板), 1 µm (右面板)。请单击此处查看此图的较大版本.

图 3: 在果蝇中的单个线粒体的序列剖面电子断层扫描间接飞行肌肉。() 2D 显微和 (B) 3D 断层从覆盖整个线粒体体积的串行部分。(C) 连接的串行节断层被投影以创建纵向剖面, z-axis 垂直显示。值得注意的是, 组织切片导致材料丢失, 在连接的断层之间留下间隙。缩放条形图 = 500 nm。请单击此处查看此图的较大版本.
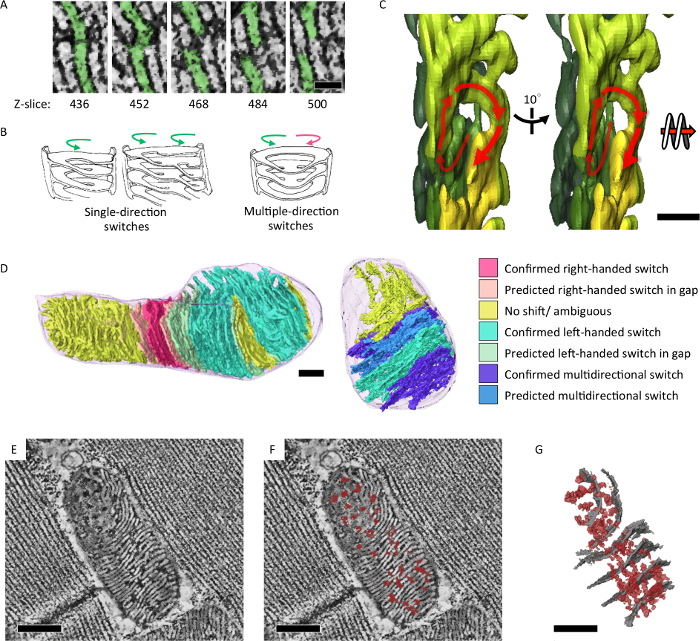
图 4: 3D 中显示的集成 intra-mitochondria 嵴和矩阵网络.(A) 线粒体电子断层重建切片, 显示通过 z-axis 的层状膜之间的开关。(B) 右手和/或 left-handed 螺旋的观察到的嵴开关模式的图示。(C) 层析分割, 在 3D (D) 中说明了 left-handed 螺旋的嵴开关模式, 并对分割模型 (E, F) 渲染了颜色。层析切片显示横向基质 70-100 (暗密度, 标记红色) 横跨嵴膜 (白色密度)。(G) 图的分割模型 (E) 显示横向矩阵 70-100 (以红色表示) 和具有代表性的嵴 (灰色)。标尺 = 50 毫微米 (A), 200 毫微米 (C) 和300毫微米 (D, E, F, G)。图为转载于江et al.7 请单击此处查看此图的较大版本.
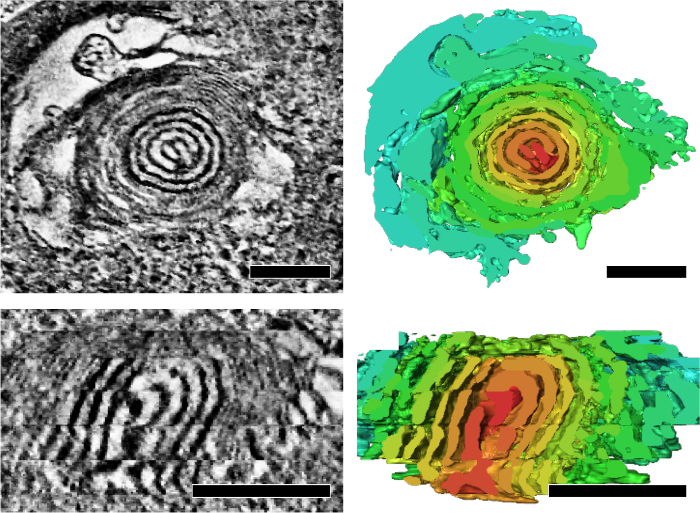
图 5: 在老化期间线粒体 DNA 复制缺陷的果蝇中积累的具有洋葱状旋转芯的线粒体.具有代表性的层析切片和相应的分割 (右面板) 显示一个横截面视图 (顶部) 和纵向剖面视图 (底部) 的漩涡核心。通过任意颜色渲染来表示体积分割, 以突出旋涡的核心。缩放栏: 200 nm。图为转载于江et al.7 请单击此处查看此图的较大版本.
| 步 | 临时 | 时间 | 解决 | |||
| 1 | -140 ° c 到-9 ° c | 30分钟 | 液氮 | |||
| 2 | -90 ° c | 96小时 | FS 鸡尾酒 | |||
| 3 | -90 ° c 到-60 ° c | 6小时 (5 ° c/小时) | FS 鸡尾酒 | |||
| 4 | -60 ° c | 12小时 | FS 鸡尾酒 | |||
| 5 | -60 ° c 到-25 ° c | 7小时 (5 ° c/小时) | FS 鸡尾酒 | |||
| 6 | -25 ° c | 12小时 | FS 鸡尾酒 | |||
| 7 | -25 ° c 到0° c | 5小时 (5 ° c/小时) | FS 鸡尾酒 | |||
| 8 | 0° c | 1小时 x 3 次 | 丙酮 | |||
| 9 | 房间温度 | 树脂渗入 | ||||
表 1: 冻结替代议定书。
讨论
在本协议中, 我们描述了一个优化的工作流程, 应用序列切片电子断层扫描研究的3D 线粒体超微结构的果蝇间接飞行肌肉。在样品中保存超微结构是这类分析的主要技术挑战。为了更好地保存超微结构, 包括两个方法步骤。首先, 用振动叶片切片切片对组织进行取样, 以尽可能地保持组织结构。其次, 对 HPF/FS 协议进行了优化, 以保留细胞的超微结构, 在准备嵌入标本块。试样在高压下被冻结, 降低了水的冰点, 减少了冰晶的形成, 破坏了超微结构的1。厚度为0.1 毫米的试样可以瞬间被玻璃化, 然后进行冷冻置换, 生成标本块进行 EM 分析。与化学固定方法相比, HPF/FS 对超微结构的保存有明显改善。利用这一系列步骤进行样品制备, 线粒体双层膜和嵴膜的保存得到了明显的改善。
获取试样的连续截面是该方法最具挑战性的步骤。由于电子束的穿透力有限, 因此该截面的厚度分别限制为 250 nm 或 500 nm, 使用 TEM 运行在200伏或300伏。由于线粒体的厚度可能超过2µm, 因此需要连续的部分才能获得完整的体积重建。但是, 恢复足够数量的串行部分来跨越整个细胞是一个技术难题。在梯形的基座之间尽可能平整地修剪块面, 可以使插槽网格容纳更多的截面, 从而覆盖较大的卷。此外, 对于精简部分, 使用一个完美的循环会增加将串行部分转移到网格的成功率。
串联电子断层扫描可以用标准的 EM 核心设备来完成。然而, 由于技术的限制, 该方法有一些不可避免的局限性。一是材料不可避免地在连续的区段之间丢失, 在联接的重建留下空白。第二是缺少的楔形工件, 这是由于有限的倾斜角度, 是可以实现的。这种限制发生的原因是, 试样持有者不能完全旋转而不堵塞电子束。尽管有这些限制, 连续切片电子断层扫描提供了足够的分辨率, 以揭示细胞和器官的超微结构在3D。
对于较小规模的成像, 低温电子断层扫描是一种新兴的技术, 可用于获得结构的大分子复合体和程序集原位在 nm 或 sub-angstrom 分辨率与 sub-tomographic 结合重建3。在这种应用中, 细胞通过切片或聚焦离子束在液氮下铣削而变薄。断层是在低温条件下收集的, 在这种情况下, 分子结构保存在靠近原生状态的地方, 没有化学固定、脱水或嵌入。在天平的另一端, 以牺牲分辨率为代价来分析大的组织体积, 串口扫描电子显微镜是一种吸引人的方式, 尽管它需要特定的仪器4。
披露声明
作者声明他们没有竞争的金融利益。
致谢
这项研究是在细胞和有机体生物学研究所和台湾台北中央研究院的低温 em 核心进行的。这项工作得到了中央研究院和大多数的支持。
材料
| Name | Company | Catalog Number | Comments |
| vibrating blade microtome | Leica | VT1200S | Tissue sectioning |
| high-pressure freezer | Leica | EM HPM100 | Specimen preparation |
| freeze-substitution device | Leica | EM AFS2 | Specimen preparation |
| ultramicrotome | Leica | EM UC7 | Ultra-thin sectioning |
| dual-axis tomography holder | Fischione | Model 2040 | tomography collection |
| transmission electron microscope | FEI | Tecnai F20 | tomography collection |
| CCD | Gatan | UltraScan 1000 | tomography collection |
| Leginon | NRAMM/AMI | tomography collection | |
| IMOD | Boulder Laboratory for 3-D Electron Microscopy of Cells | Tomography reconstruction | |
| Avizo 3D | FEI | Tomography analysis |
参考文献
- Dahl, R., Staehelin, L. A. High-pressure freezing for the preservation of biological structure: theory and practice. J Electron Microsc Tech. 13 (3), 165-174 (1989).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J Cell Biol. 17, 19-58 (1963).
- Rigort, A., et al. Micromachining tools and correlative approaches for cellular cryo-electron tomography. J Struct Biol. 172 (2), 169-179 (2010).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329 (2004).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Soto, G. E., et al. Serial section electron tomography: a method for three-dimensional reconstruction of large structures. Neuroimage. 1 (3), 230-243 (1994).
- Jiang, Y. F., et al. Electron tomographic analysis reveals ultrastructural features of mitochondrial cristae architecture which reflect energetic state and aging. SciRep. 7, 45474 (2017).
- Cogliati, S., Enriquez, J. A., Scorrano, L. Mitochondrial Cristae: Where Beauty Meets Functionality. TrendsBiochemSci. 41 (3), 261-273 (2016).
- Friedman, J. R., Nunnari, J. Mitochondrial form and function. Nature. 505 (7483), 335-343 (2014).
- Suloway, C., et al. Fully automated, sequential tilt-series acquisition with Leginon. J Struct Biol. 167 (1), 11-18 (2009).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. J Struct Biol. 197 (2), 102-113 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。