Method Article
3D mitokondriyal Ultrastructure Drosophila dolaylı uçuş kas seri-bölüm elektron tomografi tarafından ortaya
Bu Makalede
Özet
Bu protokol için seri-bölüm elektron tomografi uygulanması mitokondrial Drosophila dolaylı uçuş kas yapısında aydınlatmak için göstermektedir.
Özet
Mitokondri ATP, yağlar, metabolitleri üretmek ve yanı sıra kalsiyum homeostazı ve hücre ölümü düzenleyen hücresel güçlüdür vardır. Bu organel benzersiz cristae zengini çift cidarlı ultrastructure zarif biomolecules bölümleme tarafından birden çok işlevlerini gerçekleştirecek için ayarlandı. Mitokondriyal ultrastructure çeşitli fonksiyonları ile yakından bağlantılıdır; Ancak, bu yapı-fonksiyon ilişkileri ince detaylar tarif edilebilir sadece başlıyor. Burada, mitokondrial Drosophila dolaylı uçuş kas yapısında aydınlatmak için seri-bölüm elektron tomografi uygulanması gösterilmektedir. Seri-bölüm elektron tomografi herhangi bir hücresel yapısı üç boyutlu olarak çalışmaya adapte olabilir.
Giriş
Elektron mikroskobu hücre altı derlemeler ve hücresel süreçler yerine organelleri yapısal bağlamında incelemek için değerli bir araçtır. Yöntemleri ultrastructure doku ve hücreler tarafından aldehitler ile kimyasal fiksasyonu korumak için geliştirilmiştir ya tarafından yüksek basınçlı (HPF) ardından dondurma dondurma ikame (FS)1,2. Katıştırılmış numune blok sonra saat kesitli, lekeli ve transmisyon elektron mikroskobu (TEM) ile görülmektedir. HPF numune de cryo-koşul altında gibi soguk kesit veya freze ve cryo-EM3,4tarafından gözlenen odaklı iyon ışını (yalan) işleme.
İnce kesit EM bilgilendirici morfolojik anlayışlar sağlasa da, elde edilen 2D görüntüleri yalnızca belirli bir kesit ultrastructure ortaya çıkarabilir. Ultrastructure bir 3B cilt düzenlenme gizli kalır. Üç boyutlu hücresel ultrastructure görselleştirmek için nerede dizi tilt resmi satın aldı ve geri bir tomografik imar5 (şekil 1) oluşturmak için öngörülen bir elektron tomografi yöntem geliştirilmiştir. Bir çift tilt serisi örnek 90 ° döner ve ikinci bir tilt dizi edinme toplanabilir. Bu sınırlı örnekleme açılardan neden olur ve tomogram çözümlenmesi geliştirmek eksik-kama yapıların en aza indirmek olacaktır.
Burada, Drosophila dolaylı uçuş kas (IFM)6,7,8,9 mitokondriyal ultrastructure çalışmaya seri-bölüm elektron tomografi uygulanması açıklamak . 3D rekonstrüksiyonlar kapsayan tüm mitokondri (yaklaşık 2.5 µm kalınlığında) elde etmek için seri bölümler Drosophila IFM doku bloklardan elde edilmiştir. Tomograms her bölümün otomatik veri toplama yazılımı kullanarak tek tek toplanmıştır. Tomografik rekonstrüksiyonlar oluşturulan ve seri tomograms tüm bir mitokondri yeniden oluşturulan hacmi elde etmek için but paketiyle katıldı. Birleştirilmiş tomograms 3D yazılım tarafından analiz edildi. Mitokondriyal cristae yoğunlukları organizasyon üç boyutlu olarak ortaya bir segment oluşturma modeli oluşturmak için parçalara.
Protokol
1. bölüm Drosophila dokular bir titreşimli Blade Microtome kullanarak
- Drosophila buzda anestezi ve her tek sinek % 4 düşük erime özel fosfat tampon 1 mL içinde bırakın. Buzda kuvvetlendirmek özel izin. Genellikle, 4-6 sinekler işlendi.
- Titreşimli blade microtome özel jel içine katıştırılmış Drosophila 100 µm kalınlık ile dilim bölüm ve 0.1 M fosfat tampon % 2.5 oxazolidin içeren sabitleştirici çözüm bırakın için kullanın.
Not: doku mimari diğer yöntemlerine göre daha sağlam kalır çünkü Vibratome kesit tercih edilir. Alternatif olarak, 0.1 M fosfat tampon % 2.5 oxazolidin içeren sabitleştirici çözüm içine IFM incelemek için cımbız dissekan kullanılabilir.
2. yüksek basınç donma ve donma ikame (HPF/FS) yöntemi tarafından EM numuneler hazırlayın
- 3 damla (~ 150 µL) doku bölümlerde fosfat tampon, fosfat tampon % 20 BSA ile 2 damla (~ 100 µL) tarafından takip yıkayın. O zaman altın taşıyıcıları için arabellek ve % 20 BSA ile dolu HPF bölümleri yerleştirin.
- Kullanıcı kılavuzuna göre yüksek basınçlı bir dondurucu içine taşıyıcıları içeren örnek yükleyin.
- Dondurma sonra sıvı azot altında sahibinden taşıyıcıları serbest bırakmak ve -140 ° C'ye soğutmalı donma-ikame aygıta transfer
- Tablo 1, % 2'oxazolidin, % 2 Osmiyum tetroxide ve % 0.1 uranyl asetat aseton içeren kokteyl FS ile gösterildiği gibi freeze-ikame Protokolü gerçekleştirin.
- Dikkatle numune taşıyıcıları bir iğne ile kaldırın ve reçine oda sıcaklığında örnekler embed. 16 h için 65 ° C'de reçine polimerize.
Not: FS iletişim kuralları örnekleri diğer türleri hazırlamak için değiştirilmesi gerekir. HPF/FS ultrastructure korumak ve hücresel içeriği kaybını en aza indirmek için tercih edilir.- Alternatif olarak, bir kimyasal fiksasyonu protokole uygulanır. Numuneler ile % 2.5 oxazolidin gecede düzeltmek, arabellekleri ile yıkayın ve % 1 Osmiyum tetroxide için 2 h. yıkama ile düzeltmek ve etanol konsantrasyonları artan ile kurutmak ve sonra sızmak ve 16 65 ° C'de polymerizing önce Spurr'ın reçine örnekler embed h.
3. seri-bölümlerde örneklerin elektron tomografi için hazırlayın
- Doku içeren istediğiniz blok yüzü ortaya çıkarmak için numune blok döşeme.
- Altın parçacıkları pretreat (10 nm çapında) ile % 1 BSA 30 dk. yıkama ve altın parçacıkları PBS arabellekte askıya alma. Altın parçacıkları indirgeme işaretleri oluşturmak için karbon film ile kaplı bakır yuvası Izgaralar üzerinde yerleşimi.
- TEM altında yeterli indirgeme işaretleri (en az 5-10 işaretleri) için tomografi edinme görüş alanı içinde kontrol edin.
- Seri kesitler, 200-250 nm kalınlıkta bir ultramicrotome kullanarak, kes.
- Mükemmel bir döngü için ince bölümleri kullanarak yuvası Izgaralar üzerinde seri bölümler toplamak.
- Reynold kurşun sitrat 10 dk bölümlerle leke.
- Bölümleri üst indirgeme altın parçacıkları ikinci tabakası kaplar.
4. çift-tilt elektron tomografi toplamak
- Kılavuz bir çift eksenli tomografi tutucu üzerine yük ve 200'de işletim transmisyon elektron mikroskobu takabilirsiniz kV.
- Eucentric odak vasıl mikroskop hizalayın.
- Otomatik veri toplama yazılımı kurar. Ayarlamak ve çoklu ölçek görüntüleme ayarı, elektron ışını hizalayın. İşlem detay10 (Şekil 2) için kullanıcı el kitabına başvurun.
- Karbon film tomografi koleksiyonu ayarı altında olmaksızın boş bir alan kamera karanlık ve aydınlık referanslar elde etmek.
- Bir kılavuz atlas düşük büyütmede toplamak. Mitokondri seri bölümlerinde tomografi koleksiyonu için hedef olarak seçin.
- -60 ° ila + 60 ° 2 ° artışlarla bir tilt serisinden elde eksen-A her hedef için.
Not: Tilt açıları mekanik olarak numune tutucu tasarım tarafından kısıtlı olacak. Sahibi yüksek tilt açılarda ışın engeller. - İkinci tilt serisi toplamak için numune tutucu 90 ° döndürün. Yeni bir atlas elde etmek. Karşılık gelen pozisyonlar seçin ve tilt serisi eksen-b her hedef için kazanmak.
Not: SerialEM ve Xplore3D, gibi diğer yazılım paketlerini otomatik veri toplama için kullanılabilir.
5. yeniden 3D Tomograms ve Segment alt birimleri kullanma bilgisayar yazılımı
- Tomograms but yazılım11kullanarak çift eksenli tilt görüntülerin yeniden.
- İşlem detay için kullanıcı el kitabına başvurun.
- Bireysel tilt serisi tarafından altın indirgeme işaretleri pozisyonların hizalayın. Tomograms geri projeksiyon yöntemi veya eşzamanlı yinelemeli imar tekniği (SIRT) yöntemi için her iki eksen-A yeniden ve eksen-B, sırasıyla (şekil 3).
- Tomograms eksen-a birleştirmek ve azaltılmış eksik kama yapı ile bir çift-tilt tomogram oluşturmak için eksen-B.
- Çift-tilt tomograms seri bölümlerin tüm mitokondri Birim kapsayan rekonstrüksiyonlar elde etmek için bir araya. But program tarafından seri bölümler arasındaki boşluklar modeli.
- Birleştirilmiş tomograms ve birimin bölümleme için istenen boyuta Kutusu'na kırpın.
- 3D yazılım kullanarak birleştirilen seri tomograms analiz.
- İşlem detay için kullanıcı el kitabına başvurun.
- Kontrast özellikleri, arka plan yoğunluğunu azaltmak için bir Gauss filtre (veya diğer yöntemi) ile tomograms filtre.
- Mitokondri ultrastructure el ile veya otomatik olarak kesiminde.
- Muayene 3D izin vermek için segmentasyon modelleri görüntülemek.
- Filmler 3D araçları kullanarak oluşturun.
Sonuçlar
Biz onun enerjik devlet ve yaşlanma yansıtır mitokondriyal cristae yapısal özelliklerini analiz etmek için seri-bölüm elektron tomografi uygulanır. Drosophila IFM mitokondri entegre bir formu gösterdi cristae ve matris ağ 3D (şekil 4)7. Buna ek olarak, mitokondriyal DNA çoğaltma kusur ve bir hızlandırılmış yaşlanma fenotip mutant sinekli soğan gibi dönen çekirdek (şekil 5)7alt bölümleri bulunan mitokondri birikmiş.
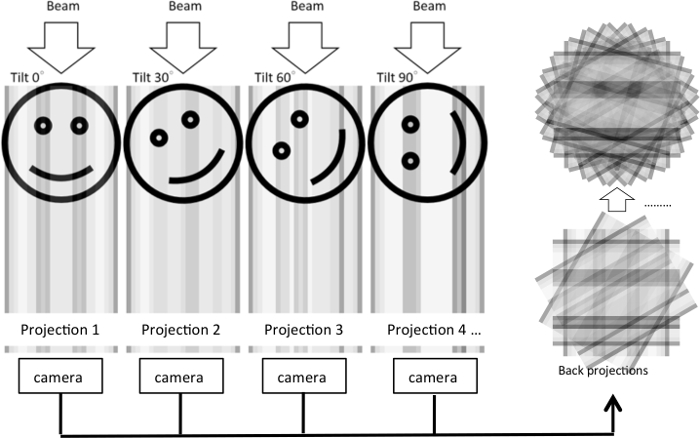
Şekil 1: Elektron tomografi imar tilt Series Illustration. Nesne için çeşitli derece hareket ettirildiğinde deneyde, bir elektron ışını 3D nesnesi üzerinden geçirilir. Her tilt koşul için bir 2D projeksiyon oluşturulur ve bir kamera ile çekilen. 2D projeksiyonlar sonra geri Merkezi dilim teoremi üzerinde tabanlı 3D nesne yeniden oluşturmak için tahmin ediliyor. Örnekte, aynı işlemi çeşitli tilt açıları altında tek bir boyut içine yansıtılır orijinal 2D görüntü için gösterilir. 1D yansımalar daha sonra 2B görüntü yeniden oluşturmak için kullanılır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
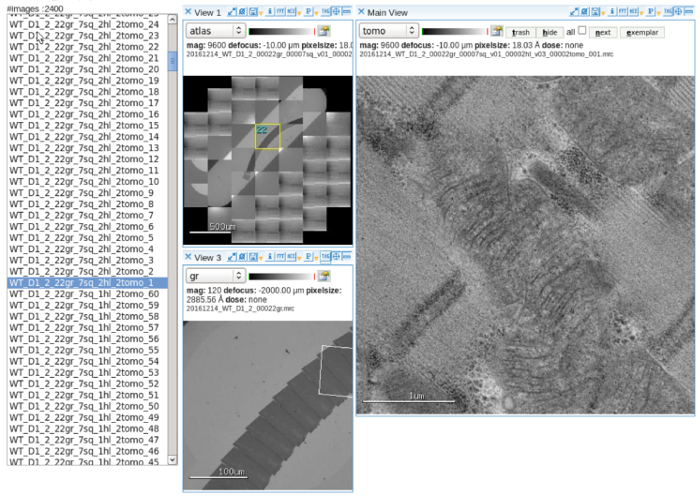
Şekil 2: otomatik veri toplama. Bir resim görüntüleyici görüntüleme yazılımı seri bölümler içeren bir yuvası kılavuz Atlası gösterilen mitokondri hedefleme ve elde çok ölçekli görüntüler eğ. Ölçek çubuğu = 500 µm (sol üst panel), 100 µm (sol alt paneli), 1 µm (doğru kapı aynası). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3: Seri-bölüm elektron tomografi, Drosophila dolaylı uçuş kas tek bir mitokondri. 2D Filmler(a)ve (B) 3D tomograms seri bölümlerden bir mitokondri tüm birimi kapsayan. (C) birleştirilen seri-bölüm tomograms ile z ekseni dikey olarak gösterilen boyuna bir bölüm oluşturmak için tahmin ediliyor. Özellikle, doku kesit kaybetme-in malzeme, birleştirilen tomograms arasında boşluklar bırakarak yol açtı. Ölçek çubuğu = 500 nm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
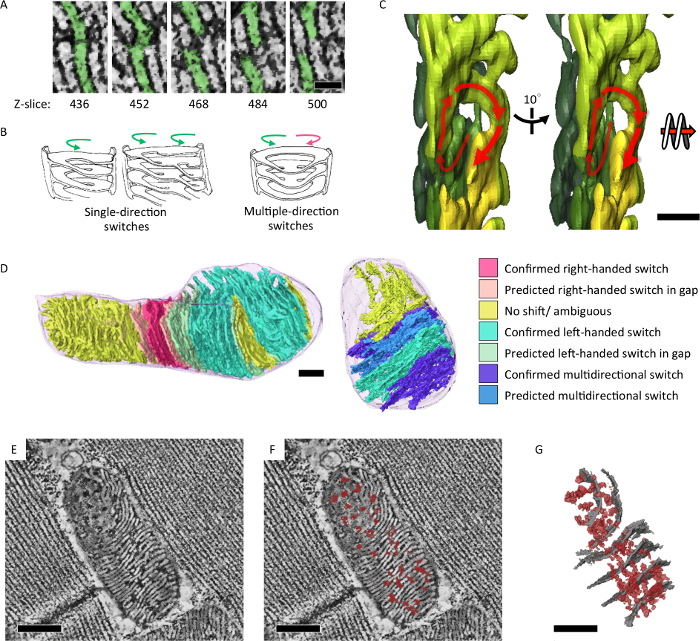
Şekil 4: entegre Intra-mitokondri cristae ve 3D ortaya matris ağ. (A)dilim mitokondrial elektron tomografik rekonstrüksiyonlar gösterilen z ekseni boyunca lamel membranlar arasında geçiş yapar. Hemen teslim ve/veya sol elle spiraller şekillerinin geçiş gözlenen cristae (B) resimler. (C) tomografik segmentasyon desenleri değiştirme 3D (D) Cristae solak bir spiral gösteren analiz ve segmentasyon modelinde (E, F) renk olarak işlenen. Yanal matris confluency (karanlık yoğunluğunu, kırmızı işaretli) cristae membranlar (beyaz yoğunlukları) arasında gösterilen tomografik dilim. (G) bölümleme model yanal matris confluency (kırmızı) gösterilen tomogram (E) ve (içinde gri) temsilcisi cristae. Ölçek çubuğu = 50 nm (A), 200 nm (C) ve 300 nm (D, E, F, G). Reprint gelen Jiang ve ark. idi 7 Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
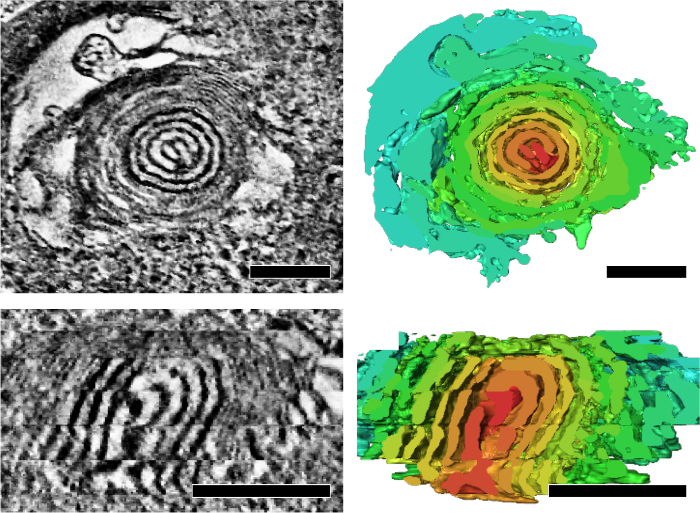
Şekil 5: mitokondri soğan gibi dönen çekirdek ile yaşlanma sırasında mitokondrial DNA çoğaltma hataları sinekli içinde birikmiş. Temsilcisi tomografik dilimleri ve kesit görünümü (üst) ve dönen bir çekirdek boyuna kesit görünümü (alt) gösterilen ilgili segmentasyon (doğru kapı aynası). Birim segmentasyon dönen çekirdek vurgulamak için rasgele renk işleme tarafından belirtilir. Ölçek çubuğu: 200 nm. Reprint gelen Jiang ve ark. idi 7 Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Adım | Temp | Zaman | Çözüm | |||
| 1 | -140 ° C-9 0 ° C | 30 dk | Sıvı azot | |||
| 2 | -90 ° C | 96 saat | FS kokteyl | |||
| 3 | -90 ° C-60 ° C | 6 saat (5 ° C/hr) | FS kokteyl | |||
| 4 | -60 ° C | 12 hr | FS kokteyl | |||
| 5 | --25 ° c 60 ° C | 7 SA (5 ° C/hr) | FS kokteyl | |||
| 6 | -25 ° C | 12 hr | FS kokteyl | |||
| 7 | -25 ° C ila 0 ° C | 5 saat (5 ° C/hr) | FS kokteyl | |||
| 8 | 0 ° C | 1 hr x 3 kez | Aseton | |||
| 9 | Oda sıcaklığında | Reçine infiltrasyon | ||||
Tablo 1: Freeze-ikame protokolü.
Tartışmalar
Bu protokol için 3D mitokondriyal ultrastructure Drosophila dolaylı uçuş kas eğitim için seri-bölüm elektron tomografi uygulamak için en iyi duruma getirilmiş bir iş akışını açıklar. Ultrastructure örnek korunması için bu tür bir çözümleme birincil teknik mücadeledir. En iyi ultrastructure iki metodolojik korumak için adımlar dahil edildi. İlk olarak, doku doku mimari mümkün olduğunca korumak için bıçak microtome titreşimli ile kesit tarafından örnek. İkinci olarak, bir HPF/FS protokol organel ultrastructure katıştırılmış numune blokları hazırlanması sırasında korumak için optimize edildi. Numuneler suyun donma noktası düşürür ve ultrastructure1zarar buz kristalleri oluşumu azaltır, yüksek basınç altında dondurulmuştu. Örnek 0,1 mm kalınlığında anında Vitrifiye ve sonra EM analiz için numune blok oluşturmak için ikame dondurmak için tabi. Kimyasal fiksasyonu yöntemlerine göre zaman ultrastructure HPF/FS tarafından geliştirilmiş korunması belirtilmişti. Bu dizi adımı numune hazırlama için kullanarak, mitokondrial Çift Kişilik membranlar ve cristae membran korunması önemli ölçüde geliştirildi.
Seri bölümlerini numune alma yönteminin en zor adımdır. Elektron ışını penetrasyon gücü sınırlı olan bölümü kalınlığı ya 250 ile sınırlı olduğu nm veya 500 nm 200'de çalışan bir TEM kullanarak kV veya 300 kV, anılan sıraya göre. Bir mitokondri kalınlığı 2'den fazla µm olduğu için seri bölümler tam birim rekonstrüksiyonlar elde etmek için gereklidir. Ancak, tüm bir organel span için seri bölümleri yeterli sayıda kurtarma teknik bir sorundur. Yamuk bazlar arasındaki mümkün olduğunca düz olmak blok yüz kırpma daha fazla bölümleri yer sağlamak ve böylece daha büyük birimleri kapak bir yuvası ızgara izin verebilirsiniz. Ayrıca, mükemmel bir döngü için ince bölümleri kullanarak seri bölümler kılavuza aktarma başarı oranı artar.
Seri-bölüm elektron tomografi standart EM temel ekipman ile gerçekleştirilebilir. Ancak, yöntem teknik kısıtlamalar ortaya kaçınılmaz bazı sınırlamalar vardır. Biri malzeme kaçınılmaz olarak birleştirilen imar boşluklar bırakarak seri bölümler arasında kaybolur. İkinci olarak ulaşılabilir sınırlı tilt açıları nedeniyle ortaya çıkar eksik kama artifakı olduğunu. Bu kısıtlama örnek sahibi tam bir rotasyon elektron ışını engelleme olmadan açılamaz oluşur. Bu sınırlamaları rağmen seri-bölüm elektron tomografi 3D cep ve organel ultrastructure ortaya çıkarmak için yeterli çözüm sağlanır.
Daha küçük ölçekli görüntüleme için cryo-elektron tomografi makromoleküllerin kompleksleri ve derlemeler in situ alt tomografik ile birlikte nm veya alt angstrom çözünürlükte yapısını elde etmek için kullanılan bir gelişmekte olan bir teknolojidir yeniden yapılanma3. Bu uygulamada, hücreleri kesit veya altında sıvı azot freze odaklı iyon demeti inceltilerek. Tomograms nerede moleküler yapıları yerli devlet kimyasal fiksasyonu, dehidratasyon veya gömme olmadan yakın korunur cryo-koşullar altında toplanır. Belirli araç4gerektirir ölçek diğer ucunda, çözünürlük, pahasına büyük doku birimleri çözümlemek için seri blok-yüz tarama elektron mikroskobu çekici bir modalite olsa bile.
Açıklamalar
Yazarlar onlar rakip hiçbir mali çıkarları var bildirin.
Teşekkürler
Çalışmalar cep Enstitüsü ve Organismic Biyoloji EM özünde ve Academia Sinica, Taipei, Tayvan cryo-EM özünü yapıldı. İş Academia Sinica ve çoğu tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| vibrating blade microtome | Leica | VT1200S | Tissue sectioning |
| high-pressure freezer | Leica | EM HPM100 | Specimen preparation |
| freeze-substitution device | Leica | EM AFS2 | Specimen preparation |
| ultramicrotome | Leica | EM UC7 | Ultra-thin sectioning |
| dual-axis tomography holder | Fischione | Model 2040 | tomography collection |
| transmission electron microscope | FEI | Tecnai F20 | tomography collection |
| CCD | Gatan | UltraScan 1000 | tomography collection |
| Leginon | NRAMM/AMI | tomography collection | |
| IMOD | Boulder Laboratory for 3-D Electron Microscopy of Cells | Tomography reconstruction | |
| Avizo 3D | FEI | Tomography analysis |
Referanslar
- Dahl, R., Staehelin, L. A. High-pressure freezing for the preservation of biological structure: theory and practice. J Electron Microsc Tech. 13 (3), 165-174 (1989).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J Cell Biol. 17, 19-58 (1963).
- Rigort, A., et al. Micromachining tools and correlative approaches for cellular cryo-electron tomography. J Struct Biol. 172 (2), 169-179 (2010).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. 2 (11), e329 (2004).
- Lucic, V., Forster, F., Baumeister, W. Structural studies by electron tomography: from cells to molecules. Annu Rev Biochem. 74, 833-865 (2005).
- Soto, G. E., et al. Serial section electron tomography: a method for three-dimensional reconstruction of large structures. Neuroimage. 1 (3), 230-243 (1994).
- Jiang, Y. F., et al. Electron tomographic analysis reveals ultrastructural features of mitochondrial cristae architecture which reflect energetic state and aging. SciRep. 7, 45474 (2017).
- Cogliati, S., Enriquez, J. A., Scorrano, L. Mitochondrial Cristae: Where Beauty Meets Functionality. TrendsBiochemSci. 41 (3), 261-273 (2016).
- Friedman, J. R., Nunnari, J. Mitochondrial form and function. Nature. 505 (7483), 335-343 (2014).
- Suloway, C., et al. Fully automated, sequential tilt-series acquisition with Leginon. J Struct Biol. 167 (1), 11-18 (2009).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. J Struct Biol. 197 (2), 102-113 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır